一株低温降解菌的分离鉴定及其降解特性研究*
闫法军,田相利,董双林,牛宇峰
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
一株低温降解菌的分离鉴定及其降解特性研究*
闫法军,田相利**,董双林,牛宇峰
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
从刺参(A postichopus japonicus)养殖池塘环境中驯化分离筛选到1株低温有机物和氨氮降解菌株DB11。根据其形态特征、生理生化特性以及16S rDNA序列分析,将该菌株鉴定为马氏副球菌(Paracoccus marcusii)。经驯化,该菌株以刺参饵料为唯一营养源,低温(15℃)、低接种量(<5×10-3)条件下能同时高效降解饵料中的有机物和氨态氮,5 d时间内对富集培养基中COD和NH4+-N的降解率分别达50%和98%。进一步研究其降解特性表明,菌株生长适温15~30℃,生长适宜p H值为7~10,降解刺参饵料中COD和N-N的最适温度条件为15~20℃、最适p H条件为8.0~8.5;在最适降解条件下、接种量为5×10-3时,对10~20 g/L高质量浓度的刺参饵料液中COD降解效果显著,3 d时间去除率达56.9%~65.7%,对1~20 g/L质量浓度的刺参饵料液中N-N 3 d时间的去除率达91.7%~99.9%。
低温菌;有机物;氨氮;分离鉴定;降解特性
刺参养殖业是我国新近迅速形成的1个经济效益很高的产业,主要分布在辽宁和山东沿海,是我国海水养殖的重要特色支柱产业之一。近几年来,类似对虾、扇贝和鱼类养殖,刺参养殖也相继发生病害,大批量死亡造成该产业的巨大经济损失,成为制约该产业可持续发展的瓶颈[1]。目前大部分刺参养殖主要依靠投喂人工饲料,饲料的粘着性极差,溶解散失严重,加上池底设置了大量的人工附着基,大量未利用的饲料残留在养殖池塘,这些残饵颗粒物将会有90%以上沉积富集在池塘底部[2],而富集在底泥中的这些污染物,在一定条件下会重新以有机物和可溶性无机氮如NH+4-N、N-N等的形式释放到养殖水体中,恶化了水质;同时,由于池塘底部温度相对稳定,有机物和营养元素丰富,为有害微生物的繁殖提供了“温床”,这些有害微生物的大量繁殖使养殖对象处于1个不健康的环境中,极易发生暴发性疾病[3]。因此,研究刺参养殖环境中饵料污染的快速解决方法,对改善修复养殖水体,减少养殖病害的发生,促进该产业的可持续发展具有重要意义。
目前微生物在环境污染控制和修复方面的作用受到人们的广泛关注,国内外对此研究颇多[4-6],在水产养殖方面也不胜枚举[7-9]。随着养殖污染的日趋严重,从养殖环境及养殖动物体上分离土著菌作为高效降解微生物的开发研究来源继而应用于养殖生产,已成为人们的研究热点,并取得了很大的成就[10-13]。但这些研究大多集中于鱼虾贝,对于刺参却鲜有报道。
本文旨在通过对刺参养殖池塘中高效低温饵料降解菌的分离筛选,获得能适于刺参养殖环境快速生长并能快速降解刺参残饵中的有机物和氨氮的优良菌株,从而为刺参养殖环境的改善修复及刺参池塘微生态制剂的研制工作提供基础条件。
1 材料与方法
1.1 培养基
刺参饵料:含粗蛋白25.9%,粗脂肪0.81%,碳水化合物47.0%,能值14.9216 kJ/g。
富集培养基:刺参饵料20 g(研成细粉),无菌陈海水1 000 mL,饵料水溶液煮沸后置于超净台浸泡48 h,离心取上清,p H=8.0,121℃,灭菌20 min备用。
驯化培养基:富集培养基基础上,按10%的比例逐级增加饵料质量,提高饵料渗出液浓度,pH=8.0,121℃,灭菌20 min备用。
分离培养基:富集培养基1 000 mL,琼脂20 g,p H=8.0,121℃,灭菌20 min后倒平板备用。
1.2 样品采集与处理
2008年5月从山东省青岛市胶南原琅琊第二虾场的3个刺参养殖池塘中用无菌器皿分别采集水样、泥样(池塘底泥和刺参附着基泥)和刺参肠道样。取泥样1 g置于盛有9 mL无菌生理盐水的试管中,充分打匀后取上清液。同时,取刺参肠道样1 g置于盛有9 mL无菌生理盐水的研磨器中,充分研磨后取上清液,然后制备样品液。水样不做处理,直接作为样品液备用。
1.3 菌株的富集、驯化与分离
将不同来源的样品液分别接种于100 mL富集培养基中,15℃摇床振荡培养1周后按10%的接种量转接驯化培养基中继续振荡培养7d,同样的操作方法连续富集驯化6次。取最后一次的培养液采用平板涂布法在分离培养基上涂布分离,挑取生长较好的单菌落经多次划线纯化,获得单菌株,编号保种。
1.4 菌株筛选
1.4.1 初筛 初将活化的细菌采用平板划线法在分离培养基上划线后,15℃培养48~72 h,记录细菌的生长情况,选取能在48~72 h内生长良好的细菌,作为二筛的菌株。
1.4.2 二筛 对初筛得到的菌株进行好氧性检测。将活化的菌悬液以10%的接种量接于盛有富集培养基的试管中,摇匀后15℃静置培养48~72 h,选取在富集培养液上层液面生长、生长好的菌株进行下一步的筛选。
1.4.3 三筛 菌株的潜在致病性检测。根据俞勇等[14]的报道,利用血平板(购于济南百博生物技术有限责任公司)检测菌株有无潜在的致病性,可以淘汰一部分潜在的病原菌。用无菌牙签分别挑取二筛菌株单菌落点种于血平板,置于15℃恒温培养48~72 h后观测有无溶血圈,选取无溶血圈的菌株进行下一步的研究。
1.4.4 四筛 通过检测细菌对刺参饵料的降解能力进行四筛,检测项目有COD和NH4-N,即通过培养一定时间后测定各菌株对饵料富集培养液中的COD值和氨氮值的去除率大小来衡量细菌利用刺参饵料的能力。每株菌为1个处理,初始菌浓度皆为1.0×106cfu/mL(即时以血球计数板计数[15]),以不加菌的处理作为对照,每个处理设3个平行,15℃、160 r/min恒温摇床振荡培养5 d后,取样于6 000 r/min离心10 min后取上清,立即测定上清液COD和NH4-N值,用1-COD5/COD0、1-N H4-N5/N H4-N0分别表示各菌株对刺参饵料中有机污染物和氨氮的5 d的降解效果,选取降解效果最好的菌株进行研究。
1.5 菌株鉴定
1.5.1 菌株的形态观察及生理生化鉴定 按照文献[15-16],对菌株的形态学特征及生理生化特性进行了初步鉴定。
1.5.2 菌株的16S rDNA序列测定 基因组DNA采用水煮法提取[17]。16S rDNA扩增引物为细菌16S rDNA通用引物,正向引物:5′-AGAGTT TGA TCC TGG CTC AG-3′(E.coli27F),反向引物:5′-TAC GGC TAC CTTGTTACG ACTT-3′(E.coli 1492R)。PCR产物(1.5 kb左右)送至北京三博远志生物技术有限公司进行测序。将测序结果用Blast软件与GenBank(http://www.ncbi.nlm.nih.gov)中的相关属种的16S rRNA序列进行比对,参照文献[18]采用Clustal X、BioEdit和MEGA 4.1等软件进行系统进化分析,Kimura2-Parameter Distance模型计算进化距离,用Neighbor-Joning法构建系统发育树,1000次Replications,计算Bootstrap值评估树的置信度。
1.6 菌株降解特性研究
生长曲线测定:采用光电比浊法[19],将菌株活化培养24 h后按1%的接种量接种2216E液体培养基,在15℃、160 r/min下恒温振荡培养,每2 h取3个重复样测定OD600值,以平均值绘制生长曲线。
降解特性研究:接种菌体于2216E培养基中,恒温振荡培养至对数期(约培养32 h),离心收集菌体,用无菌生理盐水洗涤2次后重悬作为降解试验接种菌液。若无特别说明,试验均以富集培养基为菌培养液,体积为100 mL,菌体接种量为(1~5)×10-3(菌培养液菌体密度为1.0×106cfu/mL),15℃,160 r/min摇床振荡培养,定时取样,每个处理3次重复,菌体生长量采用光电比浊法测定OD600值表示。研究菌体生长和对COD、氨氮降解的关系。研究温度对菌体生长和饵料液中COD、氨氮降解的影响,温度分别设置为5、10、15、20、25和30℃。研究初始p H值对菌体生长和对COD、氨氮降解的影响,初始p H值分别设置为5.0、6.0、7.0、7.5、8.0、8.5、9.0、10.0。研究饵料质量浓度对菌体生长和对COD、氨氮降解的影响,不同饵料质量浓度设置方法:陈海水分别浸泡不同质量的刺参饵料(0.5、1.0、2.0、5.0、10.0、15.0和20.0 g/L),48 h后离心取上清。
1.7 分析方法
参照文献[20],COD采用碱性高锰酸钾法进行测定,NH4-N采用靛酚兰比色法进行测定。实验所用试剂药品均为分析纯。
数据统计分析采用SPSS13.0 for Windows软件进行,数据结果以平均值±标准偏差(mean±S.D.)表示。各处理之间的差异采用单因子方差分析(One-Way ANOVA)和Duncan多重比较法进行,当P<0.05时认为差异达到显著水平。
2 结果
2.1 菌株分离与筛选
经多次富集和驯化,从3个刺参养殖池塘的不同来源样品中共分离纯化出18株细菌以供筛选。初筛、二筛和三筛后,共筛选到8株低温菌。对此8株菌进行四筛,结果如表1所示。
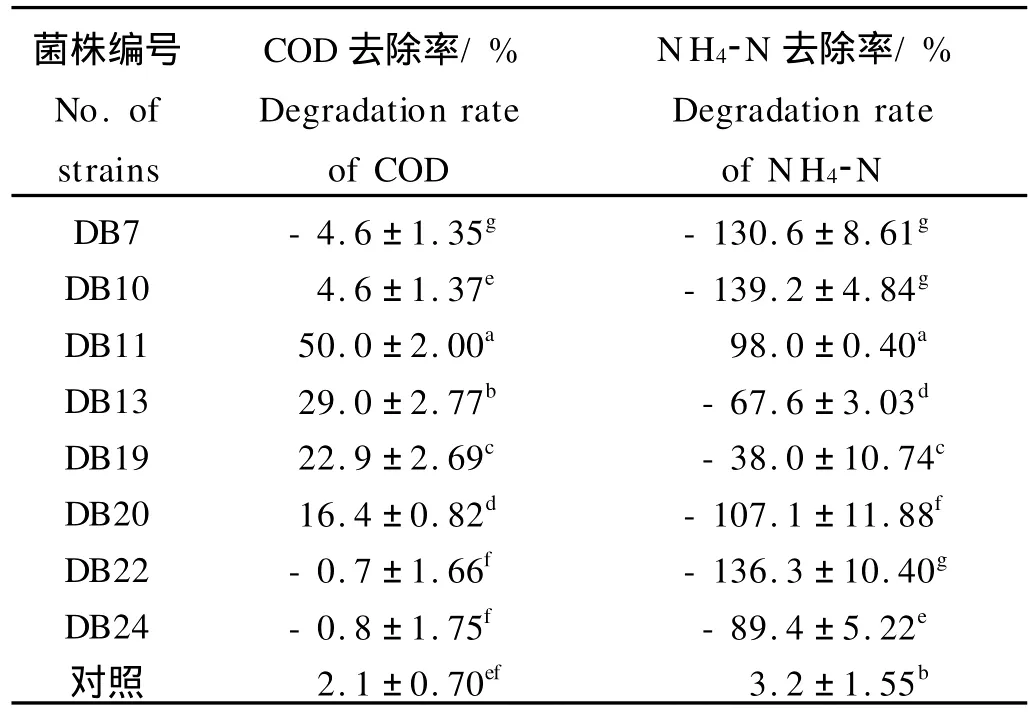
表1 菌株利用刺参饵料能力Table 1 Biodegradation of sea cucumber feed by bacteria strains
实验所用刺参饵料液有机物浓度高达878.4±32 mg/L,氨氮浓度为22.79±0.51 mg/L。在以刺参饵料为营养物质的情况下,各菌株对饵料中有机物和氨氮的利用能力不同。在5 d的时间里,发现DB11、13、19和20这4株菌能高效利用刺参饵料中的有机物,与对照差异显著(P<0.05),其中DB11利用有机物能力最强,去除率达50%;在氨氮降解方面,只有菌株DB11对饵料中的氨氮有很强的去除作用,5 d内达到了98%的去除率,而其它菌株与对照相比,不但没有降解氨氮作用,反而使饵料中氨氮浓度有显著的不同程度的提高(P<0.05),分析原因可能是菌株分解有机物的同时产生了大量的氨氮而本身又不降解所致。综合以上,本文选取最优菌株DB11进行相关研究。
2.2 菌株鉴定
经分离筛选,得到1株能高效降解刺参饵料中有机物和氨氮的菌株DB11。经初步鉴定,菌株DB11为球状,革兰氏阴性,不运动,没有鞭毛,不产生芽孢;在2216E固体平板上15℃培养48~72 h,其菌落呈橘黄色、圆形、隆起、不透明、边缘整齐、表面较湿润光滑;单个、两两或短链相聚,二分裂方式生殖。菌株生理生化特性见表2。

表2 菌株DB11的生理生化特性Table 2 Physiological and biochemical characteristics of strain DB11
菌株DB11的16S rDNA序列已在GenBank中注册,登录号:GU338411。将其与数据库中的相关16S rDNA序列进行同源性比对分析,发现与该菌株序列同源性最高的绝大多数为副球菌属(Paracoccussp.)的菌株,选取相关菌株的16S rDNA序列用Neighbour-Joining method构建系统发育树(见图1)。由图1所示,菌株DB11位于Paracoccus分支上,与副球菌属的Paracoccus marcusii(EF491972)序列相似性达99.7%,结合形态特征、生理生化特性,将菌株DB11初步鉴定为马氏副球菌。

图1 菌株DB11及其相关菌的基于16S rDNA基因序列的系统发育树Fig.1 Phylogenetic tree based on 16S rDNA gene sequences of strain DB11 and other related strains using Neighbour-Joining method
2.3 菌株特性研究
2.3.1 生长曲线的测定 采用光电比浊法测定了菌株DB11的生长曲线。结果如图2所示。
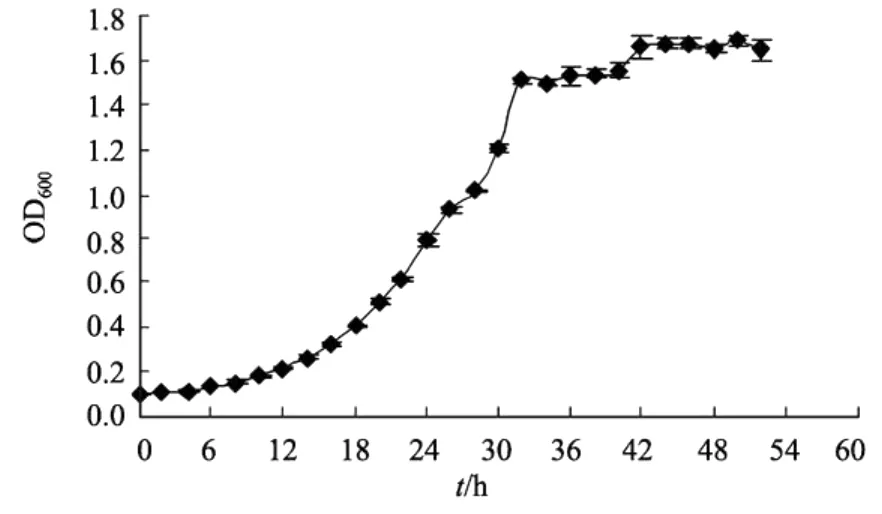
图2 菌株DB11的生长曲线Fig.2 Growth curve of strain DB11
由图可见,0~6 h菌处于生长延滞期,6~42 h处于生长的对数期,生长速度明显加快,尤其在30~32 h之间菌生长最快,42 h后进入稳定期和衰亡期。
该菌株属于低温菌,生长周期比较长,其在2216E中的生长特征与其在刺参饵料富集培养基中有明显不同(见下文图3:菌株在富集培养基中的生长特征)。通过比较发现,该菌在刺参饵料富集培养基中生长对数期长,第1~2天生长迅速,约在第4天达到稳定期;生长量大,在对数期的第2 d生长量OD600值就达到1.91±0.14,稳定期的生长量OD600值约为2.55±0.09,均明显高于其在2216E培养基中的最大生长量1.66±0.05,因此从菌生长量和生长周期两方面考虑该菌更适于在刺参饵料富集培养基中生长。
2.3.2 菌体生长与COD、NH4-N降解的关系 菌体生长与COD降解之间的关系如图3所示。可以看出,菌体的生长对饵料液中的COD具有明显的去除作用,一定时间内(2~5 d)COD浓度随着细菌的生长不断降低,总去除率达54.3%。在第1天菌体虽然有所生长,但对COD的降解作用不显著,可能是因为菌株刚从延滞期进入对数期、对饵料液的作用时间不够;在第2天COD浓度开始显著降低,与细胞已进入对数生长期(OD值显著提高)具有很大的关系;整个试验期间以第2天~第3天的去除效果最好,2 d内去除率达46.6%,占总去除率的绝大部分,这与菌株在第2~3天时生长最快、处于对数期不无相关;到第5天COD达到最大去除率,饵料液中COD浓度达到最低值,之后的5~7 d时间COD全都维持在最低水平,这也与菌体在第4~7天生长不显著、达到稳定期或衰亡期有关。综上所述可以看出,7 d试验期间在2~5 d菌体的生长对饵料液中COD含量有明显的去除作用,菌体生长的快慢对COD降解的大小有直接的显著的影响。
菌体生长与NH4-N降解之间的关系如图4所示。可以看出,菌体的生长对饵料液中的NH4-N含量亦有明显的去除和控制作用,一定时间内去除率几乎达100%。具体从第1天开始,饵料中的NH4-N含量就急剧下降,至第3天达到最低值0.04 mg/L,去除率达99.85%;第4天氨氮浓度仍处于很低的水平,第5天开始慢慢上升,至6~7 d的2 d内基本维持在5 mg/L以下,远小于初始氨氮浓度。菌体的生长以2~3 d生长最快,处于对数期,对氨氮的降解作用显著;第4天之后生长缓慢,开始进入稳定期和衰亡期,从而导致氨氮浓度有些许的升高。总的看来,菌株对饵料中的氨氮有很好的降解作用,菌体的快速生长能有效去除饵料中的氨氮。

图3 菌株DB11的生长与COD降解关系Fig.3 Influence of the growth of strain DB11 against degradation of COD

图4 菌株DB11的生长与氨氮降解关系Fig.4 Influence of growth of strain DB11 against degradation of NH4-N
2.3.3 温度和初始p H对菌体生长和对COD、氨氮降解的影响 从图4中可见,菌株DB11在5~30℃温度下均能生长,适温温度范围为15~30℃,在适温温度范围内菌株的生长量无显著性差异,但其对COD和氨氮的降解程度却不同。菌株对COD的降解在15~30℃适温范围内效果都很好,但最佳降解温度为20℃(P<0.05),15、25和30℃彼此之间无显著性差异;对氨氮的降解以10~25℃较好,最佳降解温度为15℃(P<0.05)。菌株DB11降解饵料COD和氨氮的最佳温度虽不一致,但差别不大,考虑菌株的生长量和刺参自身的生长温度环境,本文选择15~20℃作为菌株DB11降解刺参饵料的最佳温度范围。
图5表明,菌株DB11生长的适宜p H范围为7~10,最适p H为8,属于典型的海水菌;在降解COD方面,发现整个p H范围内COD降解率变化基本呈现先升后降的趋势,同菌株的生长量变化趋势基本一致,菌株的最佳降解p H范围为7.5~8.5,在此范围之外降解率都有不同程度的明显的降低;菌株对氨氮的降解以p H范围为8~10最好,当p H<8时氨氮降解率逐渐降低,可见高p H值有利于菌株对氨氮的降解。通过分析发现,菌株DB11不宜于在酸性环境下生长,其对饵料中COD和氨氮的去除效果也容易受酸性条件的制约,结合实验分析及养殖实际情况,本文确定p H值为8.0~8.5是菌株生长和饵料降解最佳p H范围。

图5 温度对菌株DB11菌体生长和COD、氨氮降解的影响Fig.5 Effects of temperature on growth of strain DB11 and degradation of COD and NH4-N
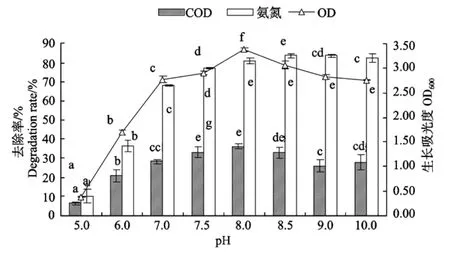
图6 p H对菌株DB11菌体生长和COD、氨氮降解的影响Fig.6 Effects of p H on growth of strain DB11 and degradation of COD and NH4-N
2.3.4 刺参饵料质量浓度对菌体生长和对COD、NH4-N降解的影响 从图7所示可见,COD和N H4-N随饵料变化变化趋势呈现出一致性,当饵料质量浓度<5.0 g/L时,COD和N H4-N含量在数值上随着饵料质量浓度的增加而略有增加,但均无显著性差异(P>0.05),COD含量在27.0~72.2 mg/L之间,N H4-N含量在0.36~0.55 mg/L之间,当饵料质量浓度>5.0 g/L时,COD和NH4-N含量均随着饵料质量浓度的增加而明显的增加(P<0.05),尤其在5.0~15.0 mg/L之间增加显著,在20.0 g/L的刺参饵料浸泡液COD高达1228.8±83.20 mg/L,NH4-N高达18.57±0.25 mg/L。可见,饵料质量浓度直接决定着饵料液中COD和N H4-N的含量。
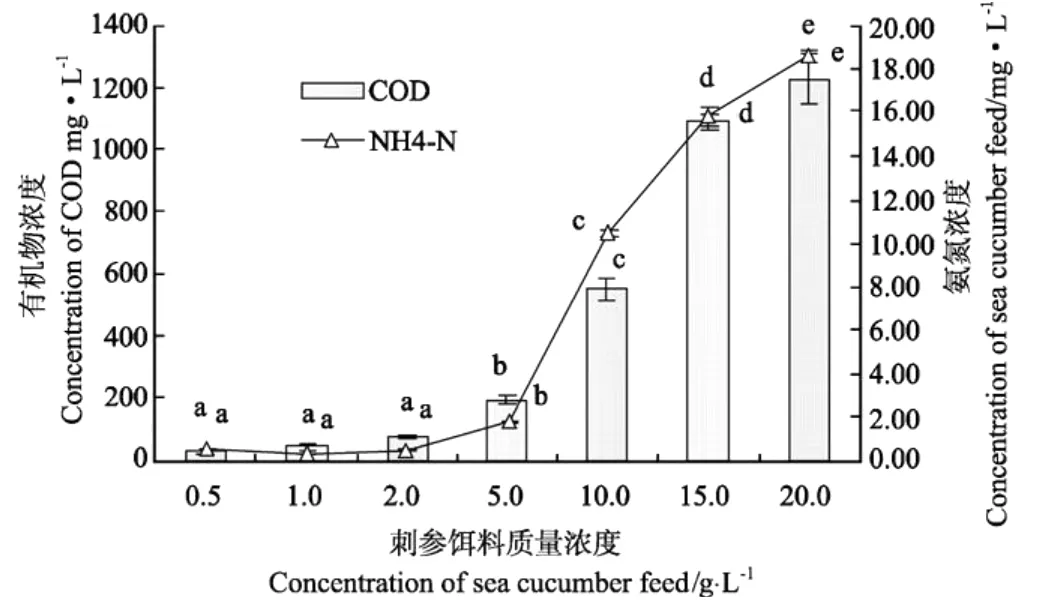
图7 不同质量刺参饵料中COD、氨氮含量的变化Fig.7 Fluctuation of COD and NH4-N contained in sea cucumber feed

图8 刺参饵料质量浓度对菌株DB11菌体生长和COD、氨氮降解的影响Fig.8 Effects of concentration of sea cucumber feed on growth of strain DB11 and degradation of COD and NH4-N
由图8可知,不同刺参饵料质量浓度对菌株DB11的生长及其对饵料的降解作用有显著的影响。在菌体生长方面,不同饵料质量浓度下的菌体生长量呈现出显著性差异(P<0.05),饵料质量浓度越高,菌体生长量越大,尤其在2.0~5.0 g/L和5.0~10.0 g/L之间的菌体生长量增长幅度最大,可见,饵料质量浓度的高低在一定范围内决定着菌体生长量的大小,浓度越高,菌体生长量越大,反之,越低。在饵料降解方面,饵料质量浓度在1.0 g/L以上时,菌株有不同程度的显著的饵料降解作用,如在1.0~5.0 g/L的时候,菌株DB11对有机物有一定的降解作用,当饵料质量浓度大于10.0 g/L的时候,各处理之间无显著性差异,COD去除率均能达到50%以上,其中以15.0 g/L的去除率最高,3 d内降解率为65.7%±7.32%,菌株DB11对N-N的降解作用相当好,对整个饵料浓度范围(1.0~20.0 g/L)内的氨氮3 d时间内几乎达到了100%的去除率;饵料质量浓度低于1.0 g/L时,菌株不但没有饵料降解作用,反而增加饵料液中的COD和N-N含量(P<0.05),分析原因可能是饵料质量浓度太低,其中的营养物质匮乏,导致菌体生长量低,不能有效降解其中的有机物和氨氮,另一方面,3 d后菌株很可能已处于衰亡期阶段,细菌的死亡及自身的分泌物会导致饵料液中COD和N-N含量的增加。
3 讨论
本研究利用刺参饵料配制的海水培养基作为唯一驯化分离筛选培养基,从刺参养殖池塘环境中分离筛选出1株能高效利用刺参饵料中COD和氨氮的优良菌株DB11。该菌株主要来源于参池泥样和刺参肠道样中,水样中含量很少未检测到。在富集驯化过程中,刺参饵料质量起始浓度为20 g/L,样品连续富集驯化6次,7 d/次,并每次按10%的比例逐级增加饵料质量,提高饵料渗出液浓度,筛选分离到能在高浓度饵料液中生长的优势菌种,为后续的筛选工作打好了基础。菌株DB11经过鉴定,为马氏副球菌(Paracoccus marcusii),序列相似性达99.7%。通过对此菌株进行了进一步的相关研究,确定了该菌株降解COD和氨态氮的动力学、最佳温度和最佳p H以及饵料质量浓度对其生长和饵料降解作用的影响。结果表明,该菌株在15~20℃(刺参生长摄食温度)、p H=8.0~8.5、低接种量((1~5)×10-3)、3~5 d时间内对1.0~20.0 g/L质量浓度的刺参饵料浸出液都有很好的降解作用,氨氮的去除率几乎达100%,COD的去除率也很高,说明菌株DB11对由于刺参饵料造成的有机物和氨氮污染具有高效降解作用,而且其大量存在于池塘底部,在刺参养殖池塘底质修复方面有不可估量的作用。
本研究中的富集培养基是参考莫照兰等[10]、俞勇等[14]文献的方法,以20 g/L的刺参饵料质量浓度浸泡而成,浸泡时间较长(2 d),以保证饵料中的可溶性有机物和氨氮完全浸出,力求接近刺参养殖池塘的自然状况。浸泡后,可见刺参饵料完全变成了散泥沉在水底。经采用碱性KMnO4法测定饵料浸出液的COD,其数值在1 g/L左右,高出上述文献报道的对虾饵料浸出液COD值的3~4倍,这可能与饵料种类及浸泡时间有关。可以看出,菌株DB11对此刺参饵料浸出液中高浓度的有机物降解率达到一半以上,这一降解效果是非常可观的。通过以上分析,菌株DB11能高效降解刺参饵料,特别是高浓度的刺参饵料,能利用饵料中的有机物和氨态氮为C、N源快速生长,是一株优良的刺参饵料降解菌株。
相关研究表明,在一定接种比例范围内,接种比例越高,菌株对降解对象的去除率越高,而目前大多数研究在降解菌株的接种量方面都是以10~100×10-3的高比例进行的[8,10-11,14]。在本研究中,为了力求与刺参养殖池塘菌密度的自然状况相接近,菌株DB11采取了比较低的接种比例(1~5×10-3),接种后菌体密度一般在1.0×106cfu/mL左右。但在研究饵料质量浓度对菌体生长以及COD、NH4-N降解影响中,接种比例设定为5×10-3,菌悬液菌体密度约为4.0×106cfu/mL,结果发现该菌株对20.0 g/L刺参饵料浸泡液中的有机物的去除率在3 d时间内就达到了63.3%±0.80%,比先前50.0%±2.00%有了很大的提高。因此,可预见,若按照(10~100)×10-3的高比例接种,该菌株对饵料中的有机物和氨氮可能会有更好的去除效果。
本研究中发现,尽管菌株DB11生长的最适温度范围为20~30℃,但其对饵料中有机物和氨氮的利用能力却在15~20℃时更好,表明该菌株在低温条件下更能有效地利用有机物和氨氮。而菌株DB11在20~30℃时的生长量稍高于15~20℃低温条件下的生长量的原因,可能与在较高温度下菌株可以额外利用饵料中的其它营养成分进行生长有关。东秀珠等[16]对副球菌属特征的描述指出,副球菌属最适生长温度在25~30℃之间,好氧,但当硝酸盐、亚硝酸盐或氧化氮存在时,其能以它们的电子受体营厌氧生长。因此菌株DB11有可能在20~30℃时利用了饵料中的N、N或者其它营养成分进行厌氧生长,从而获得较高的生长量,具体情况有待进一步研究。如果最终可以证实该菌株在高效利用有机物和氨氮的同时,还能够有效利用亚硝酸盐和硝酸盐,那么其对刺参饵料将具有更彻底、更广泛的降解作用。
本研究筛选得到的菌株DB11在15~20℃对饵料中有机物和氨氮具有较高的利用能力,表明该菌株在刺参养殖业中可能具有较大的潜在应用价值。众所周知,刺参养殖的适宜水温一般在15~20℃之间。在这一温度范围内,人工饵料的投喂比较集中,但由于大部分细菌的生长较慢,因此水体中的残饵的分解率也较低,导致大量的残饵积累在刺参养殖池塘中。而进入高温季节后,这些积累的残饵会大量分解,不仅恶化底质和水体环境,也严重影响即将或已进入夏眠的刺参的生长和存活。因此,如果能将此菌株应用到刺参养殖生产中,则可以及时降低刺参生长季节中池塘有机残饵积累,大大减少高温季节有机物分解对池塘环境的污染,从而有效缓解因环境恶化对刺参生长和存活造成的危害。
综上所述,作者认为菌株DB11是1株优良的低温刺参饵料降解菌,具有接种量低、降解效率高的特点,在刺参养殖生产实践中具有较大的潜在应用价值。从其降解特性来看,不仅可以应用于残饵分布较多的刺参养殖池塘底质的修复,还可以应用于人工饵料投喂较多的刺参工厂化养殖和育苗水体中,因此具有广阔的应用前景。
[1] Deng H,He C B.Isolation and pathogenicity of pathogens from skin ulceration disease and viscera ejection syndrome of the sea cucumberA postichopus japonicus[J].Aquaculture,2009,287:18-27.
[2] Smith F,Briggs M R P.Nutrient buintnsive shrimp ponds:Implications for sustainability[J].Aquaculture,1998,164(18):117-133.
[3] 黄凤莲.滩涂海水种植-养殖系统微生物修复研究[D].广州:中山大学,2005.
[4] 陈亚丽,张先恩.甲基对硫磷降解假单胞菌WBJ23的筛选及其降解性能的研究[J].微生物学报,2002,42(4):490-497.
[5] Milanese M.Chelossi E,Manconi R,et al.The marine sponge Chondrilla nuculaSchmidt,1862 as an elective candidate for bioremediation in integrated aquaculture[J].Biomolecular Engineering,2003,20(6):363-368.
[6] Diep C N,Cam P M,Vung N H,et al.Isolation ofPseudomonas stutzeriin wasterwater of catfish fish-ponds in the Mekong Delta and its application for wasterwater treatment[J].Bioresource Technology,2009,100:3787-3791.
[7] 刘卫东,苏浩,邓立康.微生物在水产养殖中的应用[J].水产科学,2001,20(2):28-31.
[8] 谢航,邱宏端.地衣芽孢杆菌降解水产养殖中残余饵料的特性研究[J].福建水产,2008,118(3):31-35.
[9] Zhou Q L,Li K M,Xie J,et al.Role and functions of beneficial microorganisms in sustainable aquaculture[J].Bioresource Technology,2009,100:3780-3786.
[10] 莫照兰,王祥红.虾池有机污染物降解细菌的筛选[J].水产学报,2000,24(4):334-338.
[11] 李秋芬,曲克明.虾池环境生物修复作用菌的分离与筛选[J].应用与环境生物学报,2001,7(3):281-285.
[12] Tanasomwang V T,Nakai Y.Vibrio-inhibiting marine bacteria isolated from black tiger shrimp hatchery[J].Fish Pathol,1998,33:459-466.
[13] Zhu B W,Yu J W.Purification and partial characterization of an acid phosphatase from the body wall of sea cucumberStichopus japonicus[J].Process Biochemistry,2009,44:875-879.
[14] 俞勇,李会荣.虾池养殖环境有机污染物降解细菌的筛选[J].青岛海洋大学学报:自然科学版,2003,33(1):065-070.
[15] 杨文博.微生物学实验[M].北京:化学工业出版社,2004:37-82.
[16] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:364-379.
[17] 陶天申,杨瑞馥,东秀珠.原核生物系统学[M].北京:化学工业出版社,2007:63.
[18] 孙燕,洪青,李顺鹏.一株生物表面活性剂产生菌的分离及其特性研究[J].微生物学通报,2009,36(8):1110-1116.
[19] 陈金春,陈国强.微生物学实验指导[M].北京:清华大学出版社,2005:36-38.
[20] 雷衍之.养殖水环境化学实验[M].北京:中国农业出版社,2006:31-59.
Isolation,Identification and Characterization of a Low-Temperature Degrading Bacterium
YAN Fa-Jun,TIAN Xiang-Li,DONG Shuang-Lin,NIU Yu-Feng
(The Key Laboratory of Mariculture,Ministry of Educaion,Ocean University of China,Qingdao 266003,China)
A low-temperature bacterium named DB11 was isolated from sea cucumber outdoor culturing ponds with high degradation of organic-pollutants and ammonia-nitrogen.Physiological and biochemical tests and the 16S rDNA sequence similarity analysis indicated that strain DB11 was similar toParacoccus marcusii.When inoculated into the sea cucumber-feed-enrichment-medium by less than 5×10-3,strain DB11 was able to utilize 50%of COD and 98%of NH+4-N within five days at 15℃.Further degradation studies showed that the appropriate range of temperature and p H value for growth of strain DB11 was 15~30℃and p H 7~10,respectively,while the optimal temperature and p H value conditions for degradation of sea cucumber feed was 15~20℃and p H 8.0~8.5,respectively.Strain DB11 could decompose sea cucumber feed concentration of 10~20 g/L with 56.9%~65.7%of COD degradation rate,and feed concentration of 1~20 g/L with 91.7%~99.9%of NH+4-N degradation rate,respectively,within 3 days after inoculated by 5×10-3.
low-temperature bacterium;organic-pollutants;ammonia-nitrogen;isolation and identification;degrading characteristics
S917.1
A
1672-5174(2011)03-024-07
国家十一五科技支撑计划课题(2006BAD09A01);国家高技术研究发展计划项目(2006AA10Z409);国家十一五支撑计划项目(2006BAD09A06);山东省自然科学杰出青年基金项目(JQ201009)资助
2010-02-22;
2010-06-25
闫法军(1984-),男,博士生。E-mail:yanfajun2007@163.com
**通讯作者:Tel:0532-82032117;E-mail:xianglitian@ouc.edu.cn
责任编辑 于 卫

