Pannonibacter phragmitetusBB的分离、鉴定及其对Cr(Ⅵ)还原研究
黄顺红
(湖南有色金属研究院,湖南长沙 410015)
·环 保·
Pannonibacter phragmitetusBB的分离、鉴定及其对Cr(Ⅵ)还原研究
黄顺红
(湖南有色金属研究院,湖南长沙 410015)
文章旨在分离获得高效的Cr(Ⅵ)还原功能菌。结果表明,从湖南某铬渣堆场铬污染土壤中分离出一株具有较强还原Cr(Ⅵ)能力的细菌,24 h内基本还原500 mg/L Cr(Ⅵ)。细菌16S rDNA的测序及比对均显示该菌属Pannonibacter phragmitetus,并将此细菌命名为BB。扫描电镜(SEM)表明,P.phragmitetusBB在500 mg/L Cr(Ⅵ)下,其细胞形态仍然是很完整,没有破裂和穿孔。EDAX分析表明,Cr是还原产物中的最主要元素。XPS分析进一步表明,Cr(Ⅵ)的还原产物是Cr(Ⅲ)化合物。
Pannonibacter phragmitetus;六价铬;还原;产物
环境中的铬污染主要来自于矿石的冶炼、铁合金的生产、颜料的制作、皮革加工以及煤和石油的燃烧,不合理的铬渣堆存方式导致日益严重的环境污染问题。铬主要以Cr(Ⅵ)和Cr(Ⅲ)这二种价态稳定存在于环境中,Cr(Ⅵ)具有极强毒性,有致癌性、致畸性、致突变性[1,2],而Cr(Ⅲ)毒性很小,且在环境中相对稳定。此外,Cr(Ⅵ)可移动,易溶于水,而Cr(Ⅲ)在pH>5时易形成不溶于水的氧化物和氢氧化物[3]。因而,Cr(Ⅵ)还原为Cr(Ⅲ)是一种较好的治理环境铬污染的措施。
近几十年使用的Cr(Ⅵ)化学还原法,由于其高成本和产生的二次污染问题,被认为是一种不理想的Cr(Ⅵ)污染治理手段[4]。近来,由于生物处理法具有经济性、安全性及稳定性,越来越多的学者致力于Cr(Ⅵ)污染的生物修复研究。许多不同种类的土著微生物从活性污泥和工业废水中分离出来,并有效地把有毒的、易溶的 Cr(Ⅵ)转化为低毒的 Cr (Ⅲ)[5,6]。然而,由于取样的艰巨,从铬渣堆下土壤中分离出来的铬还原菌未见报道。
Pannonibacter phragmitetusBB是一种新的高效六价铬还原菌,分离自高碱、高铬的铬渣堆放场土壤。在此,作者研究该菌在纯培养液中对Cr(Ⅵ)的还原,观察Cr(Ⅵ)还原前后该菌的形态变化,并利用X射线能谱(EDAX)和X射线光电子能谱(XPS)分析确定还原产物的成分。
1 实验方法与材料
1.1 培养基
培养基按以下组分配制:蛋白胨10 g,NaCl 2 g,酵母浸膏5 g,葡萄糖4 g,H2O 1 L,调节pH值至9.8。
配制好的培养基于121℃的高压灭菌锅中灭菌30 min后,冷却备用。
1.2 Cr(Ⅵ)还原菌的采集和分离
称取10 g湖南某厂铬渣堆场表层土壤于150 mL已灭菌的锥形瓶中,加入10 mL灭菌培养基,于30℃培养箱中培养4 d后,稀释涂布平板法分离。在250 mg/LCr(Ⅵ)固体培养基上,轻轻转动平板,使菌液与培养基混合均匀,用三角棒充分涂匀,将平板倒置于30℃培养箱中培养5 d,观察菌落的形态。用平板划线分离法,用接种针挑取不同形态的菌落,接种于含250 mg/LCr(Ⅵ)的固体培养基上,倒置于30℃培养箱中培养一段时间,即可得到铬耐受菌的纯菌株,置于4℃冰箱中保存备用。以上所用介质均在高压灭菌锅中121℃下灭菌30 min。
1.3 细菌的鉴定
委托上海生工生物工程技术服务有限公司对铬还原菌进行核酸序列的测定。
将所测得的16S rDNA序列与GenBank数据库中的已知菌株的16S rDNA序列进行比较,依据比较结果选择相关菌株的16S rDNA序列,采用Blast方式进行多序列匹配排列,通过 Mega3.1软件中Neighbor Joining的方法,构建系统发育树。
1.4 铬耐受菌还原六价铬的能力检测
用接种环挑取菌株于装有100 mL灭菌培养基的锥形瓶中,30℃,150 r/min摇床培养24 h后,移取10 mL该菌液,接种到含500 mg/L Cr(Ⅵ)的培养基中,30℃摇床培养72 h,期间,分别在培养后6 h、12 h、24 h、36 h、48 h、60 h及72 h取样,每次所取样品离心后上清液用于残余Cr(Ⅵ)的测定。以没有接种细菌的培养基做空白。所有的实验三次重复。
1.5 分析检测方法
采用二苯碳酰二肼分光光度法[7]测定溶液中Cr (Ⅵ)浓度。
还原前后细菌形貌用扫描电镜(SEM,J EOLJSM -6360LV)和透射电镜(TEM,J EM-1230)分别进行观察并拍照。
反应中生成蓝灰色沉淀,在真空抽滤装置中用去离子水冲洗4遍,除去沉淀中可溶性物质,于120℃烘干8 h,用X射线能谱仪(EDAX,Finder 1000)分析其元素组成。
取少量上述烘干的沉淀样品置于X射线光电子能谱仪(J PS-9200)测定反应产物中铬的价态。
2 结果与讨论
2.1 细菌的分离与鉴定
从铬渣堆下土壤中分离到四株铬耐受菌。从颜色上看,有兰灰色、浅灰色、白色、黄色四种铬耐受菌在含250 mg/L Cr(Ⅵ)的培养基中生长,其中一株细菌在250 mg/L Cr(Ⅵ)固体培养基中长成的菌落显示独特的兰灰色,且呈圆形、隆起,表面光滑、湿润、边缘整齐。将该细菌命名为BB菌。细菌BB的分子生物学鉴定表明,其扩增的16S rDNA基因序列长度为1 410 bp。
将细菌BB的16S rDNA序列提交到 Genbank数据库中,用BLAST程序对细菌BB的16S rDNA基因序列和Genbank中已登录的16S rDNA基因序列进行核苷酸同源性比较,结果发现细菌BB的16S r DNA与菌株Pannonibacter phragmitetusstrain有很高的同源性,其相似性达到99%(如图1所示)。因此,初步鉴定该细菌BB应归属于Pannonibacter phragmitetus。
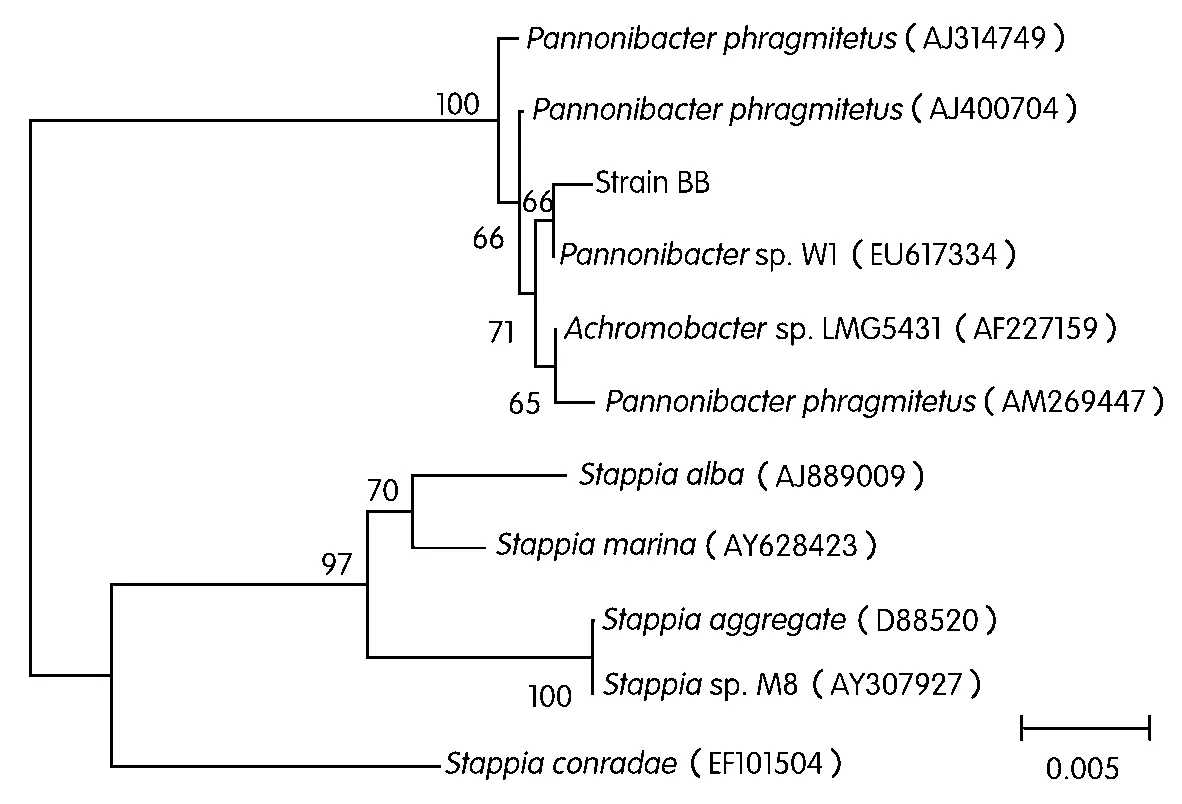
图1 基于BB菌16S rDNA序列的系统发育树
从不同污染场地分离出的铬还原菌种类很多,主要有脱硫弧菌(Desulf ovibrio vulgaris)、芽孢杆菌(Bacillus sp.)、假单胞菌(Pseudomonas sp.)、希瓦氏菌(Shewanella sp.)等。但迄今为止,还没有Pannonibacter phragmitetus strain还原Cr(Ⅵ)的报道。本研究所发现的细菌可为微生物修复Cr(Ⅵ)污染提供一种新的微生物源。
2.2 P.phragmitetusBB还原Cr(Ⅵ)
挑取P.phragmitetusBB单菌落,接种到100 mL灭菌无铬液体培养基中,于30℃振荡箱中培养24 h后,按10%接种量分别移取相应体积的菌液于含Cr(Ⅵ)浓度500 mg/L的培养基中,置于30℃恒温培养箱中培养,于培养后一定时间,取一定量培养液,离心,测定上清液Cr(Ⅵ)浓度,结果如图2所示,由图2可知,在有菌液的培养液中,24h内Cr(Ⅵ)基本去除,而在未接种细菌的培养液中,Cr(Ⅵ)浓度基本未变,这说明P.phragmitetusBB有较强的还原Cr(Ⅵ)的能力。在P.phragmitetusBB还原Cr(Ⅵ)过程中,有明显的颜色变化,含Cr(Ⅵ)的培养液从最初的黄色变成兰灰色,而且,有大量兰灰色沉淀物聚积在瓶底,这种沉淀物可能是Cr(Ⅲ)化合物。
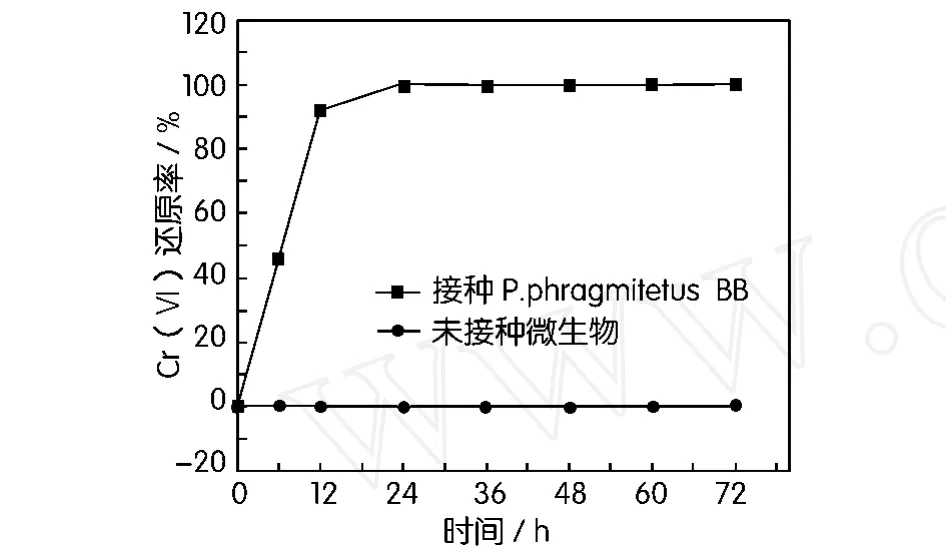
图2 Cr(Ⅵ)随培养时间递增的浓度变化
2.3 铬还原菌BB还原Cr(Ⅵ)前后的形貌特征
为进一步了解P.phragmitetusBB还原Cr(Ⅵ)前后自身形貌的变化,将上述含500 mg/L Cr(Ⅵ)和不含铬的细菌BB培养液在4℃,10 000 r/min离心,收集菌体并烘干,固定,喷金,于扫描电镜(SEM)下观察,扫描电镜图如图3所示。由图3(A)和(B)可知,无铬培养基中生长的细菌BB表面是完整的,P.phragmitetusBB呈杆状,尾部生有鞭毛,表面附有少量丝状物质。在500 mg/L Cr(Ⅵ)培养基中生长的细菌(图3(C)和(D)),其细胞形态仍然是很完整,没有破裂和穿孔,说明该Cr(Ⅵ)浓度不会对细菌BB造成毒害,P.phragmitetusBB可以耐受 500 mg/L Cr(Ⅵ)甚至更高浓度的Cr(Ⅵ)。
P.phragmitetusBB还原500 mg/L Cr(Ⅵ)后另一个形貌变化就是还原后的细菌介质中有大量的不定形物质生成(图3(C)和(D)),同时,一些细菌的末端黏附着一团不定形物质,该物质在无铬培养的细胞上是不存在的,因此初步推测,该物质为Cr(Ⅵ)还原产物——三价铬的沉淀。研究发现,Cr(Ⅵ)还原后的产物,常常以不同的形式附着在铬还原菌的表面[8~10]。Shewanella oneidensisMR-1还原 Cr (Ⅵ)的产物Cr(Ⅲ),与细菌DNA缠绕在一起,以小圆球的形式积聚在细胞表面[1]。而对于A rthrobacterK-4,铬还原的产物以不规则的小结形态束缚于细菌表面[7]。
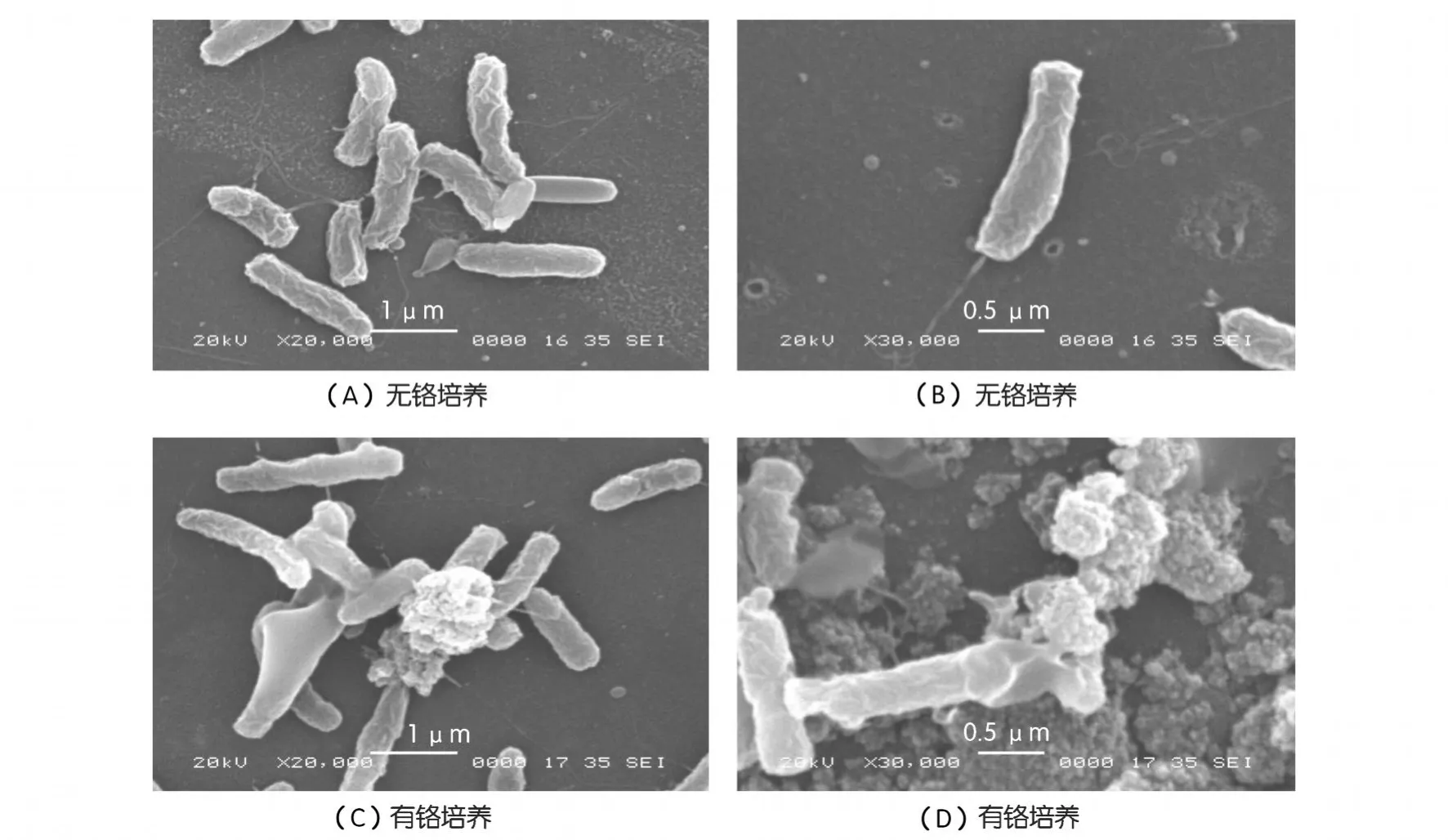
图3 无铬培养的 P.phragmitetusBB扫描电镜图(SEM)和500 mg/L Cr(Ⅵ)生长中的 P.phragmitetusBB扫描电镜图
P.phragmitetusBB透射电镜图如图 4所示。在放大倍数为20 000的透射电镜下发现,反应前细菌表面无附着物,内部有空腔或者囊泡结构,推测菌体内黑点为细菌的遗传物质(图4(A))。还原后细胞的切片截面如图4(B)所示,可以看到在细胞表面围绕着一圈深色物质,该物质相对分子质量较大,因此,可以判断该物质和扫描电镜照片中细胞末端无定形物质一样,为还原反应的产物。
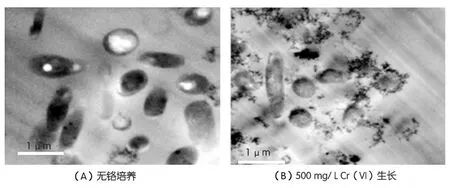
图4 P.phragmitetusBB透射电镜图(TEM)
2.4 还原产物的EDAX分析
将P.phragmitetusBB还原500 mg/L Cr(Ⅵ)后的培养液离心,下部沉淀用去离子水清洗两次,离心,烘干,进行EDAX元素分析,结果如图5所示。根据 EDAX谱线图,P.phragmitetusBB还原 Cr (Ⅵ)的产物中,基本元素有Cr、C、O、N、P、K、Na、Mg、Ca、S、Al及Si。除了元素O、C和N峰外,元素Cr峰高于其它元素峰。在收集Cr(Ⅵ)还原产物时,离心的沉淀部分含有大量P.phragmitetusBB细胞,而菌体元素主要是由C、H、O、N所组成。因此,从EDAX元素分析,反映出C、O、N含量高于Cr。除了这三种元素,Cr是产物中最主要元素。
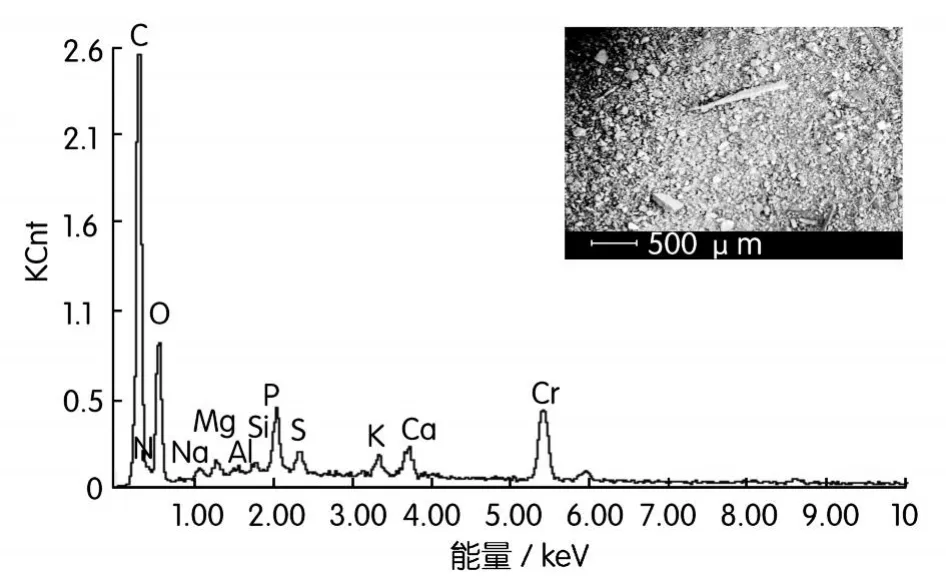
图5 还原产物的x射线能谱
2.5 还原产物的XPS分析
将P.phragmitetusBB还原500 mg/L Cr(Ⅵ)的产物,烘干,磨细,进行 X射线光电子能谱分析(XPS),分析结果如图6所示。细菌BB还原六价铬产物的XPS全元素扫描结果如图6(A)所示,从图6 (A)中可以看出,产物中含有的主要元素为Cr、C、O及N。图6(B)为Cr(Ⅵ)还原产物中铬元素Cr2p3/2和Cr2p1/2峰的XPS窄幅扫描谱,构成Cr2p3/2峰和2p1/2峰的中心位置分别位于577.1±0.1和586.9±0.1 eV。文献[12]表明,氢氧化铬中Cr-O键的Cr2p3/2峰的峰值在576.5~576.9 eV之间,三价铬的主要分裂线Cr2p3/2和Cr2p1/2峰位相差9.9 eV左右,而Cr(Ⅵ)的Cr2p3/2峰位在579.0~579.8 eV之间,主要分裂线Cr2p3/2和Cr2p1/2峰位相差 8.7~9.4 eV。文献[13]及[14]表明, Cr(OH)3·0.4H2O中 Cr(OH)3中 Cr-O键的Cr2p3/2峰位为577.0 eV及577.1 eV,在这几种化合物中,Cr是以三价存在的,细菌BB还原Cr(Ⅵ)产物中铬的Cr2p3/2峰位也在这个位置,说明Cr(Ⅵ)还原产物中有Cr(Ⅲ)存在。图6(C)表明了Cr(Ⅵ)还原后的产物中氧元素的O1s谱线,从图可以看出,其峰位在531.4±0.1 eV。另外,文献[15]报道,当金属与氢氧化物结合时(M-OH),其中的Cr-O键的O1s峰位为531.4 eV,这与Cr(Ⅵ)还原产物中氧的峰位完全重合。这表明,P.phragmitetusBB还原Cr(Ⅵ)产物中的Cr(Ⅲ)是以Cr(OH)3作为Cr的结合状态。此外,化合物 K2Cr2O7中Cr(Ⅵ)的Cr2p3/2结合能在579.4±0.2~579.8 eV之间[16],而从图6所显示的细菌BB还原六价铬产物中Cr2p3/2在这一位置上并没有谱峰出现,这说明Cr(Ⅵ)还原产物中没有Cr(Ⅵ)存在,这进一步说明了P.phragmitetusBB能彻底还原500 mg/L Cr(Ⅵ)。
3 结 论
1.从铬渣堆场铬污染土壤中分离到的细菌BB,能在24 h内能基本还原500 mg/L Cr(Ⅵ),16S rDNA的测序及比对均显示铬还原菌BB是Pannonibacterphragmitetus的一种。
2.P.phragmitetusBB可以耐受500 mg/L Cr (Ⅵ)甚至更高浓度的Cr(Ⅵ)。
3.P.phragmitetusBB还原Cr(Ⅵ)是在胞外发生。Cr(Ⅵ)还原后的产物是Cr(OH)3。
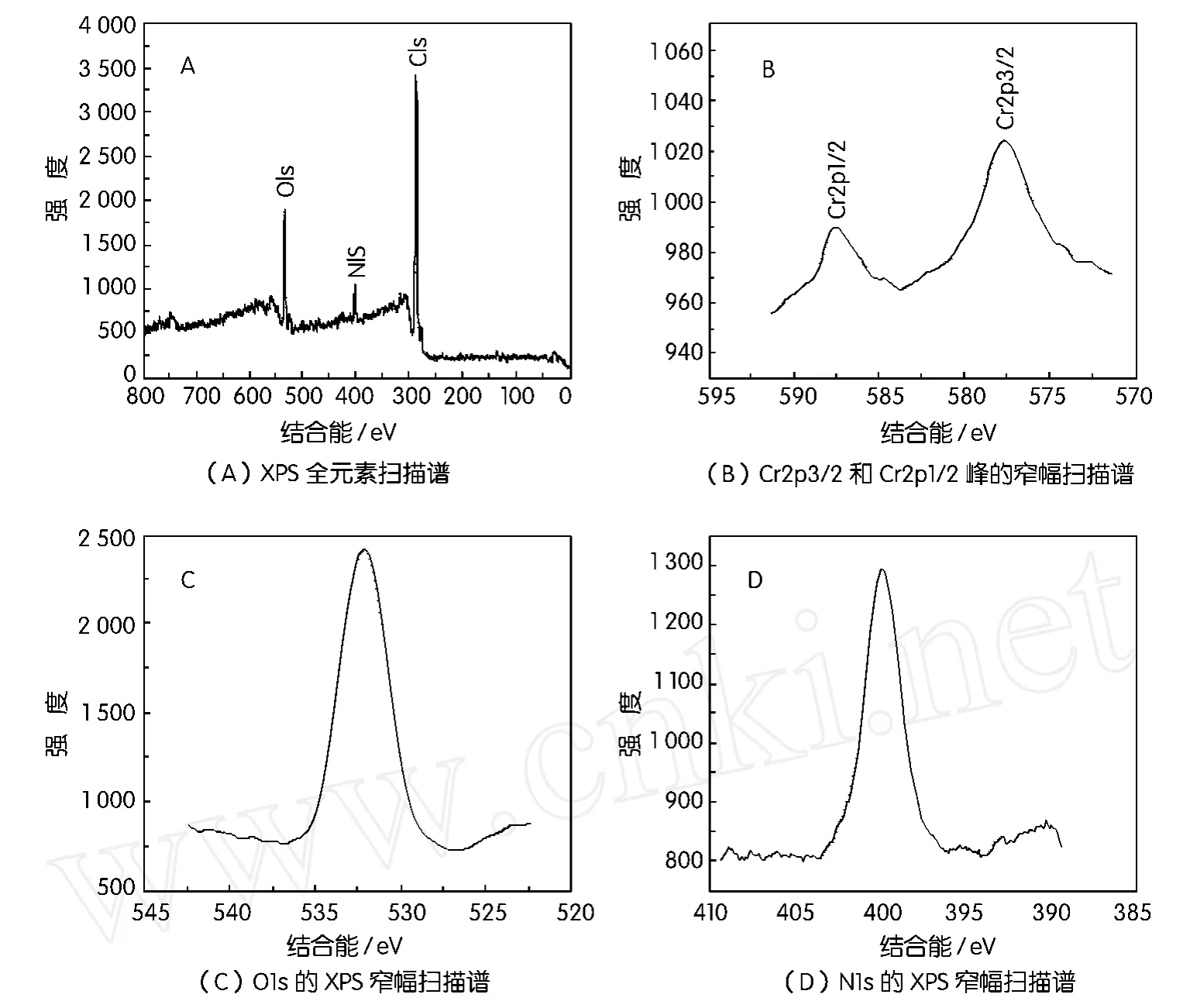
图6 细菌BB还原Cr(Ⅵ)产物的X射线光电子能谱(XPS)
[1] Cheung KH,Gu JD.Mechanism of hexavalent chromium detoxification by microorganisms and bioremediation application potential: A review[J].International Biodeterioration &Biodegradation, 2007,59(1):8-15.
[2] Messer J,Reynolds M,Stoddard L,et al.Causes of DNA singlestrand breaks during reduction of chromate by glutathione in vitro and in cells[J].Free Radical Biology and Medicine,2006,40(11): 1981-1992.
[3] Rai D,Sass B.M,Moore D.A.Chromium(II1)hydrolysis constants and solubility of Chromium(II1) hydroxide[J]. Inorg.Chem.1987,26:345-349.
[4] Fulladosa E,Desjardin V,Murat J.C,et al.Cr(Ⅵ)reduction into Cr(Ⅲ)as a mechanism to explain the low sensitivity of Vibrio fischeri bioassay to detect chromium pollution[J].Chemosphere, 2006,65(4):644-650.
[5] Srivastava S,Thakur I.S.Evaluation of bioremediation and detoxification potentiality of Aspergillus niger for removal of hexavalent chromium in soil microcosm[J].Soil.Biol.Biochem.2006,38(7): 1 904-1 911.
[6] Guha H,Jayachandran K,Maurrasse F.Microbiological reduction of chromium(Ⅵ)in presence of pyrolusite-coated sand by Shewanella alga Simidu ATCC55627 in laboratory column experiments [J].Chemosphere,2003,52(1),175-183.
[7] 魏复盛.水和废水监测分析方法[M].北京:中国环境科学出版社,1989.159.
[8] Lin Z,Zhu Y,Kalabegishvili TL,et al.Effect of chromate action on morphology of basalt-inhabiting bacteria[J].Materials Science& Engineering C-Biomimetic and Supramolecular Systems,2006,26 (4):610-612.
[9] Zhu WJ,Yang ZH,Ma ZM,et al.Reduction of high concentrations of chromate by Leucobacter sp CRB1 isolated from Changsha,China[J].World Journal of Microbiology&Biotechnology,2008,24 (7):991-996.
[10]Zakaria ZA,Zakaria Z,Surif S,et al.Hexavalent chromium reduction by Acinetobacter haemolyticus isolated from heavy-metal contaminated wastewater[J].Journal of Hazardous Materials,2007, 146(1-2):30-38.
[11]Middleton SS,Latmani RB,Mackey MR et al.Cometabolism of Cr (Ⅵ)by Shewanella oneidensis MR-1 produces cell-associated reduced chromium and inhibits growth[J].Biotechnology and Bioengineering,2003,83(6):627-637.
[12]McCafferty E,Bernett MK,Murday JS.An XPS study of passive film formation on iron in chromate solutions[J].Corrosion Science,1988,28:559-576.
[13]Asami K,Hashimoto K.X-ray photoelectron-spectra of several oxides of iron and chromium[J].Corrosion Science,1977,17:559-570.
[14]Moffat TP,Latanision RM,Ruf RR.An X-ray photoelectron spectroscopy study of chromium-metalloid alloys-Ⅲ[J].Electrochimica Acta,1995,40(11):1 723-1 734.
[15]Jung Y,Choi J,Lee W.Spectroscopic investigation of magnetite surface for the reduction of hexavalent chromium[J].Chemosphere,2007,68(10):1 968-1 975.
[16]Ikemoto I,Ishii K,Kinoshita S,et al.X-ray photoelectron spectroscopic studies of CrO2and some related chromium compounds[J]. Journal of Solid State Chemistry,1976,17(4):425-430.
Study on the Isolation and Identification of Pannonibacter PhragmitetusBBand Its Reducing Cr(Ⅵ)
HUANGShun-hong
(Hunan Research Institute of Nonferrous Metals,Changsha410015,China)
The objective of this study was to find an indigenous Cr(Ⅵ)-reducing bacterium that can effectively be usedfor Cr(Ⅵ)remediation in the contaminated soils.The results showed that one isolate from soil under a chromium-containing slag heap at a steel-alloy factory in Hunan had a strong ability of reducing Cr(Ⅵ).It can completely reduce 500 mg/L Cr(Ⅵ)within 24 h.Based on 16S rDNA gene sequence and similarity analysis,this isolate was identified asPannonibacter phragmitetusand assigned as strain BB.Images of scanning electron microscopy(SEM)indicated that the cell surface ofP.phragmitetusBB remained intact without cell rupture under 500 mg/L Cr(Ⅵ)stress.Elemental analysis by energy dispersive X-ray(EDAX)revealed that Cr was the major element comprising the reduction product.Furthermore,X-ray photoelectron spectroscope(XPS)verified that the Cr(Ⅵ)reduction product was Cr(Ⅲ)compounds.
Pannonibacter phragmitetus;hexavalent chromium;reduction;product
X172
A
1003-5540(2010)06-0052-06
黄顺红(1972-),女,博士,工程师,主要从事重金属废水、废渣处理与资源化、矿冶环境生物技术的研究工作。
2010-09-25

