m3AChR-G11α融合蛋白表达及功能检测
白立川,郭政东,张雪薇,孙 科,姜爱民
毒蕈碱型乙酰胆碱受体(mAChRs)是G蛋白偶联受体家族的成员之一,具有该家族特征性的分子结构及跨膜信号转导方式,由7个跨膜区,3个膜内环和3个膜外环以及位于胞外的N端及位于胞内的C端构成,通过与不同的G蛋白相偶联介导信号转导过程。mAChR由5种亚型m1~m5构成,经激动剂活化后,与异三聚体 G-蛋白(Gα~GDPβγ)形成受体-配体-G蛋白异三聚体复合物,并使G蛋白活化,即 Gα~GDPβγ解离成 Gα~ GDP 和 Gβγ亚基,同时Gα亚基上的GDP被GTP替换从而兴奋下游效应器,引起生物学效应。mAChR受体与G蛋白的融合使信号转导分子间具有精确的1∶1的化学定量关系及相互毗邻的空间位置,使紧紧锚定在细胞膜上,且不受内源性G蛋白的影响[1]。
本研究采用分子生物学技术,将编码m3AchR与G蛋白G11α亚单位的cDNAs进行重组,通过Baculovirus-infected Insect cells在Sf9昆虫细胞中表达m3AChR-G11α融合蛋白[2-3],利用[3H]QNB 放射性配体饱和结合实验和[35S]GTPγS放射性配体竞争替代结合实验检测这种高效偶联的融合蛋白的偶联功能,阐明m3AChR-G11α与G蛋白G11α亚单位相互作用和信号转导机制及影响因素,鉴别和寻找m3受体亚型特异性配体。
1 材料与方法
1.1 药品与试剂 人m3AChR与牛G11,的cDNAs,杆状病毒载体质粒pBacPAK9 cDNAs购于TaKara Co;乙酰胆碱(acetylcholine,ACh)、卡巴胆碱(carbachol,CCh)、匹鲁卡品(pilocarpine)、MCN-A-343、4-damp、阿托品(atropine)、GDP、GTPγS 及达菲那新等药品受赠于日本东京大学医学部脑生化研究室。PCR反应试剂盒购于宝生物公司。BCA法测定膜蛋白浓度试剂盒购于宝信公司。Sf9昆虫细胞株由北京大学生命科学院陈建国教授所赠;TNM-FH昆虫细胞培养基购于Sigma公司;胎牛血清购于TBD公司;放射性配体[3H]二苯羟乙酸奎宁酯([3H]QNB 17.8 PBq·mol-1)购于 Amersham Pharmacia Biotech 公司,[35S]GTPγS(40 TBq·mmol-1)购于中国同位素公司。
1.2 构建重组 pBacPAK9-M3-G11α的表达载体通过两步PCR方法构建的m3AChR-G11α的cDNAs的融合,第1步PCR方法分别应用m3和G11,的扩增引物,94℃ 30 s,55℃ 30 s,74℃ 60 s,30 个循环。第2步PCR:取 m3AChR 与 G11α的 cDNAs片段各6 μl,加入缓冲液、dNTPs、聚合酶,94℃ 30 s,60℃ 30 s,74℃ 60 s,5 个循环后加入引物(M3BamH1、G11αsalⅠ),94℃ 30 s,55℃ 30 s,74℃ 60 s,20 个循环。T4连接酶的作用下,通过应用限制性内切酶BamH1、salⅠ将外源性 m3AChR-G11α的 cDNAs 插入到pBacPAK9的 cDNAs载体中,形成重组的pBacPAK9-m3AChR-G11α的表达载体 m3的扩增引物:m3-BamHⅠ5'-GGATCCATCACCTTGCACAATAAC-3',m3-C 末端 5'-CAAGGCCTGCTCGGTGCGCGC TT-3',G11α的 扩 增 引 物:m3-G11α5'-GCAGGCCTTGATGCGCATCATCCA-3',G11α-Sal Ⅰ 5'-CCTCAGGCGTCGACAAAATATGAA-3'
1.3 细胞培养和病毒转染 从冷冻冰箱中取出冻存的Sf9细胞,在室温下快速复苏,而后使其附壁生长于含有8%胎牛血清的TNM-FH昆虫细胞培养基中,将培养瓶放于27℃ ±1℃培养基中进行培养。当Sf9细胞生长至50%融合时,转染重组的pBacPAK9-m3AChR-G11α表达载体,继续培养 48 h,收集Sf9细胞,置于-70℃冰箱中备用。
1.4 膜蛋白的制备及BCA法测定膜蛋白浓度取-70℃冻存的Sf9细胞沉淀,放于冰盒中,用预冷的匀浆缓冲液重悬起Sf9细胞沉淀,倒入Dounce匀浆器中,冰浴中匀浆20次,在低温(4℃)下,15 000×g离心30 min,重复1次,弃上清,收集沉淀,取部分沉淀用BCA蛋白测定法测定蛋白含量,其余沉淀分装后置于-70℃冰箱中冻存备用[4]。
1.5 [3H]QNB放射性配体饱和结合实验和[35S]GTPγS放射性配体竞争替代结合实验 取10 μl膜蛋白样品,分别加入(1~6)×10-9mol·L-1的[3H]QNB放射性配体10-5L进行放射性配体结合实验,检测融合蛋白的活性及表达水平。实验分两组系列管,即总结合管(TB)及非特异性结合管(NB),在非特异性结合反应管中加入10-5mol·L-1阿托品(atropine)。特异性结合的放射性配体数量等于总结合管结合的放射性配体数减去非特性结合管结合的放射性配体数,依据张幼怡主编的《受体信号转导研究方法》一书中的计算公式,计算出表达的融合蛋白的含量。在[35S]GTPγS放射性配体竞争替代结合实验反应体系中,依次加入用HEN缓冲液稀释的膜蛋白,药品(10-3mol·L-1ACh、10-3mol·L-1Pilo、10-3mol·L-1CCh、10-3mol·L-1MCN-A-343、10-6mol·L-1Atro、10-6mol·L-14-Damp、10-6mol·L-1Dafi)进行功能检测。
1.6 统计分析 采用SPSS 10.0及Excel软件对实验结果进行检验分析。
2 结果
2.1 构建重组的融合蛋白m3AChR-G11αcDNAs
2.1.1 分别扩增 m3AChR 与的 G11αcDNAs 通过PCR的方法分别扩增 m3AChR与的 G11αcDNA,50 μl L l反应体系经30个循环后,分别取出5 μl PCR反应产物电泳,电泳图片如图Fig 1A、Fig 1B所示,Fig 1A为G11αcDNA,片段长度为1 065 bp;Fig 1B为m3cDNA,片读长度为1 773 bp。
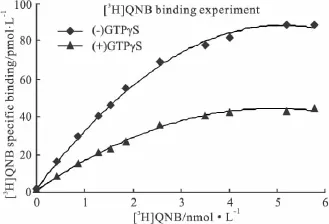
Fig 1A The PCR product of G11αcDNA. The right lane was G11α(1 065 bp),and the left lane was DNA marker.Fig 1B The PCR product of m3cDNA. The right lane was m3(1 773 bp),and the left lane was DNA marker
2.1.2 通过 2步 PCR 实现 G11αcDNA 与 m3cDNA的连接 通过第二次PCR,使m3AChR 3'端与 G11α5'端连接,得到连接的 m3AChR-G11α的 cDNAs,电泳结果如Fig 2所示,右侧的条带为m3AChR-G11α的目的条带,片段长度为2 835 bp。
2.2 将病毒重组体转染Sf9细胞 从深冻冰箱中取出冻存的Sf9细胞,在37℃水浴中迅速融化,复苏后放入27℃ ±1℃培养箱中培养,经换液、传代稳定后在倒置显微镜(×400倍)下观察细胞形态。正常的Sf9细胞小而圆,半贴壁生长,3~4 d后可长成单层,局部生长呈蜂窝状(Fig 3A)。当传代细胞生长至50%融合时,转入重组的病毒载体,72 h后观察接种病毒重组体的细胞,镜下可见细胞肿胀,细胞内颗粒增多,脱落,大量胀大、破碎细胞漂浮于培养基中(Fig 3B)。
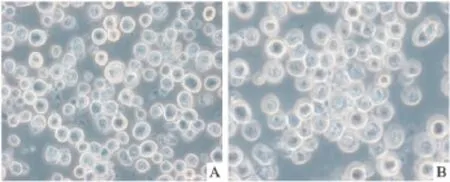
Fig 3A Normal Sf9 cells Fig 3B The Sf9 cells infected by recombinant virus
2.3 用BCA法测定Sf9细胞膜蛋白的浓度 收集Sf9细胞沉淀、经匀浆离心后制得膜蛋白,适量稀释,取部分膜蛋白溶液用BCA蛋白测定法测定膜总蛋白的含量。将其测得的光密度值用Excel软件处理后,绘制标准蛋白曲线,并可得到标准蛋白曲线方程为^Y=0.931 8X -0.098 9,r2=0.099 1,以此方程可计算出样本中的蛋白浓度为2.86 g·L-1。
2.4 [3H]QNB放射性配体饱和结合实验 Fig 4显示m3AChR-G11α融合蛋白与[3H]QNB放射性配体具有高特异性的结合位点,随着[3H]QNB放射性配体浓度的不断升高,融合蛋白与[3H]QNB的结合量随着增加,当[3H]QNB浓度为约6×10-9mol·L-1时,基本达到饱和,表达水平为 7.76 ×10-9mol·g-1,融合蛋白具有m受体与配体高度亲和力的特性,可用于检测m3与G11α相互作用和信号转导机制及影响因素的研究。在10-5mol·L-1GTPγS存在的条件下,融合蛋白与[3H]QNB放射性配体结合的饱和结合曲线明显下移,此时在达到饱和时测得的融合蛋白表达水平为 3.92 ×10-9mol·g-1,提示GTPγS通过与G蛋白的α亚单位结合,降低了非选择性m受体阻断剂QNB与m3受体的亲和力,反映出融合蛋白两组分间的偶联能力。从而为进行[35S]GTPγS放射性配体竞争替代结合实验筛选m3受体亚型特异性药物提供了有利的依据。

Fig 4 [3H]QNB binding studies on stable expressed m3AChR-G11αfusion protein in Sf9 cells withor without GTPγS(n=5)
2.5 不同配体作用下,GDP 对[35S]GTPγS竞争替代结合曲线的影响 Fig 5显示不同种类配体对GDP 替代[35S]GTPγS 与 m3AChR-G11α融合蛋白的结合产生不同的影响。在各种不同配体存在的作用下,[35S]GTPγS 与 m3AChR-G11α融合蛋白结合量不同。在 10-9~10-3mol·L-1GDP 存在时,ACh、Pilo使[35S]GTPγS 与 m3AChR-G11α融合蛋白的结合量明显增多,使[35S]GTPγS放射性配体竞争替代结合实验明显右移;CCh、MCN-A-343 使[35S]GTPγS 与m3AChR-G11α融合蛋白的结合量增加,但程度不及ACh、Pilo 使[35S]GTPγS 与 m3AChR-G11α融合蛋白的结合的增加量;Atro、4-Damp、Dafi存在的情况下与无配体时[35S]GTPγS 与 m3AChR-G11α融合蛋白的结合量相似;结果显示不同配体对 GDP替代[35S]GTPγS 与 m3AChR-G11α融合蛋白的结合产生不同的影响,ACh、Pilo、CCh、MCN-A-343、Atro、4-Damp、Dafi的 IC50值分别为:82.2,93.70,12.10,14.30,1.93,1.37,0.72 ×10-6mol·L-1,无配体存在时其 IC50为 1.99 ×10-6mol·L-1。与无配体存在时相比,激动剂(ACh、Pilo、CCh、MCN-A343)使GDP与融合蛋白中的G11α亚单位亲和力下降;而拮抗剂(Atro、4-Damp、Dafi)使 GDP与融合蛋白中的G11α亚单位亲和力增加。
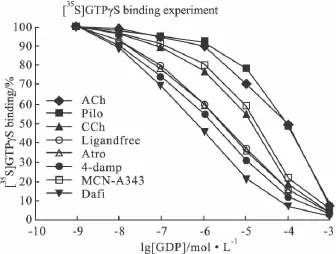
Fig 5 Displacement by GDP of[35S]GTPγS binding to m3AChRG11αfusion protein expressed in Sf9 cells in the presence of ligands:10 -3ACh,10 -3Pilo,10 -3CCh,10 -3MCN-A343,10 -6Atro,10 -64-Damp,10 -6Dafi(n=5,there is a significant difference between all ligand groups and corresponding points of ligand-free group,when GDP at concentration 10-9~10 -3mol·L-1,P <0.05)
3 讨论
本研究以高效偶联的m3AChR-G11α融合蛋白为研究对象,检测在配体作用下,m3AChR-G11α融合蛋白的表达和功能的变化,探讨信号转导中分子间相互作用的机制和影响因素,筛选m3受体亚型特异性药物。
在[3H]QNB放射性配体结合实验中,融合蛋白表现出m受体与非特异拮抗剂QNB的结合能力,并且GTPγS可以抑制融合蛋白与QNB的结合,说明Sf9细胞中表达的融合蛋白两组分间能发生相互作用,且具有与m受体配体结合的特性。
在[35S]GTPγS放射性配体替代结合实验中,[35S]GTPγS竞争性结合作用的变化表明不同配体可以引起替代结合曲线偏移的方向和幅度不同,这种偏移代表了 m3AChR-G11α融合蛋白中的 G11α与GDP亲和力的大小,ACh、Pilo使[35S]GTPγS与m3AChR-G11α融合蛋白的结合量明显增多,使[35S]GTPγS放射性配体竞争替代结合实验明显右移;CCh、MCN-A-343 使[35S]GTPγS 与 m3AChR-G11α融合蛋白的结合量增加,但程度不及 ACh、Pilo使[35S]GTPγS 与 m3AChR-G11α融合蛋白的结合的增加量量,使[35S]GTPγS放射性配体竞争替代结合实验右移;Atro、4-Damp、Dafi存在的情况下与无配体时[35S]GTPγS 与 m3AChR-G11α融合蛋白的结合量相似。也就是说,GDP与G11α的亲和力越低,m3受体催化GDP由G11α上解离下来的能力越高,即激动剂作用时亲和力减小,拮抗剂则使亲和力增强。因此,通过分析GDP与m3AChR-G11α融合蛋白亲和力的大小可以筛选和鉴定m3受体未知的特异性配体。
m3AChR-G11α融合蛋白成功表达为研究m3受体后信号转导机制提供了便利条件,同时也为筛选m3受体亚型特异性配体提供了可能性,为m3受体亚型特异性新药开发和研制提供了有力的实验手段。融合蛋白技术也可用于为其它m受体亚型寻找亚型特异性的激动剂与拮抗剂,这些选择性配体,也可在某些疾病中起到潜在的治疗作用,如阿尔采末病、膀胱过度活动症、心律失常、哮喘、胃肠道疾病等等,具有重要的理论价值和应用前景[5]。
[1] Seifert R,Wenzel-Scifert K,Kobika B K.GPCR-Gα fusion proteins:molecular analysis of receptor-G-protein coupling[J].Trends Pharmacol Sci,1999,20:383 -9.
[2] 郭政东,王海波,李 智,等.M1AChR-G11融合蛋白的表达和功能的检测[J].中国药理学通,2003,19(11):1294 -8.
[2] Guo Z D,Wang H B,Li Z,et al.Detection of the expression and function of m1AChR-G11 fusion protein[J].Chin Pharmacol Bull,2003,19(11):1294 -8.
[3] 韩雪松,郭政东,刘洪瑞,等.应用M2-Gi1α融合蛋白鉴别M2受体亚型的特异性药物[J].中国药学杂志,2005,40(11):868-72.
[3] Han X S,Guo Z D,Liu H R.Effects of various muscarinic ligands on the expression and function of M2 muscarinic acetylcholine receptor-Gi1α fusion protein[J].Chin Pharm J,2005,40(11):868 -72.
[4] Guo Z D,Suga H,Okamura M,et al.Receptor-Gs alpha fusion proteins[J].Trends Pharmacol Sci,2000,21(1):24 -8.
[5] Racke K,Juergens U R,Matthiesen S.The pharmacology of the respiratory tract[J].Eur J Pharmacol,2006,533(1 -3):57 -68.

