针对小胶质细胞上BDNF表达的siRNA筛选及其抑制效应检测
王丽娜,王秀云,左剑玲,许期年,朱卫东,贾晓明,杨建平
脑源性神经生长因子(brain-derived neurotrophic factor,BDNF)在中枢神经系统发育过程中起重要作用,同时也能维持成熟的中枢及周围神经系统神经元的正常功能。近年来研究发现[1],BDNF在脊髓水平伤害感受的调制中发挥了重要作用。最近研究更是将疼痛、神经元、BDNF和小胶质细胞四者紧密的连接在了一起[2~4]。作为沟通神经元-小胶质细胞的重要信息分子,我们已发现脊髓小胶质细胞释放的BDNF在大鼠骨癌痛痛觉过敏中也起着至关重要的作用(数据待发表)。为了进一步研究BDNF在骨癌痛痛觉过敏形成中的作用,本文设计了针对大鼠小胶质细胞BDNF的小干扰RNA(small interference RNA,siRNA),拟采用经典的 LipofectamineTM2000为转染剂,旨在寻找体外可有效抑制小胶质细胞源性BDNF表达的低毒,高效的干扰基因系列,为进一步的体内实验打下基础。此外,鉴于BDNF与小胶质细胞的功能密切相关,本文还观察了应用经筛选验证的高效低毒的BDNFsiRNA后,对小胶质细胞活性的标记物OX-42表达的调节作用。
1 材料与方法
1.1 材料
1.1.1 细胞株 大鼠小胶质细胞株:HAPI细胞株,来源于美国宾西法尼亚州医学院神经解剖学实验室,由南通医学院施建华博士惠赠。
1.1.2 试剂 LipofectamineTM2000(批号:11668-019,Invitrogen公司,美国)。兔抗大鼠 BDNF一抗(批号:ab72439,Abcam公司,美国)、小鼠抗大鼠βactin一抗、HRP标记的山羊抗兔及山羊抗小鼠二抗(Santa Cruz公司,美国)。小鼠抗大鼠 OX-42/CD11b多克隆抗体(Chemicon/Millipore公司,美国)。Alexa Fluor 488 goat anti-rabbit IgG 、Alexa Fluor 594 goat anti-mouse IgG(H+L)和Alexa Fluor 488 goat anti-mouse IgG(Molecular Probes公司,美国);通用型荧光标记的阴性对照FAM-siRNA由上海吉玛制药有限公司合成。Hoechst 33258(批号:861405,Sigma公司,美国)。定量PCR试剂盒(罗氏公司,美国);PCR引物及内参由上海生物工程有限公司合成(HPLC纯化)。
1.1.3 基因序列 根据 E1bashir的设计原则[5],查找SD大鼠BDNF基因序列(GenBank accession#NM_012513)并设计3个siRNA序列(根据靶序列起始位置命名为3对siRNA1588,siRNA283,siRNA232)及1条带合成绿色荧光标记(FAM)的通用阴性对照FAM-siRNA,由上海吉玛制药有限公司合成,序列经BLAST查询,排除与其他基因同源。所有siRNA均只有21对碱基,满足G/C含量<50,且在正、反义3'端分别有2个不配对的TT游离碱基。序列如下:

Tab 1 siRNA oligo
1.2 方法
1.2.1 细胞培养 永生化大鼠小胶质细胞复苏后,用高糖DMEM培养基(含10%胎牛血清、1×105U·L-1青霉素和1×105U·L-1链霉素)在细胞培养瓶中培养,置于CO2培养箱37℃、5%CO2、95%湿度条件下,每1~2 d换液。转染时取对数生长期的细胞(经实验摸索,约在传代2~3次后达到)接种于6孔板(用于检测表达及荧光显微镜拍照计算转染效率)或96孔板(用于细胞毒性实验),加入不含抗生素的适量DMEM培养液(含10%的胎牛血清)继续培养24 h。
1.2.2 转染条件的优化
1.2.2.1 转染细胞密度的优化 取对数生长期的细胞计数后分别接种于6孔板或96孔板稳定培养24 h后进行“伪”转染,即只加入相同容量的细胞毒性较大的LipofectamineTM2000,分别于转染前即刻及转染24 h后光镜拍照,以估算最合适的细胞接种密度。其中24孔板的接种梯度为:0.5×106、1×106、2×106;96 孔板的接种梯度为:3 ×103、1 ×104。每孔梯度组分别重复4~6复孔。
1.2.2.2 转染比例的优化 综合考虑LipofectamineTM2000转染剂要求及我们以往的转染经验[6],分别选择脂质体8 μl与相应剂量的siRNA混匀形成转染复合物,使其终浓度分别为40 μmol·L-1(1∶4)、50 μmol·L-1(1 ∶3)、80 μmol·L-1(1 ∶2);分别按照转染剂说明书及预实验摸索的时间,6孔细胞板于转染时换液,每孔先加入1 ml培养液,将转染复合物0.1 ml单独混合孵育30 min(混合时间已经预实验摸索)后,加入6孔板与培养基轻柔混匀,补充培养液至终容积为2 ml/孔,然后放入CO2孵箱中孵育。每孔梯度组分别重复4~6复孔。
1.2.2.3 转染效率的测定 6孔板的细胞转染24 h后,在培养液中加入Hoechst 33258(终浓度5 mg·L-1)孵育10 min染核,用DPBS洗3遍后,4℃遮光预冷的丙酮固定10 min,PBS洗3遍,以特制的圆形盖玻片加抗荧光淬灭封片剂(碧云天公司,江苏海门)封片。速将细胞置于荧光显微镜下(OLYMPLUS BX60)观察转染效率,选择在激发波长为488 nm下观察FAM的绿色表达,在594 nm下观察Hoechest 33258的蓝色表达,以100倍的视野为标准,两人同时独立估计相同视野下绿色荧光细胞数与蓝色荧光的总细胞数百分比,求FAM表达率:FAM表达率(转染效率)=发绿色荧光细胞数/发蓝色荧光的细胞总数。共计5个视野取其平均值作为转染效率。
1.2.2.4 细胞毒性实验 转染24h后,采用改良的磺基罗丹明 B 法(sulforhodamine B,SRB)[7]进行各转染条件下转染复合物细胞毒性的测定。于酶联免疫检测仪(LP400型号,BioRAD公司,美国)上选择最适波长490nm读数测定光吸收值,并重复3次取平均值。每孔测量组分别重复6~8复孔。计算公式如下:细胞存活率/%=实验组光吸收值/对照组光吸收值×100%。
1.2.2.5 BDNFsiRNA 转染细胞 选用 siRNA与LipofectamineTM2000最佳转染比例,混匀形成转染复合物,转染方法同上。所有的转染实验均至少重复3次。
1.2.3 Real-Time PCR测定 采用TRIzol一步法总RNA提取试剂盒提取细胞RNA。每份标本取等量RNA逆转录酶,按试剂盒说明操作合成cDNA及PCR扩增。BDNF引物序列(134 bp):sense 5'-CTGACACTTTTGAGCACGTGATC-3',antisense 5'-AGGCTCCAAAGGCACTTGACT-3';18 s内参引物(134 bp):sense 5'-AACGAGACTCTCGGCATGCTAA-3',antisense 5'-CCGGACATCTAAGGGCATCA-3'。采用染料法(SYBR Green I)进行Real-Time PCR(MJ Research OpticonTM2荧光定量PCR仪,美国),使其最终反应体系为25 μl。反应条件为:95℃预变性10 min后,95℃变性 15 s→58℃退火20 s→72℃延伸45 s,80℃读板1 s,共45个循环后绘制熔解曲线,72℃再延伸5 min。经多次预实验结合熔解曲线摸索最佳反应条件,采集各自的荧光阈值循环数(Ct值),并至少设4~6复孔进行重复,取其平均值,采用2-△△Ct方法计算基因表达的变化。
1.2.4 Western blot测定 常规ABC法抽提蛋白,变性后经10聚丙烯酰胺凝胶电泳分离,电转移至聚乙烯二氟膜上,滤膜封闭2 h,分别加入一抗(BDNF:1∶100;β-actin:1∶5 000)4℃过夜;洗膜3次;二抗(山羊抗兔:1∶2 000;山羊抗小鼠:1∶10 000)室温1 h;加发光剂ECL,曝光压片、拍照、BIO-ID图像分析软件分析,计算条带的积分光密度值(ID),ID值为平均光密度值(D)×面积。用积分光密度值相对比较蛋白的表达。
1.2.5 荧光免疫组织化学测定 各药物处理组(溶媒组,阴性对照组,BDNF siRNA1588组)细胞经固定后,取出6孔板内的细胞爬片,按照荧光免疫组化流程分别经血清室温孵育后,滴加兔抗大鼠BDNF(1∶50)或小鼠抗大鼠OX-42一抗(1∶200)(如为双标则混合滴加,效价加倍),湿盒4℃下过夜,再滴加二抗(Alexa Fluor 488 goat anti-rabbit IgG或Alexa Fluor 594 goat anti-mouse IgG,双标时混合滴加,效价加倍;OX-42单标使用 Alexa Fluor 488 goat antimouse IgG),室温孵育3 h。切片漂洗数次后用激光共聚焦荧光显微镜(TLS SP2 CLSM型号,Leica,德国)观察。每个药物组随机选取6张爬片进行数码拍照,由不知情的实验员应用计算机辅助图像分析系统(Image Pro-plus 6.0,USA)分别对相同测量面积内的染色进行灰度分析,计算免疫阳性反应的平均光密度值(IOD/area),计算方法为积分光密度(integrated optical density,IOD)除以测量面积(area),每次实验均设立空白和吸附对照。
2 结果
2.1 转染条件的优化结果 转染前即刻及转染后24 h,倒置荧光显微镜下观察拍照发现:6孔板中接种梯度为1×106的细胞生长状态最好,转染前细胞融合度高(数据未显示),且转染24 h后细胞贴壁生长仍疏密合适。96孔板的接种梯度为1×104的细胞密度最合适。此外,本研究在预实验中进行了部分转染条件的优化,发现经2~3次细胞传代,30 min脂质体-siRNA复合物形成时间,转染效率最高。
此外,从Tab 2中可见转染剂相同剂量8 μl下,与 40 μmol·L-1(1 ∶4)、80 μmol·L-1(1 ∶2)组相比,50 μmol·L-1(1 ∶3)siRNA 的转染效率最高(P<0.01),最高可达到(92.2±8.3)%。而SRB结果显示:转染剂相同剂量 8 μl下,40 μmol·L-1和 50 μmol·L-1siRNA组的细胞存活率均达到75%以上,细胞毒性较低。由此可知,应选择LipofectamineTM2000 8 μl复合 50 μmol·L-1siRNA(脂质体与siRNA比例为1∶3),不仅细胞毒性低而且转染效率高,为最佳转染条件。详见Tab 2,Fig 1。
Tab 2 The transfection efficiency and survival rate of transfected cells under different transfection conditions(¯±s,n=6)
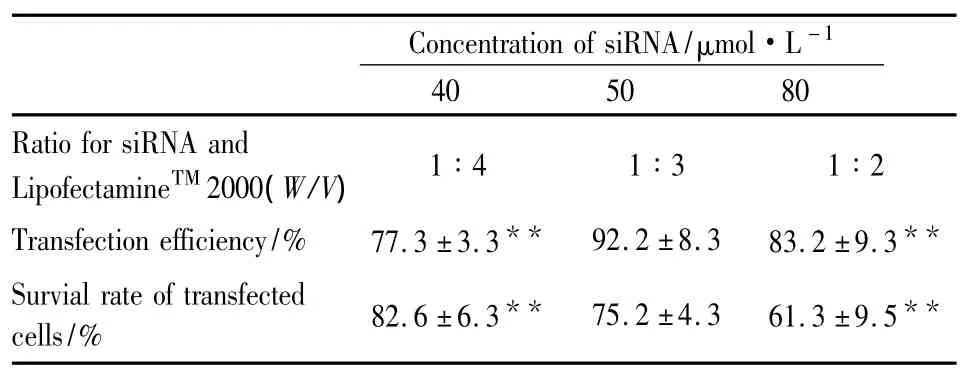
Tab 2 The transfection efficiency and survival rate of transfected cells under different transfection conditions(¯±s,n=6)
**P <0.01 vs group 50 μmol·L -1
Concentration of siRNA/μmol·L -1 40 50 80 Ratio for siRNA and LipofectamineTM2000(W/V)1∶4 1∶3 1∶2 Transfection efficiency/% 77.3 ±3.3** 92.2 ±8.3 83.2 ±9.3**Survial rate of transfected cells/% 82.6 ±6.3** 75.2 ±4.3 61.3 ±9.5**
2.2 Real-Time PCR测定结果 转染后24 h,溶媒组(仅加LipofectamineTM2000)和阴性对照组的BDNF mRNA表达没有差异(P>0.05);BDNF siRNA 3个组的BDNF mRNA表达与阴性对照组相比均有一定程度的降低,且siRNA1588抑制小胶质细胞BDNF基因表达最为明显(P<0.01)。详见Fig 2A。
2.3 Western blot测定结果 转染后48 h,溶媒组和阴性对照组的BDNF蛋白质表达没有差异(P>0.05);BDNF siRNA 3个组的对小胶质细胞的BDNF蛋白表达均有不同程度的抑制,siRNA1588抑制程度最大,详见Fig 2B。
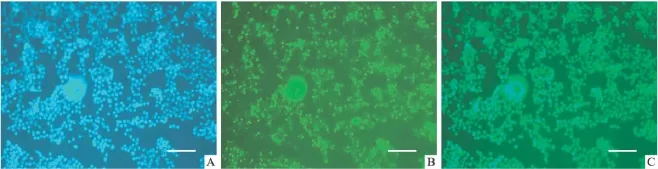
Fig 1 The transfection efficiency after 50 μmol·L -1siRNA treatment
2.4 荧光免疫组化测定结果 荧光双标共聚焦显微成像表明:BNDF和小胶质细胞标志物OX-42存
在共表达,该结果说明BNDF和OX-42共存于同一细胞水平(Fig 3A),为BNDF干扰小胶质细胞的活性提供了直接的形态学证据。
此外,溶媒组,阴性对照组以及siRNA1588组的OX-42染色 IOD/area分别为:0.38±0.01,0.32±0.03以及0.15±0.03。与溶媒组,阴性对照组(两对照组间 IOD/area无差异,P>0.05)相比,siRNA1588处理组的OX-42染色明显减淡,IOD/area明显降低,差异有统计学意义(P<0.01)。详见Fig 3。
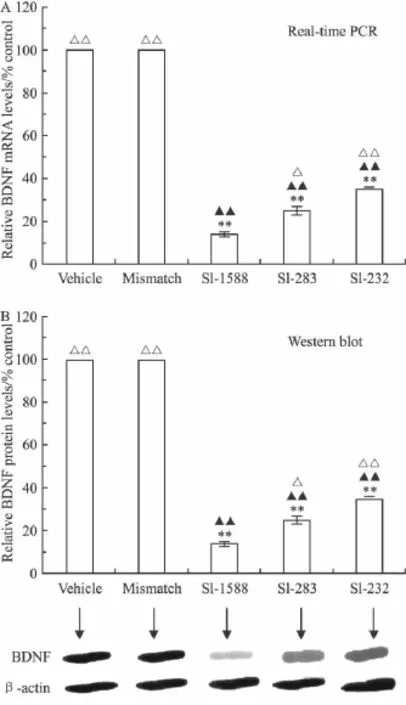
Fig 2 Down-regulation of BDNF mRNA andprotein upon treatment with siRNA
3 讨论
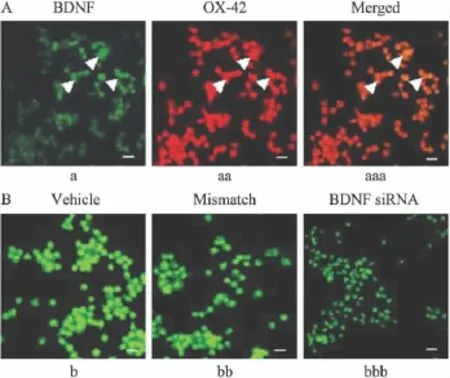
Fig 3 BDNF/OX-42 expression of cellsby immunohistochemistry staining
siRNA技术与传统的反义寡核苷酸技术相比较,具有严格的序列特异性、高效性,基因抑制效果明确、治疗的针对性强、副作用小等优势。然而神经系统的细胞系,包括神经细胞和神经胶质细胞,相对于其他细胞系来讲,是较难转染的一类细胞系。本实验室虽已有转染小胶质细胞的经验[4],但针对不同基因的干扰,要想获得体内外的稳定转染,仍旧需要不断摸索转染条件和转染剂的种类。因此,我们同时研究了细胞传代次数、接种密度、转染复合物的比例及形成时间等对转染效率的影响,以优化转染条件。结果发现:2~3次细胞传代,1×106接种密度(6孔板)、1∶3的脂质体与siRNA比例、30 min的复合物形成时间,转染效率最高。
此外,提高转染效率与降低毒性是两个密切相关的概念,一种基因转染载体真正应用于基因治疗临床必须同时具有这两个特性。因此本研究同时采用了SRB法分析转染复合物的细胞毒性。与传统的噻唑蓝法(3-4,5 diemethylthiazol-2,5 dipheuyl tetrazolium bromide,MTT)测量相比,SRB法克服了MTT法成色反应的时间依赖性,同时SRB法没有MTT试验具有的严格时间窗,从而使大规模的细胞培养实验变得更加便利[7]。我们的结果发现,LipofectamineTM2000 8μl复合50 μmol·L-1siRNA(脂质体与siRNA比例为1∶3),不仅细胞毒性低而且转染效率高,为最佳转染条件。
正常情况下,脊髓部位固有的BDNF主要来源于感觉神经纤维在脊髓的逆行性释放。在疼痛状态下,脊髓部位的小胶质细胞是BDNF分泌的主要来源。新近研究表明[8~10],BDNF 是一个重要的联系神经元和胶质细胞间信息传递和“对话”(crosstalk)的信号分子。我们基于BDNF中和抗体鞘内给药的前期研究表明(数据未发表),脊髓BDNF在大鼠骨癌痛痛觉过敏中起着重要作用。为了进一步研究BDNF在骨癌痛中的作用,我们拟采用 BDNF siRNA在体给药技术进行深入研究。因此,本实验设计并观察了针对BDNF的siRNA对大鼠小胶质细胞的干扰效果,结果发现:以LipofectamineTM2000为转染试剂,化学合成的BDNFsiRNA可成功实现对大鼠小胶质细胞的高效转染。且结合于小胶质细胞BDNF mRNA不同位点上的siRNA对靶基因表达的抑制活性不同,其中以siRNA1588的抑制效果最好,为我们进一步利用该技术研究BDNF信号转导通路在骨癌痛中的作用提供了实验基础。
此外,本文通过荧光免疫组化结合共聚焦观察发现,BDNF与小胶质细胞的标志物OX-42共存,为BDNF干扰提供了直接的解剖学证据;且与对照组相比,经BDNF siRNA1588处理的小胶质细胞活性明显降低(OX-42的IOD值降低)。该结果说明BDNF在小胶质细胞的活性调节中具有重要作用,针对BDNF为靶点进行的体内外干预可能可以通过调节小胶质细胞的功能,从而治疗痛觉过敏。
[1] Merighi A,Salio C,Ghirri A,et al.BDNF as a pain modulator[J].Prog Neurobiol,2008,85:297 -317.
[2] Boudes M,Menigoz A.Non-neuronal BDNF,a key player in development of central sensitization and neuropathic pain[J].J Physiol,2009,587(10):2111 -2.
[3] 唐元章,申 文,刘 苏,等.抑制小胶质细胞激活对骨癌痛小鼠疼痛维持的影响[J].中国药理学通报,2009,25(1):104-8.
[3] Tang Y Z,Shen W,Liu S,et al.Inhibition of microglia activation affected the maintenance of cancer pain in a murine model[J].Chin Pharmacol Bull,2009,25(1):104 -8.
[4] 刘思兰,杨建平,王丽娜,等.有效抑制小胶质细胞上TLR4表达的siRNA筛选及转染复合物细胞毒性的检测[J].中国药理学通报,2010,26(4):457 -61.
[4] Liu S L,Yang J P,Wang L N,et al.Selection of the most effective small interfering RNA which inhibits the expression of TLR4 in microglial cells and detection of the cytotoxicity of transfection complex[J].Chin Pharmacol Bull,2010,26(4):457 -61.
[5] Elbashir S M,Lendeckel W,Tuschl T.RNA inteference is mediated by 21-and 22-nucleotide RNAs[J].Genes Dev,2001,15:188-202.
[6] Liu S L,Yang J P,Wang L N,et al.Down-regulation of Toll-like receptor 4 gene expression by short interfering RNA attenuates bone cancer pain in a rat model[J].Mol Pain,2010,6:2.
[7] 周思朗,屈艳妮,张 健,等.SRB法与MTT法细胞计数应用比较[J].中国现代医学杂志,2005,15(17):2615 -20.
[7] Zhou S L,Qu Y N,Zhang J,et al.Comparison between SRB way and MTT way applying to count cells in cells culture[J].China J Modern Med,2005,15(17):2615 -20.
[8] Lu,V B,Biggs,J E,Stebbing,M J,et al.Brain-derived neurotrophic factor drives the changes in excitatory synaptic transmission in the rat superficial dorsal horn that follow sciatic nerve injury[J].J Physiol,2009,587(5):1013 - 32.
[9] Boudes M,Menigoz A.Non-neuronal BDNF,a key player in development of central sensitization and neuropathic pain[J].J Physiol,2009,587(10):2111 -2.
[10]Zhou L J,Zhong Y,Ren W J,et al.BDNF induces late-phase LTP of C-fiber evoked field potentials in rat spinal dorsal horn[J].Exp Neurol,2008,212(2):507 -14.

