胰酶水解猪皮胶原蛋白及其产物氨基酸分析
胥彩云,童军茂,周晓宏
(1.石河子大学食品学院,新疆 石河子 832000;2.北京理工大学生命科学与技术学院,北京 100081)
胰酶水解猪皮胶原蛋白及其产物氨基酸分析
胥彩云1,童军茂1,周晓宏2,*
(1.石河子大学食品学院,新疆 石河子 832000;2.北京理工大学生命科学与技术学院,北京 100081)
采用胰酶水解猪皮胶原蛋白,研究其降解规律及酶解产物氨基酸组成。研究表明:95℃热处理猪皮胶原蛋白10 min能显著提高酶解速率;整个酶解过程中,可溶性氮、氨肽氮含量呈增加趋势,但3h后增势变缓,而肽含量在3h后达到最大值;大部分不溶性蛋白在酶解6 h后已经变成可溶性多肽和氨基酸;从酶解产物氨基酸组成可表明,采用胰酶水解猪皮胶原蛋白能显著提高其营养价值。
猪皮胶原蛋白;热变性;酶解;氨基酸分析
动物皮肤最重要的一个应用就是制革,但是由于猪皮本身的质地不佳,目前在皮革工业中已经很少采用猪皮,发展猪皮深加工是猪皮加工业的必然趋势。猪皮中约含水分70%~75%[1],蛋白质21%~23%,脂肪1%,灰分0.5%。猪皮中的蛋白质以胶原蛋白为主,含量为87.7%。胶原蛋白具有独特的三股超螺旋结构,三条链相互平行而且由链间氢键相连[2],具有十分稳定的性质,一般的加工温度及短时间加热都难使其分解,因此难被人体吸收,食用利用率较低[3],将胶原蛋白水解为多肽后,其营养及生理功能可显著提高:蛋白质消化吸收率几乎达100%,能保护胃黏膜以及抗溃疡,促进皮肤胶原代谢,抑制血压上升,对关节炎等胶原病具有很好的预防及治疗作用,能促进钙吸收和降低血清中胆固醇含量等[4-6]。胶原蛋白的水解及胶原多肽的利用一直是科学工作者研究的一个热门课题。因此,利用酶技术处理猪皮制备胶原蛋白是提高其资源利用率和附加值的有效途径。目前对猪皮酶水解的研究集中在水解工艺条件的摸索方面,班玉凤等[7]确定了Alcalase对猪皮胶原蛋白水解的最优条件,王川,李燕等研究了用胰酶、木瓜蛋白酶和胃蛋白酶从猪皮中提取胶原蛋白,其中以胰酶提取物得率最高,但结构破坏较严重,用胃蛋白酶提取的胶原蛋白制品的结构最完整,色泽最为洁白,但得率最低[8]。本文采用胰酶氮存在形式、肽分子量分布变化规律以及水解产物的氨基酸组成,为酶技术应用于生产具高附加值的猪皮深加工制品(如复合氨基酸和活性肽等)提供参考。
1 材料与方法
1.1 材料
猪皮购于北京市中关村家乐福超市(冻藏)刮脂、洗净、缴碎,装袋,置于-18℃冰箱中冷冻,试验前从冰箱中取出在流动的自来水中缓化解冻,备用。
胰酶(Trypsin-chymotrypsin)由丹麦NOVO公司提供。
1.2 主要仪器设备及试剂
MM12型绞肉机:广东省韶关市食品机械厂;CU600型电热恒温水箱:上海福玛实验设备有限公司;KDN-2C型定氮仪:上海纤检仪器有限公司;GL-21M高速冷冻离心机:长沙湘仪离心机仪器有限公司;UV-2000型分光光度计:尤尼柯(上海)仪器有限公司。
试验中所采用试剂均为国产分析纯。
1.3 分析方法
氨态氮含量:水解液中游离氨基酸含量占原料中总蛋白质含量百分比,采用甲醛电位滴定法[9]分析;可溶性氮含量:水解液中蛋白质含量占原料中总蛋白质含量百分比,采用微量凯氏定氮法分析;肽基氮含量:水解液中肽含量占原料中总蛋白质含量百分比,即可溶性氮含量与氨基氮含量之差;氨基酸组成分析:日立835-50型氨基酸自动分析仪。
1.4 猪皮水解工艺
酶作用条件采用前期正交优化试验结果。取解冻后猪皮50 g,加100 g蒸馏水匀浆1 min,调节初始pH至8.5,升温至37℃,加入0.3 g胰酶,于水浴上恒温搅拌分别水解 2、4、6 、8、10 、12 h 。酶解完毕,将酶解液于沸水浴中灭酶 20 min,离心(4800 r/min,20 min)过滤,所得滤液为酶解产物。其中未水解样为猪皮匀浆后直接离心过滤的滤液部分,即猪皮水溶性提取物。所有样品均稀释至240 g用于分析。
2 结果与分析
2.1 热处理对胰酶水解猪皮胶原蛋白的影响
分别取猪皮50 g,加入100 g水匀浆1 min,分别于温度为 70、80、90、100 ℃水浴中保温 10 min,然后按照1.4工艺水解2 h。不同温度处理后猪皮胶原蛋白胰酶水解产物中氨态氮、可溶性氮以及肽基氮含量见图1。
由图1可以看出,水解时间相同时,随着热处理温度的增加,猪皮胶原蛋白胰酶酶解产物中可溶性氮、氨基氮含量呈增高趋势,即热变性温度越高,猪皮胶原蛋白消化率越高,70℃以后,这种趋势更加明显。胶原蛋白的分子量约为300000~360000,它是由3条肽链盘绕而成的三股螺旋结构[10],但热处理使三股螺旋解旋而成游离多肽链,破坏分子间的共价交联,引起胶原中键的随机水解,变成大分子明胶,肖和兰等[11]运用傅里叶红外光谱法(FTIR)和二维相关分析(2D correlation analysis)技术研究也发现,在15℃~95℃升温过程中,胶原的3条螺旋肽链之间的氢键减弱,逐渐解螺旋,每条肽链因伸直而使其螺旋度减少,整个蛋白的变化能微扰并引起胶原蛋白结构的变化。以上研究与本试验结论一致,原蛋白质分子致密的立体结构有碍于蛋白酶与底物的结合,热处理使其成为松散的结构,暴露原来包埋于内部的作用位点,从而加速了水解速率。
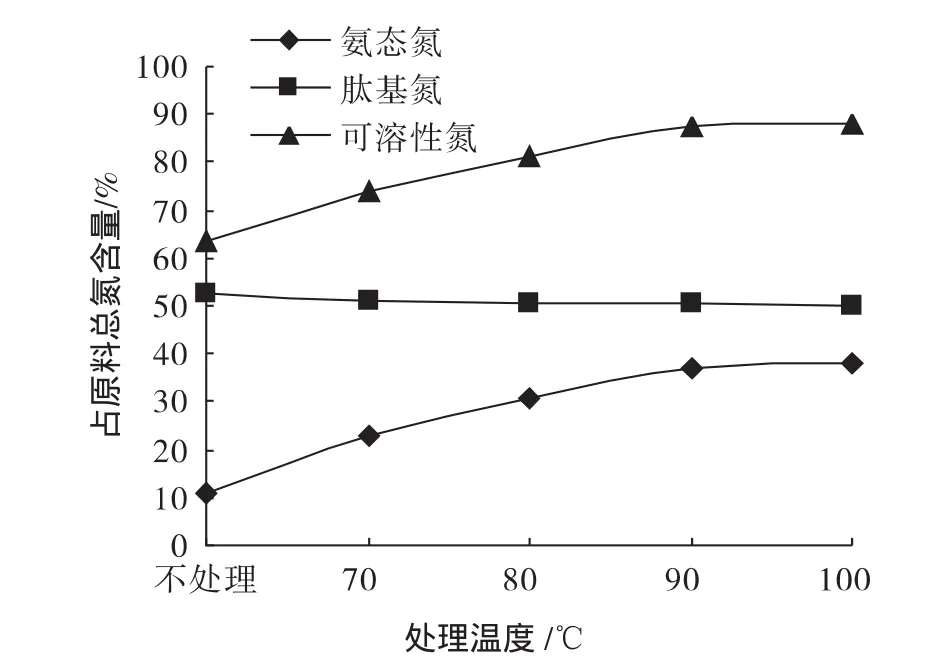
图1 不同热处理温度对猪皮胶原蛋白Trypsin-chymotrypsin酶解产物中氮存在形式影响Fig.1 Effects of different temperatures on N-forms in Pigskin collagen-Trypsin-chymotrypsin hydrolysates
2.2 胰酶水解猪皮胶原蛋白过程中氮存在形式变化规律
由图1可知,在90℃~100℃之间加热预处理可加速胰酶对猪皮胶原蛋白的水解速率,所以采用胰酶水解猪皮胶原蛋白时先于95℃处理底物10 min。再将猪皮匀浆按照酶解工艺水解不同时间,其产物中氨态氮、可溶性氮以及肽基氮含量见图2。
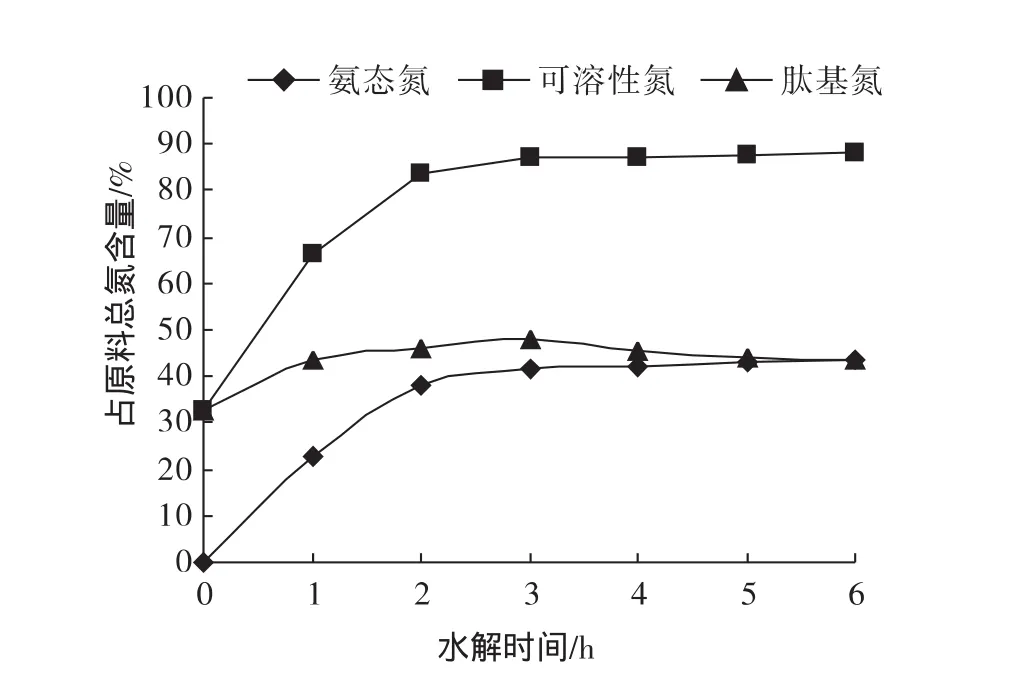
图2 胰酶水解猪皮胶原蛋白过程中氮形式变化Fig.2 Changes of N-forms during hydrolysis of Pigskin collagen by Trypsin-chymotrypsin
由图2可以看出,随着酶解时间的延长,水解产物中可溶性氮、游离氨基酸含量不断地增加,且都在水解3h内增速最快,随后增势变缓;而肽含量也是在水解3h内增速最快,这表明这段时间胰酶主要以猪皮胶原蛋白为底物,酶解3h时肽含量达到最大值,随后下降,这是由于酶解过程中同时存在着猪皮胶原蛋白降解成肽和氨基酸以及这些肽被进一步降解成更小分子量的肽和氨基酸两个过程,这两个过程在酶解过程中某一时间段孰占优势对产物中肽的含量有直接的影响,酶解后期,胰酶主要以产物中存在的肽为底物,释放出更小分子量的肽和氨基酸,因此肽的含量表现出下降趋势。
2.3 胰酶水解猪皮胶原蛋白产物氨基酸分析
一般蛋白质含有20种氨基酸,胶原含有18种氨基酸[12-13],有其特别的组成。由表1可见胶原的氨基酸组成的一些特点。
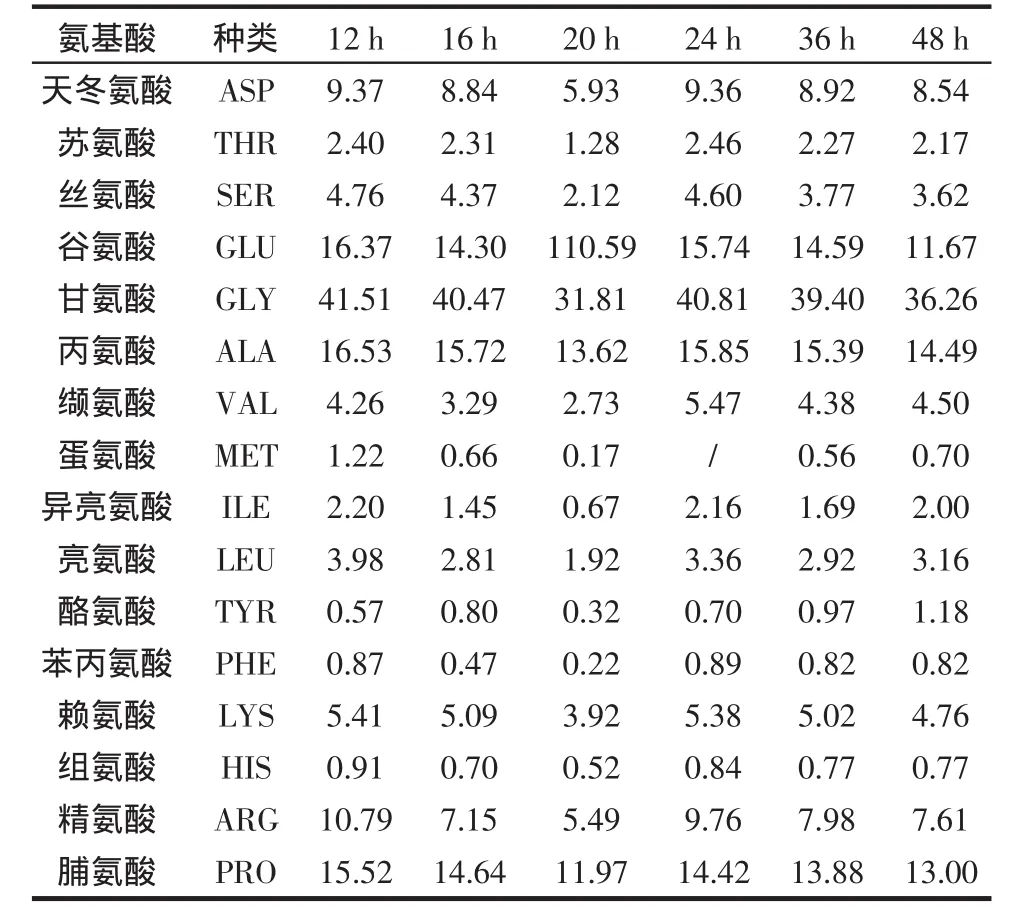
表1 胶原蛋白水解时间对氨基酸含量的影响Table 1 Comparison of amino acid composition in collagen-Trypsin-chymotrypsin hydrolysates at various hydrolysis time%
绝大多数蛋白质中脯氨酸含量很少,而胶原蛋白中脯氨酸和羟脯氨酸的含量是各种蛋白质中最高的,这两种氨基酸都是环状氨基酸,锁住了整个胶原分子,使之很难拉开,故胶原具有微弹性和很强的拉伸强度。
胶原中缺少胱氨酸和色氨酸,只说明胶原是一种不完全蛋白。从营养学意义上讲,胶原是一种硬蛋白,3条肽链之间键合牢固,人和动物很难消化吸收,因此将胶原蛋白酶法水解后,将胶原的3条肽链拆开,成为游离的多肽,进而逐步水解成为小肽和游离的氨基酸,消化吸收率大大提高。
可见,猪皮胶原蛋白经胰酶水解处理后能显著提高其营养价值。
3 结论
胰酶水解猪皮胶原蛋白研究表明:热处理猪皮胶原蛋白大大提高酶解速率:热处理后,酶解液中可溶性氮含量由63.5%增加至87.9%;氨态氮含量由10.8%增加至37.9%。在整个酶解过程中,可溶性氮、游离氨基酸含量呈增加趋势,前3h内增势较快,但3h后增势缓慢,而肽含量在水解3h达到最大值48.1%。大部分不溶性蛋白在酶解4 h后已经变为可溶性多肽和氨基酸,蛋白质的溶解过程基本结束。酶解12 h~48 h各时间段酶解产物中18种氨基酸含量略有变化,但氨基酸种类无变化。表明采用胰酶水解猪皮胶原蛋白能显著提高其营养价值。猪皮胶原蛋白胰酶水解产物中各肽段的具体生理活性、功能性有待进一步研究。
[1]赵胜年.酶解鲜猪皮提取水解胶原蛋白的研究[J].食品工业科技,1998(5):16-17
[2]Misook Kim,Susan E Hamilton,Luke W Guddat,et al.Plant collagenase:Unique collagenolytic activity of cysteine proteases from ginger[J].Biochimica et BiophysicaActa,2007:1627-1635
[3]Piez K A,Eigner E A,Lewis M S.The chromatographic separation and amino acid composition of the subunits of several collagens[J].Biochemistry,1963(2):58-66
[4]菅景颖,张志胜.酶解胶原蛋白研究进展[J].浙江化工,2007,38(1):18-20
[5]曹健,李卫林,张磊,等.酶解胶原蛋白产物分子量的控制研究[J].食品工业科技,2006,27(8):85-88
[6]李彦春,祝德义,侯立杰,等.酶解胶原蛋白多肽的制备与分析[J].中国皮革,2004,33(3):22-26
[7]班玉凤,朱海峰,马君昌.Alcalase水解猪皮胶原蛋白的研究[J].现代食品科技 2004,21(2):59-61
[8]王川,李燕,马志英,等.几种酶法从猪皮中提取胶原蛋白的对比研究[J].食品科学,2007,28(1):201-204
[9]黄伟坤,唐英章,黄焕昌.食品检验与分析[M].北京:轻工业出版社,1989:57
[10]蒋挺大,张春萍.胶原蛋白[M].北京:化学工业出版社,2001:15-23
[11]肖和兰,孙素琴,周群,等.温度对胶原蛋白结构影响的二维红外相关光谱的研究[J].原子与分子物理学报,2003,20(2):211-218
[12]邵泽恩,解守岭,李士英.中国皮革[M].化学工业出版社,2001:15-17
[13]MasatoHiyama,Masaaki Shinozuka,MasaruIizuka,etal.Degradation of Gelatin and Collagen by Serine Proteinase of Aspergillus sydowi[J].Journal of Fermentation And Bioengineering,1996,81(5):464-465
Trypsin Hydrolysis Pigskin Collagen and its Amino Acid Analysis
XU Cai-yun1,TONG Jun-mao1,ZHOU Xiao-hong2,*
(1.College of Food Science,Shihezi University,Shihezi 832000,Xinjiang,China;2.School of Life Science and Technology,Beijing Institute of Technology,Beijing 100081,China)
Pigskin collagen was hydrolyzed by Trypsin-chy motry psin to explore the degrading pattern and the amino acid composition of the resultinghydrolysate.The results showed that heat Pigskin collagen 10 min at 95℃was advantageous to enzymatichydrolysis of Pigskin collagen.Content of soluble nitrogen and amino nitrogen kept on increasing during hydrolysis,but increased slowly after 3h hydrolysis.Peptide content reached a maximum after 3h hydrolysis.A majority of unsoluble protein and peptides were degraded into soluble peptidesand amino acids after 6 h hydrolysis,acid composition in Pigskin collagen hydrolysate suggested that Pigskin collagen hydrolyzed by Trypsin-chymotrypsin improved the nutritional value of Pigskin collagen greatly.
pigskin collagen;heat denaturation;enzymatic hydrolysis;aminoacidanalysis
胥彩云(1983—),女(汉),在读硕士研究生,研究方向:农产品加工与贮藏。
*通信作者
2009-09-17

