131I标记抗Peroxiredoxin I肺腺癌噬菌体抗体在荷瘤裸鼠体内的分布及其对肿瘤生长的抑制作用
李淑杰,罗弋,庞华,李少林
(重庆医科大学1.放射医学教研室,分子医学与肿瘤学研究中心,重庆 400016;2.附属第一医院核医学科,重庆 400016)
Prx I是过氧化物酶(peroxiredoxins,Prxs)的2-Cys亚家族成员,定位于细胞质,在肺腺癌细胞中高表达[1]。Prx I可减少活性氧自由基的产生,其表达上调可增强肿瘤抗氧化能力,是肿瘤抗凋亡和耐药的重要原因[2],可作为肺癌治疗的靶点[3]。
完全人源化的噬菌体抗体作为第三代基因工程抗体的代表,克服了传统抗体的异源性、血清清除速率慢[4,5]、疗效较低及制备工艺复杂等弊端,为肿瘤的抗体诊断和治疗带来新的选择。本研究以Prx I为靶点,利用噬菌体展示技术制备人源化肺癌抗体,并偶联放射性核素,进行抗体放免显像及治疗的研究,为进一步临床抗体制剂开发和应用提供依据。
1 材料与方法
1.1 材料与主要试剂
抗Prx I肺腺癌噬菌体单链抗体为本实验室自行制备[6];人肺腺癌A549细胞株购自中科院上海细胞库;BALB/c裸鼠,SPF级,雄性,体质量20~26 g,4~6周龄,购自重庆医科大学动物中心;peroxiredoxin I抗原购自美国BPS公司;兔抗人Prx I多抗购自英国ABCAM公司;HRP/羊抗兔IgG二抗购自美国SAB公司;放射性核素Na131I、Na125I均购自中国原子能科学研究院;SN-684型放射免疫γ计数仪为上海核所日环光电仪器有限公司产品;SPECT显像仪器采用德国SIEMENS Symbia T2 SPECT仪。
1.2 可溶抗体细胞内摄量测定
氯胺T法125I标记抗体并纯化。肺腺癌A549细胞中加入125I-scFv(1.5×106cpm/1×104cells),37 ℃孵育30 min和120 min,以4℃孵育细胞为对照,各做3次。孵育结束后分别PBS液洗涤细胞3次,再以冰预冷甘氨酸缓冲液(0.1 mol/L glycine-HCl,2 mol/L urea,pH2.2)洗3 次,每次2min,以洗脱细胞表面结合的125I-scFv,收集洗脱液。再以2%SDS溶解细胞,收集溶胞产物。分别用γ计数仪测洗脱液和溶胞产物放射性计数。
1.3 细胞生长抑制检测
将 A549细胞(3×104/ml)接种 96孔板(100 μl/well),设立空白对照组,各组3个复孔。72 h后行MTT法检测(490 nm)细胞增殖情况。
将 A549细胞(1×106/ml)接种于培养瓶,培养液体积1ml。加入1ml scFv(0.5 μmol/L)。72 h 后消化细胞,用Annexin V-FITC/PI双染法上流式细胞仪进行细胞凋亡检测。
1.4 A549细胞Prx I蛋白表达
将A549细胞(5×106/ml)接种培养瓶培养。加入1 ml scFv(0.5 μmol/L)。设空白对照(以PBS替代scFv抗体)。72 h后Western blot检测Prx I蛋白表达水平,以兔抗人Prx I多抗为一抗,HRP/羊抗兔IgG为二抗。计算Prx I蛋白条带与β-actin内参条带光密度比值,以其表示Prx I蛋白表达的相对强度。
1.5 scFv的131I标记及鉴定
氯胺T法标记抗体后将标记反应液注入1×15 cm Sephadex G200柱,用0.01 mol/L PBS洗脱纯化。三氯醋酸沉淀法计算标记率。以正丁醇和乙酸混合液为展开剂,纸层析法测定标记物的放射性化学纯度和比活度。
1.6 荷瘤裸鼠模型的建立
对数生长期肺腺癌A549细胞以5×106cell/200 μl浓度接种于裸鼠右前肢后方皮下。观察生长情况,待肿瘤直径长至0.7~1.0 cm时用于下一步实验。
1.7 生物分布测定
每只荷瘤裸鼠尾静脉注射131I-scFv200 μl(约18.5 MBq),共注射12只,并随机分为4组。分别于注射后12 h、24 h、48 h和72 h处死各组裸鼠,剥离肿瘤组织及主要器官,称质量,用γ计数仪测定放射性计数,计算每克组织百分注射剂量率(%ID/g)。
1.8 放射免疫显像
取3只荷瘤裸鼠,注射131I-scFv前3 d以1%KI封闭甲状腺。每只裸鼠分别于尾静脉注射200 μl新鲜配制的131I-scFv(约18.5 MBq)。将裸鼠固定后在注射核素标记抗体后12 h、24 h、48 h和72 h分别进行SPECT显像。仪器采用高分辨准直器,距阵256×256,能峰364 keV,计数25 K-30 K,2倍放大。以肿瘤部位对侧组织为感兴趣区(region of interest,ROI),测定靶器官/周围组织(T/NT)值。
1.9 荷瘤裸鼠分组治疗观察
将15只荷瘤裸鼠随机分为3组:生理盐水对照组(注射生理盐水0.1 ml)、131I-IgG治疗组(注射131IIgG约20 MBq)和131I-scFv治疗组(注射131I-scFv约20 MBq),1次/2 d,共14次。游标卡尺每3 d测量一次肿瘤最大直径(a)和最大垂直直径(b)。4周后处死裸鼠,剥离肿瘤组织、称重,计算抑瘤率IR=(Vo-Vn)/Vo×100%,Vo为对照组肿瘤体积,Vn为治疗组肿瘤体积。4周后处死各组裸鼠,剥离肿瘤组织,用10%甲醛固定,石蜡包埋后作病理切片,HE染色后观察病理学改变。
1.10 统计学处理
2 结果
2.1 A549细胞内摄可溶抗体
溶胞产物的放射性计数评估细胞内摄125I-scFv量,甘氨酸洗脱液和溶胞产物总和的放射性计数评估细胞结合125I-scFv的总量。经γ计数仪测定,120 min时间点细胞结合抗体的总量及内摄量均为30 min时间点的2倍。内摄抗体量占细胞总结合抗体量的比例在2个时间点保持相对稳定,分别为40.3%(30 min)和 44.7%(120 min)。
2.2 MTT法及流式细胞术评价细胞生长、凋亡情况
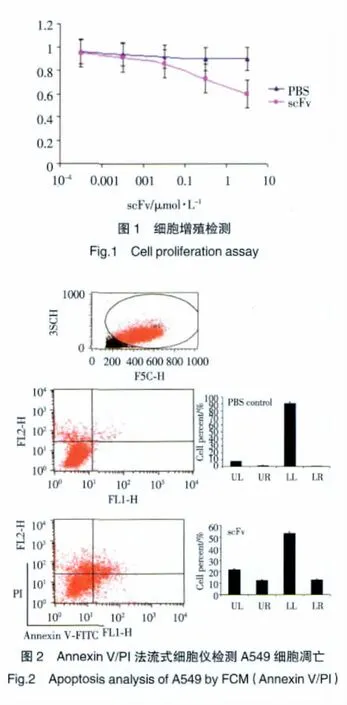
单链抗体scFv作用于A549细胞72 h后进行MTT分析。可见scFv对细胞有剂量依赖的抗增殖作用(图1)。AnnexinV-FITC/PI法流式细胞仪检测A549细胞凋亡,scFv干预组细胞凋亡率较对照组明显增加(图2)。
2.3 Prx I蛋白表达水平测定
可溶单链抗体scFv干预A549细胞72 h后,提取总蛋白,进行Western blot检测。可见样品组Prx I蛋白表达水平低于空白对照组(P<0.05)(图3)。结果证实可溶抗体scFv干预后细胞Prx I蛋白表达受到抑制。

2.4 131I-scFv的标记结果
三氯乙酸沉淀法测得131I-scFv标记率为(83.2±6.5)%。131I-scFv的放射化学纯度为(95.6±3.7)%,比活度为(2.8±0.2)MBq/μg。
2.5 131I-scFv在荷瘤裸鼠体内的分布
测定12只荷瘤裸鼠肿瘤、血液、肝、肾、脾、肠、肌肉等器官组织的放射性。在48 h肿瘤摄取131I-scFv抗体量达(3.78±0.65)%ID/g。此时瘤/血放射性比值和瘤/肌肉放射性比值均达最大值,分别为4.06±0.13 和5.17±0.97。
2.6 放射免疫显像
结果显示,肿瘤部位有放射性核素浓聚,可见肿瘤清晰显像。勾画ROI,计算T/NT值。12h、24 h、48 h 和 72 h 分别为1.26±0.15、2.18±0.16、3.73±0.20 和2.85±0.18。48 h显像的T/NT值明显高于其他时间点(F均>86,P 均<0.01),且肿瘤显示最清晰(图4)。

2.7 各组裸鼠治疗效果比较
治疗4周后131I-scFv组肿瘤质量[(2.37±0.58)g]、体积[(1.36±0.33)cm3]较其他2组有明显降低,抑瘤率56.8%,抑瘤作用明显,而其他2组间无明显差异。将各组肿瘤切片后HE染色镜下观察。与空白对照组比较,131I-scFv治疗组肿瘤切片可见大片肿瘤细胞坏死,核碎裂、核溶解明显,细胞间质呈红染无结构物质(图5)。

3 讨论
噬菌体抗体以其制备简便、可以规模化生产及完全人源化的优势,在临床肿瘤治疗中成为新的选择和补充[7,8]。经检测,本实验室前期制备的抗Prx I肺腺癌噬菌体单链抗体与高表达Prx I的肺腺癌A549细胞有较强的特异性结合活性,为抗体的体内分布及抑瘤作用研究提供了保证。
因为抗体库的筛选是在体外以肿瘤细胞及纯化的Prx I作为靶抗原进行的,因此有必要在体内对抗体结合高表达Prx I肺腺癌组织的能力进行检测。本研究观察到抗体在肿瘤部位得到有效浓聚,而肠、肝及肾脏对抗体的摄取也较高。在注射后12 h,瘤/血比值和瘤/肌肉比值分别是0.77和1.65,并且在第48 h均达到最大值,分别为4.06和5.17。SPECT也提示相同的结果,注射后12 h时胃肠和肾脏是主要的非特异性摄取器官,但随着注射后时间的延长,肿瘤部位显像越来越清晰,而到第48 h时肿瘤显像最为清晰,非特异性摄取明显减少。并且由于代谢的原因,此时肿瘤显像较第72 h时更为清晰。
抗体的治疗作用研究是接下来需要考察的内容。已有研究表明,噬菌体单链抗体与细胞表面分子的结合内摄可介导肿瘤细胞重要的生理进程,具有内在的抗增殖活性[9]。我们的前期研究中,采用肺腺癌患者癌旁淋巴结组织作为抗体基因来源,制备得到了特异性较好的抗Prx I肺腺癌相关噬菌体抗体。在本研究的体外抑制肺腺癌细胞生长实验中,证实了单链抗体与A549细胞结合后能被有效内摄进入细胞内,并介导了剂量相关的抗肿瘤细胞增殖效应,观察到靶细胞凋亡的增加,以及细胞内Prx I蛋白表达量的下降。基于以上结果,可以推测抗体的抗增殖作用是因为内摄的抗体限制了细胞受体数量,并且在与Prx I表位结合后,降低了肿瘤细胞的抗氧化能力,从而促进了细胞的增殖抑制和凋亡。关于该抗体抑制肺腺癌细胞生长的机制,需要进一步的深入研究。在荷瘤裸鼠模型进行的核素标记抗体放免治疗实验中,通过静脉给药,也同样观察到肿瘤体积和质量的减小,证实了131I标记单链抗体用于放免治疗的可行性和有效性。
噬菌体单链抗体作为最具应用潜力的治疗性抗体,在肿瘤抗体治疗中挥发日益重要的作用。本研究利用以肺腺癌细胞及其高表达的Prx I作为治疗靶点的噬菌体抗体进行抗体体内分布及抑瘤作用研究,证实抗体具有良好的药代动力学特性,与131I标记后能有效抑制肺腺癌肿瘤的生长,具有进一步开发制备肿瘤放免显像及治疗药物的应用潜力。
[1]Chang JW,Lee SH,Jeong JY,et al.Peroxiredoxin I is an autoimmunogenic tumor antigen in non-small cell lung cancer[J].FEBS Lett,2005,579(13):2873-2877.
[2]Chang JW,Jeon HB,Lee JH,et al.Augmented expression of Peroxiredoxin I in lung cancer[J].Biochem Biophy Res Commun,2001,289(2):507-512.
[3]Kim JH,Bogner PN,Baek SH,et al.Up-regulation of peroxiredoxin1in lung cancer and its implication as a prognostic and therapeutic target[J].Clin Cancer Res,2008,14(8):2326-2333.
[4]Xiao J,Horst S,Hinkle G,et al.Pharmacokinetics and clinical evaluation of125I-radiolabeled humanized CC49 monoclonal antibody(HuCC49deltaC(H)2)in recurrent and metastatic colorectal cancer patients[J].Cancer Biother Radiopharm,2005,20(1):16-26.
[5]Weiner LM.Fully human therapeutic monoclonal antibodies [J].J Immunother,2006,29(1):1-9.
[6]罗弋,庞华,李少林,等.人源抗Peroxiredoxin I肺腺癌噬菌体抗体的制备及鉴定[J].南方医科大学学报,2010,30(1):30-34.
[7]Yamashita T,Utoguchi N,Suzuki R,et al.Development of anti-tumor blood vessel antibodies by phage display method [J].Yakugaku Zasshi,2010,130(4):479-485.
[8]Majidi J,Barar J,Baradaran B,et al.Target therapy of cancer:implementation of monoclonal antibodies and nanobodies [J].Hum Antibodies,2009,18(3):81-100.
[9]Liu B,Conrad F,Cooperberg MR,et al.Mapping tumor epitope space by direct selection of single-chain Fv antibody libraries on prostate cancer cells[J].Cancer Res,2004,64(2):704-710.

