山葡萄素抗动脉粥样硬化分子机制研究
李韶菁,黄 峰,蓝 希,杜冠华
心脑血管疾病是现今危害人体健康和生命最严重的病症之一,具有高发病率、高致残率和高死亡率,是中老年人常见病和多发病。而动脉粥样硬化(atherosclerosis,AS)是心脑血管病的主要病理基础。
目前认为AS病因相对复杂,是由多种危险因子相互关联,共同作用的结果。并且AS的病理改变也是一种慢性炎症性反应[1-2],涉及多种炎性细胞因子、自由基、生长因子、黏附分子等一系列活性分子,而ox-LDL在AS发生早期是最重要的致病因子[3]。来源于山葡萄籽提取物中的白藜芦醇具有广泛的药理活性作用,有报道其四聚体山葡萄素A(vitisin A)和 7′′′-8′′′-二脱氢山葡萄素 A(7′′′-8′′′-didehydro-vitisin A),具有一定的心、脑血管保护作用[4],但对其抗AS作用研究仍较少,分子机制尚不明确。本研究采用ox-LDL和LPS损伤,拟从体外角度通过检测损伤后内皮细胞和巨噬细胞活力,脂质过氧化产物MDA的含量和SOD活性、活性氧和NO产生,巨噬细胞炎性细胞因子释放,单核细胞和内皮细胞黏附等涉及AS发生早期的多个关键环节,探讨其抗动脉粥样硬化可能涉及的分子机制。
1 材料与方法
1.1 药品与主要试剂 Hoescht 33258,Invitrogen;佛波酯(phorbomyristateacetate,PMA)、脂多糖(lipopolysaccharides,LPS)、四氮唑蓝(nitroblue tetrazolium,MTT),2′-7′-二氯荧光素双醋酸盐(2′,7′-dichlorofluorescin diacetate,DCFH-DA),Sigma 公司;ox-LDL,中国医学科学院基础研究所;一氧化氮,MDA,SOD测定试剂盒,南京建成生物工程研究所;乳酸脱氢酶测定试剂盒,北京北化康泰临床试剂有限公司;鼠源 IL-1β、TNFa酶联免疫测定试剂盒,eBioscience公司,USA;人源IL-1β酶联免疫测定试剂盒,武汉博士德;DMEM高糖、RPMI 1640培养基和胎牛血清,Gibco。
1.2 主要仪器和设备 Spectra Max M5酶标仪,Molecular Devices,USA;荧光倒置显微镜(Olympus,Tokyo,Japan)。
1.3 细胞 单核细胞源性巨噬细胞THP-1,人内皮细胞Hy926细胞株由中国医学科学院国家药物筛选中心保存;鼠巨噬细胞RAM246.7细胞株,人正常肝细胞株L02购自上海细胞所。
1.4 溶液配制
1.4.1 待测化合物配置 山葡萄素A和二脱氢山葡萄素A[5-6](以下简称为vsA和ddh-vsA)由中国医学科学院药物研究所天然药物化学室林茂老师提供,将二者均用DMSO配置成10 mmol·L-1储存液,工作液从终浓度100 μmol·L-1始3倍稀释8个浓度。
1.4.2 荧光染料DCFH-DA的配制 荧光染料DCFH-DA配置成10 mmol·L-1的 DMSO储液,加入细胞培养液使终浓度为20 μmol·L-1。
1.4.3 荧光染料Hoescht33258的配制 荧光染料Hoescht 33258用无菌培养液配成10 mmol·L-1储液,加入细胞培养液使终浓度为1 μmol·L-1使用。
1.5 实验方法
1.5.1 酶联免疫法(ELISA)测定巨噬细胞IL-1β(或TNF-α)的分泌 在24孔板中,每孔含有约2.0×108·L-1鼠巨噬细胞或经160 nmol·L-1PMA诱导分化48 h的THP-1巨噬细胞,加入阳性对照药物TO901317和待测药物,同时设置空白对照孔,预孵育30 min,加入脂多糖LPS(终浓度为1 mg·L-1),孵育24 h,取上清100 μl,检测采用ELISA试剂盒进行。
1.5.2 一氧化氮含量测定 THP-1细胞按照2×104的细胞数加入48孔板,PMA诱导分化,待细胞贴壁后,分为空白组、ox-LDL组(ox-LDL终浓度100 mg·L-1)、ox-LDL+样品组,各组设置4个复孔,处理24 h取各组细胞培养上清100 μl,按照测试盒操作说明检测NO的浓度。
1.5.3 ox-LDL致细胞损伤后MTT法和乳酸脱氢酶(LDH)法细胞活力测定 将培养好的Hy926细胞和PMA诱导的THP-1细胞,以每孔约为5×103细胞数铺96孔板,加入不同稀释浓度的测试样品孵育30 min后,再加入 ox-LDL,分别孵育 12、24、48 h后,加入 100 μl MTT,按文献方法[7]进行 MTT 细胞活力测定或取细胞上清按照北京北化康泰试剂盒方法测定乳酸脱氢酶活性。
1.5.4 MDA和SOD的测定 将24孔培养的细胞分为空白组和样品处理组,加入样品后预孵育30 min,加入ox-LDL培养2 d,收集细胞。细胞裂解液裂解细胞,Lowry法蛋白定量,分别按照试剂盒操作说明测定细胞中的MDA含量和SOD活性。
1.5.5 细胞活性氧的荧光检测方法 将培养的巨噬细胞分为空白组、阳性对照组和样品处理组,先加入样品预孵育30 min后,加入ox-LDL处理培养2 d后,用20 μmol·L-1活性氧特异荧光探针 DCFHDA处理30 min。通过Spectra Max M5酶标仪检测荧光强度评价细胞内ROS水平(Ex=485 nm,Em=530 nm)。
1.5.6 单核细胞THP-1和内皮细胞Hy926黏附实验[8-9]将长至对数生长期的Hy926细胞以5×108·L-1接种于96孔板,待细胞融合80% ~100%,加入含ox-LDL的培养基(含2%BSA,0.5%FBS),作用24 h。另外,取对数生长期THP-1细胞,控制细胞浓度2~5×109·L-1,加入终浓度为10 mg·L-1细胞核特异荧光染料Hoechst 33258,避光,培养30 min,无血清培养基洗后,1 000 r·min-1离心制备浓度为1×109·L-1的THP-1细胞悬液,加入已铺好Hy926细胞的96孔培养板中,每孔50 μl。避光培养60 min。弃上清,加入PBS,轻轻振荡,去除未黏附细胞。于倒置荧光显微镜下观察并拍照。
1.6 研究用化合物结构 见Fig 1A,1B。
Fig 1 Chemical Structure of two compoundsA:7‴-8‴-didehydro-vitisin A;B:vitisin A
2 结果
2.1 MTT法检测4个化合物细胞毒结果 检测化合物vsA和ddh-vsA对Hy926、PMA诱导的THP-1巨噬细胞和RAW264.7的细胞毒作用,结果显示除化合物vsA对RAW264.7细胞在100 μmol·L-1显示轻微细胞毒作用外,其余均未显示明显毒性作用(详细结果和具体方法略)
2.2 化合物对ox-LDL致巨噬细胞和内皮细胞氧化损伤的保护作用 实验结果如Fig 2~4显示,ox-LDL可明显导致人单核细胞源性巨噬细胞THP-1、鼠巨噬细胞RAW264.7和内皮细Hy926活力下降和LDH的释放增加。化合物vsA和ddh-vsA可明显增加ox-LDL损伤后内皮细胞活力(MTT还原法);并可明显降低不同孵育时间下的LDH释放并呈一定的浓度依赖关系。两种方法检测结果基本一致,提示两个被测化合物均起到一定的内皮细胞保护作用。
2.3 化合物对LPS诱导的TNF-α和IL-1β分泌的影响 利用ELISA方法考察LPS刺激巨噬细胞后,活性化合物对TNF-α和IL-1β分泌水平的影响。结果如Fig 5,6所示,活性化合物对人和鼠巨噬细胞TNF-α、IL-1β的分泌有非常好的抑制作用,并且呈很好的浓度依赖关系,表明化合物具有较好的抗炎作用。
2.4 化合物对巨噬细胞产生一氧化氮产生的抑制作用 以ox-LDL为炎症诱导因子,研究化合物对ox-LDL处理后的巨噬细胞产生NO是否存在抑制作用。结果如Fig 7所示,化合物对巨噬细胞NO的产生具有较强的抑制作用,而且有很好的剂量依赖关系。

Fig 2 Effect of compounds on ox-LDL induced alternation of cell viability in Hy926(48 h,MTT assay) ± s,n=4)C:Control;O:ox-LDL treated model group;T:1 μmol· L-1 TO901317 treated.**P <0.01 vs control;#P <0.05,##P <0.01 vs ox-LDL
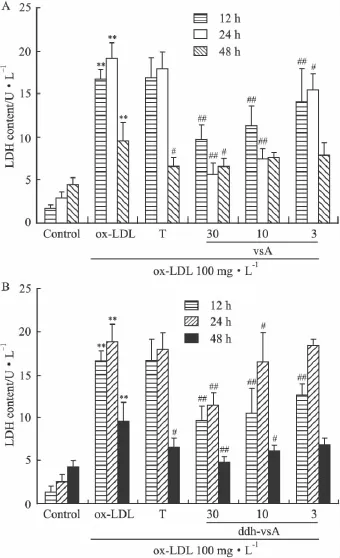
Fig 3 Effects of vsA(A)and ddh-vsA(B)on ox-LDL induced alteration of LDH release in Hy926(±s,n=4)T:1 μmol·L-1TO901317 treated,vsA and ddh-vsA:3,10,30 μmol·L-1treated.**P <0.01 vs control;#P <0.05,##P<0.01 vs ox-LDL treated
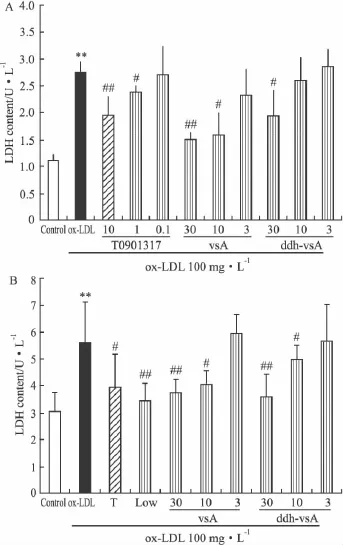
Fig 4 Effects of compounds on ox-LDL induced alteration of LDH release in mouse macrophage cell line RAW264.7(A)and PMA-induced human macrophage cell line THP-1(B)(±s,n=4)T:1 μmol·L-1TO901317 treated;vsA and ddh-vsA:3,10,30 μmol·L-1treated.**P <0.01 vs control;#P <0.05,##P<0.01 vs ox-LDL treated

Fig 5 The inhibitory effect of compounds on LPS-induced IL-1β secretion in mouse macrophage(±s,n=4)C:Control;T:1 μmol·L-1TO901317 treated;vsA and ddh-vsA:3,10,30 μmol·L-1treated. **P < 0.01 vs control;#P < 0.05,##P <0.01 vs LPS treated
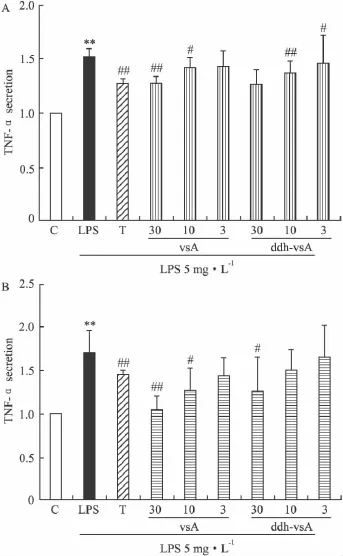
Fig 6 The inhibitory effect of compounds on LPS induced TNF-α secretion in human macrophage THP-1(A)and mouse macrophage RAW264.7(B)(±s,n=4)C:Control;LPS:Model LPS treated T:1 μmol·L-1TO901317 treated;vsA and ddh-vsA:3,10,30 μmol·L-1treated.**P < 0.01 vs control;#P <0.05,##P <0.01 vs LPS treated
2.5 化合物抑制细胞活性氧生成的作用 鉴于氧化应激在动脉粥样硬化中的关键作用,我们探讨了化合物对ox-LDL处理的内皮细胞和巨噬细胞中活性氧生成的影响。结果如Fig 8,9,活性化合物vsA和ddh-vsA均可降低ox-LDL致RAW264.7和Hy926细胞中活性氧的释放,提示化合物具有抑制细胞ROS生成的作用,并具有一定的浓度依赖关系。
2.6 化合物抑制ox-LDL致MDA生成增加和诱导SOD表达的作用 本实验通过检测体外培养Hy926和RAW264.7中MDA的含量来反映化合物对脂质过氧化损伤的影响,结果如Fig 10所示,活性化合物均可以减少Hy926细胞中MDA的含量,诱导SOD的表达,提示对过氧化脂质产生的损伤可能有保护作用。
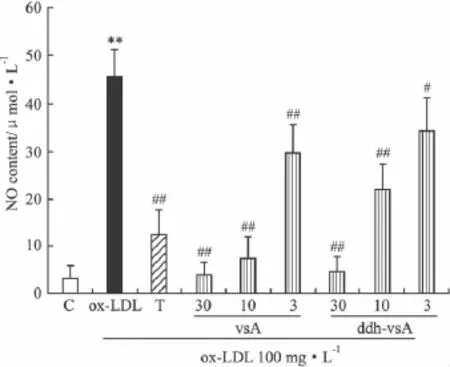
Fig 7 The inhibitory Effect of compounds on ox-LDL induced NO release in macrophage THP-1(24 h)(±s,n=4)C:Control;T:1 μmol·L-1TO901317 treated;vsA and ddh-vsA:3,10,30 μmol·L-1treated.**P < 0.01 vs control,#P < 0.05,##P <0.01 vs ox-LDL treated

Fig 8 The inhibitory effect of compounds on ox-LDL induced ROS production in mouse RAW264.7(±s,n=4)C:Control;TO901317:0.1,1,10 μmol·L-1treated;vsA and ddhvsA:10,30 μmol·L-1treated;**P < 0.01 vs control,#P < 0.05,##P<0.01 vs ox-LDL treated
2.7 白藜芦醇抑制单核巨噬细胞THP-1和内皮细胞Hy926黏附 考察了化合物ddh-vsA对ox-LDL诱导的THP-1和Hy926黏附的影响,结果如Fig 12所示,10 μmol·L-1化合物 ddh-vsA 具有抑制单核细胞和内皮细胞黏附的作用。
3 讨论
动脉粥样硬化实质也是一个包括炎性细胞激活和浸润的慢性炎症性疾病[12],涉及多种细胞因子、生长因子、氧、氮自由基和黏附分子等一系列活性分子。如在激活的巨噬细胞中通过核因子NF-κB(nuclear factor-κB)及活性蛋白-1(activation protein,AP-1)信号传递,造成IL-1β、IL-6及TNF-α等多种炎症细胞因子大量分泌[12,13]。

Fig 9 The inhibitory effect of compounds on ox-LDL induced ROS production in human Hy926(±s,n=4)C:Control;T:1 μmol·L-1TO901317 treated;vsA and ddh-vsA;3,10,30 μmol·L-1treated.**P < 0.01 vs control;#P < 0.05,##P <0.01 vs ox-LDL treated

Fig 10 The inhibitory effect of compounds on ox-LDL induced MDA production in Hy926(A)and RAW264.7(B) ± s,n=4)C:Control;T:1 μmol·L-1TO901317 treated;vsA and ddh-vsA:3,10,30 μmol·L-1treated.**P < 0.01 vs control;#P < 0.05,##P <0.01 vs.ox-LDL treated.

Fig 11 The effect of compounds on increasing SOD activity in mouse macrophage RAW264.7(±s,n=4)C:Control;TO901317:0.1,1,10 μmol·L-1treated;vsA and ddhvsA:30,10,3 μmol·L-1treated;** P < 0.01 vs control;#P < 0.05,##P<0.01 vs ox-LDL treated
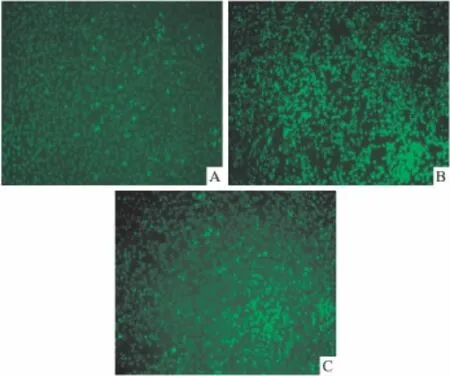
Fig 12 The inhibitory effect of 10207 on ox-LDL induced adhesion of THP-1 monocytes to the human endothelial cell line Hy926A:Normal cell;B:ox-LDL 50 mg·L-1treated;C:10 μmol·L-1 ddh-vsA pretreated 30 min before ox-LDL treated
一氧化氮(NO)也是一种具有多种生理功能的小分子物质,病理状态下大量的NO与超氧阴离子结合形成危害性极大的氮氧自由基,促进AS早期炎症性细胞和泡沫化细胞的形成[14]。
Ox-LDL具有明显的致动脉粥样硬化作用,影响AS病变发生和发展的多个过程[15]。如ox-LDL引发机体产生氧自由基,攻击生物膜形成脂质过氧化物,如醛类过氧化物丙二醛(MDA),造成细胞代谢和功能障碍,进一步加重细胞损伤。因此检测MDA含量可反映细胞内脂质过氧化的程度。
鉴于内皮细胞的损伤和功能改变是动脉粥样硬化早期的标志性病理事件,保护内皮完整性对预防动脉粥样硬化具有重要意义。ox-LDL在AS形成的早期起到类似于炎症介质的作用,可损伤血管内皮,引起细胞内脂质聚集;促进单核细胞向内皮黏附并向内皮下转移;使内皮细胞对LDL的通透性增高,诱导细胞凋亡,甚至坏死[16-17]。
氧化应激(oxidative stress)与动脉粥样硬化的发病关系也极为密切。氧化应激产生过量的氧自由基(oxygen free radical,OFR)或活性氧(ROS)造成细胞内脂质聚集,是动脉粥样硬化发生的一个重要促进因素[12-13]。而超氧歧化酶(SOD)是活性氧清除系统中发挥抗氧化作用的关键酶,在保护细胞免受氧化损伤过程中具有十分重要的作用[18]。
文献报道,核受体LXRs激动剂,TO901317具有明确的早期保护动脉粥样硬化的作用[19-20],主要表现在保护内皮细胞完整性、抑制巨噬细胞泡沫化、下调炎性相关基因,抑制炎性细胞因子和活性氧、氮自由基的表达,抑制黏附分子和单核趋化蛋白的表达,减轻炎性细胞因子诱导的单核细胞和内皮细胞黏附等,本文将其作为阳性对照药物。通过体外培养Hy926、RAM264.7和PMA诱导的THP-1三种细胞,加入损伤因素ox-LDL处理后,(1)采用了MTT法和LDH活性测定两种方法来检测细胞活力,评价了化合物对不同孵育时间下ox-LDL致细胞损伤的保护作用。实验结果表明山葡萄素A和二脱氢山葡萄素A对ox-LDL导致的内皮细胞和巨噬细胞损伤有较明显的保护作用;(2)通过检测说明山葡萄素A和二脱氢山葡萄素A可抗氧化,减少氧、氮自由基产生,抑制LPS所致的巨噬细胞炎性因子释放,抑制ox-LDL导致的单核细胞和内皮细胞黏附。因此,从体外实验充分证明了山葡萄素A和二脱氢山葡萄素A对以上AS发生早期事件的多个关键环节均有作用,对解释其抗As的分子机制具有重要意义,提示其可能的As保护机制涉及多个靶点和通路的相互作用和调节。
细胞泡沫化途径及关键调控因素,已成为防治AS的重要药物作用靶点。我国地域辽阔,植物中蕴含丰富的心血管保护成分,提取和筛选其中抗AS有效成份[21]并阐明其机制,是我国药学研究中一个有发展前途的研究方向。
[1]Sheikine Y,Hansson G K.Chemokines and atherosclerosis[J].Ann Med,2004,36(2):98-118.
[2]Daissormont I T,Kraaijeveld A O,Biessen E A.Chemokines as therapeutic targets for atherosclerotic plaque destabilization and rupture[J].Future Cardiol,2009,5(3):273-84.
[3]Choy P C,Siow Y L,Mymin D,et al.Lipids and atherosclerosis[J].Biochem Cell Biol,2004,82(1):212-4.
[4]García-Alonso M,Rimbach G,Rivas-Gonzalo J C,et al.Antioxidant and cellular activities of anthocyanins and their corresponding vitisins A-studies in platelets,monocytes,and human endothelial cells[J].J Agric Food Chem,2004,52(11):3378-84.
[5]李 娜,李小妹,黄开胜,林 茂.白藜芦醇低聚体类似物的结构与分布[J].药学学报,2001,36(12):944-50.
[5]Li N,Li X M,Huang K S,Lin M.Structure and distribution of oligostilbenes[J].Acta Pharm Sin,2001,36(12):944-50.
[6]Huang Y L,Tsai W J,Shen C C,et al.Resveratrol derivatives from the roots of vitis thunbergii[J].J Nat Prod,2005,68:217-20.
[7]李文明,刘洪涛,李秀英,等.川芎嗪对脂多糖诱导的血管内皮细胞损伤的影响[J].中国药理学通报,2009,25(11):1516-21.
[7]Li W M,Liu H T,Li X Y,et al.Effect of tetram ethylpyrazine on lipopolysaccharide-induced damage in vascular endothelial cell[J].Chin Pharmacol Bull,2009,25(11):1516-21.
[8]李国华,王 佐,王北冰,等.基质细胞衍生因子1对氧化型低密度脂蛋白诱导内皮细胞与单核细胞黏附的影响[J].中国动脉硬化杂志,2007,15(7):487-90.
[8]Li G H,Wang Z,Wang B B,et al.Effect of stromal cell-derived factor-1α on monocytes and endothelium cells adhesion induced by oxidized low density lipoprotein[J].Chin J Arterioscler,2007,15(7):487-90.
[9]Kim J A,Berlianer J A,Nadler J L.AngiotensinII increase monocyte binding to endothelial cells[J].J Biochem Biophy Res Commun,1996,226(3):862-8.
[10]Doran A C,Meller N,McNamara C A.The role of smooth muscle cells in the initiation and early progression of atherosclerosis[J].Arterioscler Thromb Vasc Biol,2008,28(5):812-9.
[11]Sanz J,Fayad Z A.Imaging of atherosclerotic cardiovascular disease[J].Nature,2008,451(21):953-7.
[12]Shin W S,Szuba A,Rockson S G.The role of chemokines in human cardiovascular pathology:enhanced biological insights[J].Atherosclerosis,2002,160(1):91-102.
[13]李玉洁,杨 庆,翁小刚,等.动脉粥样硬化炎症信号转导通路研究进展[J].中国药理学通报,2009,25(7):857-60.
[13]Li Y J,Yang Q,Weng X G,et al.The research development of inflammatory signal pathway of atherosclerosis[J].Chin Pharmacol Bull,2009,25(7):857-60.
[14]Hansson G K,Robertson A K,Söderberg-Nauclér C.Inflammation and atherosclerosis[J].Annu Rev Pathol,2006,1:297-329.
[15]徐雅琴,张钧华,唐朝枢.氧化低密度脂蛋白和血管内皮损伤[J].心血管病学进展,2000,21(1):26-9.
[15]Xu Y Q,Zhang J H,Tang C S.Oxidized low density lipoprotein and vascular endothelial cell injury[J].Adv Card Dis,2000,21(1):26-9.
[16]Salvayre R,Auge N,Benoist H,Negre-Salvayre A.Oxidized lowdensity lipoprotein-induced apoptosis[J].Biochim Biophys Acta,2002,30,1585(2-3):213-21.
[17]Stehbens W E.The oxidative stress hypothesis of atherosclerosis:cause or product[J]?Med Hypotheses,1999,53(6):507-15.
[18]张同欣,胡厚源,永 福.肝X受体激动剂对RAW 264.7细胞ABCAI蛋白表达和TNFα,IL-6产生和分泌的影响[J].中国药师,2005,8(10):810-2.
[18]Zhang T X,Hu H Y,Yong F.Effect of liver X receptor agonists on the ability of uptake Ac-LDL in RAW264.7 cells[J].China Pharm,2005,8(10):810-2.
[19]Joseph S B,Castrillo A,Laffitte B A,et al.Reciprocal regulation of inflammation and lipid metabolism by liver X receptors[J].Nat Med,2003,9(2):213-9.
[20]Wu Z L,Liang M Y,Qiu L Q.Oxidized low-density lipoprotein decreases the induced nitric oxide synthesis in rat mesangial cells[J].Cell Biochem,1998,16:153-8.
[21]王 佐,唐朝克,吕运成,等.苦瓜蛋白对THP-1巨噬细胞源性泡沫细胞的形成及三磷酸腺苷结合盒转运体A1的影响[J].中国动脉硬化杂志,2004,12(1):27-30.
[21]Wang Z,Tang C K,Lü Y C,et al.Effects of monordicin on THP-1 marcrophage-derived foam cells and ATP binding cassette transporter A1[J].Chin J Arterioscler,2004,12(1):27-30.

