荧光标记的叶酸修饰壳聚糖纳米载体研制
金鑫,张阳德,王吉伟,张丽华,杨璞, 张旭,胡玉,于丽
(中南大学 卫生部肝胆肠外科研究中心,湖南 长沙 410008)
肿瘤作为威胁人类健康的重大疾病,已引起人们的高度关注,各种抗肿瘤药物和疗法层出不穷,但抗肿瘤药物往往选择性不高,在杀伤肿瘤细胞的同时也可能杀死机体正常细胞,毒副作用大,给患者带来极大的痛苦。所以,如何提高抗肿瘤药物的靶向性和安全性成为肿瘤治疗的迫切问题。叶酸受体[1]靶向是近年来一种备受关注的新型抗肿瘤机制,而叶酸对叶酸受体具有高度的亲和性,所以,可利用这一特性将叶酸作为抗肿瘤药物的靶向配体,利用叶酸受体在某些肿瘤部位的过度表达而在正常组织低水平表达的特性实现叶酸偶联药物的靶向输送[2−3]。而偶联载体以大分子物质为主,有利于延长体内保留时间,提高疗效。壳聚糖[4]是一种价廉易得、便于修饰、无毒、生物相容性好并兼有一定抗肿瘤活性的生物大分子,广泛用于药物治疗载体。此外,壳聚糖近来被广泛应用到制药工艺中的纳米技术可进一步提高药物的稳定性,并实现缓释和控释给药。所以,可利用叶酸靶向性和壳聚糖缓释和控释给药的特点,选择壳聚糖为基质来制备叶酸靶向纳米载体,并用异硫氰基荧光素[5]做荧光标记,为下一步体内实验作准备[6−7]。
1 仪器与试剂
仪器为:AUW120D电子天平(岛津,日本);79−1磁力加热搅拌器(江苏省金坛市正基仪器有限公司);真空冷冻干燥机(LABCONCO,美国);TGL16M高速冷冻离心机(英泰有限公司,长沙);TENSOR27傅里叶红外光谱仪(BRUKER,德国);1000HSA激光粒度分析仪(马尔文,英国);MFP−3D 原子力显微镜(ASYLUM RESEARCH,美国);LB2荧光倒置显微镜(LEICA,德国)。
试剂为:壳聚糖(上海伯奥生物科技有限公司,脱乙酰度>90%);多聚磷酸钠(TPP,国药集团化学试剂有限公司);SePHadexG-50葡聚糖凝胶(国药集团上海化学试剂公司);二甲基亚砜(DMSO,国药集团化学试剂有限公司);N-羟基琥珀酰亚胺(NHS,国药集团化学试剂有限公司);二环己基碳二亚胺(DCC,J&K Chemical Ltd);叶酸(FA,国药集团化学试剂有限公司);其余试剂,均为国产分析纯。
2 实验方法
2.1 叶酸活性酯的制备
称取2.6 g叶酸,溶于50 mL无水二甲亚砜(DMSO)中,再加入2.38 g二环己基碳二亚胺(DCC)和1.35 g N-羟基琥珀酰亚胺(NHS)及1.25 mL三乙胺,于30 ℃反应,过夜,过滤除去反应副产物二环己基脲,减压蒸馏除去部分溶剂,在搅拌中逐滴滴入含30%丙酮的无水乙醚溶液中,得到黄色沉淀物。然后,用无水乙醚洗涤数遍后于真空干燥,得到叶酸活性酯[8],于室温保存备用。
2.2 叶酸偶联壳聚糖的制备及红外光谱分析
称取壳聚糖160 mg,溶于40 mL醋酸−醋酸钠缓冲液(pH 4.6)中,在磁力搅拌条件下以2 mL/min的速度缓慢加入 8 mL叶酸活性酯的 DMSO溶液(20 mg/mL),于30 ℃反应12 h,然后,用10 moL/L NaOH调pH值至9,离心,用蒸馏水洗涤数遍后,重新溶于2%醋酸水溶液,得到叶酸偶联壳聚糖溶液[9]。
取叶酸活性酯、壳聚糖和叶酸偶联壳聚糖适量,采用红外光谱仪检测偶联情况。
2.3 荧光标记的叶酸−壳聚糖纳米粒的制备
称取10 mg异硫氰酸荧光素(FITC),溶于10 mL无水乙醇中,在磁力搅拌条件下逐滴加入到20 mL叶酸−壳聚糖的醋酸溶液中,避光反应4 h,使FITC上的碳原子与壳聚糖上的氨基反应以便进行标记[10]。用10 mol/L NaOH 调节pH值至9。离心,用蒸馏水洗涤,直至滤液澄清呈无色为止。将沉淀重新用 2%醋酸溶液溶解,用10 mol/L NaOH 调节pH值至5,在磁力搅拌条件下逐滴加入10 mL TPP溶液(2 g/L)。反应20 min后得到荧光标记的叶酸−壳聚糖纳米粒[11]。
2.4 叶酸偶联壳聚糖纳米粒的形态观察
取适量叶酸偶联壳聚糖纳米粒混悬液滴加于云母片上,用原子力显微镜观察其形态,用激光粒度分析仪测定纳米粒的粒径。
2.5 体外细胞实验
取肝癌 HepG2细胞,在含有 10%的小牛血清的1640培养基中连续培养。培养环境为:5%(体积分数)CO2,37 ℃。取对数生长期细胞,胰酶消化后在培养皿中的盖玻片上接种,置于培养箱中培养24 h。
待培养皿中的细胞贴壁生长后,吸去培养基。用PBS清洗3次。加入荧光标记的叶酸偶联壳聚糖纳米粒悬浮液和壳聚糖纳米粒悬浮液,于37 ℃培养24 h,用PBS冲洗细胞3次,用小镊子取出盖玻片,放在预先洗净的载玻片上,用抗萃灭剂封片,用荧光显微镜进行观察。
3 结果与讨论
3.1 叶酸−壳聚糖纳米粒的制备
将配体连接到微粒药物载体上的方法,原则上取决于偶联是在载体组装前还是在组装后进行。在载体组装完成后连接配体,将合适的活性功能基团连接于载体某一成分的末端。活性功能基团必须与载体的组装相适应,并且可以有效地和配体连接。这一策略适用于大配体如单克隆抗体的连接。在载体自组装前将配体连接到载体上相对容易,但这种方法的缺点是在载体的最终组装完成后,一部分结合的配体会被包入微粒的内部,从而不能与受体结合。采用离子交联反应法可制备叶酸−壳聚糖纳米粒,即利用多聚磷酸钠(TPP)对叶酸−壳聚糖进行离子诱导凝胶化,可在一定条件下制备出叶酸−壳聚糖纳米药物载体。室温下,在搅拌过程中,将pH值为7~9的TPP溶液加入到pH值为 4~6的叶酸−壳聚糖醋酸溶液中,通过带负电的磷酸根离子与壳聚糖分子链上带正电的质子化氨基发生分子内和分子间的交联凝胶化,可迅速形成纳米粒子[12]。
3.2 红外光谱分析
采用红外光谱仪分析叶酸与壳聚糖的偶联情况。图1~3所示分别为壳聚糖、叶酸活性脂和叶酸偶联壳聚糖的红外光谱。从叶酸偶联壳聚糖的红外光谱可以看出(图3):—NH2在 1 640 cm−1处的吸收峰(见图1)和—COOH在1 692 cm−1处的吸收峰(见图2)消失,在1 562 cm−1处出现了新的强吸收峰,说明壳聚糖上的氨基与叶酸上的羧基形成了酰胺键[13],两者成功偶联。
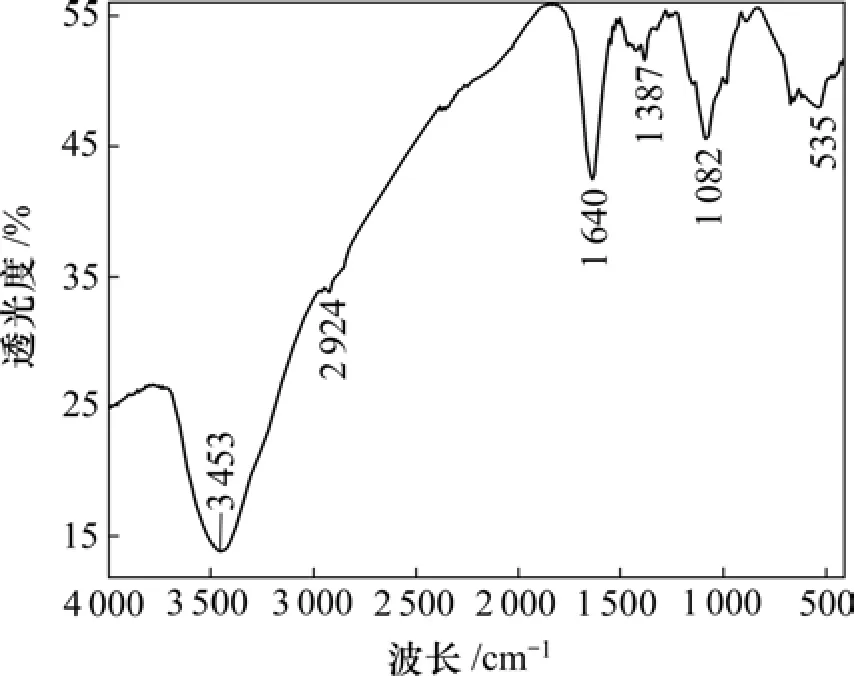
图1 壳聚糖的红外光谱Fig.1 Infrared spectra of chitosan
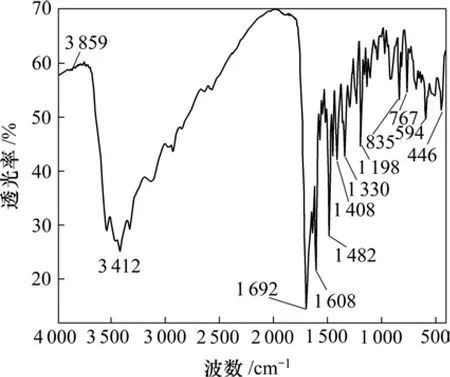
图2 叶酸活性酯的红外光谱Fig.2 Infrared spectra of folic acid
3.3 纳米粒的粒径和表面形态
图4所示为荧光标记的叶酸−壳聚糖纳米粒的粒径曲线。可见:荧光标记的叶酸−壳聚糖纳米粒的颗粒粒径比较集中,无颗粒团聚现象,平均粒径约为290 nm。荧光标记的叶酸−壳聚糖纳米粒的原子力显微镜扫描像见图5。可见:其颗粒形态规则,颗粒大小比较均匀,无颗粒团聚现象[14]。
3.4 体外细胞实验结果
使用倒置荧光显微镜观察叶酸−壳聚糖纳米载体、壳聚糖纳米粒与表达有叶酸受体的细胞之间的相互作用,结果见图6和图7。可以发现:细胞荧光效果明显,且荧光强度与纳米粒同细胞相互作用时间成正比。
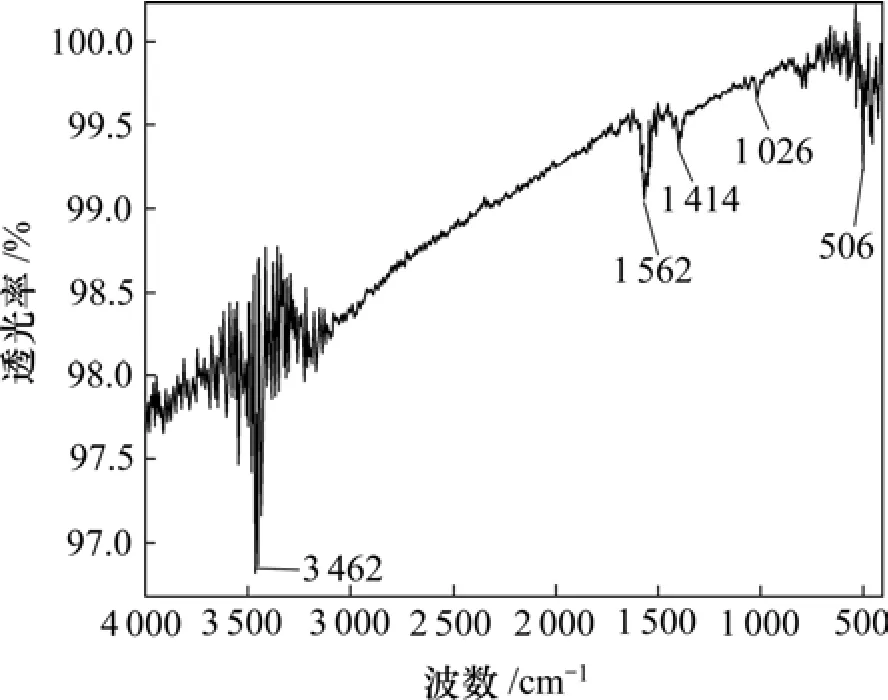
图3 叶酸偶联壳聚糖的红外光谱Fig.3 Infrared spectra of Folate-conjugated chitosan
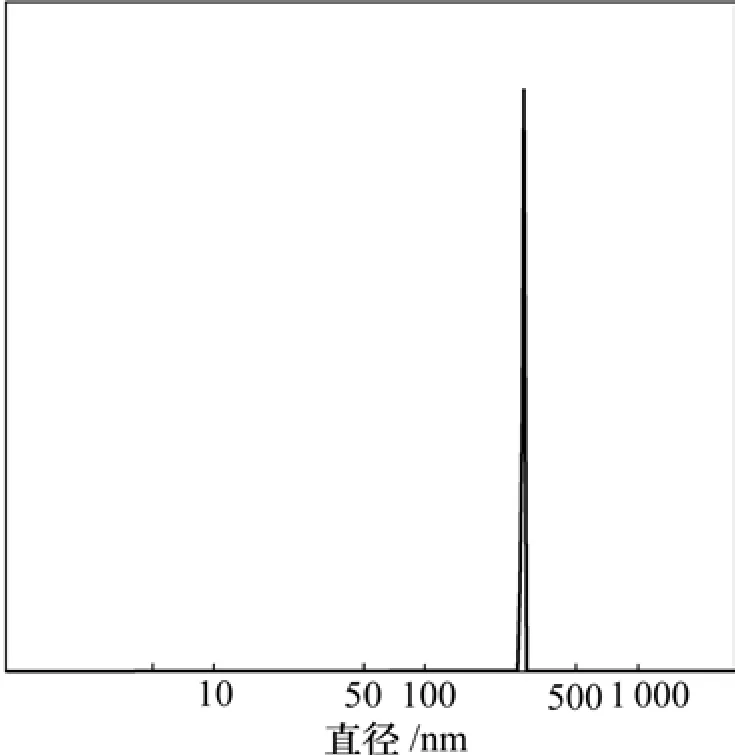
图4 荧光标记的叶酸−壳聚糖纳米粒的粒径曲线Fig.4 Measurement of particle size map of Fluorimetrc Folate-coupled Chitosan nanoparticles
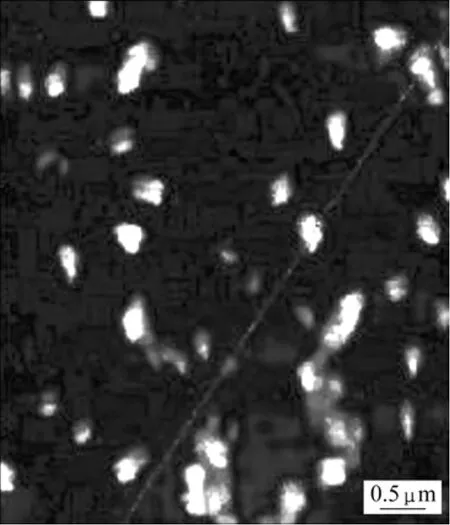
图5 荧光标记的叶酸−壳聚糖纳米粒的原子力显微镜扫描像Fig.5 Atomic force microscope scanning image of fluorimetrc folate-coupled chitosan nanoparticles
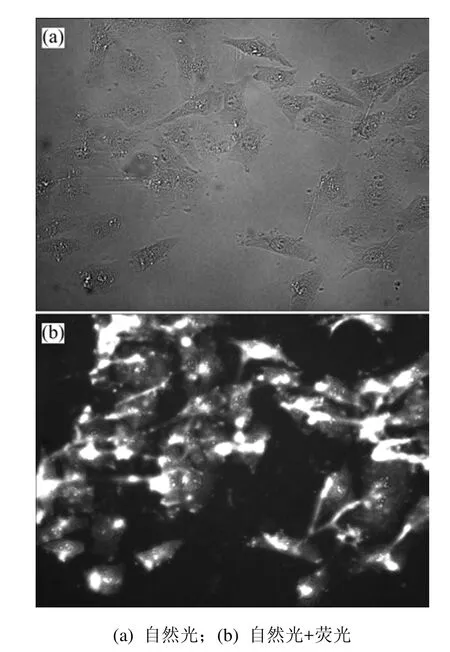
图6 荧光标记的叶酸−壳聚糖纳米粒与HepG2细胞相互作用的倒置荧光显微镜像Fig.6 Inverted fluorescence microscope images of fluorimetrc folate-coupled chitosan nanoparticles interaction with HepG2 cells
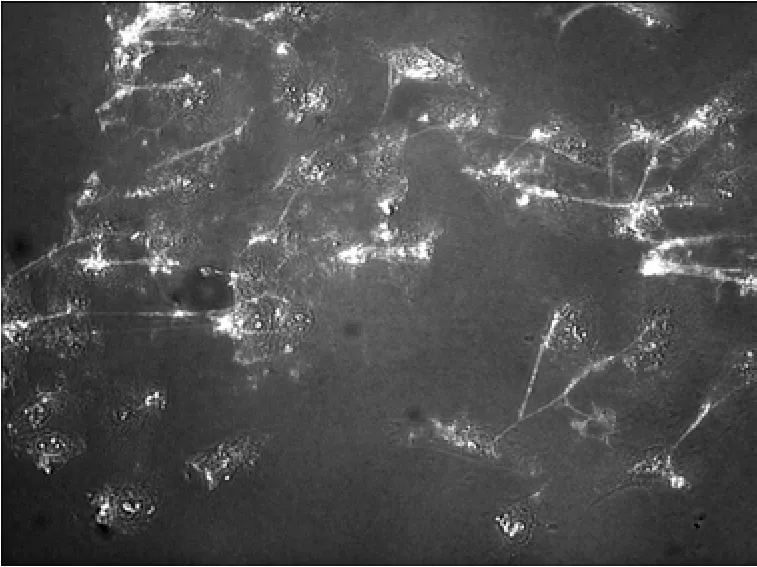
图7 荧光标记的壳聚糖纳米粒与HepG2细胞相互作用的倒置荧光显微镜像Fig.7 Inverted fluorescence microscope image of fluorimetrc chitosan nanoparticles interaction with HepG2 cells
4 结论
(1) 壳聚糖上的 2个活性基团可用于化学修饰:一个是脱去乙酞基的位点上的游离氨基,另一个是脱去乙酞基的位点上的羟基。
(2) 通过壳聚糖主链上的游离氨基与叶酸上的羧基形成酞胺键,达到壳聚糖化学修饰的目的。
(3) 由于壳聚糖的高分子特性,其水溶性差,只能在酸性水溶液中溶解,叶酸又无法溶于酸性水溶液,所以,采用先将壳聚糖与DMSO中的叶酸偶联,后进行荧光标记及采用离子交联反应法制备纳米粒的方法,制备了具有荧光标记的叶酸壳聚糖纳米粒,用异硫氰酸荧光素标记壳聚糖和叶酸偶联壳聚糖,以表面表达有叶酸受体的HepG2细胞为模型细胞,进行细胞摄取机理研究。
(4) 与HeLa细胞共培养时细胞荧光效果明显,且荧光强度同纳米粒与细胞相互作用时间成正比。
(5) 建立并完善了叶酸修饰壳聚糖纳米载体的制备工艺,为后续靶向性纳米制剂的研制提供了技术手段。
[1]Shia J, Klimstra D S, Nitzkorski J R, et al. Immunohistochemical expression of folate receptor a in colorectal carcinoma[J].Patterns and Biological Significance Human Pathology, 2008,39(4): 498−505.
[2]张良珂, 侯世祥, 毛声俊. 叶酸偶联白蛋白纳米粒制备工艺研究[J]. 生物医学工程学杂志, 2004, 21(2): 255−258.ZHANG Liang-ke, HOU Shi-xiang, MAO Sheng-jun. Study on the preparation of folate-conjugated albumin nanoparticles[J].Journal of Biomedical Engineering, 2004, 21(2): 255−258.
[3]Lee R J, Low P S. Delvery of liposomes into cultured KB cells via folate receptor-mediated endocytosis[J]. Biol Chem, 1994,269(5): 3198−3199.
[4]WANG San-lang, LIN Hue-tin, LIANG Tzu-wen, et al.Reclamation of chitinous materials by bromelain for the preparation of antitumor and antifungal materials[J]. Bioresour Technol, 2008, 99(10): 4386−4393.
[5]谭光宏, 黄风迎. FITC标记葡聚糖粘附定量测定肿瘤组织血管密度[J]. 海南医学院学报, 2007, 13(5): 409−413.TANG Guang-hong, HUANG Feng-ying. Quantitative determination of relative tumor vascularity by FITC-dextran adsorption[J]. Journal of Hainan Medical College, 2007, 13(5):409−413.
[6]高晓宁, 唐锁勤. 叶酸受体及其在介导药物靶向肿瘤细胞治疗中的应用[J]. 中国实验血液学杂志, 2005, 13(5): 911−914.GAO Xiao-ning, TAN Suo-qing. Folate receptor and its application in the selective receptor-mediated targeting therapy of tumor cells—Review[J]. Journal of Experimental Hematology,2005, 13(5): 911−914.
[7]林凤云, 朱照静. 叶酸受体介导的靶向给药研究进展[J]. 中国医院药学杂志, 2006, 26(10): 1281−1284.LIN Feng-yun, ZHU Zhao-jin. The progress of folate receptor in the selective receptor-mediated targeting therapy[J]. Chinese Journal of Hospital Pharmacy, 2006, 26(10): 1281−1284.
[8]Guo W J, George H, Hinkle, et al. 99mTc-HYNIC-Folate: a novel receptor-based targeted radiopharmaceutical for tumor imaging[J]. Nucl Med, 1999, 40(9): 1563−1569.
[9]薛昌刚, 童春义, 肖苏尧. 诺氟沙星−壳聚糖微球的制备及释药性能[J]. 中南大学学报: 自然科学版, 2008, 39(3): 480−485.XUE Chang-gang, TONG Chun-yi, XIAO Su-yao. Preparation of norfloxacin-chitosan microsphere and its drug release property[J]. Journal of Central South University: Science and Technology, 2008, 39(3): 480−485.
[10]任东文, 刘袖洞, 马小军. 荧光标记壳聚糖的反应动力学研究[J]. 功能材料, 2004, 35: 2463−2465.REN Dong-wen, LIU You-dong, MA Xiao-jun. A kinetics study of labeling reaction of chitosan with a fluorescent dye[J]. Journal of Funcyional of Materials Contents, 2004, 35: 2463−2465.
[11]蒋新宇, 周春山, 张俊山. 应用三聚磷酸钠为交联剂制备载药物纳米粒的研究[J]. 中国现代医学杂志, 2003, 13(22):69−71.JIANG Xin-yu, ZHOU Chun-shan, ZHANG Jun-shan. Study on the preparation of nanoparticles using sodium tripolyphosphate as cross-linking agent[J]. China Journal of Modern Medicine,2003, 13(22): 69−71.
[12]Aronov O. Folate-targeted PEG as a potential carrier for Carboplatin analogs: Synthesis and in vitro studies[J].Bioconjugate Chemistry, 2003, 14(3): 563−574.
[13]蒋挺大. 甲壳素[M]. 北京: 化学工业出版社, 2004: 1−649.JIANG Ting-da. Chintin[M]. Beijing: Chemical Industry Press,2004: 1−649.
[14]张斌, 朱武. 偶联改性纳米 HAP/HDPE挤出复合生物材料的力学性能和微观结构[J]. 功能材料, 2007, 38(11): 1912−1915.ZHANG Bin, ZHU Wu. Mechanical properties and microstructure of nano HAP/HDPE extrusion bio-composite modified by silane-coupling agents[J]. Journal of Functional Materials, 2007, 38(11): 1912−1915.

