中度嗜热混合菌在搅拌槽中浸出黄铜矿及其群落动态
周洪波,谢英剑,张汝兵,曾伟民,罗海浪,王玉光
(中南大学 资源加工与生物工程学院,生物冶金教育部重点实验室,湖南 长沙,410083)
生物冶金技术由于其具有反应条件温和、对环境友好、能耗少、成本低等优点,已广泛应用于难处理金矿的生物氧化预处理和次生硫化铜矿的浸出[1]。黄铜矿作为最具有商业价值的硫化铜矿物之一,在世界上所知铜矿储量中含量最大。随着铜的需求量持续增加,研究黄铜矿的生物浸出具有重大意义。目前,采用常温生物浸出黄铜矿的反应速度缓慢,难以获得较高的铜浸出速率和浸出率[1−2]。而中度嗜热菌与常温菌相比具有一定的优势。这是因为随着浸出的进行,硫化矿物氧化以及微生物代谢产生大量的热量,可以使整个浸出体系的温度升高到50 ℃,局部温度甚至可以达到75 ℃或者更高[3],此时常温菌通常已经死亡或失去活性,而中度嗜热菌在该温度下可以保持较高的活性,可以快速浸出硫化矿,因此,在工业浸出黄铜矿中,与常温菌相比,中度嗜热菌具有一定的优势。槽浸是生物浸出工业应用中常用的工艺之一,其浸出体系中传质效果好(如搅拌、通气等),可以较方便地对体系的主要工艺参数进行控制,适合硫化矿物精矿的浸出[4]。浸矿工艺中有关微生物生态学的研究对于发展生物浸出技术具有重要的指导意义,只有了解浸矿体系中的生态结构和主要微生物种群动态变化规律,才能通过浸矿工艺的调控,优化浸矿微生物群落结构,从而提高浸出速率[5]。Brierley认为, 理解生物浸出中的微生物学过程尤其是微生物生态规律是提高工艺水平的关键[6]。PCR-RFLP(限制性酶切片段长度多态性)方法是一种非常成熟的基于 PCR的基因指纹图谱技术,目前已广泛应用于酸性矿坑水(AMD)中的微生物类群分析[7],而对于生物浸出工艺中(如柱浸,槽浸等反应体系中)浸矿微生物的种群动态变化研究较少[8−9]。为此,本文作者采用 PCR-RFLP技术研究黄铜矿搅拌浸出过程中微生物群落变化动态,并分析pH值、电位等参数的变化对微生物群落动态变化的影响,以便为调控微生物种群结构、优化浸出工艺过程、提高浸出速率和浸出率提供指导。
1 材料和方法
1.1 矿样和菌种
实验所用黄铜矿精矿来自江西德兴。矿石经粉碎后过筛,粒径≤75 µm。
经X线衍射(XRD)分析,矿物主要由80%左右(质量分数,下同)黄铜矿、5%左右黄铁矿、5%左右石英等成分组成。矿样的元素分析结果为:32.02% Cu,22.65% S,30.90% Fe。矿物元素组成见表1。
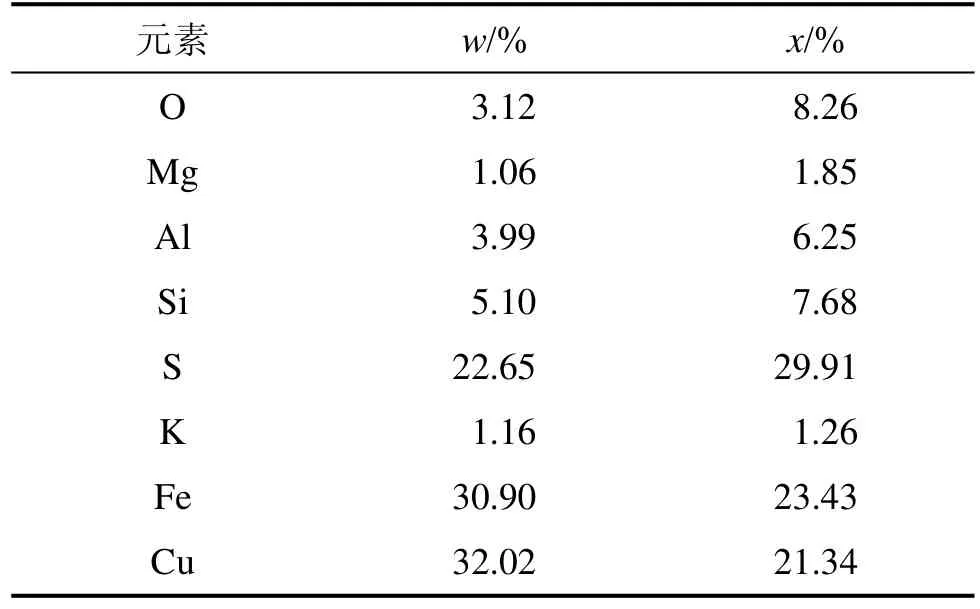
表1 矿样成分的能谱分析结果Table 1 Mineral sample composition by energy spectrum analysis
本实验所用菌种主要为Acidithiobacillus caldus,Leptospirillum ferriphilum,Sulfobacillus acidophilus和Sulfobacillus thermosulfidooxidans等中度嗜热菌种的混合菌,纯菌菌株均由教育部生物冶金重点实验室分离和保藏。其中:At. caldus为硫氧化细菌;L. ferriphilum为亚铁氧化细菌;S. acidophilus和S. thermosulfidooxidans既能氧化硫又能氧化亚铁。菌种的培养用9K基本盐溶液加入10 g/L的黄铜矿精矿。培养条件如下:pH=1.8,温度为45 ℃,转速为170 r/min。9K基本盐的成分为:(NH4)2SO43.0 g/L,K2HPO40.5 g/L,KCl 0.1 g/L,MgSO4·7H2O 0.5 g/L,Ca(NO3)20.01 g/L。
1.2 实验装置及条件
浸矿实验是在1个总容积为2.6 L的有机玻璃反应器中进行,内径为140 mm,高为170 mm,有1根通气管沿槽壁竖直通向槽底,并且水平弯折。在水平通气管的下面开一排小孔,气体从小孔中分散通入。用2个恒流泵加入H2SO4或者NaOH来调节初始pH值。pH值和电极电位Eh的测量值可以从微型电脑上直接读取。实验装置如图1所示。
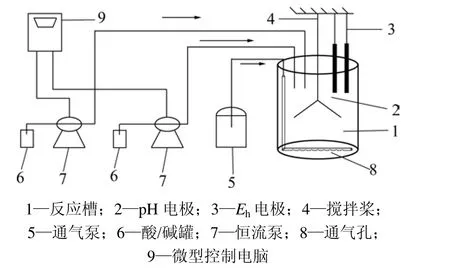
图1 实验装置Fig.1 Experiment device
把反应器装入圆形玻璃恒温水浴缸中,使反应器内浸出液恒定维持在45 ℃,实际装液量为2 L(9K基本盐培养基),矿浆质量浓度为10 g/L。菌种富集物以1.1×106个/mL的接种浓度被接入反应器,浸出时间为30 d。反应条件为:初始pH=2.0,温度为45 ℃,搅拌浆转速为500 r/min,通气量为0.6 L/min。
1.3 仪器和试剂
实验仪器有:玻璃圆形水浴锅;通气泵;测量pH值和Eh的复合电极(Pt, Ag/AgCl)(JENCO,美国任氏公司生产);原子吸收仪(北京华洋分析仪器有限公司生产);恒流泵(HL-2S,上海沪西分析仪器有限公司生产)。
实验试剂为:重铬酸钾溶液,Taq DNA 聚合酶(MBI,USA);pGEM-T 载体(Promega,USA);内切酶MspⅠ和Hin 6 Ⅰ ( M BI)。测序由北京三博远志生物公司完成。
1.4 分析方法
每2 d取样分析,用原子吸收方法测定浸出液中总Fe2+和Cu2+的浓度,用重铬酸钾滴定法测定Fe2+的浓度,在总铁含量中去除Fe2+含量即为Fe3+含量。应用血球计数板测定菌数;每天记录浸出液的 pH值和Eh值。浸出结束后得到的矿渣经洗涤及冷冻干燥后,与未浸出的矿样一起应用化学滴定分析的方法测定铜的含量,计算铜的浸出率。
1.5 RFLP分析
1.5.1 DNA的提取
每隔 6~8 d取浸出液 100 mL(含固体)提取总DNA,提取方法参照文献[10]。方法如下:在10 000 r/min转速下离心固液混合样品,去除上清液,剩余物冷冻干燥后与2 g干热灭菌的沙子混合,加液氮研磨3次,用13.5 mL的DNA抽提缓冲液(0.1 mol/L 磷酸钠,0.1 mol/L Tris-HCl,0.1 mol/L EDTA,1.5 mol/L NaCl,1% CTAB (pH=8.0))溶解研磨产物,加入50 µL蛋白酶K (10 g/L),经37 ℃水浴30 min,加入1.5 mL 20%的SDS,于65 ℃水浴2 h(每隔15 min轻微摇动1次),于4 000 r/min转速下离心15 min,转移上清液至新的离心管中,然后,加入等体积异丙醇,混匀并放入4 ℃冰箱中过夜, 最后以10 000 r/min离心15 min,弃上清液并加入2 mL预冷的70%乙醇洗涤2次,于室温干燥后用100 µL TE溶解。粗提DNA,用琼脂糖凝胶回收试剂盒(OMEGA,USA)进行回收纯化。
1.5.2 PCR扩增和纯化
提取得到的总DNA,用16S rRNA基因通用引物63F,1387R(63F:5’-CAGGCCTAACACATGCAAGTC-3’;1387R:5’-GGGCGGWGTGTACAAGGC-3’)来进行扩增[12],对所得的PCR产物进行纯化。所得片段长度为1.4 kb左右。
1.5.3 克隆
其次,你们需要接受自己,获得自信能量。初中阶段的你们不仅小秘密多了,情感也更加细腻敏感。越优秀的学生对自我的认同感就越高,一旦理想和现实出现差距,失落感就会更强烈。这时候,如果能客观认识现状,接受成长中的自己,让自己的优点更加“明亮”,缺点更加“暗淡”,我一定会离你们远远的。
把纯化后的片段连接到pGEM-T载体中,在16 ℃水浴中过夜,转化到Ecoli DH5α[0]感受态细胞内。涂平板用蓝白筛选的方法挑选出阳性克隆子。利用通用载体引物 M13F(5’-CAG GAA ACA GCT ATG AC-3’)和 M13R(5’-GTA AAA CGA CGG CCA GT-3’)对菌落PCR扩增出插入片断。然后,用内切酶MspⅠ和Hin 6Ⅰ对插入片断进行酶切,在37 ℃酶切24 h。最后,用 3%的琼脂糖凝胶作酶切分析,得到图谱。对显现不同条带的克隆子(OTU)进行测序,在GENBANK中进行序列比对,鉴定细菌种类。
2 结果和分析
2.1 浸出实验
浸出液中微生物含量的变化见图2。可见:经过对数生长期后在第 7天左右细菌浓度达到最大,为2.6×107个/mL;然后略有下降。但是,基本维持在2×107个/mL以上。经推测,部分菌体已经吸附到矿物颗粒上。
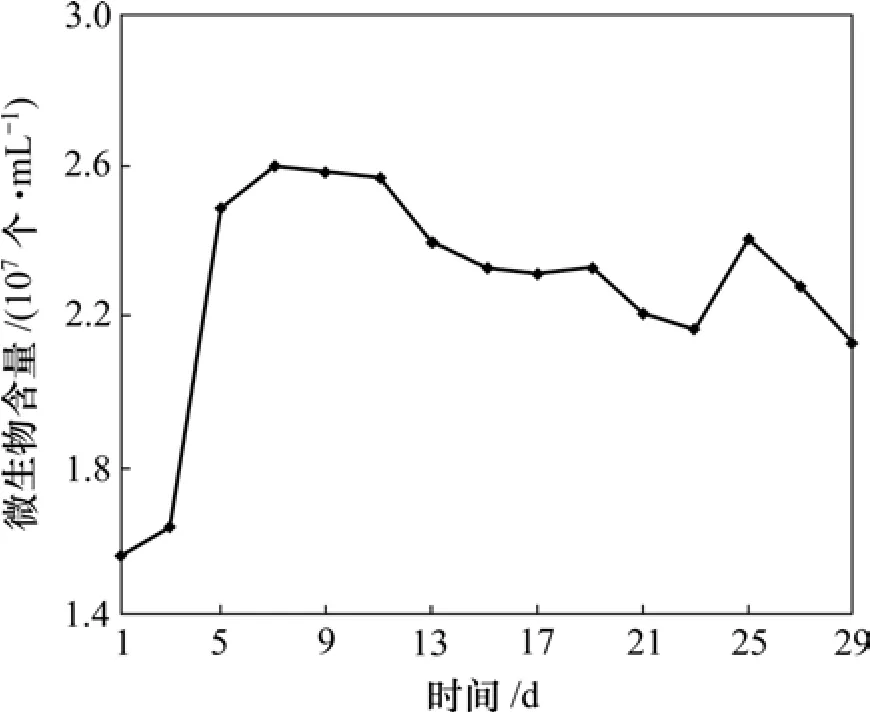
图2 浸出液中微生物含量的变化Fig.2 Variation of cell number in leachate
浸出液中pH和Eh变化曲线见图3。可见:接种后电位为400 mV,在第1天内电位很快升高,然后缓慢上升,在第15天到第19天这一阶段又有一个比较明显的上升阶段,然后,电位稳定在660 mV左右。与电位相对应,pH值在第1天内下降比较明显,然后,一直呈平缓下降的趋势。在浸出过程的后期,pH值基本保持不变。
使用重铬酸钾滴定法测定溶液中Fe2+的质量浓度时发现(见图4):浸出液中Fe2+质量浓度非常低,应用原子吸收所测定的总铁浓度近似等于 Fe3+质量浓度;在第16天左右,总铁的质量浓度最高,达到0.72 g/L,然后开始下降,到反应结束时下降到0.49 g/L。铜的浸出持续增加,浸出液中 Cu2+的质量浓度最高达到0.63 g/L。应用化学滴定分析法,计算得出最后Cu的浸出率为 26.2%。该浸出率不高,可能与铜精矿残留的浮选药剂有关,即浸矿微生物活性受到了一定程度的抑制。
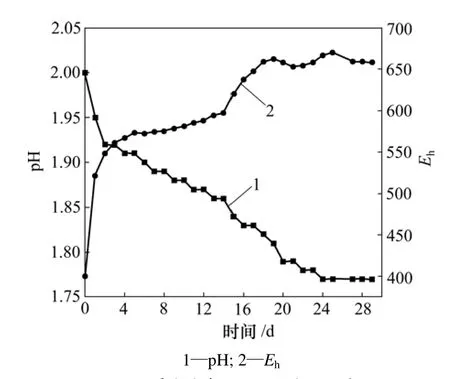
图3 浸出液中pH和Eh变化曲线Fig.3 Variations of pH and Eh in leachate

图4 浸出液中Cu2+和Fe2+的质量浓度变化曲线Fig.4 Concentrations of Fe2+ and Cu2+ in leachate
2.2 微生物群落分析
在第8,16,24和第30天分别取样,因为差异条带只有3种,所以,每个样挑取80个左右白色菌落,可足够保证结果的可靠性。阳性克隆的比例为96%。酶切图谱的条带类型见图5。从酶切图谱来看,各阶段OTU数量的差异性比较明显。挑选差异性的3个阳性克隆子测序,在GENBANK数据库比对后,发现2种是At. caldus,分别编号为AC-1和AC-2;1种为L. ferriphilum,编号为LF ;没有检测到代表其他菌种的OTU。在NCBI上比对后发现AC-1和AC-2序列与登录号为DQ661629.1的At. caldus相似度达到99%,LF的序列与登录号为EF025338.1的L. ferriphilum相似度达到99%。
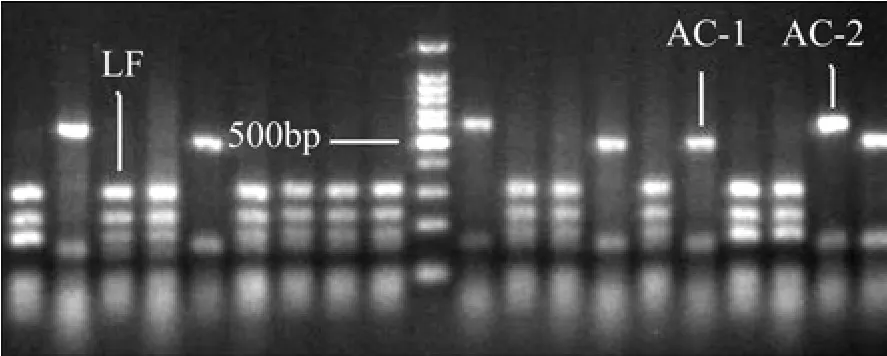
图5 酶切图谱的条带类型Fig.5 RFLP pattern of 16S rRNA gene digested by restriction enzymes
在第8天时,群落中占优势地位的是At. caldus。总共挑取 82个克隆子,AC-1样占全部克隆子数的62%,AC-2占全部克隆子数的34%,At. caldus总共占96%;代表L. ferriphilum的LF仅占全部克隆子数的4%。
到第16天时,84个阳性克隆子中AC-1占总数的31%,AC-2占总数的21%,At. caldus总共占52%;LF占总数的48%。At. caldus和L. ferriphilum两者的数量已经基本相当。
到第24天时,87个阳性克隆子中AC-1占总数的33%,AC-2占总数的17%,At. caldus总共占50%;LF占总数的50%。At. caldus和L. ferriphilum的数量仍然基本相当。
3 讨论
黄铜矿的氧化过程开始于质子对矿物的攻击和Fe3+的氧化攻击[11−12]。由黄铜矿的晶格结构可知,它的化合价键在S,Cu和Fe之间相互形成,结构稳定,键能很高。在电子传递过程中,Fe3+和H+攻击黄铜矿的晶格结构,接受S与金属之间化合键断裂后的电子,使Cu2+和Fe2+释放到溶液中。其中,浸矿细菌所起的作用是将Fe2+氧化为Fe3+,将S氧化为硫酸。生成的Fe3+可以继续对矿物起氧化作用。具体反应[13]如下:

浸出过程发生的反应很复杂,除上述反应外,浸出液中还会发生如下反应:

在每个浸出实验中,都能观察到 pH值的持续下降和Eh的持续升高[14]。这是因为浸出过程是一个不断产酸和有Fe3+释出的过程。氧化还原电位Eh由液相中的主要离子对浓度比 c(Fe3+)/c(Fe2+)和 c(H+)/c(OH−)来决定。当溶液中Fe2+浓度非常低时,Eh取决于Fe3+浓度及 pH值的变化[15]。从反应式(2)~(6)可以看出:浸出过程中不断产生H+,使pH值持续下降。由反应式(1)可知:当细菌浓度增大并起氧化作用后,浸出液中Fe3+浓度也将越来越高,所以,电位也随之升高(如图3)。
影响黄钾铁矾形成的主要因素包括pH值、温度及硫酸铁介质的浓度[16]。当温度恒定时,主要受H+和硫酸铁介质浓度的影响。如反应式(3)~(6)所示,铁沉淀的生成使溶液中如 K+,SO42−,NH4+等许多离子的浓度都发生了变化。从图4可知:在第16天以后,浸出液中Fe2+质量浓度开始下降,可推测是黄钾铁矾大量生成的缘故。从图3可以看出,当生成黄钾铁矾时Eh有上升的趋势。这是因为 H+增加,此阶段 pH值下降。
由RFLP分析可知:该中等嗜热槽浸系统中微生物多样性并不丰富,只有L. ferriphilum 和At. caldus被检测到,生物多样性远低于酸性矿坑水或堆浸系统中的多样性。这主要是因为槽浸系统的温度恒定,而且pH值、氧气、CO2、营养物水平都较均一。Foucher等[17]通过对传统机械搅拌反应器和气升式悬浮颗粒柱状反应器中微生物群落组成情况进行研究发现:L. ferrooxidans,At. caldus以及 S. thermosulfidooxidans是这2种反应器中主要的微生物种群。可见:这些反应器内的种群多样性同样并不丰富。
在浸出开始时,At. caldus是优势菌,丰度为96%,在浸出进行过程中,L. ferriphilum逐渐占主导地位,丰度为69%。这可能是矿物溶解后释出的硫元素转变为多硫化合物覆盖在矿物表面,在浸矿体系中最后氧化得到由元素硫形成的一层硫膜,而 At. caldus可以氧化元素硫变成硫酸[11]。只有在硫膜被逐渐溶解,矿物中慢慢释放出Fe2+的情况下,L. ferriphilum才能迅速生长并起作用。此外,还存在铁浓度、pH值、Eh等因素的影响。Okibe等[18]的实验研究结果表明,在低 pH值和高离子选择压力下,Leptospirillum spp.和Ferroplasma spp.将成为浸出过程中的优势种群,相反,在pH值较高时,Acidithiobacillus 和 Sulfobacillus是群落中的主要成员。Demergasso等[19]的研究表明:Leptospirillum spp.的生长与pH值密切相关。实验所用的At. caldus最适pH值为2.3左右,L. ferriphilum的最适pH值为1.6左右;L. ferriphilum比At. caldus能够耐受更高的离子选择压力。因此,在第8天的样品中,L. ferriphilum的含量只占微生物总量的4%;在浸出结束的第30天的样品中,L. ferriphilum的含量达到了微生物总量的69%,这可能与pH值下降有关。
4 结论
(1) 中等嗜热混合菌浸出黄铜矿过程中溶液 pH值逐渐下降,Eh持续升高,这是因为浸出体系的复杂反应不断产酸并有Fe3+释出。浸出中间阶段Fe3+质量浓度下降,是由于有黄钾铁矾沉淀生成。
(2) 槽式搅拌反应器中浸出黄铜矿精矿的微生物群落结构简单,微生物种类不丰富,应用 PCR-RFLP方法只检测到 2种微生物,分别为 At. caldus和L. ferriphilum。这是因为反应器浸出体系的选择压力更大。
(3) 槽式搅拌反应器中浸出黄铜矿精矿的群落动态变化很明显。在浸出开始阶段,At. caldus 是优势种群,其丰度为96%。随着浸出的进行,L. ferriphilum 逐渐增多,在浸出后期代替At. caldus成为优势种群,其丰度为69%。
[1]Rawlings D E, Dew D, du Plessis C. Biomineralization of metal-containing ores and concentrates[J]. Trends Biotechnol,2003, 21(1): 38−44.
[2]Gericke M, Pinches A, Rooyen J V. Bioleaching of a chalcopyrite concentrate using an extremely thermophilicculture[J]. Int J Miner Process, 2001, 62: 243−255.
[3]Olson G J, Brierley J A, Brierley C L. Bioleaching review part B:Progress in bioleaching: applications of microbial processes by the minerals industries[J]. Applied Microbiology and Biotechnology, 2003, 63(3): 249−257.
[4]Brierley C L. Bacterial succession in bioheap leaching[J].Hydrometallurgy, 2001, 59(2): 249−255.
[5]Acevedo F. The use of reactors in biomining processes[J].Electronic Journal of Biotechnology, 2000, 3(3): 184−194.
[6]周洪波, 邱冠周, 邬长斌, 等. 嗜酸微生物生态学与矿物生物浸出技术[J]. 应用与环境生物学报, 2005, 11(6): 784−788.ZHOU Hong-bo, QIU Guan-zhou, WU Chang-bin, et al.Ecology of acidophilic microorganisms and mineral bioleaching technologies[J]. Chin J Appl Environ Biol, 2005, 11(6):784−788.
[7]刘新星, 霍强, 刘学端, 等. 古矿井区域酸性矿坑水微生物群落的多样性[J]. 中南大学学报: 自然科学版, 2007, 38(3):414−420.LIU Xin-xing, HUO Qiang, LIU Xue-duan, et al. Diversity of microbial community in acid mine drainage in ancient mine area[J]. Journal Central South University: Science and Technology, 2007, 38(3): 414−420.
[8]Johnson D B. Biodiversity and ecology of acidophilic microorganisms[J]. FEMS Microbiol Ecol, 1998, 27(4):307−317.
[9]Schrenk M O, Edwards K J, Goodman R M, et al. Distribution of Thiobacillus ferrooxidans and Leptospirillum ferrooxidans:Implications for generation of acid mine drainage[J]. Science,1998, 279: 1519−1522.
[10]Zhou J Z, Bruns M A, Tiedje J M. DNA recovery from soils of diverse composition[J]. Applied and Environmental Microbiology, 1996, 62(7): 316−322.
[11]Sand W, Gehrke T, Jozsa P G, et al. (Bio)chemistry of bacterial leaching––direct vs. indirect bioleaching[J]. Hydrometallurgy,2001, 59(2): 159−175.
[12]Tributsch H. Direct versus indirect bioleaching[J].Hydrometallurgy, 2001, 59(2/3): 177−185.
[13]舒荣波, 阮仁满, 温建康. 黄铜矿生物浸出中钝化现象研究进展[J]. 稀有金属, 2006, 30(3): 395−399.SHU Rong-bo, RUAN Ren-man, WEN Jian-kang. Review on passivation of chalcopyrite during bioleaching process[J].Chinese Jouranal of Rare Metals, 2006, 30(3): 395−399.
[14]Meruane G, Vargas T. Bacterial oxidation of ferrous iron by Acidithiobacillus ferrooxidans in the pH range 2.5−7.0[J].Hydrometallurgy, 2003, 71(1/2): 149−158.
[15]杨红斌, 荆秀艳. Fe3+离子在低品位铜矿生物浸出中的行为分析[J]. 西安科技大学学报, 2005, 25(2): 183−186.YANG Hong-bin, JING Xiu-yan. Fe3+behavior in the low copper bioleaching[J]. Journal of Xi’an University of Science and Technology, 2005, 25(2): 183−186.
[16]王长秋, 马生凤, 鲁安怀, 等. 黄钾铁矾的形成条件研究及其环境意义[J]. 岩石矿物学志, 2005, 24(6): 109−113.WANG Chang-qiu, MA Sheng-feng, LU An-huai, et al. The formation conditions of jarosite and its environmental significance[J]. Acta Petrologica et Mineralogical, 2005, 24(6):109−113.
[17]Foucher S, Brunet F B, Hugues P, et al. Evolution of the bacterial population during the batch bioleaching of a cobaltiferous pyrite in a suspended-solids bubble column and comparison with a mechanically agitated reactor[J].Hydrometallurgy, 2003, 71(1/2): 5−12.
[18]Okibe N, Gericke M, Hallberg K B, et al. Enumeration and characterization of acidophilic microorganisms isolated from a pilot plant stirred-tank bioleaching operation[J]. Applied and Environmental Microbiology, 2003, 69(4): 1936−1943.
[19]Demergasso C S, Galleguillos P P A, Escudero G L V, et al.Molecular characterization of microbial populations in a low-grade copper ore bioleaching test heap[J]. Hydrometallurgy,2005, 80(4): 241−253.

