TNF-α基因多态性与2型糖尿病患者轻度认知功能障碍的相关性
沈芳芳 谢 云 赵 霞 孟宪海 汪玮琳 韩丽萍 齐秀英
随着对糖尿病研究的逐步深入,很多学者认为糖尿病与认知障碍之间有明显的相关性,它是诱发Alzheimer病(Alzheimer’s disease,AD)的一个危险因素[1]。因此,对糖尿病患者认知功能障碍的易感因素,尤其遗传易感性研究对筛选出AD的高危人群及预防和延迟T2DM患者认知减退具有重要意义。为探讨TNF-α基因多态性与T2DM合并轻度认知功能障碍(MCI)的关系,本研究分析TNF-α2等位基因在T2DM合并MCI发病中的作用,及T2DM合并MCI的相关危险因素。
1 对象与方法
1.1 研究对象 选择2008年5月—2009年1月在天津医科大学代谢病医院住院的198例2型糖尿病患者作为调查疾病史;癫;影响认知功能测试的其他严重躯体疾病。
1.2 方法
1.2.1 采集资料 分别采集研究对象的性别、年龄、家族史、病程、空腹血糖(FBG)、餐后2 h血糖(P2BG)、糖化血红蛋白(HBA1c)、糖尿病并发症以及是否使用胰岛素治疗等项目,并计算体质量指数(BMI)。
1.2.2 检测TNF-α-308A/G基因多态性 应用PCR-RFLP法进行检测。(1)模板DNA提取:抽取空腹肘正中静脉血2~3 mL,EDTA抗凝,利用血液基因组DNA抽提试剂盒(大连TaKaRa公司)提取外周血白细胞DNA。(2)PCR扩增:上游引物为 5′-AGG CAA TAG GTT TTG AGG GCC AT-3′,下游引物为 5′-TCC TCC CTG CTC CGA TTC CG-3′。PCR 条件为 94℃5 min预变性,35个循环(94℃1 min变性,59℃45 s退火,72℃6O s延伸),72℃5 min终末延伸;扩增产物为107 bp。(3)PCR产物以限制性核酸内切酶NcoⅠ在37℃酶切1 h,2.5%琼脂糖凝胶电泳分离酶切片段,溴化乙锭染色,在紫外灯下观察基因型结果。(4)序列分析:由天根生化科技(北京)有限公司进行PCR产物的纯化和测序。
1.3 统计学方法 所有分析应用SPSS 11.5统计软件包完成。计量资料用均数±标准差(±s)表示,采用t检验。计数资料用率或构成比表示,组间的比较采用χ2检验。等位基因频率、基因型频率的分析采用χ2检验。T2DM合并MCI危险因素的分析采用非条件Logistic回归分析。对象。2型糖尿病的诊断根据1999年WHO诊断标准,运用简易智能精神状态检查量表(MMSE)、画钟测验(CDT),对每位受检者的认知功能进行综合评定:MMSE包括定向力、记忆力、注意力和计算力、回忆能力、语言能力5个方面的检查,满分为30分;CDT采用国际上普遍采用4分法计分。依据《2006年中国防治认知功能障碍专家共识》:23分<MMSE<27分,CDT 0~2分的调查者诊断为MCI。调查对象中的40例MCI患者作为T2DM MCI组,从认知功能正常组中随机抽取80例患者作为T2DM非MCI组。排除标准:严重低血糖以及糖尿病酮症酸中毒等昏迷史;退行性神经系统疾病,如帕金森病、Down综合征等;在3个月内有急性脑血管
2 结果
2.1 MCI组和非MCI组临床及生化指标比较 2型糖尿病患者MCI组与非MCI组的年龄、病程、DM家族史、BMI、P2BG、HbA1c、DM 视网膜病变、DM 周围神经病变、高血压比较差别有统计学意义(P<0.05或 P<0.01),性别、FBG、总胆固醇、DM 肾病、冠心病以及胰岛素治疗的差别无统计学意义(P>0.05),见表1。
2.2 TNF-α-308A/G基因多态性分析 TNF-α基因在-308位点为G时定义为TNF-α1,为A时定义为TNF-α2。TNF-α PCR产物经限制性核酸内切酶NcoⅠ酶切后,TNF-α-308AA基因型电泳可见:107 bp 1条带;TNF-α-308 GG基因型电泳可见:87 bp和20 bp 2条带;TNF-α-308 GA基因型电泳可见:107 bp、87 bp和 20 bp 3条带,见图1。2组 TNF-α-308A/G基因型及等位基因的分布差别有统计学意义(P<0.05或P<0.01),见表2。
表1 2型糖尿病患者MCI组和非MCI组临床及生化指标比较 (±s或构成比)
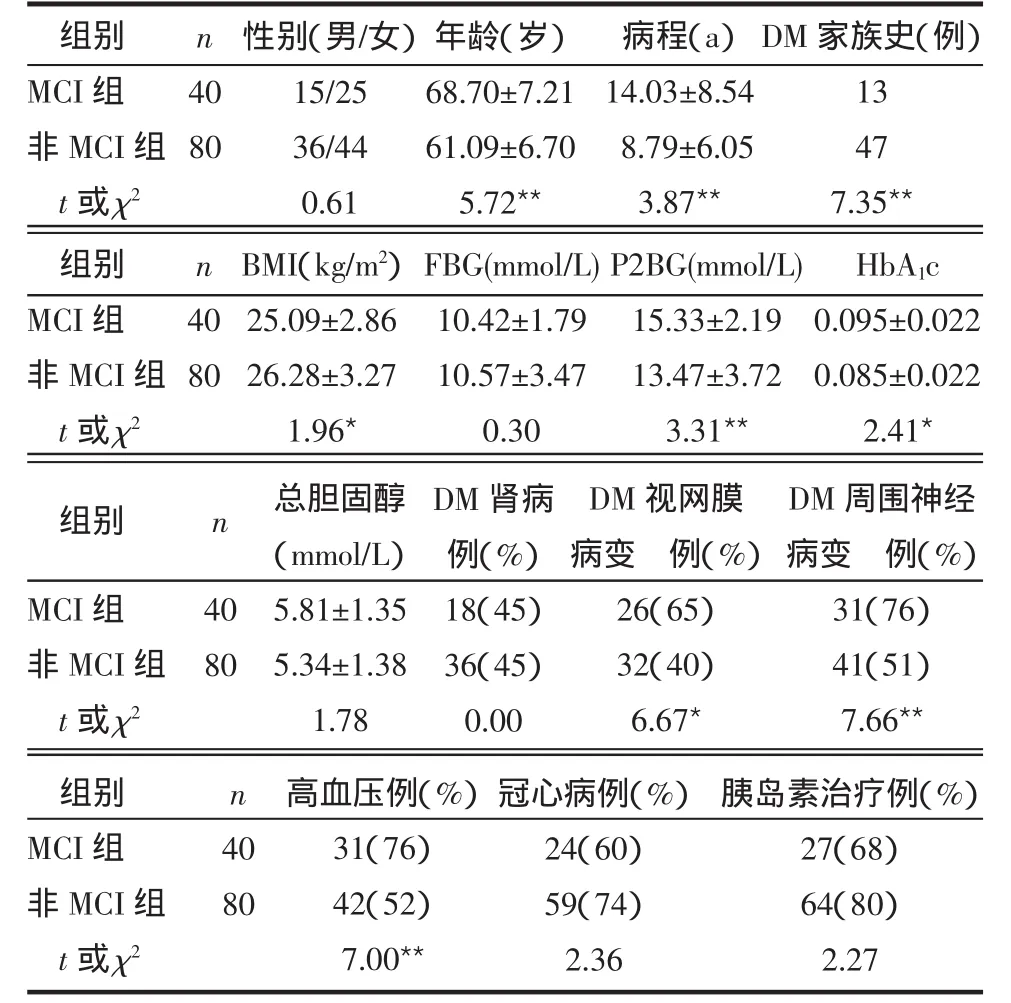
表1 2型糖尿病患者MCI组和非MCI组临床及生化指标比较 (±s或构成比)
*P<0.05,**P<0.01;表2 同
组别MCI组非MCI组t或 χ2 n 40 80性别(男/女)15/25 36/44 0.61年龄(岁)68.70±7.21 61.09±6.70 5.72**病程(a)14.03±8.54 8.79±6.05 3.87**DM家族史(例)13 47 7.35**组别MCI组非MCI组t或 χ2 n 40 80 BMI(kg/m2)25.09±2.86 26.28±3.27 1.96*FBG(mmol/L)10.42±1.79 10.57±3.47 0.30 P2BG(mmol/L)15.33±2.19 13.47±3.72 3.31**HbA1c 0.095±0.022 0.085±0.022 2.41*组别 n MCI组非MCI组t或 χ2 40 80总胆固醇(mmol/L)5.81±1.35 5.34±1.38 1.78 DM肾病例(%)18(45)36(45)0.00 DM视网膜病变 例(%)26(65)32(40)6.67*DM周围神经病变 例(%)31(76)41(51)7.66**组别MCI组非MCI组t或 χ2 n 40 80高血压例(%)31(76)42(52)7.00**冠心病例(%)24(60)59(74)2.36胰岛素治疗例(%)27(68)64(80)2.27
图1 TNF-α基因PCR产物限制性酶切电泳图
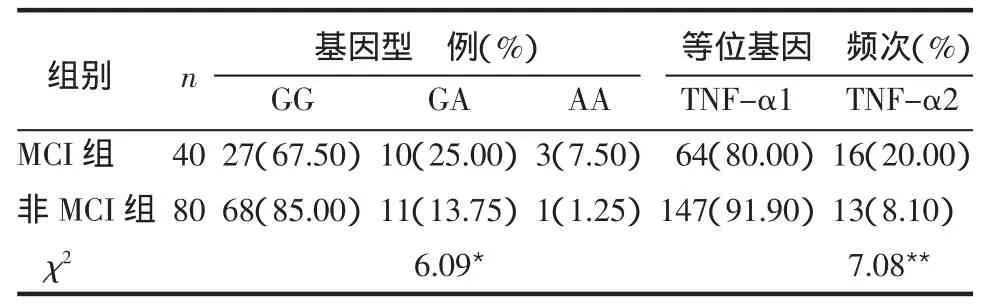
表2 TNF-α-308A/G基因多态性分布
2.3 非条件Logistic回归分析 将MCI组和非MCI组临床及生化指标中差别有统计意义的9项指标和TNF-α基因型作为自变量,以T2DM是否合并MCI作为因变量,进行非条件Logistic回归。结果表明,TNF-α、糖尿病周围神经病变、视网膜病变、年龄、餐后2 h血糖是T2DM合并MCI的危险因素,见表3。
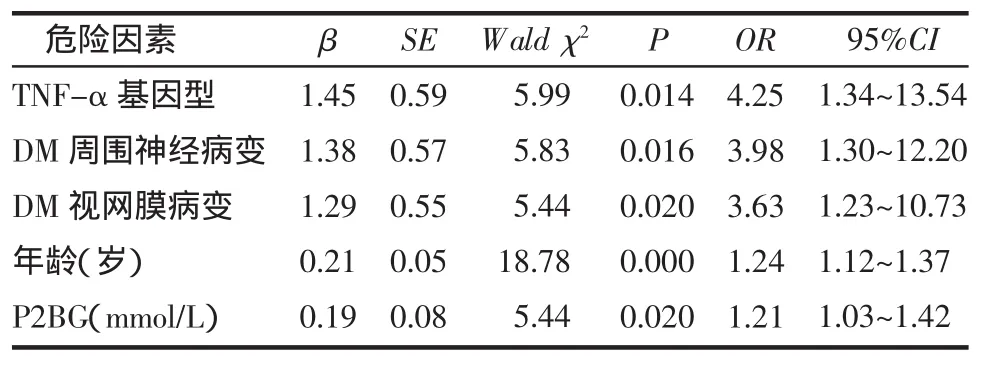
表3 非条件Logistic回归分析
3 讨论
目前医学界公认的MCI指介于正常老化和痴呆之间的一种认知缺损状态,主要表现在记忆减退与年龄的不相称,但没有达到AD的标准。Logroscino等[2]通过大人群前瞻性研究发现,老年T2DM患者基线认知功能测试的得分低于非糖尿病者,并且在2~6年的随访过程中其认知功能下降的危险性增加。
糖尿病患者慢性高血糖及其慢性代谢异常可造成脑血管损害和神经元变性。有研究表明,高血压、糖尿病、高胆固醇和脑白质变性及脑梗死与MCI有关,提示血管危险因素可能是MCI的重要原因[3]。Akisaki等[4]研究发现,T2DM患者的认知功能障碍主要与糖尿病微血管并发症有关,与本文调查结果相似。本研究显示MCI与糖尿病视网膜病变和周围神经病变有关,后者均为糖尿病常见的微血管并发症;未见糖尿病肾病在2组之间有差别,可能与例数较少有关。国外研究表明,高血糖时醛糖还原酶活性显著增高,使葡萄糖转化为山梨醇增加,可引起神经细胞高渗和水肿[5]。此外,高血糖时tau蛋白和 β 淀粉样蛋白(amyloid β protein,Aβ)发生非酶糖基化,形成糖基化终末产物(AGEs),后者通过受体途径刺激免疫应答反应或直接作用产生氧化损伤,导致神经细胞功能障碍甚至死亡。
人TNF-α基因启动子区域-308位点存在G/A多态性并与TNF-α的表达水平有关。与TNF-α1等位基因比较,TNF-α2基因使TNF-α表达增加,TNF-α的浓度也增加[6]。在AD及MCI患者的大脑、脑脊液及外周血中发现TNF-α的升高。Culpan等[7]发现AD患者TNF-α2等位基因频率异常增高,而且携带TNF-α2等位基因者发病年龄较早。目前大多学者认为TNF-α基因多态性增加了AD的发病风险[8]。Bermejo等[9]研究表明AD脑内炎症反应增强,活化的炎性细胞和大量炎性细胞因子(主要包括IL和TNF)通过一系列信号传导通路促使Aβ沉积以及老年斑和神经纤维缠结的形成,造成神经元的损伤和死亡。
本研究结果显示,TNF-α与DM合并MCI的遗传易感性相关,推断TNF-α2等位基因是DM罹患MCI的危险因素。但DM合并MCI的发生为多因素参与,且TNF-α基因多态性在不同人种、地区的差异及与其发病机制目前尚未完全清楚。本研究例数有限,需进一步深入研究。同时,强调早期、有效地治疗DM患者的血糖、并发症等可能是防止MCI发生的有效措施,对预防痴呆可能起到一定的作用。
[1]Kalaria RN.Neurodegenerative disease:Diabetes,microvascular pathology and Alzheimer disease[J].Arch Neurol,2009,66(3):315-322.
[2]Logroscino G,Kang JH,Grodstein F.Prospective study of type 2 diabetes and cognitive decline in women aged 70-81 years[J].BMJ,2004,328(7439):548.
[3]Roberts RO,Geda YE,Knopman DS,et al.Association of duration and severity of diabetes mellitus with mild cognitive impairment[J].Arch Neurol,2008,65(8):1066-1073.
[4]Akisaki T,Sakurai T,Takata T,et al.Cognitive dysfunction associates with white matter hyperintensities and subcortical atrophy on magnetic resonance imaging of the elderly diabetes mellitus Japanese elderly diabetes intervention trial(J-EDIT)[J].Diabetes Metab Res Rev,2006,22(5):376-384.
[5]Pavlović DM,Pavlović AM.Dementia and diabetes mellitus[J].Srp Arh Celok Lek,2008,136(3-4):170-175.
[6]Elahi MM,Asotra K,Matata BM,et al.Tumor necrosis factor alpha-308 gene locus promoter polymorphism:an analysis of association with health and disease[J].Biochim Biophys Acta,2009,1792(3):163-172.
[7]Culpan D,MacGowan SH,Ford JM,et al.Tumor necrosis factor alpha gene polymorphisms and Alzheimer’s disease[J].Neurosci Lett,2003,350(1):61-65.
[8]Tan ZS,Beiser AS,Vasan RS,et al.Inflammatory markers and the risk of Alzheimers’disease[J].Neurology,2007,68(22):1902-1908.
[9]Bermejo P,Martín-Aragón S,Benedí J,et al.Differences of peripheral inflammatory markers between mild cognitive impairment and Alzheimer’s disease[J].Immunol Lett,2008,117(2):198-202.

