瑞林类寡肽抗癌药物的合成研究进展
宋 芸, 魏绍川,, 王永峰, 焦淑清
(1. 天津天士力集团研究院 化学药物研究所,天津 300402;2. 佳木斯大学 化学与药学院 黑龙江省生物药制剂重点实验室,黑龙江 佳木斯 154007)
瑞林类药物的母体是促性腺激素释放激素(Gonadotropin-releasing Hormone,简称GnRH),亦称黄体生成素释放激素(Luteinizing Hormone-releasing Hormone,简称LH-RH ),是由下丘脑脉冲式分泌的十肽激素,其氨基酸序列为:焦谷氨酸(pGlu)-组氨酸(His)-色氨酸(Trp)-丝氨酸(Ser)-酪氨酸(Tyr)-甘氨酸(Gly)-亮氨酸(Leu)-精氨酸(Arg)-脯氨酸(Pro)-甘氨酸(Gly)-氨基。将母体GnRH的6-位和10-位Gly进行构型转换和残基置换,得到了一系列GnRH激动剂,即具有重要临床价值的瑞林类寡肽药物,通式为pGlu-His-Trp-Ser-Tyr-X-Leu-Arg-Pro-Y,其氨基酸序列与构型见表1。
瑞林类药物属于寡肽类化合物,具有易于吸收、生物利用度高、生物活性强且对人体无毒副作用等诸多优点,临床在治疗前列腺癌、乳腺癌、子宫肌瘤、青春性早熟、子宫内膜异位症和功能性子宫出血等一些激素依赖性疾病[1]上有着显著疗效,其价格昂贵,市场前景非常广阔。巨大的经济效益刺激着人们对其合成方法的研究和不断完善。目前,多肽的合成方法主要包括液相合成、固相合成以及液-固联用合成,本文简要介绍这几种方法在瑞林类寡肽药物合成中的应用。

表 1 瑞林药物的氨基酸序列及构型Table 1 Sequence and configuration of amino acids in Relin drugs
1 液相合成
液相多肽合成是在溶液中进行的化学合成方法,因其每步中间产物都可以纯化、可以随意进行非氨基酸修饰并避免氨基酸缺失等优点而成为短肽合成的首选方法。采用液相合成法已经成功合成了多个瑞林药物。
1.1 氨基、羧基及侧链官能团的保护
氨基酸作为肽合成的基本单元,含有氨基、羧基及某些活泼的侧链基团,为确保反应定向进行及减少副反应的发生,不参与反应的活性基团在接肽反应时必须处于被保护状态。以戈舍瑞林(1, Chart 1)为例,合成中所用到的氨基酸有pGlu, His, Trp, Ser, Tyr, D-Ser, Leu, Arg及Pro,文献中对这些氨基酸的氨基、羧基及活泼侧链的保护如表2所示。
1.2 短肽片段的合成
氨基酸的活性基团进行保护后,前一个氨基酸分子裸露的羧基和下一个氨基酸分子裸露的氨基在溶液中可以定向形成酰胺键。文献所用到的瑞林药物的接肽方法主要有碳二亚胺法、混合酸酐法、活化酯法和叠氮物法。这几种方法经常交叉混合使用于同一个瑞林药物不同短肽片段的合成中。下面仅以二肽 pGlu-His 的合成为例简要介绍这几种方法的具体操作。
(1) 碳二亚胺法[4]: 将pGlu和His-OMe·2HCl悬浮在DMF中,搅拌下于-5 ℃加入三乙胺和二环己基碳二亚胺(DCC),反应2 h后室温反应过夜得保护二肽pGlu-His-OMe。
(2) 混合酸酐法[11]: 将Z-pGlu溶解在THF中,冷却至-20 ℃时加入N-甲基吗啉(NMM)和氯甲酸异丁酯,搅拌反应1 min得混合酸酐,加N-羟基琥珀酰亚胺(HOSu)反应30 min后再加入His-OH·HCl和三乙胺的水溶液,于0 ℃反应1 h后室温反应过夜得保护二肽Z-pGlu-His。
(3) 活化酯法[2]: 将等摩尔的His-OH·HCl和Na2CO3溶解在水和DMF的混合溶剂中,搅拌下于室温加入Z-pGlu-ONB的二氧六环溶液,反应14 h得保护二肽Z-pGlu-His。
(4) 叠氮物法[10]: 均以氨基酸酯或肽羧酸酯为起始原料。pGlu-His-OMe和99%水合肼溶解在甲醇中,搅拌下于10 ℃反应1 h后室温反应过夜得pGlu-His-NHNH2。 0 ℃将其溶解在干燥的 DMF和DMSO的混合溶剂中,加入无水HCl的THF溶液。冷却至-20 ℃时加入亚硝酸异戊酯,反应30 min后再冷却至-24 ℃,缓慢滴加三乙胺调节体系的pH 8~9。于-20 ℃加入Trp-OBzl的干燥DMF溶液,反应30 min后于0 ℃反应18 h得保护三肽pGlu-His-Trp-OBzl。
1.3 保护基的脱除
通过以上方法得到的保护短肽片段,只有脱除氨基或羧基保护基后,才能和另一个氨基酸或短肽片段进行下一步接肽反应以增长肽链。从表2可以看出,瑞林类寡肽原料药的合成所用到的氨基保护基主要是苄氧羰基(Cbz)和叔丁氧羰基(Boc)。其中包含有Arg(NO2或Tos)的肽片段,如果需要保持侧链保护基,则用HBr/AcOH体系处理以脱去Cbz[6,15,16],而其余氨基酸的Cbz则用5%Pd/C催化氢化脱除。Boc-Arg[8]保护基的脱除是在室温下用3 mol·L-1HCl在乙酸乙酯中反应,其余Boc的脱除则在冰浴下用少量三氟乙酸处理[4]。
对于羧基保护基的脱除,His(Bzl)-OBzl[3]和Trp-OBzl[9,10]中苄酯保护基采用5%Pd/C催化氢化进行;除Arg(NO2)-OMe[14]之外,其余肽甲酯的脱除则用1 mol·L-1NaOH室温进行皂化[5,7,13];而大部分羧基保护基则在水合肼、HCl 和亚硝酸异戊酯等的作用下转变为叠氮化物[4,6,8,9,11~14],而后
用于下一步接肽反应。
瑞林类寡肽的合成所用到的侧链保护基的脱除大都采用催化还原法,如 His(Bzl)[3], Tyr(Bzl)[8,14]和Arg(NO2)[8,11]的侧链保护基均采用Pd/C催化氢化脱除,而Arg(Cbz2)[14]则采用Pd/BaSO4在甲醇中催化氢化脱除侧链保护基。Arg(Tos)[11]中侧链保护基Tos则用HF/苯甲醚体系脱除。
需要指出的是,侧链保护基与α-氨基保护基的选择必须符合正交保护策略,即α-氨基保护基的脱除条件要尽量远离脱除侧保护的条件,以便在肽链缩合的过程中保持侧链保护基的完整性。
1.4 瑞林类寡肽药物的合成
将氨基酸的活性基团进行合理保护后,可以通过溶液中的逐个增长肽链法和片段缩合法合成瑞林类寡肽药物。
逐个增长肽链法[18]: 从肽链的羧端氨基酸Gly开始,依次和Boc或Cbz保护氨基酸在DCC作用下逐步向氨端增长肽链,直至侧链保护的戈那瑞林的生成。

Chart1

表 2 合成戈舍瑞林所用氨基酸活性基团的保护*Table 2 Protection of active groups of amino acids in the synthesis of goserelin
*-:无保护基; Cbz:苄氧羰基; Boc: 叔丁氧羰基; Bzl: 苄基; Tos: 对甲苯磺酰基; Trt: 三苯甲基; Mtr: 4-甲氧基-2,3,6-三甲基苯磺酰基
片断缩合法: 是指在溶液中将几个预先合成的短肽片断连接起来。文献报道的片段缩合方式主要有2+8[19], 3+7[14,20], 4+6[8,17,21,22], 5+5[7,23,24]以及6+3[25]。其中一个典型的4+6[17]片段缩合合成戈舍瑞林的路线如Scheme 1所示。
首先液相合成保护二肽pGlu-His-OMe和Trp-Ser-OMe及保护三肽Cbz-Tyr(Bzl)-D-Ser(But)-Leu-OMe和Arg(NO2)-Pro-Azagly-NH2,然后分别采用叠氮物法合成保护的四肽(2+2)及六肽(3+3)片段。脱除六肽的氨基保护基及精氨酸侧链胍基保护基后和四肽片段重复采用叠氮物法合成十肽戈舍瑞林。需要指出的是,除本例采用的叠氮物法外,碳二亚胺法、混合酸酐法和活化酯法也适用于片段缩合合成瑞林化合物。
在液相合成瑞林药物的过程中,每次接肽反应后都需要对产物进行分离纯化以除去未反应的原料和副产物,步骤冗长且麻烦,因操作带来的损失也很大。早在1971年,A V Schally等[27]采用固相方法合成了第一个GnRH 类似物,由于此方法使多肽合成实现了自动化,只在最后一步进行分离纯化,省时省力,基于其优点固相肽合成也已经广泛应用于瑞林类寡肽药物的合成中。
pGlu-His-OMe+Trp-Ser-OMe Cbz-Tyr(Bzl)-D-Ser(But)-Leu-N3(3)+Arg(NO2)-Pro-Azagly-NH2(3)

pGlu-His-Trp-Ser-OMe(4) Cbz-Tyr(Bzl)-D-Ser(But)-Leu-Arg(NO2)-Pro-Azagly-NH2

pGlu-His-Trp-Ser-N3+ Tyr-D-Ser(But)-Leu-Arg-Pro-Azagly-NH2·HCl

pGlu-His-Trp-Ser-Tyr-D-Ser(But)-Leu-Arg-Pro-Azagly-NH2(1)
Scheme1
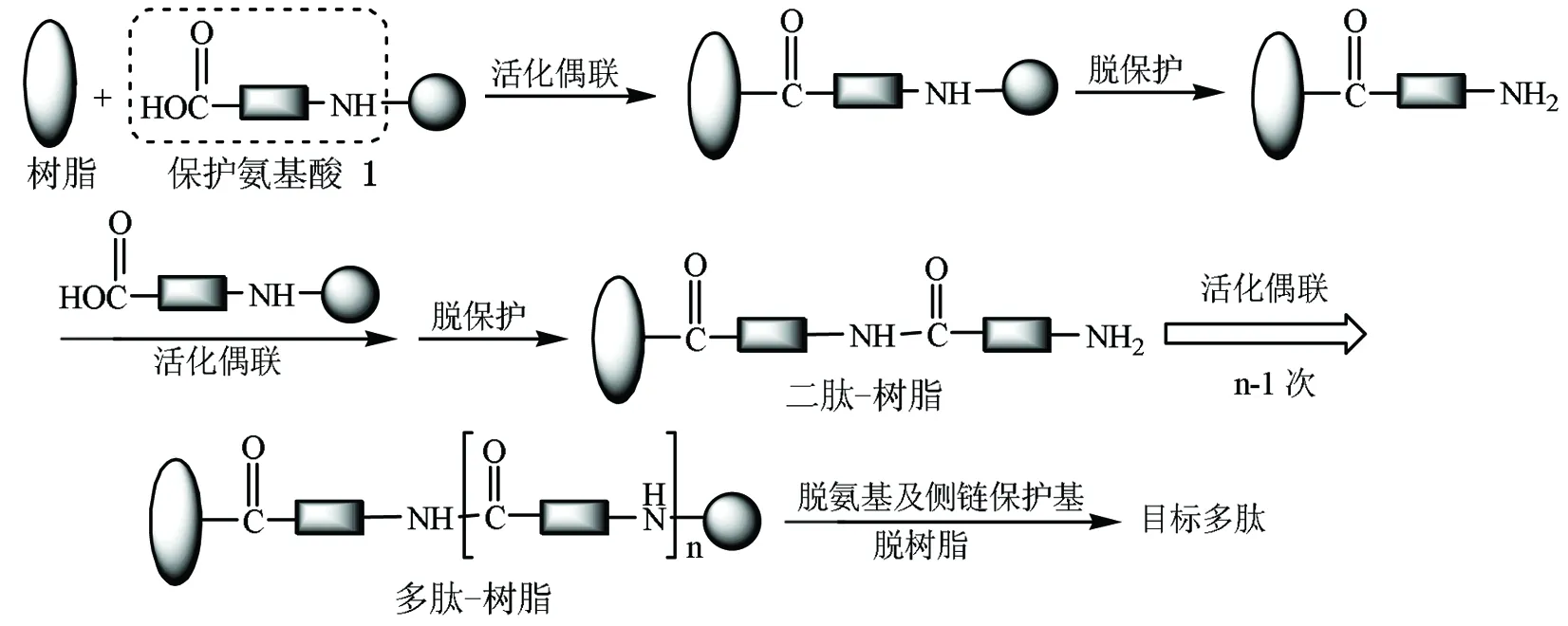
Scheme2
2 固相合成法
固相肽合成的反应过程如Scheme 2所示。先将所要合成肽链的末端氨基酸的羧基共价键合到一个不溶性的高分子树脂上,然后脱去此氨基酸的氨基保护基,以此为氨基组分同过量的活化羧基组分反应以接长肽链。这样的步骤重复多次至目标肽的生成,即缩合→洗涤→去保护→中和、洗涤→下一轮缩合。根据α-氨基保护基的不同,目前合成瑞林类寡肽药物的固相方法主要分为Boc法,Fmoc(芴甲氧羰基)法以及两者的结合,下面对这三种方法所用到的固相载体、缩合方法,α-氨基以及侧链保护基及脱保护基的条件、肽从树脂上脱除方法等方面进行总结。
2.1 Boc法
Boc法是指所有参与反应的氨基酸其α-氨基均采用Boc进行保护,其羧基活化后(已报道的瑞林类寡肽的Boc法固相合成,羧基均采用DCC活化)与树脂末端裸露的氨基组分进行接肽反应。每一步接肽反应完成后,在中强酸作用下脱除Boc保护基,使α-氨基裸露出来以便进行下一步接肽反应。
为了确保反应的定向进行及减少副反应,活泼的侧链基团必须进行保护。侧链保护基的选择原则仍需符合正交保护策略,即其脱除条件必须远离脱除Boc的中强酸条件,以便在肽链形成的过程中保持侧链保护的完整性。表3列出了文献报道的瑞林类寡肽药物固相Boc法合成中所用的树脂、脱Boc条件、侧链保护基及其脱除方法以及寡肽从树脂上的切割方法等。从表3可以看出,固相合成瑞林类寡肽药物中,Boc的脱除均采用了三氟乙酸(TFA)/二氯甲烷(DCM)和1 mol·L-1HCl/AcOH的中强酸条件。肽链从二苯甲胺树脂上切割采用了HF/苯甲醚体系的酸裂解法,从聚苯乙烯/二乙烯基苯交联树脂和氯甲基树脂上的切割则采用了氨解的方法。接肽反应完成后,所有的侧链保护基的脱除和肽链的切割同时进行或者切割后一步脱除。
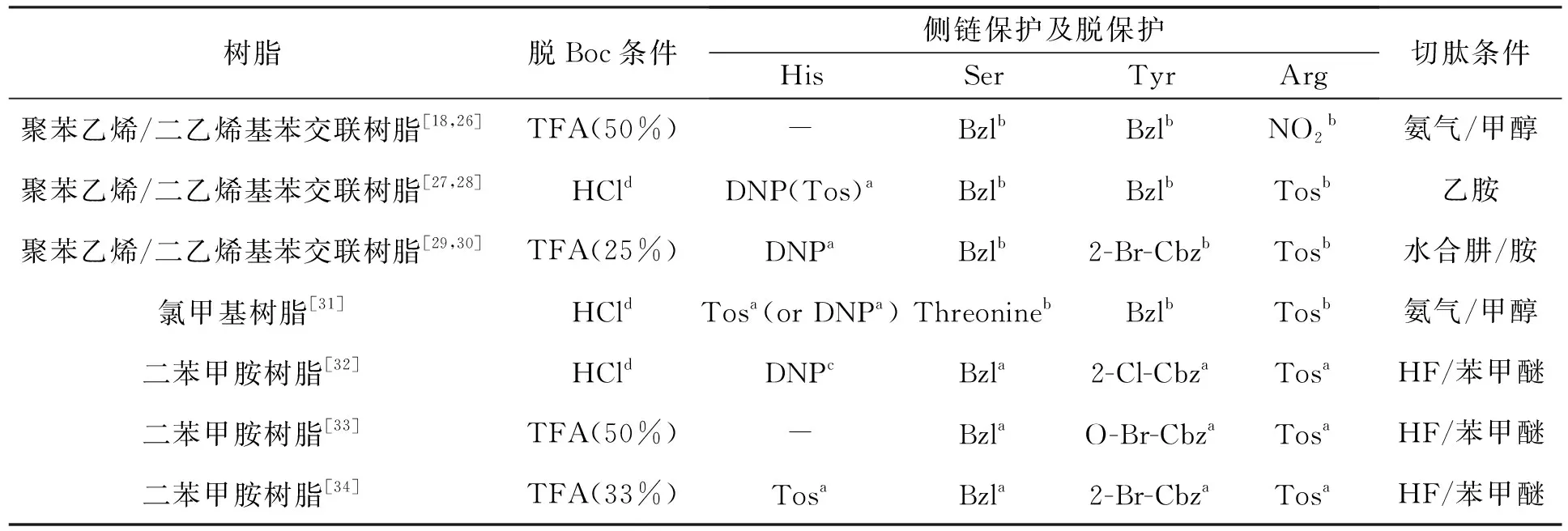
表 3 固相Boc法合成瑞林类寡肽药物 Table 3 Solid phase Boc methods for the synthesis of Relin drugs
a. 和肽链从树脂上脱除时一起脱掉; b. 用HF在苯甲醚(20%)中脱去(0 ℃); c. 氨解; d. 1 mol·L-1

表 4 固相Fmoc法合成瑞林类寡肽药物Table 4 Solid phase Fmoc methods for the synthesis of Relin drugs
a.V(TFA) ∶V(DCM)=2 ∶98; b. TFA/TIS/H2O/EDT溶液,室温反应2 h; c. 5%Pd/C; d. AcOH/TFE/DCM
以文献[34]方法为例说明固相Boc法合成曲普瑞林的实验过程:将二苯甲胺树脂放在反应器中,按如下顺序洗涤:(a)DCM; (b)33%TFA/DCM洗两次; (c)DCM; (d)乙醇; (e)氯仿; (f)10%TFA/氯仿洗两次,每次25 min; (g)氯仿; (h)DCM。洗过的树脂和Boc-Gly在二环己基碳二亚胺(DCC)作用下于DCM中室温反应2 h,而后用DCM,乙醇和DCM分别洗树脂三次。再用33%TFA/DCM体系脱保护,而后重复c~h洗涤步骤。采用如上相同的方法依次连接下面的氨基酸:Boc-Pro; Boc-Arg(Tos); Boc-Leu; Boc-D-Trp; Boc-Tyr(2-Br-Cbz); Boc-Ser(Bzl); Boc-Trp; Boc-His(Tos)和pGlu。所得到的十肽-树脂用DCM和甲醇分别洗三次,减压干燥;于20%的HF/苯甲醚中0 ℃反应30 min,肽链从树脂上脱落的同时侧链保护基全部脱除,分离纯化得曲普瑞林。
2.2 Fmoc法
所有参与反应的氨基酸,其α-氨基均采用Fmoc进行保护,其羧基活化后与树脂末端裸露的氨基组分进行接肽反应。每一步接肽反应完成后,Fmoc均采用20%的哌啶/DMF进行脱除。为确保肽链形成过程中侧链保护的完整性,侧链保护基的脱除条件也必须远离脱除Fmoc的碱性条件。表4列出了文献报道的瑞林类寡肽药物固相Fmoc法合成中所用的树脂、接肽条件、侧链保护基及其脱除方法以及寡肽从树脂上的切割方法等。从表4 可以看出,Fmoc固相合成瑞林药物,接肽反应采用了RCO2Bt活化酯中间体,肽链从树脂上的切割均采用酸裂解方式。接肽反应完成后,所有的侧链保护基的脱除和肽链的切割同时进行或者切割后一步脱除。
2.3 Boc和Fmoc联用法
C F Hayward[40]采用了Boc和Fmoc联用法成功合成了1。首先将Boc-Pro连接到聚苯乙烯/二乙烯基苯交联树脂上,用45%TFA/DCM溶液脱Boc保护基,同时采用HOBt和DIPC(二异丙基亚胺)在DMF中将Boc-Arg(HCl)-OH和Boc-Leu-OH的羧基活化为苯并三唑酯,然后依次和脱Boc保护基后的氨基进行接肽反应得到Boc-Leu-Arg(HCl)-Pro-树脂。其余氨基酸的α-氨基采用Fmoc保护,其羧基用HOBt活化,然后按如下顺序Fmoc-D-Ser(But)-OH, Fmoc-Tyr(BrCbz)-OH, Fmoc-Ser-OH, Fmoc-Trp-OH, Fmoc-His(Fmoc)-OH, pGlu-OH依次连接到肽-树脂上。其中Fmoc保护基的脱除采用20%哌啶/DMF溶液。所得到的九肽-树脂和20倍过量的无水肼/DMF室温反应24 h可使肽从树脂脱落,并同时除去Tyr的侧链保护基Br-Cbz,得九肽pGlu-His-Trp-Ser-Tyr-D-Ser(But)-Leu-Arg-Pro-NHNH2,再和氰酸钾在水/乙酸的混合溶剂中反应得到终产物1。
E Nicolás等[41]还采用类Merrifield树脂从碳端开始前四个氨基酸[Pro, Arg(Mtr), Leu和D-Leu]采用Boc法,后四个氨基酸[Tyr(But), Ser(But), Trp和His(Trt)]采用Fmoc法依次连接,最后和pGlu连接后使用乙胺液体从树脂上切割下来得亮丙瑞林。
3 液-固联用法
无论是单用液相还是固相合成寡肽药物,均存在着方法上的缺陷。液相合成步骤繁琐冗长,耗时费力,而固相合成需使用大量的洗脱溶剂,最后的分离纯化困难。因此发展了液-固联用法,并且此方法也已经成功应用于瑞林类寡肽药物的合成中。
其中一个成功的例子是内源性戈那瑞林的合成[42]。先采用Boc固相合成法将Boc-Gly, Boc-Pro, Boc-Arg(NO2)和Boc-Leu在2,2′-联吡啶二硫化物和三苯基磷作用下依次连接到羟甲基树脂上,得四肽Boc-Leu-Arg(NO2)-Pro-Gly-树脂。同时采用传统的液相合成法合成短肽片段Boc-Ser(Bzl)-Tyr(Bzl)-Gly-OH和Boc-His(Tos)-Trp-OH,再采用固相接肽法依次将这两个短肽片段连接到四肽-树脂上得侧链保护的九肽-树脂。用 Na/液氨除去所有的侧链保护基,再用HF/苯甲醚将九肽从树脂上切割下来后,同羧基活化的pGlu-OPcp液相反应得戈那瑞林。该文另一种液-固联用法合成戈那瑞林是先将Glu连接到氯甲基甲酰化树脂上,同时采用液相法合成短肽片段H-His-Trp-Ser(But)-Tyr-Gly-OBut和H-Leu-Arg(NO2)-Pro-Gly-NH2。树脂-Glu-OBut和三倍量的短肽片段在2,2′-联吡啶二硫化物和三苯基磷作用下进行固相片段接肽合成树脂-十肽,用HF/苯甲醚将肽从树脂上切割下来并脱除侧链保护基后,Glu环化即得到戈那瑞林。
最近,上海吉尔生化的朱琦等[43]以Arg(pbf)-Trt(2-Cl)-Cl树脂为起始原料,在 DIC(1 eq)和HOBt作用下在DMF溶液中将Fmoc保护氨基酸依次连接,得全保护八肽pGlu-His(Trt)-Trp-Ser(But)-Tyr(But)-D-Leu-Leu-Arg(Pbf)-树脂,再用1%的TFA/DCM溶液将肽链切割下来。同时,Boc-Pro在THF中和NMM,氯甲酸乙酯及乙胺反应,经2 mol·L-1HCl/二氧六环脱Boc得H-Pro-NHEt·HCl,而后和全保护八肽在DMF中,在HOBt和NMM或DIEA及DIC或BOP作用下生成侧链保护的九肽,一步脱除侧链保护基得到亮丙瑞林粗品。
4 结束语
目前,国内对GnRH类似物的年需求量在50 kg左右,并以15%的年增长率增长。由于受合成技术的限制,几种具有广阔市场前景的瑞林原料药在国内尚不能够进行规模化生产,用于制剂研究的原料药需要进口,这极大制约了瑞林类药品的国产化。瑞林药物90%以上的市场由外资企业所控制,中国产品几乎为零,所以该类药品价格昂贵。鉴于此,本文在查阅大量文献的基础上,对瑞林类药物已有的合成方法进行了归纳总结,希望以此推动瑞林类原料药在国内早日实现规模化生产。
[1] 田玲,路学智. 瑞林类人工合成肽类药物的研究进展[J].中国新药杂志,2006,15:1723-1726.
[2] Fujino M, Kobayashi S, Obayashi M,etal. The use ofN-hydroxy-5-norbornene-2,3-dicarboximide active ester in peptide synthesis[J].Chem Pharm Bull,1974,22:1857-1863.
[3] Folkers K, Chang J K, Sievertsson H,etal. Synthesis of analogs of the thyrotropin-releasing hormone and structure.Activity relations[J].J Med Chem,1971,14:484-487.
[4] Veber D F, Brady S F. Pentapeptide intermediate of LHRH and derivatives thereof[P].US 3 888 836,1975.
[5] Terada S, Nakagawa S H, Yang D C,etal. Iodination of luteinizing hormone-releasing hormone[J].Biochemistry,1980,19:2572-2576.
[6] Yardley J P, Corbin A. Claudogenic-interceptive nonapeptide[P].US 4 272 432,1981.
[7] Daniel K, Gerhard J, Voker A. Solution-phase synthesis of leuprolide[P].EP 1 790 656,2007.
[8] Dutta A S, Furr B J A, Giles M B. Polypeptide[P].US 4 100 274,1978.
[9] Immer H U, Nelson V R, Gotz M K. Decapeptide having luteinizing hormone(LH)- and follicle stimulating hormone(FSH)-releasing activity,salts and compositions thereof,a process for preparing same,and intermediates thereof[P].US 3 888 838,1975.
[10] Chang J K, Sievertsson H, Currie B L,etal. Synthesis of the luteinizing-releasing hormone of the hypothalamus and the 8-lysine analog[J].J Med Chem,1972,15:623-627.
[11] Kashimoto K, Nagano Y, Ohata A. Process for producing LH-RH derivatives[P].US 6 448 031,2002.
[12] Rebstock M C, Nicolaides E D, Mick T F,etal. Pyroglutamyl-histidyl-tryptophanyl-seryl-tyrosyl hydrazides[P].US 4 128 540,1978.
[13] Fischer B F, Whetstone R R. Peptide derivatives containing two trifunctional amino acids[J].J Am Chem Soc,1954,76:5076-5080.
[14] Konig W, Geiger R, Sandow J K. Peptide having LH-RH/FSH-RH activity[P].US 4 024 248,1977.
[15] Flegel M, Pospisek J, Picha J,etal. Luteinizing and follicle stimulating hormones and process for the preparation thereof[P].US 4 512 923,1985.

[17] Dutta A S, Furr B J A, Giles M B,etal. Synthesis and biological activity of highly activeα-aza analogues of luliberin[J].J Med Chem,1978,10:1018-1024.
[18] Flouret G, Arnold W H, Cole J W,etal. Synthesis and biological activity of the hypothalamic LH- and FSH-releasing decapeptide[J].J Med Chem,1973,16:369-373.
[19] Geiger R, König W, Wissmann H,etal. Synthesis and characterization of a decapeptide having LH-RH/FSH-RH activity[J].Biochem Biophys Res Commun,1971,45:767-773.
[20] Chien A, Shinsuke W. A method for peptide synthesis using a microchip pileup type chemical reaction system[P].JP 2 006 169 165,2006.
[21] Elzbieta M. Method of obtaining l-pyroglutamyl-l-histidyl-l-tryptophil-l-seril-l-thyrosil-d-o-t-butyloseril-l-lucyl-l-arginyl-l-pyroline-ethylamide[P].PL 170 653B1,1997.
[22] Tikhonov A V, Bobkov J U, Titov M I,etal. Preparation of highly active nonapeptide-ethylamide includes condensation of tetrapeptide with pentapeptide to increase yield and simplify procedure[P].RU 2 086 561,1997.
[23] Torres J L, Adlercreutz P, Clapes P. Reaction medium engineering in enzymatic peptide fragment condensation:Synthesis of eledoisin and LH-RH[J].Bioorg Med Chem,1998,6:891-901.
[24] Krzysztof B, Teresa W, Elzbieta F,etal. Method of obtaining L-pyroglutamyl-L-histidyl-L-tryptophyl-L-seryl-L-tyrosyl-D-(O-t-butyl)-seryl-L-leucyl-L-arginyl-L-prolyl-azaglycine acetate[P].PL,194 997,2007.
[25] Fujino M, Kobayashi S, Obayashi M,etal. Synthesis and biological activities of analogs of luteinizing hormone releasing hormone(LH-RH)[J].Biochem.Biophys Res Commun,1972,49:698-705.
[26] Matsuo H, Arimura A, Nair R M G,etal. Synthesis of the porcine LH- and FSH-releasing hormone by the solid-phase method[J].Biochem Biophys Res Commun,1971,45:822-827.
[27] Coy D H, Coy E J, Schally A V,etal. Synthesis and biological properties of [D-ala-6,des-gly-NH2-10]-LH-RH ethylamide,a peptide with greatly enhanced LH- and FSH-releasing activity[J].Biochem Biophys Res Commun,1974,57:335-340.
[28] Coy D H, Coy E J, Schally A V,etal. Stimulatory and inhibitory analogs of luteinizing hormone releasing hormone[J].Biochemistry,1974,13:323-326.
[29] Coy D H, Coy E J, Arimura A,etal. Solid phase synthesis of growth hormone-release inhibiting factor[J].Biochem Biophys Res Commun,1973,54:1267-1273.
[30] Coy D H, Coy E J, Schally A V,etal. Synthesis and biological activity of LH-RH analogs modified at the carboxyl terminus[J].J Med Chem,1975,18:275-277.
[31] Coy D H, Coy E J, Schally A V. Effect of simple amino acid replacements on the biological activity of luteinizing hormone-releasing hormone[J].J Med Chem,1973,16:1140-1143.

[33] Humphries J, Wan Y P, Wasiak T,etal. Structural requirements in positions 1,2,3 and 6 of the luteinizing hormone-releasing hormone(LH-RH) for antiovulatory activity[J].J Med Chem,1979,22:774-777.
[34] Schally A V, Coy D H. [D-Trp6]-LH-RH and intermediates thereof[P].US 4 0101 25A,1977.
[35] Cotton R, Giles M B. Solid phase peptide synthesis[P].EP 0 518 655 A,1992.
[36] Berta P O, Marc C P, Gemma J F,etal. Peptide synthesis procedure in solid phase[P].US 6 897 289B1,2005.
[37] Zurit A T, Oshrat C E, Karmiel S S,etal. Methods for the production of peptide derivatives[P].US 0 276 626A,2006.
[38] Kim K M, Ryoo S J, Cha K H,etal. A method for preparing peptides using by solid phase synthesis[P].WO 044 890A1,2008.
[39] 周达明. 固相多肽合成亮丙瑞林的制备方法[P].CN 1 865 280A,2006.
[40] Hayward C F. Peptide process[P].US 5 510 460A,1996.
[41] Nicolás E, Clemente J, Ferrer T,etal. The use of the Nbb-resin for the solid-phase synthesis of peptide alkylesters and alkylamides.Synthesis of leuprolide[J].Tetrahedron,1997,53:3179-3194.
[42] Matsueda R, Maruyama H, Kitazawa E,etal. Solid phase peptide synthesis by oxidation-reduction condensation.Synthesis of LH-RH by fragment condensation on solid support[J].Bull Chem Soc Japan,1973,46:3240-3247.
[43] 徐红岩,朱琦. 亮丙瑞林的固液合成法[P].CN 101 195 653A,2008.
——细胞生长因子

