胰腺实性假乳头状肿瘤的组织病理特征分析
程东峰 沈柏用 袁菲 韩宝三 朱延波 邓侠兴 陈皓 金佳斌 金晓龙 彭承宏
·论著·
胰腺实性假乳头状肿瘤的组织病理特征分析
程东峰 沈柏用 袁菲 韩宝三 朱延波 邓侠兴 陈皓 金佳斌 金晓龙 彭承宏
目的分析总结胰腺实性假乳头状肿瘤(SPT)的组织病理特点。方法回顾性分析51例SPT患者的临床资料,通过免疫组化法检测其中39例SPT组织蜡块中神经特异性烯醇化酶(HSE)、突触素(SYN)、神经细胞黏附分子1(CD56)、神经内肽酶(CD10)、巢蛋白(Nestin)、波形蛋白(Vim)、S100收集组织蛋白(S100)、α1抗糜蛋白酶(α1-ACT)、α1抗胰蛋白酶(α1-AT)、上皮膜抗原(EMA)、抗广谱细胞角蛋白单抗(AE1/AE3)、角蛋白多肽(CK19)的表达。结果SPT组织病理特征为假乳头结构形成和区域性坏死,无腺泡结构。39例SPT中,NSE表达率达97.4%,CD56和CD10的表达率均为84.6%,Nestin和Vim表达率分别为64.0%和87.0%,S100的表达率为79.5%,α1-ACT 和α1-AT的表达率分别为82.1%和79.5%,而SYN的表达率仅12.8%,EMA、AE1/AE3和CK19等表达很少,呈弱阳性反应。结论SPT典型病理特征是由于肿瘤组织不同区域相对缺血、缺氧所造成的退行性变的结果,SPT表达多种组织来源的抗原,反映其可能来源于胰腺干细胞及与其发育密切相关的胚胎神经嵴的神经前体细胞,且在发育过程中发生分化不成熟的结果。
胰腺肿瘤; 干细胞; 胰腺实体假乳头肿瘤
材料和方法
一、一般资料
收集我院1996年1月至2009年2月经术后病理确诊为SPT的51例患者,其中男4例,女47例。发病年龄11~65岁,平均(33±13)岁,30岁以下25例(49.0%),50岁以上7例(13.7%)。病程3 d至5年不等,平均为7.2个月。
临床症状为腹部胀痛或隐痛不适27例(52.9%),腰背胀痛3例(5.9%),无腹痛症状21例(41.2%);体检时B超首次发现胰腺或腹腔肿块13例(25.5%),以腹部包块就诊者5例(9.8%);病程中有明显消瘦者4例(7.8%,其中2例为首发症状),皮肤巩膜黄染1例(2.0%)。
二、病理及超微结构检查
标本均常规用10%福尔马林液固定,石蜡包埋,切片, HE染色,光镜观察。8例肿瘤组织送电镜室,常规处理后用H600-Ⅳ型透射电镜观察。
三、免疫组化染色
39例SPT的组织蜡块进行EnVision 二步免疫组化染色,检测的蛋白有神经特异性烯醇化酶(NSE)、突触素(SYN)、神经细胞黏附分子1(CD56)、神经内肽酶(CD10)、巢蛋白(Nestin)、波形蛋白(Vim)、S100收集组织蛋白(S100)、α1抗糜蛋白酶(α1-ACT)、α1抗胰蛋白酶(α1-AT)、上皮膜抗原(EMA)、抗广谱细胞角蛋白单抗(AE1/AE3)和角蛋白多肽(CK19)。抗原修复采用 0.1%胰蛋白酶37℃孵育30 min,所用抗体为Dako、NOVO及上海生物技术有限公司产品,二抗用生物素化猪抗兔多抗或生物素化兔抗鼠单抗。设阳性和阴性对照组。免疫组化染色判定结果参照Kelley教授实验室的标准[2],根据Speiser的标准[3]进行半定量判断,-~+为低表达,++~+++为高表达。
结 果
一、SPT的组织病理特征
肿瘤位于胰头部19例,胰颈部12例,胰体部10例和胰尾部10例。肿瘤直径2.5~25 cm,平均(7.3±4.9)cm。肿瘤表面为纤维性包膜,剖面见囊实相间的结构,囊性区囊内可见明显的出血、暗红色坏死物及黏稠液体,实性区呈灰白及灰黄色,质软,大的坏死灶可形成假囊,散在的小坏死灶使其呈现海绵状外观。
镜下见肿瘤组织由实性区、假乳头区及两者的过渡区混合组成。实性区内肿瘤细胞排列成片状,瘤细胞中等大小,均匀较一致,呈圆形、椭圆形、多角形或细长形,细胞间界限清楚(图1a);细胞质中等量,透明或弱嗜酸性,偶见嗜酸性小球;胞核圆形或椭圆形,位于中央,部分瘤细胞的核有皱折而呈锯齿状或出现核沟(图1b);核染色质细腻,核仁不清,隐约可见单个小核仁,核分裂象罕见。假乳头区肿瘤细胞以纤细血管为轴心形成分支状假乳头(图1c),假乳头表面细胞呈复层排列,远离血管的肿瘤细胞退行性变,显著出血、坏死、囊性变。过渡区表现为肿瘤细胞围绕血管周围生长形成假菊形团(图1d),近血管处肿瘤细胞呈放射状排列,远血管处肿瘤细胞排列松散,间质胶原纤维组织黏液样变性, 血管周围透明变性和黏液变,局部可见大量灶性泡沫状巨噬细胞和异物巨细胞聚集,并见因坏死而出现的囊性区域,透明变的结缔组织条索内可见局灶性钙化。实性区和过渡区肿瘤细胞间可见泡沫细胞、胆固醇结晶裂隙和钙化。
二、SPT细胞的超微结构改变
肿瘤细胞大多分化良好,呈圆形或多角形,胞质内含许多空泡,为溶解的细胞器,以变性的线粒体为多,其次为粗面内质网;肿瘤细胞内含有大小不等的类似酶原颗粒的小体,8~1.2 μm,有界膜,电子密度不均,少数瘤细胞核形状不规则,部分细胞核有皱折而呈现核沟(图1e)。
三、不同组织来源蛋白在SPT中的表达
NSE表达在肿瘤细胞的胞质及胰岛细胞内,表达率为97.4%(图2a);CD56、CD10主要表达在肿瘤细胞的胞质,表达率均为84.6%(图2b),正常胰腺组织不表达;Nestin表达率为64.0%,Vim为87.0%(图2c),S100为79.5%(图2d),α1-ACT为82.1%(图2e),α1-AT为79.5%,SYN仅为12.8%。EMA、AE1/AE3和CK19等的表达很少且很弱,表达率分别为15.4%、12.8%和0(图2f、2g)。
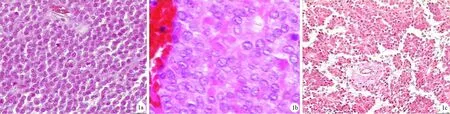
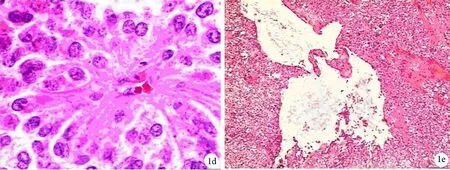
图1SPT细胞的病理及超微结构改变 1a.实性区瘤细胞呈片状或巢状分布(HE ×100);1b.部分癌细胞核出现核沟(HE ×200);1c.以纤维血管为轴心的假乳头状结构(HE ×100);1d.菊花团状结构(HE ×400);1e.类似酶原颗粒的小体(×4000)
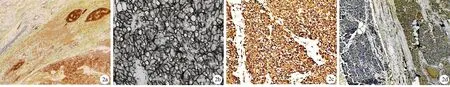

图2SPT细胞中的蛋白表达 2a.HSE(IHC ×40);2b.CD56(IHC ×200);2c.Vim(IHC ×200);2d.S100(IHC ×40);2e.α1-ACT(IHC ×200);2f.EMA阴性(IHC ×200);2g.CK19阴性,导管上皮细胞阳性对照(IHC ×100)
讨 论
SPT分布无明显特征,但原发肿瘤根部总是与胰腺组织紧密相连。该肿瘤在临床发现时,瘤体通常较大,本组SPT的平均直径达7.3 cm。瘤体多具有包膜,或呈“指状”、“小团状”突破包膜进入正常胰腺组织内。因其包膜是在生长过程中推挤周围正常组织所形成的纤维性假包膜,故不能认为是肿瘤的真正边界,外科医师在手术切除时,应稍扩大肿瘤的局部切除范围,以防止肿瘤残留和复发。
镜下显示肿瘤组织多由形态较为一致的瘤细胞构成实性肿瘤细胞巢,这虽与神经内分泌肿瘤相似,但无腺泡或微腺泡结构。SPT实性区多位于外围部,偶有钙化,数层肿瘤细胞围绕纤细血管呈复层排列,邻近血管的肿瘤组织呈假乳头结构;远离血管的肿瘤组织形成囊性区,其中可见泡沫细胞、变性的组织细胞、多核巨细胞、胆固醇结晶和囊内坏死。SPT多种组织学结构的形成是由于肿瘤组织不同区域相对缺血、缺氧所造成的退行性变的结果。实性区肿瘤细胞密集排列,间质极少,仅有纤细的血管,肿瘤易发生缺血、缺氧。过渡性区域的肿瘤细胞排列成以血管为中心的实性巢片状区,远离血管的肿瘤细胞黏附性明显下降,排列松散或成簇地脱落,形成大小不等的裂隙。肿瘤血管周围广泛的纤维化、玻璃样变性、黏液变,也进一步造成血管通透性差,使瘤组织更易缺血,导致囊性变频繁发生。
SPT的肿瘤细胞可表达不同组织来源的蛋白。本组SPT高表达NSE、CD56、CD10、Vim。NSE是神经特异性烯醇化酶,CD56阳性可能表明神经内分泌的分化,CD10是一神经性肽链内切酶。Vim是神经干细胞的标志蛋白,神经早期发生时需要Vim[4],它作为构筑和染色体修饰蛋白直接参与了核内DNA 的重组过程[5],并随年龄增长、细胞分化的逐渐成熟而降低[6]。这些蛋白在胚胰组织中也高表达[7],表明SPT肿瘤细胞的“返祖”现象。
Nestin是一种细胞骨架蛋白,主要在未分化、具有增殖能力的细胞中表达,Nestin阳性细胞具有很强的增殖能力[8],在细胞分化结束时表达下降[9]。近年研究发现,Nestin 阳性细胞存在于胎儿胰腺的间充质、导管基底部以及胰岛内[10]。在胰腺发育过程中,Nestin只在围绕胰腺上皮的间充质表达,并不在上皮组织中表达[11],且Nestin阳性细胞不发育为内分泌细胞[11-12]。此外,Vim也限制性表达于未分化、具有向胰腺内、外分泌细胞分化潜能的细胞中。因此,SPT高表达Vim和Nestin提示其可能源于间叶组织中胰腺干细胞。
S100蛋白广泛表达于神经外胚叶、中胚层、外胚层来源的正常组织细胞中[13],它不仅是黑色素细胞标记物,也是少突细胞、雪旺细胞标记物。本组SPT高表达S100。由于神经鞘瘤、少突胶质细胞瘤、星形细胞瘤和黑色素瘤都来源于神经巢,因此SPT也有可能来源于神经巢或胚胎神经嵴细胞。Chen等[14]的研究也支持此观点。EMA、AE1/AE3、CK19等是上皮细胞性来源的标记物,是导管内皮的特异性标记物,本组SPT中多为低表达而且呈散在分布,提示SPT可能不是来源于上皮细胞。
SPT细胞虽有一定的酶原颗粒,且部分瘤细胞在电镜下可见胞质内有膜包绕的电子致密颗粒,类似于腺泡细胞中的酶原颗粒,似具有腺泡细胞分化特征,但始终未证实有神经内分泌产物的产生,相关研究未发现SPT能产生胰腺激素或其他神经性多肽,临床上也未发现有关的内分泌紊乱综合征,而且SPT中虽NSE多为阳性高表达,但SYN的阳性表达率低而弱,故SPT不能被认为是神经或胰腺内分泌肿瘤。
[1] Choi JY,Kim MJ,Kim JH,et al.Solid pseudopapillary tumor of the pancreas:typical and atypical manifestations.Am J Roentgenol,2006,187:178-186.
[2] Wang D,Luo M,Kelley MR.Human apurinic endonuclease 1 (APE1) expression and prognostic significance in osteosarcoma:enhanced sensitivity of osteosarcoma to DNA damaging agents using silencing RNA APE1 expression inhibition.Mol Cancer Ther,2004,3:679-686.
[3] Faleiro-Rodrigues C,Macedo-Pinto I,Pereira D,et al.Association of E-cadherin and beta-catenin immunoexpression with clinicopathologic features in primary ovarian carcinomas.Hum Pathol,2004, 35:663-669.
[4] Sakairi T,Kobayashi K,Goto K,et al.Greater expression of transforming growth factor alpha and proliferating cell nuclear antigen staining in mouse hepatoblastomas than hepatocellular carcinomas induced by a diethylnitrosamine-sodium Phenobarbital regimen.Toxicol Pathol,2001,29:479-482.
[5] Ros JE,Schuetz JD,Geuken M,et al.Induction of Mdr1b expression by tumor necrosis factor-alpha in rat liver cells is independent of p53 but requires NF-kappaB signaling.Hepatology,2001,33:1425-1431.
[6] Wang X,Hung NJ,Costa RH.Earlier expression of the transcription factor HFH-11B diminishes induction of p21 (CIP1/WAF1) levels and accelerates mouse hepatocyte entry into S-phase following carbon tetrachloride liver injury.Hepatology,2001,33:1404-1414.
[7] Kosmahl M,Seada LS,Jänig U,et al.Solidpseudopapillary tumor of the pancreas:its origin revisited.Virchows Arch,2000,436:473-480.
[8] Humphrey RK,Bucay N,Beattie GM,et al.Characterization and isolation of promoter-defined nestin-positive cells from the human fetal pancreas.Diabetes,2003,52:2519-2525.
[9] Docherty K.Growth and development of the islets of Langerhans:implications for the treatment of diabetes mellitus.Curr Opin Pharmacol,2001,1:641-650.
[10] Selander L,Edlund H.Nestin is expressed in mesenchymal and not epithelial cells of the developing mouse pancreas.Mech Dev,2002,113:189-192.
[11] Huang H,Tang X.Phenotypic determination and characterization of nestin-positive precursors derived from human fetal pancreas.Lab Invest,2003,83:539-547.
[12] Treutelaar MK,Skidmore JM,Dias-Leme CL,et al.Nestin-lineage cells contribute to the microvasculature but not endocrine cells of the islet.Diabetes,2003,52:2503-2512.
[13] Takahashi M,Kawaguchi M,Shimada K,et al.Cyclooxygenase-2 expression in Schwann cells and macrophages in the sciatic nerve after single spinal nerve injury in rats.Neurosci Lett,2004,363:203-206.
[14] Chen C,Jing W,Gulati P,et al.Melanocytic differentiation in a solid pseudopapillary tumor of the pancreas.J Gastroenterol,2004,39:579-583.
2009-05-18)
(本文编辑:吕芳萍)
Pathologicalcharacteristicsofthesolidpseudopapillarytumorofpancreas
CHENGDong-feng,SHENBai-yong,YUANFei,HANBao-san,ZHUYan-bo,DENGXia-xing,CHENHao,JINJia-bin,JINXiao-long,PENGCheng-hong.
CenteroftheorgantransplantationandDepartmentofSurgery,ShanghaiInstituteofDigestiveSurgery,RuijinHospital,MedicalCollege,ShanghaiJiaotongUniversity,Shanghai200025,China
PENGCheng-hong,Email:chhpeng168@126.com
ObjectiveTo summarize and analyze the pathological characteristics of solid pseudopapillary tumor of pancreas (SPTs).MethodsThe clinical data of 51 cases of SPTs were retrospectively analyzed. The immunohistochemical localizations of different markers (HSE, SYN, CD56, CD10, Nestin, Vim, α1-ACT, EMA, AE1/AE3 and CK19) on 39 SPTs were studied.ResultsPathological features included a combination of solid and cystic components with pseudopapillae formation and degenerative regions without glands. Among the 39 cases of SPTs, the expression rate of NSE was 97.4%, the expression rate of CD56, CD10was 84.6%, the expression rate of Nestin and Vim was 64% and 87%, the expression rate of S100 was 79.5%, the expression rate of α1-ACT and α1-AT was 82.1% and 79.5%, while the expression rate of SYN was 12.8%; however there was low expression and weak positive reaction of EMA, AE1/AE3 and CK19.ConclusionsThe typical pathological characteristics of SPTs may result from gradual degenerative changes induced anoxemia in some SPT′s areas. The heterogeneity of SPTs on different antibody markers showed that the SPTs may be originated from pancreatic embryonic stem cells, and result from immature differentiation of the pluripotential stem cells during pancreatic genesis.
Pancreatic neoplasms; Stem cells; Solid-pseudopapillary tumor of pancreas
胰腺实性假乳头状肿瘤(solid pseudopapillary tumor,SPT)最初由Frantz′s报道,并认为其为一独特的无功能性胰腺肿瘤实体。迄今为止,英文文献中已超过500例的报道,但采用了众多不一的名称,如胰腺实性囊性肿瘤、胰腺乳头状囊性肿瘤、胰腺实性乳头状上皮性肿瘤、低度乳头状肿瘤、儿童期腺瘤和Frantz′s瘤等[1]。文献中多种命名的出现反映出对该肿瘤的组织病理特征存在不同程度认识上的异议,其组织病理学特征尚有待于进一步深入分析和研究。本文回顾性分析51例SPT的组织病理表现,检测多种蛋白的表达,以帮助临床医师更为深刻认识和准确把握SPT的组织病理学特征,及时做出正确的临床和病理诊断。
10.3760/cma.j.issn.1674-1935.2010.01.005
200025 上海,上海交通大学医学院附属瑞金医院外科器官移植中心消化外科研究所(程东峰、沈柏用、韩宝三、邓侠兴、陈皓、金佳斌),病理科(袁菲、朱延波、金晓龙、彭承宏)
彭承宏,Email:chhpeng168@126.com

