大鼠胰腺干细胞的分离纯化、鉴定及定向分化
史光军 张磊 许评 于江
·论著·
大鼠胰腺干细胞的分离纯化、鉴定及定向分化
史光军 张磊 许评 于江
目的探讨大鼠胰腺干细胞体外分离、纯化的实验条件及其定向分化潜能。方法应用胰腺原位灌注V型胶原酶消化大鼠胰腺组织,100目滤网滤过,Ficoll 400浓度梯度离心法分离胰腺干细胞,采用添加表皮生长因子(EGF)、成纤维细胞生长因子(bFGF)的培养基行体外培养。运用荧光免疫染色法检测细胞表面CK-19、Pdx-1、Nestin、Insulin和Glucagon蛋白,计算阳性细胞率。双硫腙(DTZ)染色鉴定诱导分化后的细胞,光电酶标记法ELISA检测胰岛素分泌功能。结果本实验获取的胰腺干细胞,体外培养可稳定传代培养8代以上。细胞表面CK-19、Pdx-1和Nestin蛋白均呈阳性,阳性细胞率分别为(88.6±6.2)%、(84.6±8.6)%和(81.3±7.5)%。诱导分化后细胞经DTZ染色呈棕红色。在高糖刺激下,培养上清液中胰岛素含量增高。结论本法可获取高纯度、多数量的胰腺干细胞,在人工诱导下可定向分化为具有胰岛素分泌功能的胰岛样细胞团,为临床胰岛移植获得足量细胞来源提供实验基础。
胰腺; 干细胞; 细胞培养技术; 细胞分化; 鉴定
糖尿病,尤其是1型糖尿病患者需终身应用胰岛素替代治疗,并且无法有效遏制远期并发症的发生,危及人类健康[1]。胰岛移植为1型糖尿病患者摆脱胰岛素替代治疗提供了光明前景,并已有成功治愈的研究报道。但临床胰岛来源匮乏。研究表明[2-3],胰腺干细胞可以在体外稳定传代培养,并可诱导分化为有胰岛素分泌功能的胰岛细胞。但目前对胰腺干细胞的分离纯化技术还不够成熟。本实验进一步探讨大鼠胰腺干细胞的分离、纯化及定向分化技术。
材料与方法
一、大鼠胰管V型胶原酶灌注和胰腺获取
Wistar大鼠,4~6周龄,体重160~230 g,雌性,购于山东鲁抗医药动物饲养中心,适应性喂养1周以上。麻醉、消毒、铺单后,取腹正中切口入腹。用棉棒将肝脏翻向右上,胃肠翻向左下,暴露胆总管。穿膈剪心放血处死,钳夹胆总管两端,10号套管针穿刺胆胰管,注入0.1%Ⅴ型胶原酶5 ml。分离周围组织,完整切除胰腺,置4℃ Hank′s液中。
二、胰腺干细胞的分离、培养
胰腺组织加3倍容积的Ⅴ型胶原酶,38℃水浴消化10 min,3 min震荡1次,至胰腺组织消化成细沙粒状,加入含10% FCS的冷Hank′s液,100目网滤过、冲洗、离心,用2 ml Hank′s吹打制成细胞悬液,应用23%、17%、11%的Ficoll 400浓度梯度离心分离。吸出位于中上层的干细胞层,加含10% FCS的RPMI 1640液常规培养,第3天添加表皮生长因子(EGF)、碱性纤维生长因子(bFGF),第7天转入培养瓶中改用含10%FCS、100 U/ml青霉素-链霉素、20 ng/ml EGF和bFGF、10 mmol/L HEPES、1.0 mmol/L丙酮酸钠、71.5 μmol/L β-巯基乙醇的RPMI 1640液继续培养、传代,3 d换液1次。
三、胰腺干细胞的鉴定
取出传代后细胞行爬片培养,采用SABC-FITC免疫荧光染色。小鼠抗大鼠细胞角蛋白(cytokeratin, CK-19)单抗(Sigma公司)、兔抗大鼠神经巢蛋白(Nesting)单抗工作浓度1∶100;兔抗鼠胰十二指肠同源异型基因(Pdx-1)多抗(Chemicon公司)工作浓度1∶150;小鼠抗大鼠胰岛素(Insulin)及Glucagon单抗(Sigma公司)工作浓度均1∶100;羊抗小鼠 FITC荧光抗体1∶100稀释。以 PBS替代一抗作为空白对照组。借鉴张中明等[4]计算病毒转染率的方法,计数荧光染色阳性细胞,并计算阳性细胞百分率。
四、胰腺干细胞的诱导分化
将培养细胞更换为含有2 g/L牛血清白蛋白(BSA)、10 mmol/L尼克酰胺、10 μg/L HGF、71.5 ng/ml胰岛素-转铁蛋白-硒(ITS)和100 U/L青霉素-链霉素的无血清DMEM/F12培养液中进行诱导分化,每2~3 d换液一次[5]。1周后,当细胞形态发生结构变化时行双硫腙(DTZ)染色鉴定。
五、诱导细胞的胰岛素释放功能测定
诱导分化后的细胞更换10 mmol/L的高糖培养基,2 h后每隔30 min吸取1次培养上清,共取8次,经光电酶标记的ELISA染色,测定培养液中胰岛素含量,制作胰岛素释放曲线图。
结 果
一、细胞培养状况
获取的中上细胞层细胞培养后2 d可见细胞增殖,3 d后生长加速(图1),7d后细胞融合80%以上,可稳定传8代。传代细胞的CK-19、 Pdx-1 和 Nestin染色阳性率分别为 (88.6±6.2)%、(84.6±8.6)%和(81.3±7.5)%(图2a、b、c)。

图1 培养3 d的胰腺干细胞(×200)

图2CK-19(a)、 Pdx-1(b)和Nestin(c)阳性染色细胞(×200)
二、干细胞的诱导分化
胰腺干细胞诱导分化后形成胰岛样细胞团,被DTZ特异性染成棕红色(图3)。在高糖刺激下,培养上清液中胰岛素含量不断升高(图4 )。
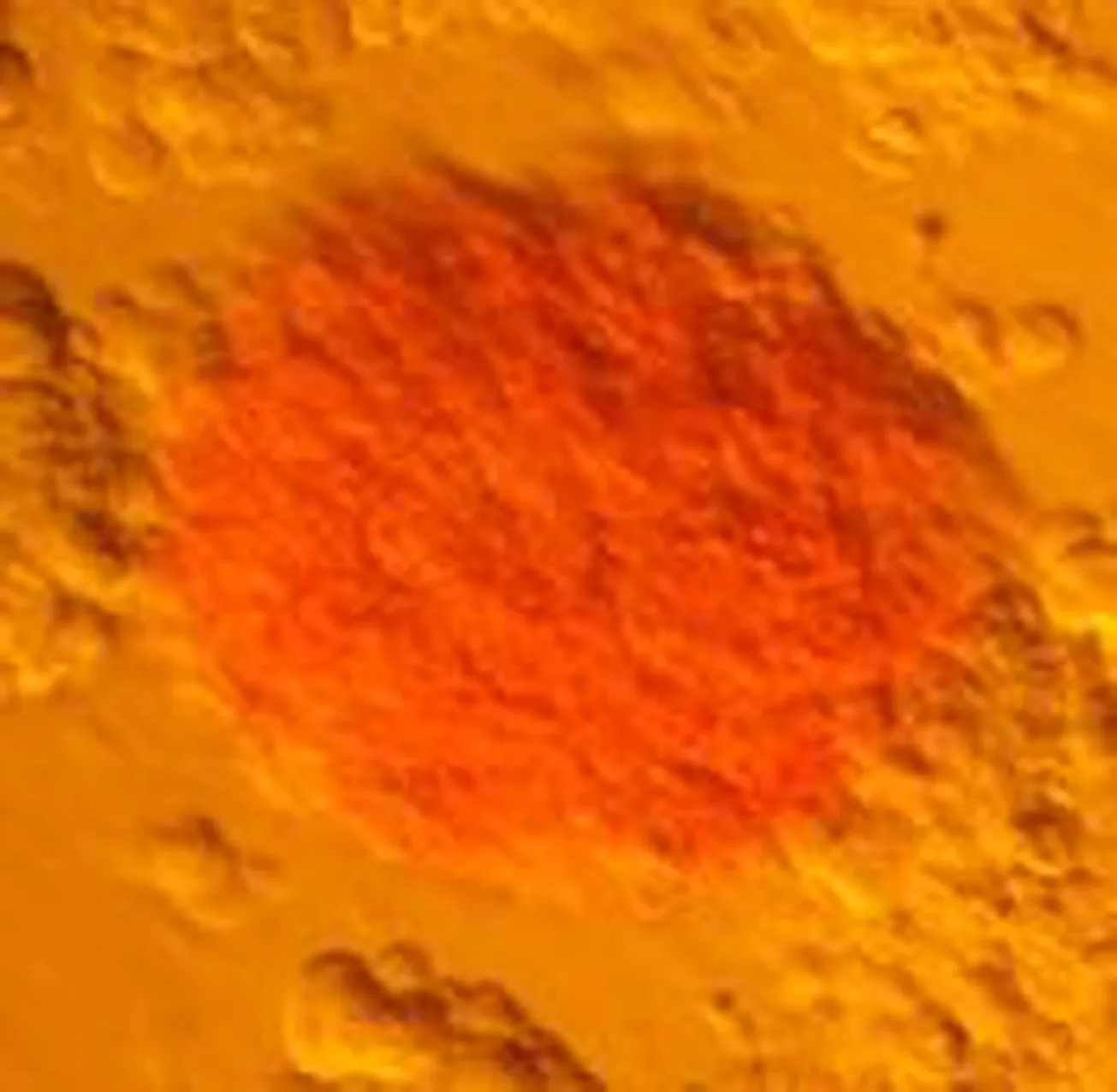
图3 诱导分化后的胰岛样细胞(DTZ染色 ×400)

图4 胰岛素释放曲线
讨 论
胰腺干细胞原先是在取下胰腺剪碎后再消化获取,但这种方法耗时,且细胞损伤较大。胰腺原位灌注消化法能很好地克服这些弊端。因大鼠胆胰管较细,在行胆胰管穿刺时容易断裂,故解剖辨认应准确,穿刺要耐心仔细。对胆管的远端和近端都要进行钳夹或丝线结扎,可以避免套管针穿刺位置过低而损伤肠道,并且可以防止肠液反流入胆胰管,引起细菌污染。为判断胆胰管穿刺是否成功,可以先缓慢少量推注Ⅴ型胶原酶,如穿刺不成功,胰腺表现为局部膨胀,而穿刺成功时,胰腺为均匀的膨胀。
本实验运用3个步骤对胰腺干细胞进行分离和纯化:(1)将消化均匀的胰腺组织进行滤网滤过,初步筛选掉较大的纤维和脂肪组织;(2)滤过后的细胞采用Ficoll 400浓度梯度离心法舍弃胰岛层,保留干细胞层培养;(3)根据胰腺干细胞贴壁生长的特性,通过换液将悬浮的胰岛和其他混杂细胞去掉,进一步提高干细胞纯度。
胰腺干细胞的鉴定主要依据细胞表面的标志物,常用的有:(1)CK-19:在发育过程中,胰腺的内分泌细胞来自角蛋白阳性的内胚层上皮细胞,胰腺的内分泌细胞高表达角蛋白[6]。(2)Nestin:它是神经干细胞的标志物,而胰腺与神经系统的发育控制机制相似,胰腺干细胞可能来源于神经前体细胞。(3)胰十二指肠Pdx-1:它是胰腺干细胞发育过程中表达的第一个分子标记,是一个同源区蛋白,也就是胰岛素增强子1。本法提取的以上3种标志物均阳性率在80%以上。此外有学者报道利用Notch信号、kit基因、端粒酶活性等来鉴定胰腺干细胞,但尚无定论。
文献报道,肝细胞生长因子(HGF)、角朊细胞生长因子(KGF)、ITS均可诱导胰腺干细胞分化为胰岛细胞。尼克酰胺(Nicotinamide)是一种核酶多聚合成酶抑制剂,因其能够诱导人类胚胎胰岛内分泌细胞的分化和成熟,增加胰岛素和C肽的表达而广泛用于诱导干细胞向胰岛内分泌细胞分化。本实验应用HGF、ITS和尼克酰胺进行诱导。诱导分化的细胞经双硫腙(与胰岛细胞内含有的锌离子特异性结合)染色证实为胰岛细胞,并通过高糖刺激,培养上清液中胰岛素含量不断增加,进一步证实诱导分化的细胞具有分泌胰岛素的功能。
[1] Rueda SF,Fernández C,Nicolau J,et al.Prevalence of cardiovascular risk factors in patients with type 1 diabetes in end-stage renal disease:changes in the trend from 1999 to 2006.J Diabetes Complications,2009,23:317-322.
[2] Zhang YH,Wang HF,Liu W,et al.Insulin-producing cells derived from rat bone marrow and their autologous transplantation in the duodenal wall for treating diabetes.Anat Rec (Hoboken),2009,292:728-735.
[3] Bonner-Weir S,Inada A,Yatoh S,et al.Transdifferentiation of pancreatic ductal cells to endocrine beta-cells.Biochem Soc Trans,2008,36:353-356.
[4] 张中明,姜波,董红燕,等.低氧反应元件对低氧复氧状态下心肌细胞转染人血管内皮生长因子165基因表达的调控作用.中华实验外科杂志,2005,22:1510-1512.
[5] Bonner-Weir S,Taneja M,Weir GC,et al. In vitro cultivation of human islets from expanded ductal tissue.Proc Natl Acad Sci USA,2000,97:7999-8004.
[6] Zhong Q,Liu D,Liu F.Study on related proteins of proliferation and differentiation of epidermal stem cells in diabetic rats.Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2010,24:133-137.
2010-05-24)
(本文编辑:吕芳萍)
Separatepurificationanddirecteddifferentiationpotencyofpancreaticstemcellsofadultratsinvitro
SHIGuang-jun,ZHANGLei,XUPing,YUJiang.
DepartmentofPancreaticBiliarysurgery,Qingdaomunicipalhospital,Qingdao266071,China
XUPing,Email:xu.ping@263.net
ObjectiveTo investigate the experimental condition of separate purification and directed differentiation potency of pancreatic stem cells of adult rats in vitro.MethodsThe pancreas of adult rats were digested by collagenase V in situ perfusion. Filtration was performed by 100 mesh filter. Ficoll 400 density gradient centrifugation was used to separate pancreatic stem cells and stem cells were for cultivation. Epidermal growth factor (EGF), fibroblast growth factor (bFGF) was added to medium for in vitro cultivation. Immunofluorescence staining method was used to detect the expression of CK19, Pdx-1, nestin, insulin and glucagon, and the positive cell rate was calculated. The differentiated cell was evaluated by dithizone (DTZ) staining; insulin excretion function was determined by optical enzyme labeled ELISA staining.ResultsThe pancreatic stem cell obtained from the study could be cultivated in vitro for 8 generations. The expression of CK19, Pdx-1 and nestin of the tem cells were all positive, and the rate of positive cells were (88.6±6.2)%, (84.6 ±8.6)% and (81.3 ±7.5)%. The differentiated cell was in brownish red color by DTZ dye. After high concentration sugar stimulation, the expression of insulin secretion was increased in the supernatant.ConclusionsThis method can harvest highly purified, and large amount of pancreatic duct stem cell. Artificial induction may result directed differentiate for islet-like clusters and have insulin secrete function.
Pancreas; Stem cells; Cell culture techniques; Cell differentiation; Identify
10.3760/cma.j.issn.1674-1935.2010.04.012
青岛市科技局资金资助课题(07-2-1-2-nsh)
266071 山东青岛,青岛市立医院肝胆胰外科(史光军、许评、于江);济宁医学院附属医院急诊普外科(张磊)
许评,Email:xu.ping@263.net

