骨质疏松大鼠晚期糖化终末产物含量及胍乙酸的防治效果△
咸宁学院临床学院(咸宁437100)
李伟民 傅祖植*
绝经后骨质疏松症 (Postmenopausol osteoporosis,PMOP)的发病机制目前还不十分清楚,晚近研究报道,除雌激素水平下降外,增龄和绝经可引起糖代谢紊乱,体内晚期糖化终末产物(Advanced glycosylation end products,AGEs)在体内积累增多,高水平的AGEs可使成骨细胞的数量和活性降低,骨形成减少。而 AGEs特异性抑制剂胍乙酸(Glycocyamine)则可能具有降低 AGEs,启动成骨细胞从而增加骨形成的作用[1]。国内少见此类报道,本研究以去势大鼠建立的绝经后骨质疏松模型,给予胍乙酸溶液治疗,观测其对骨形成指标的作用。
材料与方法
1 实验动物 54只3月龄雌性Sprague-dawly大鼠,武汉大学医学院实验动物中心提供,体质量 210±18g,随机分为3组,每组 18只。胍乙酸组(groups 1,G1):去势后给予1%胍乙酸水溶液,自由饮用;去势组(groups 2,G2):行输卵管峡部结扎后切除双侧卵巢;假去势组(groups 3,G3):单纯开腹假去势。术后第 4、10和16周定为实验周。各组再按各实验周分为3个亚组(每组 6只)。
2 方 法
2.1 给药方法:各亚组动物分笼,标准固体饲料和双蒸水(实验组给予胍乙酸液)自由摄食喂养,光照12h,黑暗 12h。室温为(25±2)℃。实验组按 1‰浓度胍乙酸水溶液(深圳 genzyme晶美公司产品)浸兑,自由饮用。于去势手术次日开始给药,疗程分别为4W、10w和16w。
2.2 标本的收集和处理
2.2.1 血和骨标本的收集:分别于每实验周获取标本前14d和前4d各鼠皮下注射1%四环素500mg/kg双重标记。处死前称量体重,右心室采血,离心分离血清,-70℃冻存备用;取左侧胫骨下端 3g,置于预冷的70%乙醇中,4℃冰箱固定,作骨形态计量学分析;无菌分离各鼠右侧胫骨下端 4g,Hant’S液反复冲洗,用骨钳将其分离为1mm3碎块,置于3ml RPMI1840培养液的12孔培养板,37℃,100%湿度,φ=5% CO2培养箱中 48h。吸取培养液离心后取上清液,置-20℃保存备做骨 AGEs测定。
2.2.2 骨切片的制备[2]:左胫骨标本依次梯度乙醇脱水,丙酮脱酯,二甲苯透明 24h后用甲基丙烯酸甲酯包埋;电动 Jung① K型切片机(德国)制备 7μm和10μm的切片,薄片分别做甲苯胺蓝和Von Kossa染色,用于计量学静态指标测定;厚片不染色,在荧光显微镜下做动态指标测定。脱去包埋剂,中性树脂封片。
2.2.3 尿标本的收集:术后各实验周常喂养后,于处死前 24h代谢笼收集尿液 2ml,4℃,2000r/min,留取上清液,储存于-70℃至同一批。备作尿吡啶醚(PYD)和脱氧吡啶醚(DYD)测定。
2.3 测定标准:骨形成指标骨钙素(BGP)和骨特异性碱性磷酸酶(骨 AKP),检测药盒由美国 Metra Biosystems Inc提供(ELISA),批内变异<5%,批间变异<9%。反映骨吸收指标:尿吡啶醚(PYD)和脱氧吡啶醚(DYD)测定,用 RP-HPLC法[3]。观测骨形态计量学用IBAS计算机全自动图像分析系统(中山大学生理学图像分析室提供),德国 KONTRON IBA 2.0全自动分析系统,包括 Varico Cam冷水图像输入仪,ZELSS Axiatron研究显微镜(中山大学生理室)和EMAIL-200病理图像分析仪(广东亿鸣科技术公司提供),不脱钙骨组织切片 [7μm在显微镜下,10μm厚片在荧光显微镜下(×200,360波长)],每张切片在骨生长线下1mm的范围,选择2~3个视野,求得下述参数:骨小梁体积比(TBV,%),骨小梁平均厚度(MTT,μm),骨形成表面(FS%),骨吸收表面(RS,%),四环素标记面积百分比(TLS%)和骨矿化沉积速率(MAP,μm/d)。骨培养上清液以胶原中羟脯氨酸的含量为14%,计算出骨胶原含量。AGEs含量以每毫克胶原中相对荧光强度表示 RU/mg胶原)。
3 统计学处理 实验数据以表示,各组间比较用方差分析,相关分析用直线相关分析,以 SPSS 11.5完成所有统计学工作。
结 果
1 各组胶原中 AGEs及骨形成、骨吸收指标变化:见表1。结果显示,去势后 AGEs含量明显升高,与假去势组比较有显著差异(P<0.01)。经胍乙酸治疗后骨胶原中 AGEs明显降低,与去势组比较有显著差异(P<0.01)。骨吸收指标尿PYD和DPD在胍乙酸组与单纯去势组比较均无明显差异(P<0.05),但较假去势组明显升高(P<0.05)。骨形成指标 BGP和骨AKP在胍乙酸组明显高于去势组(分别为P<0.01和P<0.05)。
2 胍乙酸组和去势组4~16w骨形态计量学参数变化比较:见表2。FS、TBV、M TT在去势后第 4周,胍乙酸组明显高于去势组,这种差异在第 10周表现最为显著。尤其是 TBV和FS(分别为P<0.001和P<0.01)。随着给药时间的延长(去势后第16周)MAR逐渐增加(P<0.001)。而 RS随着给药时间延长,虽有逐渐减少的趋势,但无显著性,且与去势组比较差异不明显。TLS在 4~16w胍乙酸组与去势组比较差异无显著性。
表1 三组骨胶原中 AGEs含量和骨吸收骨形成生化指标比较(±s)
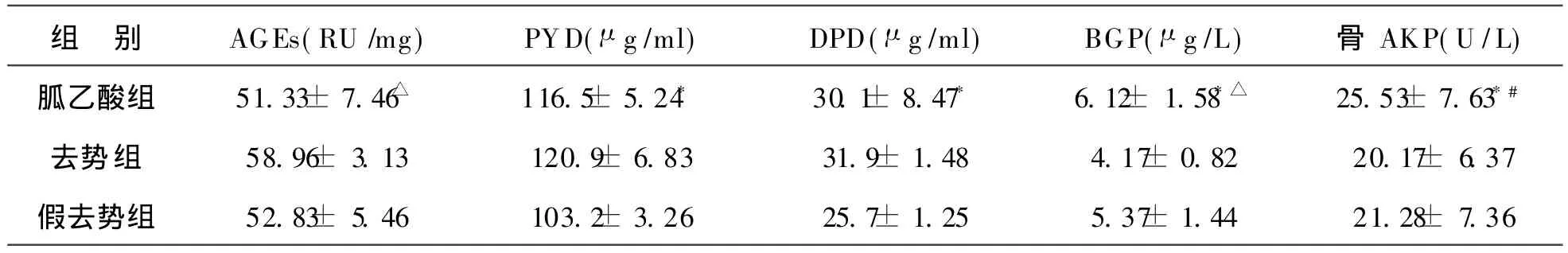
表1 三组骨胶原中 AGEs含量和骨吸收骨形成生化指标比较(±s)
注:与假去势组比较:*P<0.05;与去势组比较:△P<0.01;#P<0.05
去势 组 58.96±3.13 120.9±6.83 31.9±1.48 4.17±0.82 20.17±6.37假去势组 52.83±5.46 103.2±3.26 25.7±1.25 5.37±1.44 21.28±7.36
表2 去势后第4~16w骨形态计量学参数动态对照(±s)

表2 去势后第4~16w骨形态计量学参数动态对照(±s)
注:与去势组比较*P<0.05;△P<0.01
RS(%)5.95±1.10 6.12±0.51 5.56±1.38 6.07±1.00 5.49±1.27 6.03±1.25 TBV(%)41.6±2.20* 33.86±2.71 51.73±4.29* 39.14±1.59 53.18±2.23△ 42.37±0.12 M TT(μm) 79.14±1.98* 70.00±2.10 87.21±0.50* 82.33±1.58 96.42±6.30* 91.74±3.60 TLS(%)19.07±3.70 17.5±1.80 19.83±0.18 17.94±2.31 20.15±0.14 18.56±1.70 M AR(μm/d)0.82±0.15 0.78±0.14 0.93±0.08* 0.81±0.09 0.94±0.17* 084.±0.11
3 第 10周各组骨形态改变:去势后第10周可见胫骨骺板下区骨小梁大片消失,髓腔内残留纽扣样或棒状骨小梁结构;排列疏松。给胍乙酸后第 10周可见胫骨骺板下区骨小梁结构连接较紧;排列有规则,小梁间相互呈网状,骨小梁各壁厚度较为一致。
讨 论
骨质疏松症是一种全身性骨量减少及骨组织结构改变伴有骨脆性增加并易导致骨折的老年性疾病。绝经后骨质疏松症的发生由于骨形成减少,骨吸收超过了骨形成所致。目前的治疗药物,如雌激素,二膦酸盐及降钙素等多系抑制破骨细胞的吸收作用以减少骨丢失。而对促进骨形成作用的药物则研究和应用较少[1]。Gaspard等[5]提出,绝经后雌激素降低和增龄,使机体易发生胰岛素抵抗,引起糖代谢紊乱(此时 AGEs产生增多),高浓度的AGEs阻碍成骨细胞对骨基质蛋白和骨胶原蛋白的粘附,并抑制成骨细胞分化,导致骨质疏松。胍乙酸是一种亲核肼类化合物,主要与早期糖基化反应中间产物 3-脱氧葡萄糖酮醛(3-deoxyglucosome)反应,使其不能生成终产物 AGEs,并增加成骨细胞对骨胶原蛋白粘附,启动成骨作用,增加骨形成。
本研究发现去势后大鼠骨胶原中 AGEs明显升高,经胍乙酸治疗后 AGEs显著减少,骨形成指标上升。提示胍乙酸溶液能明显增加成骨作用,BGP、骨AKP等静态指标较去势组和假去势组均有增高;而反映骨吸收作用的指标:尿 PYD和DYD,与假去势组比较胍乙酸组虽有促进作用(P<0.05),但相对去势组抑制骨吸收作用差异不明显。反映骨吸收的骨形态计量学指标在给药后 4~16w均较去势组有下降趋势,但无显著性。这些结果均提示胍乙酸溶液也可抑制骨吸收,但相对促进骨形成而言作用不明显,且我们认为这种作用是在一定药物浓度基础上持续缓慢进行的。这一点与Munch等[6]报道一致,胍乙酸溶液可刺激骨髓成骨细胞,促进新骨形成,同样也可刺激破骨细胞骨吸收减少和骨重建加强。
骨形态计量学方面的动态观察发现,给药后第 4周骨形成指标 FS、TBV、MTT与去势组比较有明显升高(P<0.05),而 M AP至第 10周也明显升高,说明给予胍乙酸液早期就有骨形成作用,而这种作用至第 10周最为明显。FS(P<0.01)、TBV(P<0.001)。所有实验周(4~16w)胍乙酸对 TLS的改变作用略有升高(P<0.05)。胍乙酸对骨质疏松大鼠的骨代谢影响是明显促进成骨作用。尤其反映在骨形态计量学参数中的骨形成指标都明显增高,说明给药后使成骨细胞活跃增生,骨矿化和类骨质增多,骨量丢失相对减少[7]。
综上,本研究表明,胍乙酸溶液对去势后骨质疏松大鼠刺激骨形成作用大于抑制骨吸收作用,使二者骨代谢耦联趋于平衡。骨量丢失减少。继续这方面的研究,可能会对临床上防治骨质疏松症的用药开辟新的途径。
[1] Cortizo AM,Caporossi M,Lettieri G,etal.Vanadate induced nitric oxide production: role in osteoblast growth and differentiation[J].Eur J Pharmacal,2007,407(3):279-285.
[2] Spencer CP,Codsland IF,Cooper AJ,etal.Effects of oral and transdermal 17β-estradial with oral norethindrome acetate on insulin sensitivity,seeretion,and elimination in postmenopausol women[J].Metabolism,2006,55(6):742-747.
[3] 翁建平,廖 瑛,余斌杰.反相高效液相色谱法测定尿中吡啶醚和脱氧吡啶醚的方法建立[J].色谱,1997,15(6):521-523.
[4] 赵伟业,董碧蓉,欧雪梅,等.骨质疏松药物治疗的新进展及循证证据 [J].中国骨质疏松杂志,2003,9(1):80-82.
[5] Gaspard UJ,Gottal JM.Postmenopausol changes of lipid and glucose metabolism:A review of their main aspect[J].Maturitas,2008,20(13):171-178.
[6] Munch G,Thome J,Foley P,etal.Advanced glycation end products in ageing and Alzheimer's disease[J].Brain Res Rrain Res Rev,2003,29(2):134-143.
[7] 李伟民,王 伟.去势后骨质疏松大鼠与氨基胍的防治研究 [J].陕西医学杂志,2006,35(3):302-304.

