马杜霉素及其检测技术研究进展
吴荔琴,方炳虎,肖田安,邓国东
(1.广东省兽药与饲料监察总所,广东 广州510230;2.华南农业大学兽医学院,广东 广州510642)
马杜霉素,又名马度米星,马杜拉放线菌发酵产物分离获得,是聚醚类抗生素(PEs)中药效最强的一种。该药由美国氰胺公司于20世纪80年代开发成功,1992年在我国研制成功并大批量生产。马杜霉素对柔嫩艾美耳、堆型艾美耳、布氏艾美耳、变位艾美耳及毒害艾美耳球虫都有很好的驱杀效果[1],不易产生耐药性,可与其他抗生素、磺胺类及呋喃类药物配伍使用[2],且价格合适,因此在临床上得到了广泛的应用。据统计,1996年马杜霉素已取代莫能菌素、盐霉素、拉沙里菌素占国内抗球虫药物使用量的首位。2004年对全国各地共545个鸡场进行调查,其中有525个鸡场在饲料中添加了马杜霉素预防球虫病[3]。
1 马杜霉素性质概述
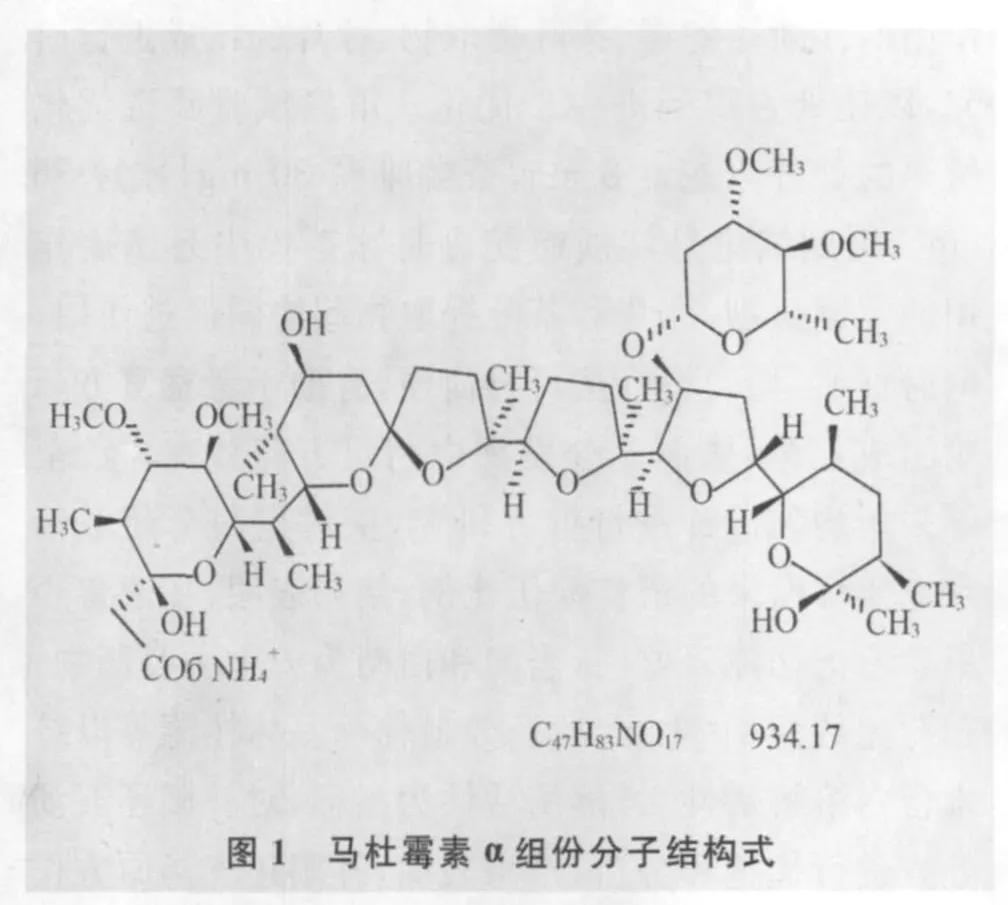
1.1 化学结构及理化性质 马杜霉素呈酸性,p Ka 6~8,属于极性较低的化合物。市场上销售马杜霉素铵盐,其为白色或类白色晶体性粉末,溶于甲醇、乙腈或三氯甲烷,不溶于水[4]。马杜霉素为多环醚结构有机酸,基本骨架由一定数量含氧杂环(四氢呋喃和四氢吡喃)连接而成的开链结构,一端连接羧基,另一端含羟基,骨架上连接有众多甲基、甲氧基和羟基[5]。马杜拉放线菌发酵产生α、β两种组份。其中,α组份活性强,占 91%~97%;β组份较α组分在A环上少一个甲基,活性远不如α组份[6]。α组份的分子结构式如图1。
1.2 药理作用 马杜霉素易与金属离子(Na+、K+、Ca2+)形成离子复合物。这种复合物脂溶性强,易进入生物膜脂质层,使细胞内外离子浓度发生变化,进而影响渗透压,使球虫细胞崩解,达到杀灭球虫的效果[7]。该药主要作用于球虫无性繁殖的早期阶段,通过干扰球虫子包子或裂殖子细胞的离子平衡,影响一些酶的活性,或导致表膜或细胞器破裂,阻止其侵入宿主肠上皮细胞。马杜霉素的作用特点决定了其特别适宜作为预防用药,且该作用机制缺乏特异性,不易产生抗药性[5]。
1.3 代谢与残留 聚醚类离子抗生素在动物体内分布广泛,绝大部分药物及其代谢产物经胆管排泄,最终随粪便排出体外。其中,肝脏和脂肪残留物浓度最高,其次为肾脏、肌肉和血浆。一般地,肝脏中主要以代谢物形式存在,脂肪中主要以原形药物形式存在。绝大部分被吸收的PEs在肝组织内被迅速代谢并失去活性,随胆汁排泄。主要代谢方式是O-脱甲基,其他包括羟化、脱羧、氧化(成酮)及葡萄糖醛酸结合等[5]。马杜霉素在火鸡中的主要代谢途径是脱一个或多个甲氧基,其次是羟化或与葡萄糖醛酸结合[8]。
Kennedy D G等[9]以含马杜霉素5 mg/kg饲料饲喂28日龄肉仔鸡14 d停药后,连续7 d屠宰取样测定,结果表明,停药当天,肝脏中马杜霉素浓度最高(0.16 mg/kg),消除半衰期为20 h,胸肌中马杜霉素浓度为28μg/kg,消除半衰期为39 h。休药5 d,肝脏和胸肌中仍有马杜霉素残留,检出值分别是1.6μg/kg和1.5μg/kg。
沈建忠等[10-11]用ELISA方法测定,研究了马杜霉素在AA肉仔鸡组织中的残留消除规律。其研究认为,马杜霉素在脂肪和肝脏中残留最高,其次是肾脏,肌肉残留最小。马杜霉素在组织中的消除速度很快,以5.0 mg/kg剂量添加于饲料中饲喂肉鸡42 d,停药2~3 d,试鸡组织中马杜霉素的残留量已低于农业部规定的马杜霉素在鸡组织中的最高残留限量,但随着添加剂量的增大,马杜霉素在试鸡各组织中的残留量也相应增加。
1.4 毒理学特征 马杜霉素的中毒剂量与安全剂量非常接近,在生产实际中,添加过量或拌料不均引起鸡中毒现象时有发生。Laczay P[12]报道,饲料中马杜霉素的剂量达到7.5 mg/kg时,可使鸡增重和饲料转化率下降。沈建忠等[10-11,13]报道,饲料中马杜霉素的添加量超过7 mg/kg时会出现鸡生长抑制,饲料转化率下降,死亡率上升等中毒症状;在研究鸡马杜霉素慢性中毒时,发现心肌有出血和坏死,肝脏有变性和坏死。姜柏芳等[14]报道,安全预防量为每千克饲料添加不得超过5 mg,添加量超过6 mg时就会引起厌食、抑制生长等轻度中毒反应,超过10 mg时就可引起软脚,行走困难等症状,致死、致残率可达10%~80%。
高剂量的PEs主要通过干扰动物细胞的离子平衡和能量代谢而产生细胞毒性作用,细胞出现变性或坏死。一些对ATP依赖性强的组织最敏感,如心肌、膈肌等[5]。食入残留有马杜霉素的食物可引起人血管舒张,特别是诱发心脏冠状动脉扩张和血流量增加,对正常人群而言没有明显的不良反应,但当患有冠状动脉疾病的人群,食入过多残留有马杜霉素的食物后,可引起冠状动脉扩张,心脏局部缺氧加重,使病情恶化[15]。
2 检测分析方法
目前,国内外关于马杜霉素的检测分析方法不多,主要包括:紫外分光光度法、原子吸收法、薄层色谱法、高效液相色谱法及免疫法。根据检测目的选择相应检测方法。当对大批量药物残留样品进行筛选时,简便、快速、灵敏、特异性强的 ELISA方法是最佳选择。当测定制剂、饲料及预混剂等药物含量较高的样品时,可选择薄层色谱法、紫外分光光度法及液相色谱紫外检测法。液相色谱荧光检测法灵敏度较高,可进行动物组织中兽药残留的检测。当对马杜霉素进行确证及多残留检测时,需采用价钱昂贵的液相质谱仪进行测定。
2.1 紫外分光光度法 紫外分光光度法具有快速、简便、低成本等优点。但其精确度较差,适用于样品含量较高时测定。徐恩民[16]用甲醇稀释,香草醛衍生,紫外分光光度法测定马杜霉素制剂的含量,与高效液相测定结果无明显差异。浓度在20μg/mL~45μg/mL范围内线性良好,回收率达到99.66%。
2.2 原子吸收法 Johnson[17]用原子吸收光谱法检测饲料中马杜霉素含量。样品经丙酮提取,氧化铝柱净化,二甲苯定容后标记上Na+进行检测。添加浓度在1 mg/kg~8 mg/kg范围内,该方法的平均回收率达到89.5%,检测限为100 ng/kg~200 ng/kg。
2.3 色谱法 包括薄层色谱法和高效液相色谱法等常见方法。因马杜霉素分子量大和多功能团的存在,无法用GC检测,且缺乏紫外吸收和电化学特征,无法直接测定[9]。但其结构中含有活性基团供紫外或荧光衍生。其中,羟基和羰基在强酸条件与香草醛等发生羟醛缩合反应,生成具有紫外吸收的物质;半缩醛在酸性条件下与丹磺酰肼缩合成具有强荧光的腙衍生物[10]。荧光检测的灵敏度较紫外高一个数量级。除此之外,液相色谱还可与质谱联用进行直接测定。
2.3.1 薄层色谱法 薄层色谱法(TLC)不要昂贵仪器,具有便利、特异等优点。常作定性和半定量分析。但其灵敏度、准确度不高。陈运勤等[18]用薄层色谱法测定组织中马杜霉素的残留,样品经过丙酮简单提取,香草醛浓硫酸甲醇溶液显色,薄层扫描仪上扫描定量。该方法的检测限在0.8 g以下,线性范围为1~8 g的相关系数在0.97以上。莫能菌素、盐霉素不会干扰测定。
2.3.2 液相色谱法 液相色谱仪可以与紫外检测器(UV)、荧光检测器(FLD),质谱(MS)等检测器联用进行马杜霉素的测定。通常采用C18色谱柱进行分离。紫外检测常以磷酸-甲醇溶液为流动相,荧光常以硫酸氢化四丁胺-乙腈溶液为流动相,液相质谱则采用水-乙腈为流动相。
Jong J D等[19]采用反相液相色谱法测定饲料和预混剂中马杜霉素的含量。样品经甲醇提取,香草醛柱后衍生,紫外520 nm处检测。该方法的回收率在90%以上,检测限是2 mg/kg,饲料(1 mg/kg~5 mg/kg)和预混剂(500 mg/kg)的相对标准偏差在2.7~7.7%间。此方法还可用于莫能菌素、甲基盐霉素、盐霉素的测定。Gliddon M J等[20]用二氯甲烷-乙腈提取,丹磺酰肼柱前衍生,florisil柱净化,测定鸡饲料中的马杜霉素铵。该方法在0~1.6 μg/kg范围内线性关系良好,相关系数达到0.995,平均回收率为99%,相对标准偏差为6.0%。同年,Markantonatos A[21]用乙腈提取饲料和预混剂中马杜霉素铵的含量,其余方法同于Gliddon M J。该方法在线性范围0.2μg/kg~10.0μg/kg的相关系数达到0.999 88。回收率在74.8%~112.9%之间,平均回收率为 98.0%,变异系数 9.2%。Dubuis M[22]采用液相色谱-电喷雾串联质谱法(LC-MS/MS)测定肌肉和鸡蛋中包括马杜霉素在内的九种抗球虫药。样品经乙腈提取,硅胶固相萃取小柱净化,C18色谱柱分离,流动相为一定比例的水和乙腈,并进行梯度洗脱。采用电喷雾电离源,[M+Na]+进行监测,马杜霉素的回收率为52%。
3 免疫检测方法
免疫检测方法是利用抗原与抗体在体外的特异性反应建立起来的检测技术,具有高选择性、高灵敏度等特点。常用酶联免疫吸附法(ELISA)。
马杜霉素属于小分子物质(分子量为934),没有免疫原性,必须与大分子载体物质(如牛血清白蛋白)进行偶联成人工抗原才能获得免疫原性,才能使动物体内产生特异性的抗马杜霉素的抗体。在此基础上建立了酶联免疫法测定马杜霉素的含量。
沈建忠等[10]发现马杜霉素分子羧基上连接一个6个碳分子后再与卵清蛋白结合成的包被抗原(M-C6-OVA),能大大提高ELISA检测灵敏度。首次制备针对马杜霉素特异性的高容量免疫亲和色谱柱,能满足马杜霉素残留分析的要求。样品添加回收率达到76.4%~107.5%,变异系数为3.8%~16.4%,检测限为 1.0μg/kg~2.8μg/kg。说明IAC-ELISA方法的灵敏性和可靠性均达到残留检测的要求,而且此方法未发现马杜霉素抗血清对基本结构相识的莫能菌素、盐霉素、拉傻洛菌素和甲基盐霉素同属聚醚类抗生素有交叉反应,说明此方法具有较高的亲和性和选择性。
4 分析联用技术
各种分析技术联用是现代兽药残留分析乃至整个分析化学方法的发展方向,联用技术可以取长补短,获得单一分析技术难以达到的效果,如:免疫分析-液相色谱(IAS-HPLC)。
2002年,项新华等[23]建立了用丙酮提取,免疫亲和层析柱纯化,丹磺酰肼衍生,以C18色谱柱分离,乙睛-硫酸氢四丁胺溶液为流动相,λex=220 nm、λem=520 nm荧光检测兔可食组织中马杜霉素残留量,在0.1μg/g~2.0μg/g范围内线性关系良好,相关系数r为0.999 52;各组织样品的平均回收率在80%左右。该方法具有 IAC高度特异性与HPLC极高分辨率的双重特点,免疫亲和层析纯化动物组织中马杜霉素,不必使用大量有机溶剂,过程简单,最大限度地消除杂质引起的非特异性反应和交叉反应,从而提高了检测限和回收率。
5 小结
马杜霉素作为饲料添加剂广泛应用于鸡球虫病的预防。但添加剂量与中毒剂量非常接近。添加过量或不遵守休药期均可导致药物在组织中的残留,建立灵敏的检测方法保障动物源性食品安全势在必行。
[1] 侯和菊.家禽马杜霉素中毒的防治[J].当代畜禽养殖业,2005(3):21-22.
[2] 周汉林,杨建泉.肉仔鸡马杜霉素中毒[J].畜牧兽医科技信息,2006(12):78.
[3] 安健,刘月繁,汪明,等.肉鸡球虫病和球虫抗药性的调查[J].中国兽医杂志,2004,40(6):29-31.
[4] 中国兽药典委员会.中华人民共和国兽药典[S].北京:中国农业出版社,2006:19.
[5] 李俊锁,邱月明,王超.兽药残留分析[M].上海:上海科学技术出版社,2002:540-546.
[6] Tsou H R,Rajan S,Fiala R,et al.Biosynthesis of the antibiotic maduramicin:origin of the carbon and oxygen atoms as well as the13CNMR assignments[J].J Antibiot,1984,37:1651-1663.
[7] 陈杖榴.兽医药理学[M].2版.北京:中国农业出版社,2002:285.
[8] Steven J S,Jinn W,Adrian R,et al.maduramicinα:characterization of14C-derived residues in turkey excreta[J].J Agric Food Chen,1991,39:386-391.
[9] Kennedy D G,Blanchflower W J,Dorman B C.Development of an ELISA for maduramicin and determination of the depletion kinerics of maduramicin residuesin poultry[J].Food Addit Contam,1997,14(1):27-33.
[10]沈建忠,钱传范,杨汉春,等.肉鸡组织中马杜霉素残留检测的研究[J].畜牧兽医学报,1998,31(6):62-68.
[11]沈建忠,钱传范,江海洋,等.马杜霉素在鸡组织中残留消除及临床毒性的研究[J].畜牧兽医学报,2000,31(5):458-463.
[12] Laczay P.Study of the maduramicin tolerance in broilers[J].Magyar-Allator-Vosok-Lapia,1989,44(9):529-532.
[13]沈建忠,钱传范,杨汉春,等.马杜霉素在鸡组织中残留检测方法的研究[J].畜牧兽医学报,1999,30(2):172-179.
[14] 姜柏芳,朱梦代,陆新浩,等.慎防禽畜马杜霉素中毒症[J].浙江畜牧兽医,2006(6):35.
[15]美国食品与药物管理局网.Maduramicin[EB/OL].http://www.fda.gov/cvm/FOI/766.htm,1989.
[16]徐恩民.紫外分光光度法测定马杜霉素制剂的含量[J].山东农业科学,1999(3):47.
[17]Nelsona,Johnson.Determination of Maduramicin by Liquid Chromatography with Atomic Absorption Spectrometric Detection[J].Drugs in Feeds,1989,172(2):235-237.
[18]陈运勤,李跃龙,伍绍登,等.用薄层扫描法测定马杜霉素残留[J].中国动物保健,2003(7):21-23.
[19]Jong J D,Sroisser B,Wager K,et al.Determination of maduramicin in Feedingstuffs and Premixtures by Liquid Chromatography:Development,Validation,and Interlaboratory Study[J].Journal of AOAC International,2004,87(5):1033-1041.
[20]Gliddon M J,Wright D,Markantonatos A,et al.Determination of maduramicin ammonium in poultry feedstuffs by highperformance liquid chromatography[J].Analy st,1988,113:813-816.
[21]Mark antonatos A.Derivatization and HPLC/Flourescence quantitation of maduramicin ammonium in feed and premixes at levels down to 5μg/g[J].Journal of Liquid Chromatography,1988,11(4):877-890.
[22]Dubois M,Pierret G,Delahaut P H.Efficient and sensitive detection of residues of nine coccidiostats in egg and muscle by liquid chromatography-electrospray tandem mass spectrometry[J]Journal of Chromatography B,2004,813:181-189.
[23]项新华,涂晓明,贾明宏,等.高效液相色谱法检测动物组织中马杜霉素残留[J].中国公共卫生,2002,18(1):101-102.