甲氧苄啶对黄芩苷体外抗菌增效作用的试验
王 新,崔一喆,韩铁锁
(黑龙江八一农垦大学动物科技学院,黑龙江大庆163319)
黄芩苷是从唇形科植物黄芩的干燥根中提取的一种黄酮类化合物,具有抗菌、消炎和免疫调节等多种药理作用[1]。甲氧苄啶(TMP)为广谱抗菌增效剂,临床上常与磺胺类药物联用以增强磺胺类药物的了抗菌效果,其还可增强多种抗生素以及中药的抗菌作用[2-3]。而关于TMP对黄芩苷的抗菌增效作用未见报道。为了探讨TMP对黄芩苷抗菌活性的影响,促进黄芩苷在防治畜禽传染性疾病上的应用,进行黄芩苷与TMP联用的性质和增效剂量关系的试验,并确定TMP对黄芩苷体外抗菌增效的最佳剂量,为开发高效中药复方抗菌制剂奠定基础。
1 材料与方法
1.1 菌种 沙门菌(CMCC50115)、大肠杆菌(ATCC35218)、金黄色葡萄球菌(ATCC25923)均购于中国兽医药品监察所。
1.2 药物 TMP购于太原市康瑞宝兽药制造有限公司,批号:20080503。黄芩苷购于四川什邡市宏升植物原料有限公司,批号:081102。
1.3 药物溶液的制备 将128 mg的TMP制成浓度为1 280μg/mL的 TMP溶液100 mL。9.6 g黄芩苷用5%碳酸氢钠溶液溶解后,再用蒸馏水稀释成浓度为96 mg/mL的黄芩苷溶液100 mL,用孔径为0.22μm的微孔滤膜滤过除菌后,4℃冰箱保存备用。
1.4 菌种活化 采用常规方法进行细菌活化,将菌液稀释至浊度为 1×107CFU/mL,4℃冰箱保存备用。
1.5 黄芩苷与TMP联合抑菌试验 参照徐淑云报道[4]的微量棋盘稀释法进行黄芩苷和TMP的联合抑菌试验,并进行组分抑菌浓度(FIC)指数的计算和判定药物联合作用的性质。
1.6 黄芩苷与TMP联用体外抗菌增效试验 用无菌肉汤将黄芩苷溶液稀释到2MIC浓度,将TMP溶液稀释到 640μg/mL、320 μg/mL、160 μg/mL、80μg/mL和40μg/mL浓度。取7只已编号无菌试管,1~5号管分别加入已稀释的5种TMP溶液1 mL和2MIC的黄芩苷溶液1 mL,6号管中加入2MIC的黄芩苷溶液和肉汤各1 mL,7号管为对照管加入肉汤 2 mL;然后每个试管中加入 2×106CFU/mL细菌悬液0.1 mL。充分摇匀后,4℃条件下静置。分别在1 h、2 h、4 h和8 h,采用平板计数的方法测定菌落数[5],并计算杀菌率。其计算公式为:杀菌率=(对照管菌落数-试验管菌落数)/对照管菌落数×100%。试验重复3次。
1.7 数据处理 采用SPSS软件中ANOVA程序进行数据统计学分析。
2 结果
2.1 黄芩苷与TMP联合抑菌试验 由表1可知,黄芩苷与TMP联用对3种细菌的MIC值均小于单独应用,经计算对 3种细菌的 FIC指数均为0.75,呈现相加作用。
2.2 黄芩苷与TMP联用体外抗菌增效试验 试验结果见表2、表3、表 4。从表中可知,当 TMP的添加剂量从20μg/mL-160μg/mL时,表现出随着TMP剂量的增加对黄芩苷增效作用越强,与 TMP 0μg/mL组比较(P<0.05或P<0.01);但 TMP添加剂量为160μg/mL与320μg/mL两组比较差异性不显著(P>0.05),表明TMP的添加剂量与对黄芩苷的增效作用并不是简单的直线关系。利用最小二乘法对各表的1 h、2 h、4 h和8 h杀菌率数据进行拟合,拟合度均达到0.95以上,发现均符合一元二次方程y=ax2+bx+c;然后依据公式ymax=-b/2a计算各时间TMP添加的最优值。对于金黄色葡萄球菌、大肠杆菌和沙门菌,TMP添加的最优值的平均值分别为 310μg/mL、276μg/mL和 233μg/mL;将TMP添加最优值的平均值与黄芩苷的实际用量进行换算,得到TMP对黄芩苷体外抗金黄色葡萄球菌、大肠杆菌和沙门菌最优添加剂量分别为103.3 mg/g、46.0 mg/g和38.8 mg/g。
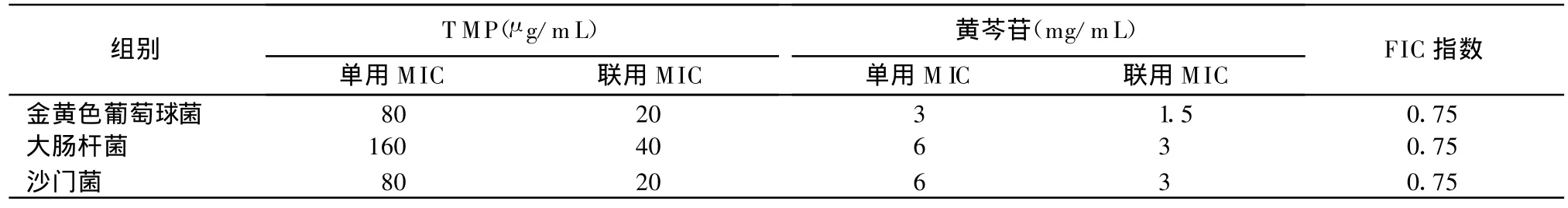
表1 黄芩苷与TMP联合应用的抗菌效果

表2 黄芩苷与不同浓度TMP联合应用对金黄色葡萄球菌的杀菌率 (%)

表3 黄芩苷与不同浓度TMP联合应用对大肠杆菌的杀菌率 (%)

表4 黄芩苷与不同浓度TMP联合应用对沙门菌的杀菌率 (%)
3 讨论
TMP对中药增效作用的报道多是定性的研究[6-8],而TMP最佳添加剂量的研究更具有临床应用价值。试验采用了国内外常用的微量棋盘稀释法测定了TMP与黄芩苷联用的FIC指数,同时以黄芩苷和TMP的MIC值为基础,设定了 TMP的系列添加剂量,然后将不同浓度的TMP与MIC浓度的黄芩苷联合应用对金黄色葡萄球菌、大肠杆菌和沙门菌进行体外抗菌量效关系试验,采用了4℃静置的方式使药物作用于细菌,避免了37℃恒温培养时细菌呈几何基数增殖造成的用药组与对照组之间的不可比性;再利用最小二乘法对试验数据进行处理,从而提高了试验结果的准确性。试验结果表明,TMP对黄芩苷发挥显著的增效作用。黄芩苷抗菌作用机制主要是通过抑制细菌的DNA、RNA、蛋白质的生物合成导致细菌细胞死亡而起到杀菌作用[9],这与TMP抑制细菌核酸合成的抗菌机制相近,可能是TMP对黄芩苷发挥抗菌增效作用的基础,但具体机制有待于进一步探讨。
[1] 文敏,李雪,付守廷.黄芩苷药理作用研究新进展[J].沈阳药科大学学报,2008,25(2):158-162.
[2] 中国兽药典委员会.中国兽药典兽药使用指南[S].北京:中国农业出版社,2005:76-77.
[3] 周可炎,曹迎春,谭超,等.TMP对中草药煎液的抗菌增效作用[J].湖南农业大学学报,1999,25(6):483-484.
[4] 徐淑云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2001:1662-1663.
[5] 马绪荣,苏德模.药品微生物学检验手册[M].北京:科学出版社,2000:73-79.
[6] 常明向,高虹,吴梅梅.五味消毒饮与TMP联用抗菌作用研究[J].中国药理与临床,2001,17(6):10-11.
[7] 张文平,张文书,曾雪英.千里光与TMP联用抗菌作用实验研究[J].时珍国医国药,2006,17(6):944-945.
[8] 马卓,刘小平,何福艳,等.甲氧苄啶配用如意金黄散的抗菌实验研究[J].湖北中医杂志,2001,21(3):5-6.
[9] 熊英,傅颖媛,况南珍,等.黄芩苷抗白念珠菌作用及机制研究[J].中国药理学通报,2004,20(12):1404-1407.

