篦子三尖杉愈伤组织的诱导
吕 梅, 王瑞辉, 曹基武, 姚利辉, 刘春林
(中南林业科技大学, 湖南 长沙 410004)
篦子三尖杉愈伤组织的诱导
吕 梅, 王瑞辉, 曹基武, 姚利辉, 刘春林
(中南林业科技大学, 湖南 长沙 410004)
以篦子三尖杉的幼茎和嫩叶作为外植体进行组织培养,研究不同激素及不同浓度组合对其诱导愈伤组织的影响,结果表明:篦子三尖杉幼茎比嫩叶的愈伤组织诱导率高;MS+NAA 1mg·L-1+6-BA 0.15mg·L-1+2,4-D 1mg·L-1是诱导幼茎愈伤组织的最佳培养基,诱导率达100%;MS培养基相比B5培养基更适合篦子三尖杉嫩叶愈伤组织的诱导;幼茎在75%的酒精中消毒1min,在0.1%的升汞溶液中浸泡15min,其消毒效果最佳。
篦子三尖杉; 组织培养; 愈伤组织; 诱导
篦子三尖杉(CephalotaxusoliveriMast.)别名阿里杉、梳叶圆头杉,属三尖杉科,是国家二级保护植物,也是我国特有的比红豆杉还要古老的一个孑遗物种[1]。篦子三尖杉经济价值较高。 其全株是生产抗白血病药物三尖杉酯碱和高三尖杉酯碱的主要原料之一。种子含油率高,可榨油,供制肥皂和润滑油,加工后也可供食用。木材坚韧,纹理细致,有弹性,可作家具和细木工用材[2]。但是由于其本身的生物、生态学特性,加上人类对其生境的破坏以及过度砍伐,使原本自然资源就十分匮乏的篦子三尖杉陷入更加濒危的境地。目前,随着篦子三尖杉的开发利用及其潜在价值的被发现, 篦子三尖杉的快速繁殖显得越来越重要。但是目前尚未见有关篦子三尖杉快速繁殖技术等其它方面的研究报道,人工繁殖技术体系还不完整。因此我们选用1年生篦子三尖杉幼茎和嫩叶诱导愈伤组织,为篦子三尖杉的苗木培育,以及种植推广提供参考。
1 材料与方法
1.1实验材料
篦子三尖杉样品采自中南林业科技大学苗圃,采集时间为2009年6月。样品为1年生篦子三尖杉幼茎和嫩叶。
1.2实验设计
1.2.1 愈伤组织诱导 以MS为基本培养基,采用L9(33)正交试验设计(见表1),对细胞分裂素6 — 苄基嘌呤(6 — BA)、生长素萘乙酸NAA、2, 4- 二氯苯氧乙酸 (2, 4 — D)不同浓度配比方案进行筛选,试验共9个处理,每个处理共20瓶,5次重复,每瓶接2个外植体[3-6]。
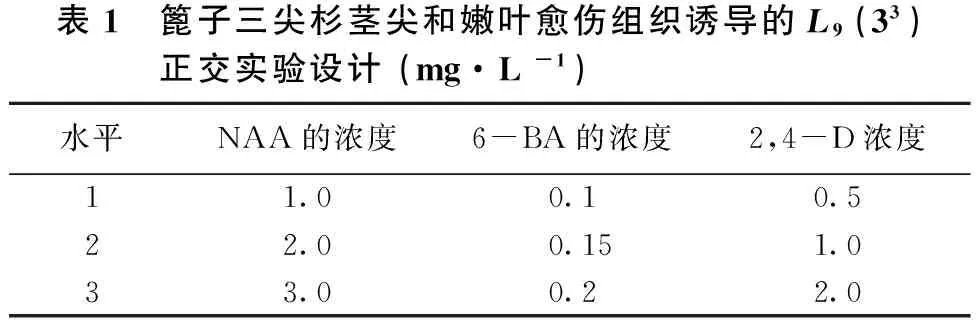
表1 篦子三尖杉茎尖和嫩叶愈伤组织诱导的L9(33)正交实验设计(mg·L-1)水平NAA的浓度6-BA的浓度2,4-D浓度11.00.10.522.00.151.033.00.22.0
1.2.2 B5培养基与MS培养基对嫩叶愈伤组织的诱导 分别配置B5与MS培养基,在其中添加细胞分裂素6 — BA 0.2mg·L-1,生长素NAA 3mg·L-1,每处理4瓶,5次重复,每瓶接3个外植体。
1.3实验方法
1.3.1 外植体的消毒 剪取生长良好,无病虫害的篦子三尖杉植株上的幼茎和嫩叶,在流水中冲洗,然后放入稀释的洗衣粉溶液中清洗,再在流水中逐个冲洗干净后,于无菌条件下选择75%的酒精和0.1%的升汞作为消毒剂消毒。茎段在酒精中消毒1min,用无菌水冲洗4~5次,在升汞中消毒分别设置10min、15min、20min 3个处理。然后用无菌水冲洗7~8次。嫩叶在75%酒精中消毒30~40s,并用无菌水冲洗4~5次,在0.1%的升汞中消毒12min,最后用无菌水冲洗7~8次[7]。
1.3.2 培养条件 采用MS为基本培养基,添加不同浓度的不同激素,以30g·L-1蔗糖调节渗透压,按8g·L-1加入琼脂,调整pH值至5.8~6.0,于121℃、0.105MPa条件下高温高压灭菌20min后置于无菌室待用。将消毒后的茎段切成3~4mm,嫩叶5mm接种于培养基内。培养温度为(25±2)℃。光培养以日光灯为光源,连续照光10~12h·d-1,光照度为1000~1500lx。
1.4观察和统计方法
主要观察污染、愈伤组织诱导以及褐化情况,其统计方法为:


以出现肉眼可见的愈伤组织记为外植体启动;

观察外植体生长状况及愈伤的颜色与质地[8]。
2 结果与分析
2.1茎尖消毒效果
药剂处理的时间不同,外植体灭菌效果的差异则较大, 具体效果见表2。
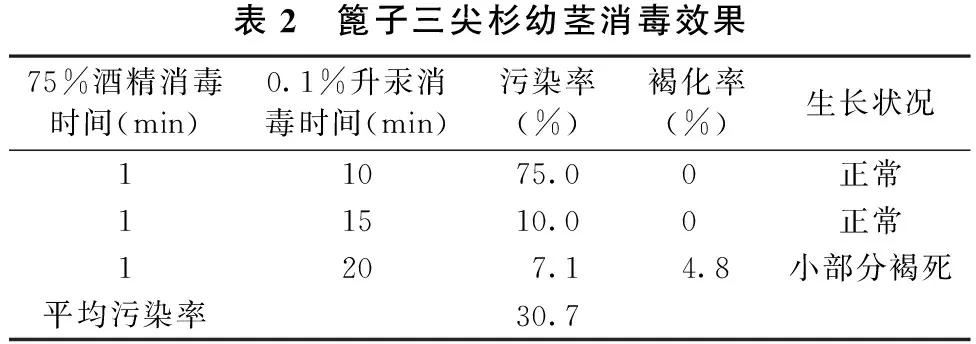
表2 篦子三尖杉幼茎消毒效果75%酒精消毒时间(min)0.1%升汞消毒时间(min)污染率(%)褐化率(%)生长状况11075.00正常11510.00正常1207.14.8小部分褐死平均污染率30.7
从表2可以看出,篦子三尖杉嫩茎消毒的平均污染率为30.7%,最大污染率为75.0%,最小污染率为7.1%;升汞消毒10min时,外植体生长正常,但其污染率较高;消毒20min时可以保证低污染率,但会使一些细胞活力丧失甚至死亡;升汞消毒15min基本上可以保证低污染率和外植体正常生长。即75%的酒精消毒1min,0.1%的升汞消毒15min是篦子三尖杉幼茎最佳的消毒方法。
2.2篦子三尖杉幼茎和嫩叶愈伤组织的诱导
2.2.1 篦子三尖杉幼茎愈伤组织的诱导 幼茎在接入培养基的第9天开始萌动,与培养基接触的一端开始膨大,颜色比初始外植体透明,第13天开始长愈伤组织,茎段的一端或两端长出较小的愈伤颗粒,呈黄色、黄绿色或淡黄色;不同处理的外植体愈伤组织开始萌发的时间不同,在不同培养基上长出的愈伤组织其大小、颜色、质地均有差异;总的来看,愈伤组织的平均体积较小,分化不很完全,颜色均偏黄。从表3可以看出,9个处理平均诱导率为48.2%,最高的是②号处理,其培养基配比为:MS+ NAA 1.0mg·L-1+6-BA 0.15mg·L-1+2,4-D 1.0mg·L-1,愈伤组织诱导率达到100%;最低为⑨号处理,其培养基配比为: MS+NAA 3.0mg·L-1+6-BA 0.2mg·L-1+2,4-D 1.0mg·L-1,愈伤组织诱导率为24.3%。从效果看,②号处理的愈伤组织颜色最好,呈黄绿色,有透明感,质地疏软。良好的愈伤组织必须有高度的胚性和再分化能力,以期可以由这些愈伤组织获得再生植株,并且要容易分散,有利于分离原生质体[9-10]。从本试验的继代培养中也可以看出,②号处理诱导出的愈伤组织具有粘性,可以进一步分化,其他处理诱导的愈伤组织颜色逐渐变成枯黄或褐色甚至停止生长。

表3 篦子三尖杉幼茎愈伤组织诱导率统计表编号植物激素浓度组合(mg·L-1)茎愈伤组织的诱导效果NAA6—BA2,4—D颜色质地诱导率(%)①1.00.10.5黄绿色疏软87.5②1.00.151.0黄绿色疏软100③1.00.22.0黄色紧密26.7④2.00.11.0黄色紧密46.7⑤2.00.152.0淡黄色紧密48.6⑥2.00.20.5黄色紧密26.3⑦3.00.12.0黄色致密25.0⑧3.00.150.5淡黄色致密48.7⑨3.00.21.0淡黄色致密24.3 注:平均诱导率48.2%;最高诱导率100%;最低诱导率24.3%。
2.2.2 篦子三尖杉嫩叶愈伤组织诱导 将消毒后的嫩叶接种于配置好的培养基内,至第6天时,叶片颜色透明,有的弯曲成拱形,第12天开始有愈伤组织长出,在叶片表面有愈伤组织颗粒突出。但愈伤组织生长缓慢,两个月后,叶片表面仍有小愈伤颗粒突起。
从表4中可以看出,嫩叶愈伤组织平均诱导率为23.7%,最高诱导率为⑦号处理,其培养基配比为; MS+ NAA 3.0mg·L-1+6 — BA 0.1mg·L-1+2,4 — D 2.0mg·L-1,诱导率为48.6%;最低诱导率为⑨号处理,其培养基配比为: MS+ NAA 3.0mg·L-1+6— BA 0.2mg·L-1+2,4-D 1.0mg·L-1,诱导率为2.8%。可见,6 — BA的浓度太高不利于嫩叶愈伤组织诱导。邹露、曹福祥等人在篦子三尖杉嫩叶愈伤组织诱导实验中也发现,6 — BA对愈伤组织诱导影响作用较大,其次是2,4 — D,但两者浓度过高对愈伤组织诱导不利[6]。对比幼茎愈伤组织诱导,嫩叶愈伤组织诱导率较低,平均比幼茎愈伤组织诱导率低24.5%,且诱导出的愈伤组织生长缓慢,在继代培养中进一步分化困难。

表4 篦子三尖杉嫩叶愈伤组织诱导率统计表编号植物激素浓度组合(mg·L-1)嫩叶诱导的愈伤效果NAA6—BA2,4—D颜色质地诱导率(%)①1.00.10.5黄色疏散12.5②1.00.151.0淡黄色疏散36.1③1.00.22.0黄色紧密6.7④2.00.11.0淡黄色疏散27.0⑤2.00.152.0黄色紧密39.4⑥2.00.20.5黄色紧密5.2⑦3.00.12.0淡绿色紧密48.6⑧3.00.150.5淡黄色紧密35.3⑨3.00.21.0黄色紧密2.8 注:平均诱导率23.7%;最高诱导率48.6%;最低诱导率2.8%。
2.3不同培养基对篦子三尖杉嫩叶愈伤组织的诱导效果
接种在MS培养基内的嫩叶,第7天开始弯曲变形,有得成拱形,第13天时叶的表面长出不均匀的愈伤颗粒,B5培养基的主要特点是含有较低的铵,实验发现在B5培养基内的嫩叶,颜色变成深绿色,没有愈伤组织生成。表明B5培养基不适宜篦子三尖杉愈伤组织的诱导。

表5 B5与MS培养基对嫩叶愈伤组织的诱导效果培养基配方接种外植体数(个)愈伤组织数(个)愈伤组织诱导率(%)B5+6—BA0.2mg·L-1+NAA3mg·L-16000MS+6—BA0.2mg·L-1+NAAmg·L-1603361.1
3 结论与讨论
最适宜篦子三尖杉幼茎消毒的方法是75%酒精消毒1min,0.1%的升汞消毒15min;篦子三尖杉的幼茎比嫩叶的愈伤组织诱导率要高。诱导愈伤组织的最佳培养基配方是MS+NAA 1mg·L-1+6 — BA 0.15mg·L-1+2,4 — D 1mg·L-1,诱导率为100%;且诱导出的愈伤组织颜色黄绿,质地疏软,适合于以后的分化培养;但是,在此配方培养基上,愈伤开始生长的时间偏长,且生长缓慢,有待于进一步探讨其他更好的诱导方法。实验还发现,B5培养基不适合篦子三尖杉嫩叶愈伤组织的诱导。
[1] 傅立国.中国珍稀濒危保护植物[M].上海:上海教育出版社,1989.
[2] 胡玉熹.三尖杉生物学[M].北京:科学出版社,1999:3-5,95-118.
[3] 曹孜义.实用植物组织培养技术教程[M].兰州:甘肃科学技术出版社,2001.
[4] 李浚明.植物组织培养教程[M].北京:中国农业大学出版社,2001.
[5] 梁一池.植物组织培养技术的研究进展[J].福建林学院学报,2002,22 (1) :93-96.
[6] 邹露.篦子三尖杉愈伤组织的研究[M].经济林研究,2009,27(2):74-77.
[7] 符文英,杜道林,符木均.海南粗榧愈伤组织的诱导和培养[J].植物生理学通讯,2004,40(1):36-38.
[8] 洪伟.林业试验设计技术与方法[M].北京:北京科学技术出版社,1993:148- 158.
[9] 洪伟,吴承祯.试验设计与分析[M].北京:中国林业出版社,2004:49.
[10] 姜新兵.香榧离体再生系统建立的研究[D].杭州:浙江大学农业与生物技术学院,2004.
(责任编辑:唐效蓉)
(英文编译:张 珉)
CallusinductionofCephalotaxusoliveri
Lü Mei, WANG Ruihui, CAO Jiwu, YAO Lihui, LIU Chunlin
(Central South University of Forestry and Technology, Changsha 410004, China)
Taken young leaves and stem segments ofCephalotaxusoliverias explants, the effects of different hormone and proportions on callus induction ofCephalotaxusoliveriwere researched. The results indicated the induction rate of young stem callus were higher than that of young leaves callus. The best medium for inducing young stem callus was MS+NAA 1mg·L-1+6-BA 0.15mg·L-1+2,4-D 1mg·L-1and the induction rate reached 100%. MS medium was more suitable for inducing young leaves callus than B5 medium. The best sterilization procedure for young stem was to soak stem for 1min in 75% alcohol and 15min in 0.1% HgCl2.
Cephalotaxusoliveri; tissue culture; callus; induction
2009 — 11 — 06
2009 — 12 — 31
国家林业局项目“珍稀濒危树种篦子三尖杉资源调查及利用状况评估”(2008-353)
S 722.3+7
A
1003 — 5710(2010)01 — 0007 — 03

