过敏原小麦醇溶蛋白的ELISA定量检测方法的建立
秦倩茹,高宏伟,马洪明,*
(1.中国海洋大学食品科学与工程学院,山东青岛266003;2.山东出入境检验检疫局技术中心,山东青岛266002)
过敏原小麦醇溶蛋白的ELISA定量检测方法的建立
秦倩茹1,高宏伟2,马洪明1,*
(1.中国海洋大学食品科学与工程学院,山东青岛266003;2.山东出入境检验检疫局技术中心,山东青岛266002)
建立了检测小麦过敏原醇溶蛋白的定量ELISA抗体夹心法,以2μg/mL的鼠抗醇溶蛋白单抗包被酶标板,HRP标记兔抗醇溶蛋白抗体作为酶标抗体,工作浓度为1∶8000,将醇溶蛋白精确配制成一定浓度的标准品,检测醇溶蛋白的含量。最佳的线性范围是19.53~5000ng/mL,R2≥0.99,定量检测限为19.53ng/mL,对应的食品样品检测限为7. 81ppm。样品的回收率在93.57%~105.72%之间,实验内CV为3.07%~5.91%,实验间CV为0.26%~5.24%,仅对大麦有一定的交叉反应,可在4℃放置两周。本法准确度和精密度高,重复性和稳定性好,特异性较强,适用于食品过敏原小麦醇溶蛋白的检测。
醇溶蛋白,ELISA,定量检测
醇溶蛋白(gliadin)是分子量28~55kDa的单体蛋白质,是小麦蛋白的主要成分,占蛋白总含量的40%,主要以贮藏蛋白形式存在于小麦胚乳中,溶于60%~70%的乙醇。在低pH条件下,根据在电泳图谱上的迁移率不同,主要分为α-、β-、γ-和ω-四种类型,它们分别占醇溶蛋白总量的25%、30%、30%和15%[1]。根据完全和部分氨基酸序列分析,它们能分为四组不同的类型:ω5-、ω1,2-、α/β-和γ-醇溶蛋白[2]。醇溶蛋白是小麦等谷物类的主要过敏原,小麦过敏会影响皮肤、内脏、呼吸道的健康,引起运动激发过敏症、职业哮喘、鼻炎、接触性荨麻症、乳糜泻肠炎、麻风皮肤病等[1]。乳糜泻肠炎是遗传易感患者摄入小麦麸质后不能耐受所致的慢性小肠吸收不良综合症,并且目前认为醇溶蛋白是乳糜泻患者的主要诱因。Codex Alimentarius(Alinorm 08/31/26)定义无麸食品为麸质含量低于20ppm的食品,而醇溶蛋白约占麸质含量的一半,所以检测醇溶蛋白的含量应低于10ppm。因此,需要建立一种有效检测过敏原醇溶蛋白的方法,检测食品中醇溶蛋白的含量,既符合美国《食物过敏原标签及消费者保护法》的要求,也为患者健康提供保障。本文针对醇溶蛋白含量建立了ELISA双抗体夹心定量快速检测方法,并对该方法进行了初步验证。
1 材料与方法
1.1 材料与仪器
醇溶蛋白、TMB底物、HRP标记兔抗醇溶蛋白抗体、HRP标记羊抗鼠IgG SIGMA公司;鼠抗醇溶蛋白单克隆抗体 德国ZEDIRA公司;牛血清蛋白BSA Solarbio公司;酪蛋白胨 青岛海博公司;特级胎牛血清FBS 北京元亨圣马公司;其他化学试剂 均为分析纯。
恒温培养箱 上海跃进医疗器械厂;酶联检测仪(BIO-RAD 680)。
1.2 实验样品的前处理[3]
样品依次为:富凯小麦胚芽,宏光麦仁,宏光小麦,宏光大麦,宏光燕麦米,宏光燕麦片,宏光荞麦米,宏光长粒糯米,宏光圆粒糯米,宏光黑香米,宏光薏仁米,宏光大黄米,宏光西米,宏光糙米,宏光高粱米,宏光玉米面,君盛爽滑蛋面。
将样品研磨成细粉,精确称取100mg,溶于1mL 65%的乙醇,即按照1∶10稀释。混匀,4℃过夜提取醇溶蛋白,4000r/min离心20min,取上清,上清用样品稀释液(即封闭液)稀释一定倍数,用于双抗体夹心ELISA检测。
醇溶蛋白标准品的配制:取SIGMA公司的粗提麦醇溶蛋白100mg,溶于100mL 65%的乙醇,溶解成1mg/mL的母液,分装冻存。母液用样品稀释液精确稀释成所需的浓度。
1.3 包被抗体和酶标抗体的最适浓度的确定
首先以ELISA直接法做单因素实验,分别初步测定包被抗体和酶标抗体的工作浓度,然后按照单因素实验的结果,选择适当的包被抗体浓度和酶标抗体浓度,按照方阵滴定法,设置阳性对照(10000ng/mL醇溶蛋白标准品)和阴性对照(0ng/mL醇溶蛋白标准品),进一步确定包被抗体和酶标抗体的最适浓度。
1.4 封闭液的选择
根据确定的包被抗体和酶标抗体浓度,选择不同配方的封闭液,主要是以胎牛血清、牛血清蛋白、酪蛋白和蔗糖为主,溶解在0.01mol/L pH7.4的PBS或加入Tween20的PBS中的不同组合的封闭液。分别设置阳性对照和阴性对照,以阴性值小于0.1、阳性对照和阴性对照比值(P/N)最大者为合适的封闭液。
1.5 ELISA双抗体夹心法
1.5.1 包被 用包被液(0.05mol/L pH9.6碳酸盐缓冲液)将鼠抗醇溶蛋白单抗稀释至包被浓度,以100μL/孔加入酶标板中,置4℃过夜。
1.5.2 洗板 弃去酶标板孔内液体,用PBS/T20洗板3次,每次3min,拍干。
1.5.3 封闭 用浓度为10%的FBS-PBS/T20封闭游离结合位点,每孔100μL,37℃温育1h,洗板。
1.5.4 加入待测抗原 用样品稀释液将醇溶蛋白母液作梯度稀释,待测样品作适当稀释,每孔100μL,并设阳性对照和阴性对照,37℃温育1h,洗板。
1.5.5 加入酶标抗体 将酶标记兔抗醇溶蛋白抗体稀释至工作浓度,每孔加100μL,新鲜配制,37℃温育45~60min。
1.5.6 显色 各孔加TMB(3,3′,5,5′-四甲基联苯胺)底物液100μL,室温避光反应10~15min。
1.5.7 终止 各孔加2mol/L硫酸50μL终止反应。
1.5.8 读数 用酶标仪在450nm处测定吸光值A,以阴性对照孔调零,以醇溶蛋白标准溶液A值及相应的浓度对数作直线回归,得回归方程,将待测样品A值代入回归方程求出相应的醇溶蛋白含量。
1.6 方法验证
1.6.1 醇溶蛋白定量标准曲线的建立 将1mg/mL醇溶蛋白母液精确稀释成4.88、9.77、19.53、39.06、78.13、156.25、312.5、625、1250、2500、5000、10000、20000ng/mL一系列浓度的标准品,以醇溶蛋白标准品的A值为纵坐标,相应的浓度对数为横坐标,建立标准曲线,根据直线回归方程计算待测样品中的醇溶蛋白含量。
1.6.2 精密度、准确度和重复性验证 在检测范围内将醇溶蛋白母液精确稀释成一定浓度,每一浓度重复测定6次,另外在三次实验中每个浓度重复测定6次。分别取测定结果的平均值,根据回归方程计算醇溶蛋白含量的测定值,并计算其标准差(S)、变异系数(CV%)和回收率(%),评价此方法的精密性、准确性和重复性。
1.6.3 特异性验证 按照1.2样品处理方法处理样品1~16,上清用样品稀释液稀释40倍,检测A值,与阴性对照比较,以P/N≥2.1为阳性。阳性为有交叉反应,阴性为无交叉反应。
1.6.4 稳定性验证 将本实验的试剂配制成试剂盒,分别在4℃放置7、10、14d,按照上述ELISA检测方法测定醇溶蛋白标准品A值,相比较观察试剂的稳定性。
2 结果与分析
2.1 包被抗体和酶标抗体的最适浓度
2.1.1 酶标抗体浓度的初步确定 以10μg/mL醇溶蛋白包被酶标板,将酶标记兔抗醇溶蛋白抗体从1∶100的稀释浓度开始,按2n倍比稀释成不同浓度,以ELISA直接法的单因素实验测定450nm处的A值。取A值为1.0时的稀释度作为酶标抗体的工作浓度[4],当稀释度为6~7时符合条件,所以酶标记抗体的工作浓度约为1∶6400~1∶12800。
2.1.2 包被抗体浓度的初步确定 选择鼠抗醇溶蛋白单抗的初始浓度为40μg/mL,按2n倍比稀释成不同浓度包被酶标板,加入工作浓度为1∶5000的HRP标记羊抗鼠IgG,以ELISA直接法测定450nm处的A值。可以得出,鼠抗醇溶蛋白单抗包被浓度由40μg/mL降至1.25μg/mL时,A值变化不大;降至1.25μg/mL以下时,A值随之明显降低。说明抗醇溶蛋白单抗的浓度达到约1.25μg/mL时,酶标板达到最大包被吸附量,此时能够最大量的捕获目的蛋白。因此,初步确定包被抗体的工作浓度为1.25μg/mL左右。
2.1.3 包被抗体和酶标抗体的最适浓度 根据单因素实验结果,选择包被抗体浓度为1、2、4μg/mL包被酶标板,酶标抗体浓度为1∶6000、1∶8000、1∶10000、1∶12000,分别设置阳性对照和阴性对照,以方阵滴定法测定结果显示,包被抗体浓度为2μg/mL,酶标抗体浓度为1∶8000时,阴性对照值为0.08,阳性对照与阴性对照相差最大,为最适的包被抗体和酶标抗体浓度配伍。
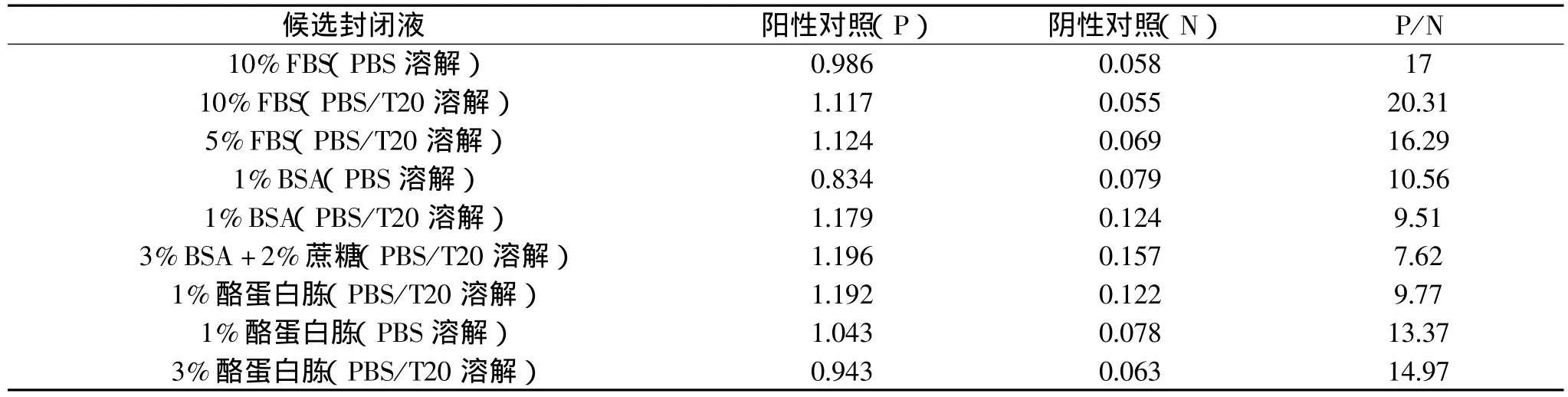
表1 9种配方封闭液的封闭效果
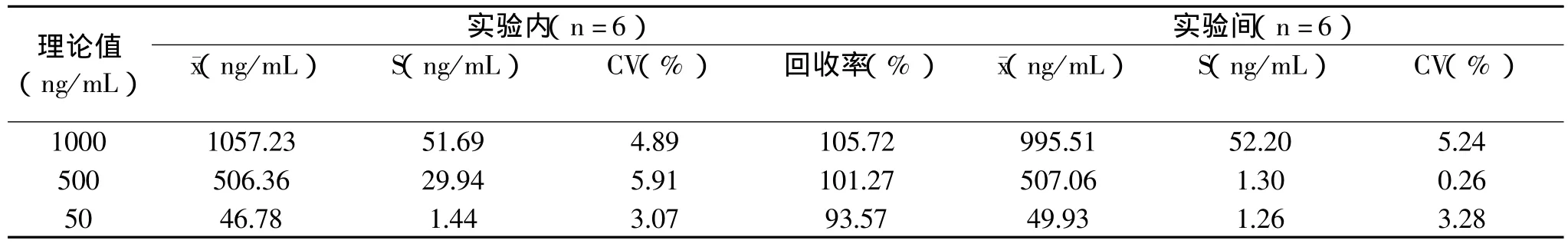
表2 ELISA的准确度、精确度、重复性实验
2.2 封闭液选择
选择合适的封闭液,能够有效减小背景信号的干扰,增强阳性样品的信号,即减少非特异性反应[5]。在最适的包被抗体浓度和酶标抗体浓度下,选择9种配方的封闭液,分别做抗体夹心ELISA检测的A值如表1。显然,以10%FBS(PBS/T20溶解)做封闭液,阴性值最低,阴阳性差别最大,封闭效果最好。
2.3 标准曲线的线性范围和检测限
将4.88~20000ng/mL的醇溶蛋白标准品在所建立的抗体夹心ELISA法中检测,每个浓度检测3次,取A值的平均值与对应的浓度对数进行线性分析,结果显示最佳的线性范围是19.53~5000ng/mL,R2= 0.9957,定量检测限为19.53ng/mL。

图1 醇溶蛋白检测标准曲线
2.4 精密度、准确度和重复性验证
在检测范围内将醇溶蛋白母液精确稀释成1000、500、50ng/mL,每一浓度重复测定6次,另外在三次实验中每个浓度重复测定6次。分别取测定结果的平均值,根据回归方程计算醇溶蛋白含量的测定值,并计算其标准差(S)、变异系数(CV%)和回收率(%),结果如表2。在同一次实验内,样品的回收率在93.57%~105.72%之间,说明本法准确度比较高。同一次实验内精密度CV为3.07%~5.91%,3次实验间精密度CV为0.26%~5.24%,说明本法精密度较高,重复性较好。
2.5 特异性验证
按照1.2样品处理方法处理样品1~16,根据本实验的定量检测限19.53ng/mL,上清用样品稀释液稀释50倍,相当于原始样品稀释了500倍,检测限19.53ng/mL乘以稀释倍数后,约为7.81μg/mL,即7.81ppm,属于无麸质范围。因此,样品测定的A值在检测限以下,即P/N<2.1,均判定为阴性,以P/N≥2.1为阳性。实验结果表明:
富凯小麦胚芽,宏光麦仁,宏光小麦为强阳性,宏光大麦表现为阳性。
宏光燕麦米,宏光燕麦片,宏光糙米,宏光玉米面均为弱阳性,带入回归方程计算出含量均小于10ppm。
宏光荞麦米,宏光长粒糯米,宏光圆粒糯米,宏光黑香米,宏光薏仁米,宏光大黄米,宏光西米,宏光高粱米均为阴性。
说明本实验对小麦醇溶蛋白有较强的特异性,但对大麦有一定的交叉反应。
2.6 稳定性验证
将本实验的试剂配制成试剂盒,分别在4℃放置7、10、14d后测定,对于500ng/mL和50ng/mL浓度的醇溶蛋白标准品分别测定6次,回收率在92.58%~114.84%之间,回归方程的R2在0.9817~0.9984之间,CV为3.52%~5.95%之间。并且本实验用的抗体、醇溶蛋白母液等试剂原液在4℃放置1个月,效价均没有降低,表明本实验的稳定性较好。
2.7 试剂盒应用
取样品宏光小麦、宏光大麦、宏光燕麦片、宏光玉米面、君盛爽滑蛋面,按照上述1.2样品处理方法处理后,用样品稀释液稀释50倍,每份样品做6次测定,带回标准曲线,计算各样品中醇溶蛋白含量,乘以稀释倍数,得到样品的实际醇溶蛋白含量(表3)。

表3 实测阳性样品的实际醇溶蛋白含量
3 结论
应用酶联免疫法检测麦醇溶蛋白,为食品中醇溶蛋白的定量检测提供了简便快速的手段。醇溶蛋白作为小麦麸质的主要蛋白质,约占麸质蛋白含量的一半,定量检测醇溶蛋白的含量,能估算出麸质蛋白的含量,从而根据无麸食品定义以20ppm为界限,应美国《食物过敏原标签及消费者保护法》的要求,在食品标签上标识是否为无麸食品。乳糜泻患者从此可以根据标签标识选择可以食用的食品。
目前,国内外检测醇溶蛋白主要采用ELISA方法,而市面上大部分销售的都是检测人血清中抗醇溶蛋白抗体的ELISA试剂盒,只能在医学诊断层面上检测患者血清,确定患者是否患乳糜泻病。而从预防角度上,检测食品中的醇溶蛋白,只有国外的商品化ELISA试剂盒,但是价格非常昂贵。国内目前尚无标准化和商品化的检测醇溶蛋白的ELISA试剂盒。因此,需要建立一种有效的定量检测过敏原醇溶蛋白的方法,为ELISA试剂盒的研制提供理论依据,弥补国内商品化ELISA试剂盒的空缺。
本文所建立的抗体夹心ELISA法,以2μg/mL的鼠抗醇溶蛋白单抗包被酶标板,1∶8000的HRP标记兔抗醇溶蛋白抗体作为酶标抗体,检测小麦醇溶蛋白含量的最佳的线性范围是19.53~5000ng/mL,R2≥0.99,定量检测限为19.53ng/mL,对应的食品样品检测限为7.81ppm。样品的回收率在93.57%~105.72%之间,实验内 CV为3.07%~5.91%,实验间CV为0.26%~5.24%,但对大麦有一定的交叉反应性,可在4℃放置两周,稳定性较好。本实验的初步验证表明,本法准确度和精密度高,重复性和稳定性好,特异性较强,为进一步研制醇溶蛋白ELISA定量检测试剂盒奠定了基础。
[1]毛炜翔,高金燕,陈红兵.小麦过敏研究进展[J].食品科学,2007,28(8):559-562.
[2]Herbert Wieser.Chemistry of gluten proteins[J].Food Microbiology,2007,24:115-119.
[3]荣建华,许金东,张东星,等.小麦醇溶蛋白提取条件的研究[J].粮食与饲料工业,2006(3):14-15.
[4]金伯泉.细胞和分子免疫学实验技术[M].西安:第四军医大学出版社,2002:34-35.
[5]Takai T,Ochiai Y,Ichikawa S,et al.Enzyme-linked immunosorbent assays with high sensitivity for antigen-specific and total murine IgE:a useful tool for the study of allergies in mouse models[J].Allergol Int,2009,58(2):225-235.
Quantitative determination of gliadin protein from wheat in foods by ELISA method
QIN Qian-ru1,GAO Hong-wei2,MA Hong-ming1,*
(1.College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China;2.Shandong Technical Center of Entry-Exit Inspection and Quarantine Bureau,Qingdao 266002,China)
To establish a method for quantitative analysis of gliadin from wheat in foods by ELlSA.The mouse anti-gliadin McAb was used as a coating antibody in the concentration of 2μg/mL,and a horseradish peroxidaseconjugated anti-gliadin as an enzyme-labeled antibody in the optimal working dilution of 1∶8000,and a series of concentrations of gliadin solution as standards.The contents of gliadin in samples were determined.The optimal linear range was 19.53~5000ng/mL and R2≥0.99.The quantitative limit of detection was 19.53ng/mL,which was corresponding to 7.81ppm in food samples.The recovery rate for the accuracy test was 93.57%~105.72%.The coefficient of variation for precision assay were 3.07%~5.91%in the same test and 0.26%~5.24%among three tests.Cross reaction was only observed with barley.The set of kit could be placed 4℃for two weeks.The method is sensitive,accurate,specific.lt is suitable for quantitative determination of gliadin in foods.
gliadin;ELlSA;quantitative determination
TS207.3
A
1002-0306(2010)11-0360-04
2009-12-16 *通讯联系人
秦倩茹(1984-),女,在读硕士,研究方向:食品安全与质量控制。
科技部质检公益项目(2007GYJ036)。

