冷冻对甲壳素固体结构的影响
刘廷国,宋 雪,李 斌,*,陆志敏
(1.华中农业大学食品科技学院,湖北武汉430070;2.池州学院化学与食品科学系,安徽池州247100)
冷冻对甲壳素固体结构的影响
刘廷国1,2,宋 雪1,李 斌1,*,陆志敏2
(1.华中农业大学食品科技学院,湖北武汉430070;2.池州学院化学与食品科学系,安徽池州247100)
甲壳素和质量浓度45%的NaOH溶液按料液比1∶10充分混匀,分别在-18℃和-35℃下冷冻处理,研究碱-冷冻处理对甲壳素凝聚态结构的影响。采用酸碱滴定法测定样品的脱乙酰度,X-射线衍射、红外光谱和差示扫描量热分析研究经冷冻后样品聚集态结构的变化情况。结构分析结果表明,慢速冷冻过程中,冰晶的形成和生长能够破坏分子内/分子间氢键相互作用,使有序的分子结构紊乱,破坏致密的晶体结构,使甲壳素结晶度下降。但是这种结晶结构的破坏作用是不稳定的、可逆的。尽管如此,碱-冷冻处理仍可以作为一种有效的甲壳素化学修饰前处理手段,能够明显加快反应速率而不影响甲壳素分子链主体结构。
甲壳素,冷冻,非均相,凝聚态结构
甲壳素是由2-乙酰氨基-2-脱氧-D-吡喃葡萄糖通过β-1,4糖苷键缩合而成的线性同聚多糖,主要是由海产品虾和蟹加工后的废弃物——虾头和蟹壳经过稀酸脱钙和稀碱脱除蛋白质后制成的高附加值天然多糖[1]。它是自然界中迄今为止所发现的唯一具有明显碱性、带有正电荷、产量仅次于纤维素的天然多糖,也是除蛋白质外含氮量最高的可再生天然有机化合物,估计每年自然界生物合成的甲壳素将近100亿t[2-3]。甲壳素及其衍生物具有优良的透气性、成膜性、成纤维性、吸湿性、生物降解性、生物相容性、广谱抗菌性及重金属离子螯合性等[4-5],在纺织、印染、造纸、医药、食品、化工、环保、生物工程、农业等诸多领域显示出其独特的应用价值,市场发展前景乐观[6-7]。但甲壳素不溶于一般溶剂,浓酸虽可使其溶解,但对分子链降解严重[8]。分子链上存在大量化学反应惰性的乙酰氨基,强化了甲壳素分子致密的晶体结构,增大了对甲壳素直接进行化学修饰的难度。破坏甲壳素结晶结构、提高溶解性和化学反应活性成为近年科学家广泛关注的热点研究问题之一[9-10]。化学修饰[11]、高能射线辐射[12-13]、超声波[14]、冷冻[15-16]以及超微粉碎[17]等众多方法被用来破坏甲壳素致密的晶体结构,提高其溶解性或化学反应活性。其中,冷冻法因其安全、高效、对甲壳素分子链主体结构损伤小而被广泛应用。科学家已经注意到在冷冻过程中,冰晶体的存在和生长,会不同程度地对碳水化合物高聚物微观结构造成机械损伤,进而破坏其晶体结构[16,18-19]。目前对甲壳素冷冻处理的研究报道较少且不系统,国内尚无该方面文献报道,本研究着重探讨了缓慢冻结和快速冻结对甲壳素凝聚态结构的影响,以期为冷冻法在碳水化合物研究中的扩大应用积累理论和实践经验,也为甲壳素的深加工提供新的研究思路。
1 材料与方法
1.1 材料与仪器
甲壳素 食品级,脱乙酰度21.11%,粒度60~80目,浙江金壳生物化学有限公司;除特别说明外,实验用水均为双蒸水,所用化学试剂均为分析纯。
循环水式多用真空泵(SHB-III) 郑州长城科工贸有限公司;冷冻离心机(TGL-16C) 珠海云天环保科技有限公司;真空干燥箱(DZF-6050) 上海精宏实验设备有限公司;X-射线衍射仪(D/Max-IIIA)日本Rigaku公司;红外光谱仪(NEXUS 470 FT-IR)美国Nicolet公司;差示扫描量热仪(204-F1) 德国Netzsch公司。
1.2 实验方法
1.2.1 碱甲壳素冷冻处理 一定质量的甲壳素粉末与质量浓度为45%的NaOH溶液按料液比1∶10(W∶V)充分混合均匀,室温静置8h后真空脱气30min,使甲壳素颗粒充分浸润,密封后分别置于-18℃和-35℃下冷冻1~5d。处理结束后,样品取出经自然解冻后观察样品溶解情况,样品于4℃、4000r/min离心20min,沉淀用70%(V/V)乙醇洗涤至用0.1mol/L AgNO3检测无Cl-残留为止,再分别用95%乙醇、无水乙醇脱水,60℃真空干燥24h,取出研磨置干燥器备用。
1.2.2 测试方法
1.2.2.1 理化指标 溶解性的测定采用目测法,0.20g干燥的甲壳素样品分散于20mL 0.1mol/L盐酸溶液中,25℃磁力搅拌4h,观察样品溶解情况。样品脱乙酰度(Degree of Deacetylation,DDA,%)采用改进的碱量法测定[20]。
1.2.2.2 结构表征 粉末 X-射线衍射(X-Ray Diffraction,XRD)图谱由X-射线光谱仪获得,测定条件为20℃,35kV,30mA,石墨单色器,DS/SS=1°,RS =0.3mm,采用Cu Kα1辐射λ=1.54184Å。扫描角度(2Theta,2θ,°)范围为4~60°,步进0.02°,每分钟4°,结晶度由(110)晶面的结晶指数(Crystallinity Index,CrI110,%)表示,计算公式如下:CrI110=(I110-Iam)× 100/I110(式中I110指2θ为20°左右最强衍射峰的相对强度,Iam指2θ为16°处的无定形漫散射峰的相对强度)[21],数据的分析处理采用MDI Jade软件包(Jade 5.0,Materials Data Inc,Japan)实现。
傅立叶变换红外光谱(FT-IR)由FT-IR光谱仪在室温、干燥条件下扫描获得,扫描范围为4000~400cm-1,分辨率4cm-1,累加32次,以空气为背景,每个样品扫描前扣除背景[20,22],所有数据的采集和处理采用仪器自带的OMNIC分析软件包分析获得。
差示扫描量热(Differential Scanning Calorimetry,DSC)仪研究样品热特性,纯金属铟(99.99%)校正仪器的温度和热焓,准确称取5.0±0.1mg样品放入盖子中心带孔的铝坩埚中,密封,用相同的空坩埚作参比,以20℃·min-1升温速率从30℃升至190℃,恒温5min。快速冷却后重新称重,再以10℃·min-1从30℃加热到500℃,整个过程均在干燥N2下进行,吹扫气流量20mL·min-1,保护气流量60mL·min-1,数据的采集和分析利用仪器自带的Proteus软件包实现[23-24]。
2 结果与讨论
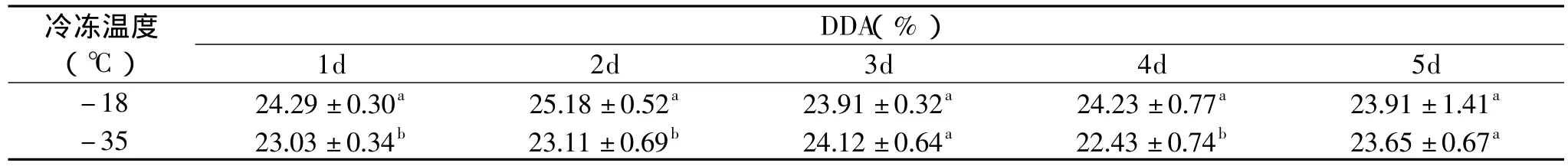
表1 -18/-35℃碱冷冻处理对甲壳素脱乙酰反应的影响
2.1 碱-冷冻处理对甲壳素理化性质的影响
甲壳素非均相脱乙酰反应可视为典型的液固复相反应,遵循复相反应规律。探讨了甲壳素浓碱混合物经不同冻结温度冷冻处理后对甲壳素脱乙酰反应的影响,通过测定样品的脱乙酰度间接监测脱乙酰反应进程。常规家用冰箱冷冻室温度为-18℃,而常规大型冷库温度为-35℃,碳水化合物冷冻加工的已有研究表明,温度高于-18~-23℃的冻结属慢速冻结,低于-30℃属快速冻结,在慢速冻结过程中,冰结晶首先出现在样品颗粒间隙,且分布不均匀,对样品结构的损伤较大;反之,在快速冻结过程中,冰结晶即可均匀地分布在样品颗粒间隙中并形成小的针状冰结晶,对结构的损伤较小。结合工业生产实际和浓碱溶液的性质本研究选择-18℃和-35℃分别作为冷冻处理温度。
在两种不同温度下冷冻处理的样品,冷冻结束后经解冻均未观测到样品有溶解现象,而文献[20]报道,采用低温冷冻-解冻的温度循环处理可以使甲壳素溶解于10%NaOH溶液中,从而获得一种甲壳素均相溶液。经碱-冷冻处理的甲壳素样品分散于一定量0.1mol/L HCl溶液中,搅拌一定时间,亦未观测到溶解现象,-18℃处理样品有轻微溶胀现象,而-35℃处理样品未有明显溶胀现象发生。表1反映了碱-冷冻处理对甲壳素脱乙酰反应的影响。由表可知,经过5d的冷冻处理,甲壳素样品间脱乙酰度无显著差异,与原料甲壳素相比亦无显著差异。以上现象说明,冷冻过程中冰晶的形成和生长强制NaOH分子渗透进甲壳素颗粒内部,打开分子间或分子内部分氢键相互作用,破坏甲壳素致密的晶体结构,但是对甲壳素分子链的破坏较少,能够较好地保持甲壳素分子结构的完整性,为利用甲壳素为原料进行进一步化学修饰提供了可能。
2.2 碱-冷冻处理对甲壳素凝聚态结构的影响
2.2.1 XRD分析 图 1给出了纯化甲壳素和经-18℃冷冻处理样品的XRD图谱。纯甲壳素在2θ为9.44、19.28、20.80、23.70和26.40°有5个尖锐的衍射峰,分别对应于(020)、(110)、(120)、(101)和(130)晶面,属正交晶系,符合α-甲壳素的衍射特征。经冷冻处理,这5个清晰衍射峰强度明显减弱或被掩盖。特别是对应于(120)和(101)晶面的衍射峰几乎完全被掩盖。由图可知,冷冻处理1d的样品19.28°处衍射峰强度急剧下降为甲壳素的35%,随后下降缓慢,第2d达到最低值34.62%,随着处理时间的延长,又开始缓慢回升,冷冻5d样品衍射峰强度又恢复到原料甲壳素的59.43%。冷冻处理1d样品的CrI110由原料的99.15%下降到83.16%,2d样品CrI110降至最低值为 82.30%,处理 5d后回升至96.05%,说明冷冻2d即可较大限度破坏甲壳素晶体结构,作为甲壳素化学修饰前处理手段是比较合适的,单纯通过增加冷冻处理时间并不能进一步破坏甲壳素凝聚态结构。
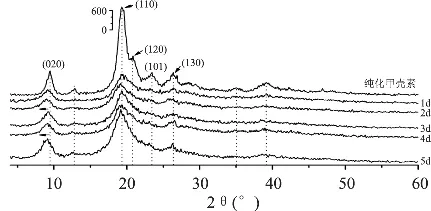
图1 -18℃冷冻处理样品的XRD图谱
值得注意的是,文献报道(020)晶面衍射峰强度随脱乙酰度的增加而降低,结晶度也随之降低[25]。而从图1可以看出,与甲壳素相比,该晶面衍射强度确有降低,但在处理达到2d以后,衍射峰的强度反而上升,不过该晶面的面间距由未处理的9.3685Å增大到2d的9.9580Å,然后维持在9.7171Å左右,这进一步证明了冷冻可以降低甲壳素分子结构的规整性,使其分子间排列松散,结晶度降低,有利于进一步处理。之所以产生与上述文献的差异,可能是在此脱乙酰度差别不大(表1)的前提下,脱乙酰度变化对结晶区的影响,尚不及冷冻产生的影响。
图2给出了分别在-18℃和-35℃冷冻1、2、5d样品的XRD图谱,由图可见,-35℃处理样品,在1~5d冷冻中衍射峰强度几乎无差异。而在-18℃处理1d和2d的样品,却比-35℃处理的样品衍射峰强度明显低得多,说明-18℃左右的温度处理最适合破坏甲壳素分子间相互作用力,更低的温度反而不利于这种作用。其主要原因是-18℃更接近甲壳素碱混合物的冻结点温度(不能简单理解为冰点温度),在此温度下,冰晶中小分子的运动性显然强于-35℃下,冰晶的晶粒亦大于后者,因此可以更加有效地破坏甲壳素晶体结构。而-35℃冷冻时,体系完全处于玻璃态下,分子运动性大大减弱,形成的冰晶晶粒细小、分布均匀,对甲壳素结构的破坏作用比较有限。这实际上与碳水化合物冷冻加工中的许多现象是吻合的。

图2 -35℃与-18℃冷冻处理样品的对比XRD图谱
-18℃处理更长时间后,已被强制疏松排列的运动性较强的甲壳素分子,并不能处于稳态,需要重新进行自组装,比如以熵增的方式,回到低能态,此时为适应新的环境相态,部分微晶结构可能稍有差异,但结晶度提高,图2处理5d的样品与-35℃样品的衍射谱线几乎重合即说明这一问题。
2.2.2 FT-IR分析 红外光谱是研究有机物氢键相互作用的一种较为有效的常规手段之一。图3和图4分别给出了冷冻处理温度为-18℃和-35℃样品的红外光谱图。对比甲壳素的FT-IR光谱图[20],对于-18℃冷冻处理样品,甲壳素3448cm-1处的O-H伸缩振动吸收峰变宽并向低波数方向移动,处理1d样品最为明显,移动了14cm-1,这是典型的分子间氢键作用减弱的标志,然而,随处理时间的延长又缓慢恢复,5d时重新回到3448cm-1,这与XRD分析的结果是一致的。
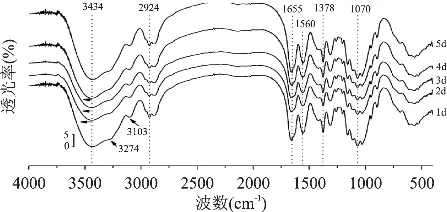
图3 -18℃冷冻处理样品的FT-IR图谱

图4 -35℃冷冻处理样品的FT-IR图谱
-35℃处理样品在该O-H伸缩振动及氢键作用区域,变化明显不及-18℃处理样品,除了4d样品向低波数方向移动了17cm-1外,其它样品偏移量很小,仅1~7、3274、3103cm-1处分别反映N-H伸缩振动的吸收峰和C(21)NH…O=C(73)和C(61)OH…HOC(62)分子内氢键[20],与原料甲壳素相比均明显减弱,-18℃和-35℃样品差别并不显著,这亦与XRD分析结果相吻合。
2.2.3 DSC分析 对原料与样品进行差示扫描量热分析,从热力学角度分析处理前后甲壳素凝聚态结构的差异,-18℃和-35℃处理样品DSC图谱和一阶微分DSC图谱与甲壳素和壳聚糖原样相比明显不同,所有样品的热分解参数列于表2中。经过冷冻处理的所有样品DSC图谱,观测到两个明显的热行为,第一个是分别以293.2℃和296.0℃为中心的放热峰,归因于甲壳素分子的重结晶;第二个是分别以343.3℃和337.6℃为中心的吸热峰,归因于甲壳素的热分解,这与甲壳素原粉的热特性极为相似,但分解温度提前了50℃左右。说明经过碱-冷冻处理使甲壳素致密的氢键网络结构破坏或减弱,导致分子柔性增加,分子运动性、扩散性增强,稳定性变差,分解温度提前。

表2 -18/-35℃碱冷冻处理对甲壳素热分析特性的影响
文献报道甲壳素和壳聚糖的玻璃化转变温度(Glass Transition Temperature,Tg)分别为236℃[26]和203℃[27]。从表2数据可以看出,样品经过冷冻处理后玻璃化转变温度急剧降低,这也有力地说明了样品经过冷冻处理后,分子的运动性大大提高。然而各组样品自身之间Tg变化并不显著,特别是经过-35℃处理样品的Tg降低的更多,但重结晶峰温度变化却不及-18℃处理样品剧烈,说明-35℃处理的样品比-18℃处理样品处于更不稳定的亚稳态,这与XRD、FT-IR的分析结果相吻合。
综上所述,冷冻处理样品的热特性显然不同于甲壳素,重结晶峰的出现,说明经冷冻诱导的甲壳素结晶破坏作用并不是十分彻底,而且这种破坏作用是可逆的,经过加热后又可以重新形成结晶。然而,即使如此,冷冻处理还是可以显著降低甲壳素分子致密的晶体结构,使其稳定性降低、分解温度提前。
3 结论
探讨了碱液冷冻处理对甲壳素凝聚态结构的影响,冷冻处理过程中形成的冰晶能够显著破坏甲壳素分子内、分子间氢键相互作用,破坏甲壳素高度规整的分子结构,使其结晶度下降,有利于进一步结构修饰。慢速冷冻过程较快速冷冻的破坏作用更为显著,两者均能迫使甲壳素分子由稳态趋向于亚稳态。结构分析及理化分析结果表明,冷冻处理只破坏甲壳素结晶结构,对分子链骨架结构不造成损伤,有利于保持甲壳素固有的生物活性。冷冻导致结晶度降低的程度有限,最初2d处理时迅速下降,其后逐渐回升,且这种由冷冻诱导的结晶破坏作用部分可逆,经过加热处理后又会重新形成分子间氢键,产生新的微晶,使结晶度提高。但可以肯定的是,冷冻处理可以作为一种有效、可控的甲壳素化学修饰前处理手段,以提高反应活性。
[1]欧春艳,杨磊,李思东,等.甲壳素红外干燥特性及动力学模型研究[J].农业工程学报,2008,24(4):287-289.
[2]蒋挺大.甲壳素[M].北京:化学工业出版社,2003.
[3]董炎明,黄训亭,赵雅青,等.甲壳类液晶高分子研究--低分子量壳聚糖溶致液晶性及分子量对液晶临界浓度的影响[J].高分子学报,2006(1):16-20.
[4]Chae S Y,Jang M Y,Nah J W.Influence of molecular weight on oral absorption of water soluble chitosans[J].J Controlled Release,2005,102(2):383-394.
[5]Je J Y,Cho Y S,Kim S K.Cytotoxic activities of watersoluble chitosan derivatives with different degree of deacetylation[J].Bioorg Med Chem Lett,2006,16(8):2122-2126.
[6]Baxter S,Zivanovic S,Weiss J.Molecular weight and degree of acetylation of high-intensity ultrasonicated chitosan[J].Food Hydrocolloids,2005,19(5):821-830.
[7]No H K,Park N Y,Lee S H,et al.Antibacterial activity of chitosans and chitosan oligomers with different molecular weights[J].Int J Food Microbiol,2002,74(1-2):65-72.
[8]Marguerite R.Chitin and chitosan:Properties and applications[J].Prog Polym Sci,2006,31(7):603-632.
[9]董炎明,汪剑炜,袁清.水溶性甲壳素的研究进展[J].厦门科技,1999(1):8-9.
[10]杜予民.甲壳素化学与应用的新进展[J].武汉大学学报:自然科学版,2000,46(2):181-186.
[11]万欣荣,顾汉卿.水溶性壳聚糖的研究进展[J].透析与人工器官,2005,16(1):26-31.
[12]康斌,戚志强,伍亚军,等.γ辐射降解法制备小分子水溶性壳聚糖[J].辐射研究与辐射工艺学报,2006,24(2):83-86.
[13]Ge H C,Luo D K.Preparation of carboxymethyl chitosan in aqueous solution under microwave irradiation[J].Carbohydr Res,2005,340(7):1351-1356.
[14]Liu H,Bao J G,Du Y M,et al.Effect of ultrasonic treatment on the biochemphysical properties of chitosan[J].Carbohydr Polym,2006,64(4):553-559.
[15]Cho Y W,Jang J H,Park C R,et al.Preparation and solubility in acid and water of partially deacetylated chitins[J]. Biomacromolecules,2000,1(4):609-614.
[16]Liu Y L,Liu Z F,Pan W L,et al.Absorption behaviors and structure changes of chitin in alkali solution[J].Carbohydr Polym,2007,72(2):235-239.
[17]Chau C F,Wang Y T,Wen Y L.Different micronization methods significantly improve the functionality of carrot insoluble fibre[J].Food Chem,2007,100(4):1402-1408.
[18]Hu X W,Du Y M,Tang Y F,et al.Solubility and property of chitin in NaOH/urea aqueous solution[J].Carbohydr Polym,2007,70(4):451-458.
[19]Feng F,Liu Y,Hu K A.Influence of alkali-freezing treatment on the solid state structure of chitin[J].Carbohydr Res,2004,339(13):2321-2324.
[20]Liu T G,Li B,Lv B,et al.Effects and kinetics of a novel temperature cycling treatment on the N-deacetylation of chitin in alkaline solution[J].Carbohydr Polym,2009,77(1):110-117.
[21]Focher B,Beltranme P L,Naggi A,et al.Alkaline N-deacetylation of enhanced by flash treatments:reaction kinetics and structure modifications[J].Carbohydr Polym,1990,12(4):405-418.
[22]Duarte M L,Ferreira M C,Marvao M R,et al.An optimised method to determine the degree of acetylation of chitin and chitosan by FTIR spectroscopy[J].Int J Biol Macromol,2002,31(1-3):1-8.
[23]Guinesi L S,Cavalheiro É T G.The use of DSC curves to determine the acetylation degree of chitin/chitosan samples[J]. Thermochim Acta,2006,444(2):128-133.
[24]Kittur F S,Prashanth K V H,Sankar K U,et al. Characterization ofchitin,chitosan and theircarboxymethyl derivatives by differential scanning calorimetry[J].Carbohydr Polym,2002,49(2):185-193.
[25]Zhang Y Q,Xue C H,Xue Y,et al.Determination of the degree of deacetylation of chitin and chitosan by X-ray powder diffraction[J].Carbohydr Res,2005,340(11):1914-1917.
[26]Kim S S,Kim S H,Lee Y M.Preparation,characterization,and properties of β-chitin and N-acetylated β-chitin[J].J Polym Sci,Part B:Polym Phys,1996,34(14):2367-2374.
[27]Sakurai K,Maegawa T,Takahashi T.Glass transition temperature of chitosan and miscibility of chitosan/poly(N-vinyl pyrrolidone)blends[J].Polymer,2000,41(19):7051-7056.
Effect of alkali-freezing treatment on the solid state structure of chitin
LIU Ting-guo1,2,SONG Xue1,LI Bin1,*,LU Zhi-min2
(1.College of Food Science and Technology,Huazhong Agricultural University,Wuhan 430070,China;2.Department of Chemistry and Food Science,Chizhou College,Chizhou 247100,China)
The effects of alkali-freezing treatment on the condensed state structure of chitin were explored.Chitin powder was soaked in concentrated sodium hydroxide(with a mass concentration of 45%,and the ratio of chitin and NaOH solution was 1∶10,W/V)and freezed at-18℃ and-35℃ for further modification.The degree of deacetylation(DDA)was determined by acid-base titration method.X-ray diffraction(XRD),infrared spectroscopy(lR)and differential scanning calorimetry(DSC)measurements were employed to investigate the condensed state structural changes of the freezing-treated chitin powders.Structural analysis results showed that the formation and growth of ice crystal during the slowly freezing process that can break the intra-and/or inter-molecular hydrogen bonds interaction,disorder the ordered molecular structure and destruct the compact crystal structure and decline the crystallinity of chitin.The study explained that the alkali-freezing treatment was beneficial for further modification of chitin,which can increase the chemical reaction rate and keep the main molecular chain structure of chitin completely.
chitin;freezing;heterogeneous;condensed state structure
TS254.9
A
1002-0306(2010)11-0094-05
2009-11-04 *通讯联系人
刘廷国(1982-),男,硕士,讲师,研究方向:农副产品深加工与应用。
国家“863”资助项目(2007AA10Z310);池州学院化学材料与工程省级实验中心建设项目。

