THPED化学镀铜溶液中Cu(II)的存在形式与阴极还原
邹伟红,郑雅杰
(1.广州市二轻工业科学技术研究所,广东 广州 510663;2.中南大学冶金学院,湖南 长沙 410083)
THPED化学镀铜溶液中Cu(II)的存在形式与阴极还原
邹伟红1,*,郑雅杰2
(1.广州市二轻工业科学技术研究所,广东 广州 510663;2.中南大学冶金学院,湖南 长沙 410083)
采用循环迭代法研究了以四羟丙基乙二胺(THPED)为配位剂的化学镀铜溶液中 Cu(II)的主要存在形式。通过循环伏安法,研究了Cu(II)的阴极还原反应。研究表明:THPED(以T表示)与Cu(II)形成的配合物主要是CuT(OH)2和CuT2(OH)2,其浓度分别占总Cu(II)浓度的56%和42%。CuT(OH)2和CuT2(OH)2分别在电位−0.7 V和−1.2 V左右(均相对于饱和甘汞电极)发生如下不可逆的电化学还原:CuT(OH)2+ 2e−→ Cu + T + 2OH−和CuT2(OH)2+ 2e−→ Cu + 2T + 2OH−。
化学镀铜;四羟丙基乙二胺;二价铜;配合物;阴极还原;循环伏安法
1 前言
目前,有关化学镀铜的理论主要有原子氢理论、氢化物传输理论、金属氢氧化物理论、电化学理论等[1-6],而以混合电位为基础的电化学理论被人们普遍接受。电化学理论认为,铜离子的局部阴极还原过程和甲醛的局部阳极氧化过程同时发生,但其位置不断变化,这两个过程的速度相等,只取决于其电极电位[7-8]。化学镀铜反应分为甲醛的阳极氧化反应和 Cu(II)的阴极还原反应,因此可采用一定的电化学方法进行单独研究。在一定的pH下,化学镀铜液中Cu(II)的主要存在形式及其阴极还原动力学规律对于阐明化学镀铜的沉积过程有非常重要的意义。本文对以四羟丙基乙二胺(THPED)为配位剂的化学镀铜溶液中 Cu(II)的存在形式进行了定量计算,并采用循环伏安曲线探讨了Cu(II)的阴极还原过程。
2 实验
2. 1 电极
工作电极采用铜电极(面积1.5 mm2),辅助电极采用铂片电极(面积 234 mm2),参比电极采用饱和甘汞电极(SCE)。工作电极每次使用前都经过以下处理:金相砂纸打磨─丙酮脱脂─稀盐酸活化─蒸馏水冲洗。文中所述电位均相对于SCE。
2. 2 仪器
CHI660A型电化学工作站(上海辰华),H型电解槽(带有砂芯玻璃隔膜),盐桥(带有鲁金毛细管)。
2. 3 药品
CuSO4·5H2O(AR)、THPED(98%)、NaOH(AR)、KCl(AR),二次蒸馏水。
3 结果与讨论
3. 1 Cu(II)的主要存在形式
在THPED体系中,Norkus等[9-10]通过直流极谱法观察发现:碱性溶液中,当pH >6时,THPED(以T表示)与Cu(II)主要生成 CuT2+和配合物;当pH >10时,THPED与Cu(II)主要生成 CuT2(OH)2和 CuT(OH)2配合物,其稳定常数分别为1010.6、1014.6、1026.9和1029.1。
pH = 13.0时,[OH−]= 10−1,Cu(II)和THPED在镀液中的物料平衡方程式如下:
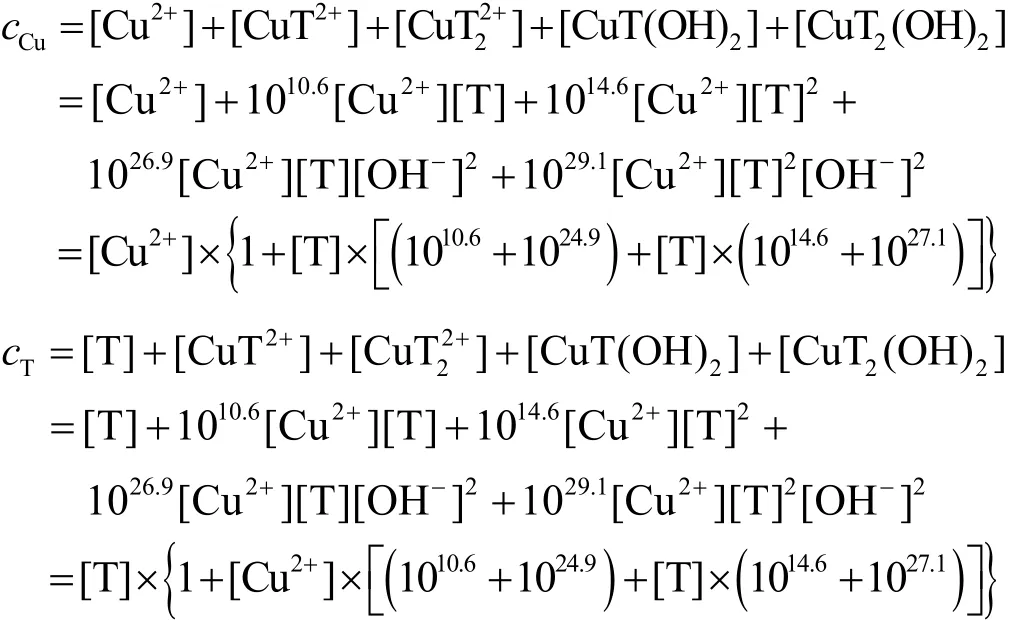
由这2个方程确定各种配合物浓度的方法繁琐,而采用以下循环迭代法则很容易确定配合物存在的主要形式:
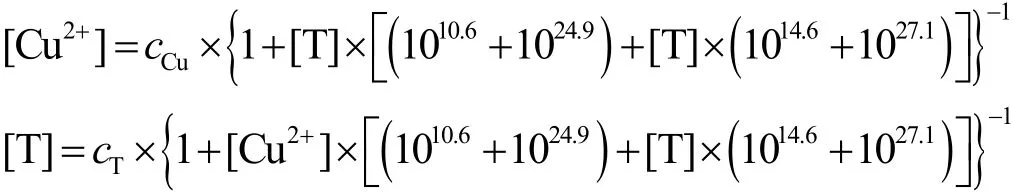
将cCu= 0.05 mol/L、cT= 0.06 mol/L代入循环迭代法方程,并取初始值 [Cu2+]0= 7.5 × 10−25mol/L、[T]0= 0.005 mol/L代入方程式右边,算出 [Cu2+]1、[T]1,再将其代入方程式右边,算出 [Cu2+]2、[T]2。如此类推,8次循环迭代后,得 [Cu2+]= 7.837 8 × 10−25mol/L、[T]= 0.004 792 mol/L,相对误差小于0.05%。各种配合物浓度计算如下:

以上计算结果表明,镀液中 CuT(OH)2的浓度最大,其次是CuT2(OH)2,这两种配合物的浓度分别占总Cu(II)浓度的56%和42%。
3. 2 Cu(II)的阴极还原
pH为13.0时,首先对含20 g/L THPED和5 mol/L KCl的溶液进行循环伏安曲线测量(扫速10 mV/s),然后在上述基础液中加入15 g/L CuSO4·5H2O,再测试循环伏安曲线(扫速10 mV/s),所得曲线分别如图1a和1b所示。
由图1a可知,阴极扫描至电位−1.3 V左右时,电极表面析氢,电流急升,在−0.4 V至−1.3 V之间无电流峰出现;阳极扫描时亦无电流峰出现。
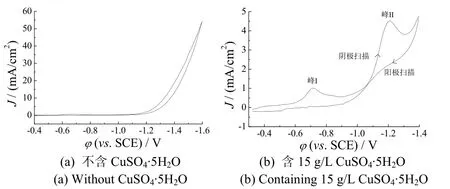
图1 20 g/L THPED + 5 mol/L KCl的溶液中添加15 g/L CuSO4·5H2O前后的循环伏安曲线Figure 1 Cyclic voltammograms for the solution containing 20 g/L THPED and 5 mol/L KCl before and after adding 15 g/L CuSO4·5H2O
由图 1b可知,阴极扫描至电位−0.7 V(峰 I)和−1.2 V(峰II)左右时出现2个电流峰。与图1a比较可知,这两个还原峰是由Cu(II)阴极还原所造成的;在阳极扫描至−0.3 V时,阳极分支上没有出现与峰I和峰II相对应的氧化峰。
循环伏安曲线出现 2个不可逆反应峰的可能原因有:(1)Cu(II)离子的分步放电还原;(2)Cu(II)离子的2种主要配合物分别进行放电还原。
上述 2种情况可通过改变电位扫描条件后的伏安曲线变化进行区分。在扫速30 mV/s条件下,分别对峰I和峰II进行扫描,其结果如图2所示。

图2 图1b中峰I和峰II的循环伏安曲线Figure 2 Cyclic voltammograms of peak I and II in Figure 1b
从图2a可知,提高扫速后,峰I的阳极分支上仍无对应的氧化峰出现。从图2b可知,以−1.1 V为开路电位对峰II进行扫描,在电位−1.2 V左右出现1个还原峰,其图形与图1b阴极分支后半部分相同;阳极扫描时亦无对应的氧化峰出现。由此可见,峰 I和峰 II均代表独立的完全不可逆反应。
以不同的扫速对峰I和峰II进行扫描,其结果如图3所示。由图3可知,峰I和峰II的峰电位与扫速有关──扫速提高,阴极峰电位负移。M. Paunovic认为在化学镀铜反应中有类似曲线的过程是伴随有前置化学转化反应的不可逆电极过程[11]。因此,循环伏安曲线上两个反应峰处应对应两个独立的并伴随有前置化学转化反应的不可逆电化学反应。

图3 扫速对循环伏安曲线阴极分支的影响Figure 3 Effect of scan rate on cathodic branch of cyclic voltammogram
由于镀液中CuT(OH)2和CuT2(OH)2的浓度最大,因此峰I和峰II对应的Cu(II)阴极还原不可逆总反应为:

4 结论
(1) 以THPED为配位剂的化学镀铜溶液中,Cu(II)形成的配合物主要是CuT(OH)2和CuT2(OH)2,其浓度分别占总Cu(II)浓度的56%和42%。
(2) 在以 THPED为配位剂的化学镀铜溶液中,Cu(II)在电位−0.7 V和−1.2 V左右(均相对于SCE)分别发生的不可逆电化学反应为:

[1] GUTZEIT G. An outline of the chemistry involved in the process of catalytic nickel deposition from aqueous solution—Part I [J]. Plating, 1959, 46 (10): 1158-1164.
[2] GUTZEIT G. An outline of the chemistry involved in the process of catalytic nickel deposition from aqueous solution—Part II [J]. Plating, 1959, 46 (11): 1275-1278.
[3] BRENNER A, RIDDELL G E. Nickel plating on steel by chemical reduction [J]. Journal of Research of the National Bureau of Standards, 1946, 37: 31-34.
[4] PINKERTON H L, SMITH J W. PR copper cyanide plating of printed wiring boards [J]. Plating, 1972, 59: 672-676.
[5] LUKES R M. The chemistry of the autocatalytic reduction of copper by alkaline formaldehyde [J]. Plating, 1964, 51: 1066-1068.
[6] SALVAGO G, CAVALLOTTI P L. Characteristics of the chemical reduction of nickel alloys with hypophosphite [J]. Plating, 1972, 59 (7): 665-671.
[7] 李宁. 化学镀实用技术[M]. 北京: 化学工业出版社, 2004.
[8] VAN DE MEERAKKER J E A M. On the mechanism of electroless plating—Oxidation of formaldehyde at different electrode surfaces [J]. Journal of Applied Electrochemistry, 1981, 11 (3): 387-393.
[9] NORKUS E, VAŠKELIS A, ŽAKAITÉ I, et al. Polarographic investigation of Cu(II) complexes with N,N,N′,N′–tetrakis(2-hydroxypropyl)ethylenediamine [J]. Talanta, 1995, 42 (11): 1701-1705.
[10] PERRIN D D. Stability Constants of Metal-Ion Complexes—Part B: Organic Ligand [M]. Oxford: Pergamon Press, 1979.
[11] PAUNOVIC M. Ligand effects in electroless copper deposition [J]. Journal of the Electrochemical Society, 1977, 124 (3): 349-354.
[ 编辑:温靖邦 ]
Existing forms of Cu(II) and its cathodic reduction in THPED electroless copper plating bath //
ZOU Wei-hong*, ZHENG Ya-jie
The main existing form of Cu(II) in an electroless copper plating bath with N, N, N’, N’–tetrakis (2-hydroxypropyl)ethylenediamine (THPED) as complexing agent and the cathodic reduction reaction of Cu(II) were studied by cyclic iterative method and cyclic voltammetry, respectively. The results showed that the main complexes in the bath are CuT(OH)2and CuT2(OH)2, and their concentrations are 56% and 42% respectively of the total Cu(II) amount. The irreversible electrochemical reduction of CuT(OH)2and CuT2(OH)2occurring respectively at −0.7 V and −1.2 V (versus saturated calomel electrode) can be expressed as follows: CuT(OH)2+ 2e−→Cu + T + 2OH−and CuT2(OH)2+ 2e−→ Cu + 2T + 2OH−.
electroless copper plating; N, N, N’, N’-tetrakis (2-hydroxypropyl)ethylenediamine; copper(II); complex; cathodic reduction; cyclic voltammetry
Guangzhou Etsing Plating Research Institute, Guangzhou 510663, China
TQ153.14; O646.541
A
1004 – 227X (2010) 02 – 0030 – 03
2009–03–10
2009–06–12
邹伟红(1980–),女,新疆喀什人,硕士,电镀工程师,从事金属及非金属电镀添加剂研究。
作者联系方式:(E-mail) zou_mail@sina.com,(Tel) 020–61302521。

