预处理方式对酶修饰大豆分离蛋白水解程度的影响
齐莲子,迟玉杰
(1.东北农业大学食品科学学院,黑龙江哈尔滨150030;2.大豆生物学教育部重点实验室,黑龙江哈尔滨150030)
预处理方式对酶修饰大豆分离蛋白水解程度的影响
齐莲子1,迟玉杰2,*
(1.东北农业大学食品科学学院,黑龙江哈尔滨150030;2.大豆生物学教育部重点实验室,黑龙江哈尔滨150030)
研究微波辐照、加热处理、高速剪切三种预处理方式对大豆分离蛋白酶修饰产物水解程度的影响。以水解度、溶解性为指标进行综合评价,揭示水解度与溶解性的关系。结果显示,与空白对照相比较,三种预处理方式均能提高酶修饰产物的水解度和溶解性,溶解性随水解度的增加而增加。在底物浓度10%,温度50℃,酶添加量0.50%条件下,水解度分别提高了2.43倍、2.87倍和3.19倍,蛋白粉溶解性提高了1.65倍、1.76倍、2.23倍。其中,高速剪切预处理对大豆分离蛋白酶修饰水解度和溶解性增加尤为显著。与传统酶修饰方法相比,本实验将酶修饰时间由4.5h缩减至2.0h,提高了反应效率。
大豆分离蛋白,水解度,微波辐照,加热处理,高速剪切
大豆分离蛋白(SPI)具有溶解性、乳化性、凝胶性等多种功能特性,广泛应用于食品中[1]。蛋白质强化酸性饮料因口感独特和营养丰富逐渐被人们所青睐,其pH在4.0~5.0[2]范围内,而在此pH范围内SPI溶解性差,限制了其添加量和使用范围,因此需有针对性地提高SPI在此范围内的溶解性,拓宽其应用。酶修饰作用条件温和,专一性强,产品安全性高,通过部分降解蛋白质增加其分子内或分子间交联或连接特殊功能基因,改变其功能性质[3]。许多学者[4-7]利用蛋白酶对大豆蛋白进行修饰,并对提高其溶解性进行了探讨。B.P.Lamsal[8]等利用菠萝蛋白酶对SPI进行修饰,水解度(DH)为4%时,pH4.0条件下的溶解性近40%。但以上研究中,大多在较长水解周期、较高酶添加量条件下,利用预热处理对较低底物浓度的大豆蛋白进行酶修饰,最终溶解性有所提高。而针对高底物浓度、低酶添加量对SPI进行酶修饰,研究酶修饰SPI在等电点处溶解性的报道比较少。原因可能在于:10%(W/V)含量的SPI溶液经加热会凝固产生凝胶化现象[2],高黏度底物对酶产生抑制及失活作用而引起酶活力下降,导致反应速率下降[9]。为解决传统酶修饰方法时间长、成本高、得率低的问题。实验以DH为指标,分别采用微波辐照、加热处理、高速剪切对高浓度SPI进行酶修饰预处理,比较三种方法对酶修饰产物的影响,筛选出适宜的预处理方法及参数,使高浓度SPI在较短时间的酶修饰作用下提高DH,以增加其等电点处的溶解性。
1 材料与方法
1.1 材料与设备
大豆分离蛋白 哈高科大豆食品有限责任公司,蛋白质87.11%、脂肪1.98%、水分5.84%、灰分4.95%;风味蛋白酶 丹麦NOVO公司,酶活力5.0×104U/g;果糖、水合茚三酮等 均为分析纯。
BÜCHI B-290型喷雾干燥机 瑞士 BÜCHI Spray Dryer公司;HR-7103EI微波炉 青岛海尔集团;JJ-2B高速组织捣碎机 江苏省金坛市容华仪器制造有限公司;LD4-2A离心机 北京医用离心机厂;H722可见分光光度计 天津市普瑞斯仪器有限公司;HYP-Ⅱ型消化炉与凯氏定氮仪 上海纤检仪器有限公司;pHS-3C型酸度计 上海精密仪器有限公司。
1.2 实验方法
1.2.1 大豆分离蛋白组分含量的测定 蛋白质含量测定采用(GB/T 5511-2003);水分含量测定采用(GB/T 5479-85);脂肪含量测定采用(GB/T 5009.6 -2003);灰分含量测定采用(GB/T 14770-1993)。1.2.2 蛋白酶活力的测定 福林酚法(QB/T 1803-1993)。
1.2.3 水解度(DH)的测定 采用茚三酮比色法[10]。
1.2.4 溶解性的测定 准确称取100mg样品,加入15mL蒸馏水,用0.1mol/L HCl调节pH4.5,室温下磁力搅拌30min,离心(4000r/min,30min)。凯氏定氮法测定该pH条件下离心后上清液中蛋白质含量及总的蛋白含量[11]。
溶解性(%)=(离心后上清液中蛋白含量/总蛋白含量)×100%
1.2.5 蛋白质含量测定 采用凯氏定氮法(GB5009.5-2003)。
1.2.6 微波辐照预处理 在不同微波功率、辐照时间条件下,对10%(W/V)的SPI溶液进行预处理,其它酶修饰参数同1.2.9。考察微波功率、辐照时间对0.5~2.0h内酶修饰产物DH的影响。
1.2.7 加热预处理 在不同加热温度、时间条件下,对10%(W/V)的SPI溶液进行预处理,其它酶修饰参数同1.2.9。考察加热温度、加热时间对0.5~2.0h内酶修饰产物DH的影响。
1.2.8 高速剪切预处理 在不同转数、时间条件下,对10%(W/V)的SPI溶液进行预处理,其它酶修饰参数同1.2.9。考察高速剪切转数、时间对0.5~2.0h内酶修饰产物DH的影响。
1.2.9 酶修饰产物的制备 配制10%(W/V)的SPI溶液,置于酶反应器中,添加0.50%风味蛋白酶,维持反应pH 7.0、温度50℃恒定,每隔0.5h取样,于90℃、15min钝化蛋白酶,测定DH。经喷雾干燥得到酶修饰SPI。
1.2.10 统计分析 DH及溶解性平行测定三次,采用SAS 8.1软件进行数据处理。
2 结果与分析
2.1 微波辐照辅助酶修饰的研究
2.1.1 微波辐照预处理功率对酶修饰的影响 有研究证实,微波辐照可加速蛋白水解进程[12]。由图1可知,辐照功率对酶修饰有显著影响,修饰产物的DH随辐照功率增加明显升高(空白对照的DH仅为1.29%)。在辐照功率为420W,水解时间为2.0h时,样品的DH达最大值3.14%。
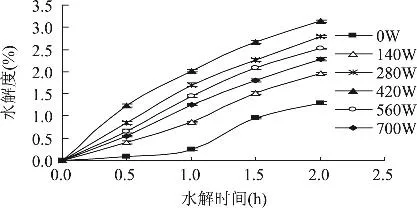
图1 功率参数对SPI酶修饰的影响
样品在微波作用下有一个加温和水分扩散的过程。蛋白质和作为极性分子的水在高频率、强电场强度的微波场中可被极化,随微波场极性的迅速改变,蛋白质及水等极性分子的电性质发生变化,将微波能转换成热能,从而使自身温度升高,引起蛋白质变性[13]。提高辐照功率能促使二硫键(S-S)断裂成为巯基(-SH),防止蛋白分子间的聚集作用,但功率过高又会促进S-S的形成,同时过度变性导致蛋白分子之间的聚集作用增强,酶修饰不完全,DH降低。2.1.2 微波辐照预处理时间对酶修饰的影响 由图2所示,在相同的水解时间条件下,DH随辐照时间的延长而缓慢增加。在水解时间2.0h,辐照时间为2min时,样品DH达最大值3.14%;随后DH下降,辐照时间为5min时,DH仅为2.44%。
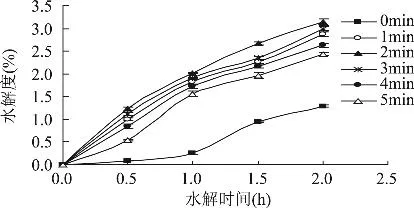
图2 时间参数对SPI酶修饰的影响
在微波的作用下,蛋白质变性后暴露出更多的酶作用位点,从而加速酶解反应,但辐照时间过长,则会引起分子间频繁碰撞而产生大量的摩擦热,样品因微波热效应引起过度变性而凝聚,使蛋白酶无法与其作用位点结合[14]。
2.2 加热辅助酶修饰的研究
2.2.1 加热预处理温度对酶修饰的影响 温度对SPI酶修饰的影响如图3所示,随温度的升高DH增大,当温度为90℃时,样品的DH达最大值3.12%。温度达100℃时,DH又有所下降。

图3 温度参数对SPI酶修饰的影响
Shigeru Utsumi等[15]研究表明,SPI的 11S在70℃下开始解离,在90℃时完全解离,7S在75℃时开始解离,亚基的解离使得立体结构变得松驰。因此,经90℃处理后,SPI四级结构遭到破坏,原来处于分子内部的水解位点暴露出来,有利于酶与SPI结合;温度继续上升会使SPI结构破坏过度,解离出来的亚基将重新结合成新的四级结构,降低水解速率[16]。
2.2.2 加热预处理时间对酶修饰的影响 由图4所示,90℃水浴预处理15min,水解效果最好,DH可达3.70%。随后,加热时间延长,DH反而下降,加热25min时,酶解物在2.0h时DH仅为2.02%。

图4 时间参数对SPI酶修饰的影响
Lydia J Campbell等[17]研究表明,热变性程度和-SH变化有内在关系,适度热变性使SPI分子中的-SH完全暴露出来。然而加热时间过长,使原来存在于可溶性蛋白的部分-SH随不溶性蛋白增加而逐渐减少,在较高的蛋白浓度下,11S的碱性亚基(通过S-S)和7S的β亚基(通过次级键)进一步聚合,形成的不溶性聚合多肽不利于酶的修饰,从而导致DH降低[18]。
2.3 高速剪切辅助酶修饰的研究
2.3.1 高速剪切预处理转数对酶修饰的影响 由图5可知,高速剪切转数的大小对DH有显著的影响。随转数的增加,酶修饰产物的DH呈先上升后降低的趋势。当转数在6000r/min时,酶修饰产物的DH增加趋势最明显,水解2.0h时样品的DH达最大值3.60%。

图5 转数参数对SPI酶修饰的影响
对样品进行高速剪切处理,物料受到强烈剪切、高速撞击、剧烈振荡等动力作用,使蛋白质分子结构伸展,内部的极性基团和疏水基团暴露出来-SH使酶与SPI充分接触,因此DH增加。同时高速剪切处理使蛋白质聚集体产生不可逆的裂解,SPI的粒径变小,增加了反应接触面,加快酶修饰速率。但剪切转数过大,使剪切稀释作用过强,导致蛋白质分子的表观直径减少,不利于酶修饰的进行。
2.3.2 高速剪切预处理时间对酶修饰的影响 由图6所示,酶修饰产物的DH随剪切时间的增长,呈先上升后降低的趋势,当酶修饰时间在2.0h,剪切时间为4min时,DH达最大值4.12%;剪切时间达5min时,样品DH降至3.02%。
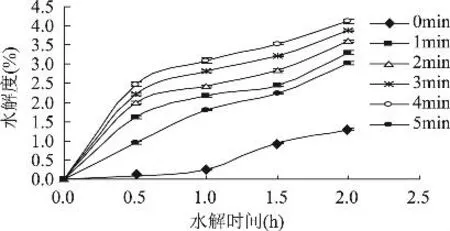
图6 时间参数对SPI酶修饰的影响
研究表明,高速剪切时间过长,使样品在分流、撞击、剪切等一系列作用下产生的机械能转化为不可逆热能,从而导致温度升高,蛋白过度变性,形成不溶聚合体,不利于酶修饰的进行[19]。
2.4 预处理辅助酶修饰之间的比较
在本实验条件下,采用三种方法辅助风味蛋白酶对SPI进行酶修饰,得出适宜的微波辐照功率与时间、加热温度与时间、高速剪切转数与时间等酶修饰的预处理条件,研究了在这些适宜条件下酶修饰物DH的变化,将其与空白对照样进行比较。
由图7可知,通过三种处理辅助SPI酶修饰,在相同水解条件下,酶修饰时间0.5~2.0h内DH均有不同程度的提高,其中,高速剪切处理辅助酶解物DH提高最显著。说明通过高速剪切辅助SPI进行酶修饰,在短时间内提高DH,并提高其溶解性,具有一定的可行性。高浓度SPI溶液在高速剪切过程中,剧烈的处理条件如液体高速撞击、高剪切、空穴爆炸、高速振荡等作用可能会导致大分子结构的改变[20]。
2.5 DH对溶解性的影响
溶解性与DH呈正相关[4],本实验对SPI在等电点(pH4.5)处溶解性和DH的关系进行了研究。

图7 DH对照实验
由图8所示,经酶预处理修饰的SPI溶解性与空白对照相比有显著提高。在低DH范围内,溶解性随DH的增加明显上升。可能的原因在于:SPI经预处理后,蛋白质分子的表面电荷加强,使溶解性增强。SPI经风味蛋白酶作用后断裂成小分子肽,使得-NH2和-COOH的数目增多,分子极性增加,分子间排斥作用增加,从而使溶解性增加[21]。当 DH为4.12%时,在等电点处,酶修饰SPI的溶解性可达到45.96%,提高了2.23倍。

图8 DH对大豆分离蛋白溶解性的影响
2.6 预处理辅助酶修饰的结果比较
由表1可以看出,与空白对照相比,采用高速剪切处理辅助酶修饰,将改性时间由原来的4.5h减少到了2.0h,DH基本一致,且经高速剪切处理辅助酶修饰作用使SPI溶解性有提高。该预处理方式缩短了酶修饰时间,提高了反应效率。

表1 酶修饰结果的比较
3 结论
3.1 实验表明:在相同酶修饰条件下,三种预处理方式均能提高酶修饰产物的水解度和溶解性,溶解性随水解度的增加而增加。水解度分别提高了2.43倍、2.87倍和3.19倍,蛋白粉溶解性提高了1.65倍、1.76倍、2.23倍。
3.2 高速剪切预处理对大豆分离蛋白酶修饰水解度和溶解性增加尤为显著,确定了高速剪切辅助酶修饰参数:剪切时间4min、转数为6000r/min、SPI底物浓度10%,酶添加量0.50%。随DH的增加,辅助酶修饰SPI粉在其等电点处的溶解性得到了显著的改善,为扩大其应用范围提供了条件。
3.3 高速剪切预处理可以加速酶修饰反应,缩短反应时间,提高效率。
[1]Qi M,Hettiarachchy N S,Kalapathy U.Solubility and emulsifyingproperties ofsoy protein isolates modified by pancreatin[J].Food Science,1997,62(6):110-115.
[2]迟玉杰,朱秀清,李文滨,等.大豆蛋白质加工新技术[M].北京:科学出版社,2007:195.
[3]Adler-Nissen.Enzymatic hydrolysis of proteins for increased solubility[J].Food Chemistry,1976,24(6):1090-1093.
[4]Allaoua A,Wang Z,Xu S Y.Enzymatic hydrolysis of soy protein isolate and effect of succinylation on the functional properties of resulting protein hydrolysates[J].Food Research International,1998,31(9):617-623.
[5]Kim S K,Park P S,et al.Functional properties of proteolytic enzyme modified soy protein isolate[J].Agricultural and Food Chemistry,1990,38(3):651-656.
[6]Calderon-de-la B A M,Ruiz-Salazar,et al.Enzymatic hydrolysis and synthesis of soy protein to improve its amino acid composition and functional properties[J].Food Science,2000,65(2):246-253.
[7] HrckovaM,RusnakoVaM,ZemanoVicJ.Enzymatic hydrolysis of defatted soy flour by three different proteases and their effect on the functional properties of resulting protein hydrolysates[J].Food Science,2002,20(1):7-14.
[8]Lamsal B P,Jung S,L A.Rheological properties of soy protein hydrolysates obtained from limited enzymatic hydrolysis[J].Food Science and Technology,2007,40(7):1215-1223.
[9]刘粼.大豆分离蛋白酶法有限水解过程动力学研究[J].中国粮油学报,2000,15(6):11-13.
[10]赵新淮,冯志彪.大豆蛋白水解物水解度测定研究[J].东北农业大学学报,1995,26(2):178-181.
[11]Ponnampalam R,Goulet G,Amiot J,et al.Some functional and nutritional properties of oat flours as affected by proteolysis[J].Journal of Agriculture and Food Chemistry,1987,35:279-285.
[12]Chen S T,Chiou S H,Chu Y H,et al.Rapid hydrolysis of proteins and peptides by means of microwave technology and its application to amino acid analysis[J].International Journal of Peptide and Protein Research,1987,30(4):572-576.
[13]Ohlsson T,Bengtsson N.Microwave technology and foods[J].Advances in Food and Nutrition Research,2001,43:65-140.
[14]崔蕊静.微波辅助处理在豆奶酶解技术中的应用研究[J].中国粮油学报,2007,22(4):54-57.
[15]Shigeru U.Heat induced interactions between soybean proteins preferentialassociation of 11S basicsubunitsand subunits of 7S[J].Agric Food Chemistry,1984,32(6):1406-1412.
[16]豆康宁,黄纪念,郑学玲.热处理对大豆蛋白酶解的影响[J].食品工业科技,2007,28(3):76-81.
[17]Lydia J Campbell,Gu,X Susan J,et al.Effects of heat treatment and glucono-δ-lactone-induced acidification on characteristics of soy protein isolate[J].Food Hydrocolloids,2009,23(2):344-351.
[18]班玉凤,朱海峰,关纳新.热处理对大豆蛋白水解物的影响[J].食品工业科技,2005,26(3):63-65.
[19]Tang C H,Ma C Y.Effect of high pressure treatment on aggregation and structural properties of soy protein isolate[J]. Food Science and Technology,2009,42(2):606-611.
[20]Molina E,Papadopoulou A,Ledward D A.Emusifying properties of high pressure treated soy protein isolate and 7s and 11s globulins[J].Food Hydrocolloids,2001,15(3):263-269.
[21]Marianne Hammersh.Enzymatic hydrolysis of ovomucin and effect on foaming properties[J].Food Research International,2008,41(5):522-531.
Effect of pretreatments on the degree of hydrolysis of hydrolyzed soy protein isolate
QI Lian-zi1,CHI Yu-jie2,*
(1.College of Food Science,Northeast Agricultural University,Harbin 150030,China;2.Administration of Education Key Laboratory of Soybean Biology,Harbin 150030,China)
With the aim to determine the effect of microwave irradiation,heating and high-speed shearing on soy protein isolate,which have undergone protease hydrolysis.The degree of hydrolysis and solubility were evaluated to reveal the connection between them.Results showed that the solubility of soy protein isolate was improved with the degree of hydrolysis enhancement,which was increased by pretreatments.Hydrolysates were prepared at 50℃,depending on the concentration of flavourzyme at 0.5%and the protein concentration in solution at 10%.lt demonstrated that the degree of hydrolysis and solubility increased most significantly by high-speed-assisted hydrolysis.Degree of hydrolysis and solubility were increased by 2.43,2.87,3.19 and 1.65,1.76,2.23 times compared with the native protein respectively.Compared with the single hydrolysis reactions,the hydrolysis time by high-speed shearing-assisted technology was shortened from 4.5h to 2.0h.lt can be concluded that high-speed shearing can be used as an efficient method to improve the degree of hydrolysis and the DH and solubility of soy protein isolate.
soy protein isolate;degree of hydrolysis;microwave irradiation;heating treatment;high-speed shearing
TS201.2+1
A
1002-0306(2010)12-0156-04
2010-01-28 *通讯联系人
齐莲子(1983-),女,硕士,研究方向:食品化学。
教育部博士点基金(20070224001);黑龙江省自然科学重点基金项目(ZD200902)。

