Cu掺杂TiO2及其纳米管的制备、表征与光催化性能
王泽高 郑树楠 贾春阳*, 延 卫*,
(1电子科技大学电子薄膜与集成器件国家重点实验室,微电子与固体电子学院,成都 610054)(2西安交通大学动力工程多相流国家重点实验室,西安 710049)
Cu掺杂TiO2及其纳米管的制备、表征与光催化性能
王泽高1郑树楠2贾春阳*,1延 卫*,2
(1电子科技大学电子薄膜与集成器件国家重点实验室,微电子与固体电子学院,成都 610054)(2西安交通大学动力工程多相流国家重点实验室,西安 710049)
通过溶胶-凝胶法和水热法制备了Cu掺杂TiO2纳米粉末及其纳米管,并通过XRD、TEM、FE-SEM、EDS、UV-Vis/DRS等手段分析了样品的结构。发现以Cu掺杂TiO2纳米粉末为水热反应原料制备的纳米管中不含Cu,对其原因进行了分析讨论并通过Zn掺杂TiO2纳米粉末证实:以金属掺杂TiO2纳米粉末为原料,通过水热法制备TiO2纳米管中不含有相应金属离子,这是由于金属离子在强碱水热条件下形成金属配离子,使金属离子溶解于水中而不能形成金属掺杂TiO2纳米管。对所得样品进行了光催化性能测试,发现:Cu掺杂TiO2粉末的光催化产氢效率为0.75 μmol·(g·h)-1,高于由其本身及P25通过水热法制备的TiO2纳米管(分别为:0.42 μmol·(g·h)-1,0.25 μmol·(g·h)-1)的光催化产氢效率。
二氧化钛;掺杂;纳米管;光催化
TiO2作为一种稳定的光催化剂,其催化活性主要受制于光生电子-空穴对数及其寿命。研究发现,掺杂金属离子不但可以有效降低TiO2的禁带宽度,提高光生电子-空穴对数;而且掺杂金属在TiO2表面可以形成相应氧化物空间电荷层促进光生电子-空穴对的有效分离,提高TiO2光催化效率[1-3]。1998年 Tomoko Kasuga等[4]通过水热法制备TiO2纳米管,引起了人们广泛的兴趣。Peng等[5]发现TiO2纳米管的比表面积比粉末的大,有利于提高TiO2的光催化性能。其间一些新的TiO2纳米管的制备方法被陆续报道,如模板法[6-8],阳极氧化法[9-10]以及水热法[11-12]。 最近,Li等[13]将 Cu(NH2CH2CH2NH2)2(OH)2与水热制备的TiO2纳米管表面羟基(-OH)成键制备了Cu掺杂的TiO2纳米管,发现这些金属掺杂TiO2纳米管的光电性能均有明显提高。
尽管许多学者制备了金属离子掺杂TiO2粉末及金属离子表面修饰TiO2纳米管,并对其光催化性能进行了研究。但利用金属离子掺杂TiO2纳米粉末为原料,进而制备金属离子掺杂TiO2纳米管的研究报道还未见到。本工作通过溶胶-凝胶法制备了Cu掺杂TiO2纳米粉末,进一步利用该粉末在水热法的条件下制备了TiO2纳米管。通过XRD、TEM、FESEM、EDS、UV-Vis/DRS分析了掺杂纳米粉末及纳米管的结构特性,并进一步研究了其光催化活性。
1 实验部分
1.1 原 料
钛酸丁酯(成都方舟化学试剂厂,C.P.)﹑硝酸铜(天津市津北精细化工有限公司,A.R.)﹑氢氧化钠(天津市瑞金特化学品有限公司,A.R.)﹑无水乙醇(成都方舟化学试剂厂,A.R.)、硝酸(成都欣海兴化工试剂厂,A.R.),P25 二氧化钛样品购自 Acros Organics。 以上药品使用前没有经过再次提纯。
1.2 实 验
5.0 mL钛酸丁酯溶于20.0 mL无水乙醇得到溶液 A。 将 27.8 mg Cu(NO3)2粉末溶解在 10.0 mL 蒸馏水、10.0 mL 乙醇和 2.0 mL 浓硝酸的混合溶液中,搅拌1 h后,将A溶液慢速滴入其中,快速搅拌,形成溶胶。将溶胶陈化24 h,于100℃下烘干,600℃下烧结3 h,得到Cu掺杂TiO2粉末S0。
取 100.0 mg S0 粉 末 投 入 装 有 35.0 mL,10.0 mol·L-1NaOH 溶液的高压釜(容积为 50 mL)中。将高压釜于150℃下保温48 h,过滤,经0.1 mol·L-1的HCl清洗至酸性,用蒸馏水洗至中性,得到纳米管S1。再将其在90℃下烘干,450℃下烧结2 h,得到纳米管S2。同样利用水热法以商业P25为原料,通过相同实验条件制备纯TiO2纳米管NT,以备比较使用。
1.3 测试方法
光催化产氢实验是在自制的内置式石英玻璃反应器中进行的。 用 0.1 mol·L-1Na2S,0.04 mol·L-1Na2SO3复合体系为牺牲剂,300 W准直高压汞灯为内置式光源,50.0 mL 去离子水,50.0 mg 催化剂。 整个反应体系温度用冷却水循环泵控制为30±0.2℃,开灯反应之前通入N220 min排除体系中的氧气,用排水法收集气体,HP 6890 GC进行分析得到产氢量 (色谱柱为兰州化物所产C-2000型石英毛细管柱, 规格(0.53 mm×20 μm×25 m), 进样口温度100℃、手工进样,每次进样量为100 μL,不分流,热导(TCD)检测,检测温度150℃、柱箱温度为40℃恒温、N2做载气,流速 4.5 mL·min-1)。
本实验中使用XPert Pra MPD X型XRD衍射仪测定实验样品的XRD图,以此来分析样品的晶型(激发光源为 Cu Kα(λ=0.154 06 nm),靶电压 40 kV,电流40 mA,连续扫描方式,扫描范围为2θ=20°~65°,入射光发散狭缝为1/2度,未使用平行光单色器,无衍射光路防反射狭缝,接收狭缝为0.3 mm,使用位敏探测器);通过日本电子JEM-100XCII型(80 kV加速电压)透射电子显微镜来分析纳米管的形貌;通过FEI-INSPECT F型场发射电镜来分析烧结后的纳米管形貌;通过JEOL型EDS分析样品中掺杂含量(20 kV);通过日本岛津UV-2100型紫外光谱仪来分析S0、S2和NT样品的紫外可见光吸收特性。
2 结果与讨论
2.1 XRD分析
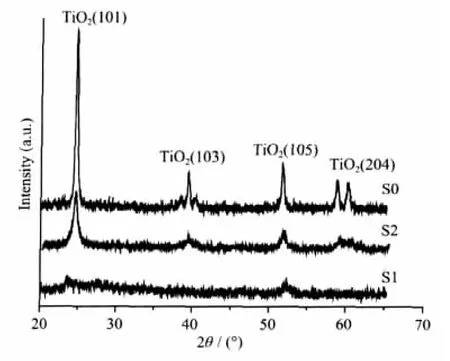
图1 样品S0、S1、S2的XRD图Fig.1 XRD patterns of S0,S1 and S2
图1为样品的XRD图与TiO2标准图(PDF 21-1276)比对,发现600℃下烧结制备的S0样品粉末为锐钛矿型,这一结果说明掺入Cu2+使TiO2由锐钛矿相转变为金红石相的转变温度升高。通过Scherrer公式计算得到Cu掺杂TiO2粉末粒径大小约40 nm。从图中可见S1没有明显峰位,属于无定型结构。这是由于在强碱条件下,TiO2纳米粉末发生片状脱落,经卷曲形成纳米管。在卷曲过程中,二氧化钛原子堆积方式发生变化,形成了无定型结构。而S2具有明显的XRD衍射峰,该纳米管由烧结前的无定型结构转变为锐钛矿结构。
2.2 TEM及FE-SEM分析
图2是以S0为原料通过水热法制备的S1样品的透射电镜(TEM)图像。从图中可见,S1样品的形貌是中空管状,而非实心纳米线,其外径约10 nm,长度约300 nm,管壁较薄,纳米管长度及外径分布较均匀。图3是S2样品的场发射扫描电镜(FE-SEM)照片,由图可见S2样品的形貌多为管状,其直径在10 nm左右,同时纳米管团聚现象比较严重,管子的弯曲度较大。与烧结前S1样品的形貌有较大差别,这可能是由于烧结过程中高温条件下纳米管团聚所致。

图2 样品S1的TEM图Fig.2 TEM image of S1

图3 样品S2的FE-SEM图Fig.3 FE-SEM image of S2
2.3 EDS分析及相应TiO2纳米管成管机理
由样品S0的EDS能谱分析可以看出样品S0中含有掺杂Cu元素。 而样品S2不含有Cu元素,即在水热法生长TiO2纳米管的过程中导致了TiO2中Cu元素的丢失。这可能是由于在Cu掺杂TiO2纳米粉末中,Cu元素以氧化物形式存在于TiO2中,在高温高压及强碱条件下使TiO2中的CuO溶解于NaOH强碱中,生成了Cu(OH)42-离子。该过程可能的机理如图4所示:
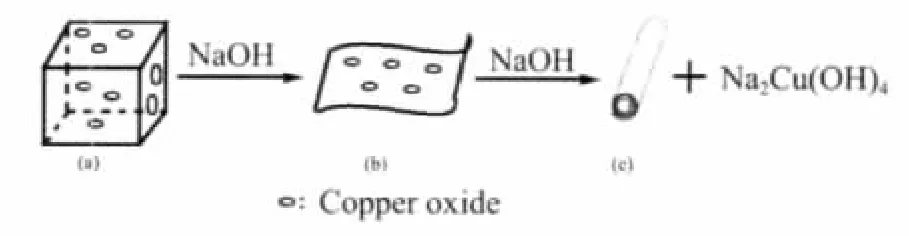
图4 水热法制备样品S1反应机理Fig.4 Growth mechanism of S1 by hydrothermal method
为了检验Cu(OH)42-离子的存在,向水热反应后的滤液中加入葡萄糖溶液,其颜色由蓝色变为砖红色(Cu2O)(菲林反应),如图5所示:

图5 (A)水热处理Cu掺杂TiO2滤液(浅蓝色);(B)在滤液A中加入葡萄糖后溶液(由原来的浅蓝色变为砖红色)Fig.5 (A)The filtrate of Cu doped TiO2powder treated by hydrothermal method(B)The solution of A reacted with glucose
为证实CuO在水热条件下能够溶于强碱NaOH溶液中,取100 mg CuO(水热处理的Cu掺杂TiO2粉末中含有1 mg CuO)在相同水热条件进行反应,反应后过滤得蓝色溶液。向该蓝色溶液中加入葡萄糖(C6H12O6)溶液,产生砖红色沉淀(Cu2O)。该试验结果说明水热处理CuO后的确可以产生Cu(OH)42-离子。
为了进一步证实以金属离子掺杂TiO2粉末为原料,通过水热法得不到相应的金属离子掺杂TiO2纳米管,利用同样的溶胶-凝胶法制备了1wt%Zn掺杂TiO2纳米粉末,并在同样的条件下通过水热合成其纳米管。通过EDS分析发现,1wt%Zn掺杂TiO2纳米粉末中含有Zn元素,而对应的纳米管中不含有Zn元素。这是由于TiO2中掺入的Zn元素在强碱条件下形成了[Zn(OH)4]2-离子而丢失。该试验再次证实了利用掺杂金属元素的TiO2粉末制备相应金属离子掺杂纳米管是不可行的,同时也进一步证实图4中的水热法生长TiO2纳米管机理的合理性。
2.4 光学特性分析
图6为实验样品的紫外可见漫反射光谱。由图可见,样品NT,S0和S2的吸收阈值依次红移,样品NT及S2在可见光区的吸收率非常低,吸收强度基本相同,而样品S0在可见光区的吸收强度较高。Cu掺杂TiO2,将在其禁带间形成杂质能级,降低禁带宽度,提高了样品在光照时产生的光生电子数量。而样品S2低光吸收率可能是由于掺杂Cu元素未能进入TiO2纳米管,使其与样品NT基本相同,这与EDS分析结果相一致。

图6 样品NT、S0、S2 UV-Vis/DRS光谱Fig.6 UV-Vis/DRS spectra of NT,S0 and S2
2.5 光催化产氢测试
图7为3个样品光催化分解水制备氢气的实验结果。由图可见,NT样品的产氢效率最低为0.25 μmol·(g·h)-1,S2 样品的催化效率次之为 0.42 μmol·(g·h)-1,样品 S0 的产氢效率最高达到 0.75 μmol·(g·h)-1。 由以上结果可以看出在样品S0中,由于掺杂Cu2+半径(0.073 nm)与 Ti4+半径(0.068 nm)较接近,Cu2+离子进入TiO2晶格形成代位离子(CuTi”),以致在禁带中引入更多的弱束缚电子和杂质能级,有利于光电激发,增加光生电子-空穴对的数量进而提高了光催化性能。因此样品S0的光催化效率最高,而样品S2的催化产氢效率比样品NT的效率略高,这可能是因为在水热环境中,虽然大部分Cu脱离TiO2,还有极少量Cu存在于TiO2纳米管中的原因。此外,由图7可见3个样品的产氢速率相对稳定,没有随反应的进行而衰减,表明3个样品都有较好的光学稳定性。

图7 样品NT、S1、S2的光催化产氢曲线Fig.7 Curves of hydrogen production of NT,S1 and S2
[1]Feng L R,Lu S J,Qiu F L.Acta Chim.Sin.,2002,60(3):463-467
[2]Yang X,Wang Y H,Xu L L,et al.J.Phy.Chem.C,2008(30),112:11481-11489
[3]Zou X X,Li G D,Guo M Y,et al.Chem.Eur.J.,2008,14(35):11123-11131
[4]Kasuga T,Hitamatsu M,Hoson A.Langmuir,1998,14(12):3160~3163
[5]Hou L R,Yuan C Z,Peng Y.J.Hazardous Materials,2007,139(2):310-315
[6]Jiang W F,Ling Y H,Bai X D,et al.Rare Metal Mater.Eng.,2007,36(7):1178~1180
[7]Peng T Y,Hasegawa A,Qiu J R.Chem.Mater.,2003,15(10):2011~2016
[8]Kobayashi S,Hamaski N,Suzuki M.J.Am.Chem.Soc.,2002,124(23):6550~6551
[9]Maggie P,Karthik S.J.Phys.Chem.B,2006,110(33):16179~16184
[10]CHENG Wei(程 伟),XUJin-Ye(徐金叶),HUJing(胡 静),et al.Chin.J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(1):92-98
[11]Tian Z R,Voigt J A,Liu J.J.Am.Chem.Soc.,2003,125(41):12384-12385
[12]Nian J N,Teng H S.J.Phys.Chem.B,2006,110(9),4193-4198
[13]Li H B,Duan X C,Liu G C,et al.Mater.Res.Bull.,2008,43(8/9):1971-1981
Preparation,Structure Characterization and Photocatalytic Performance of Cu Doped TiO2Nanopowder and Its Corresponding Nanotube
WANG Ze-Gao1ZHENG Shu-Nan2JIA Chun-Yang*,1YAN Wei*,2
(1State Key Laboratory of Electronic Thin Films and Integrated Devices,School of Microelectronic and Solide-State Electronic,University of Electronic Science and Technology of China,Chendu 610054)(2State Key Laboratory of Multiphase Flow in Power Engineering,Xi′an Jiaotong University,Xi′an 710049)
The Cu doped TiO2nanopowder and its corresponding nanotube were prepared by sol-gel method and hydrothermal method,respectively.The samples were characterized by XRD,TEM,FE-SEM,EDS,UV-Vis/DRS.When the Cu doped TiO2nanopowder is used as starting material to prepare the corresponding nanotube by hydrothermal method,there is no Cu element in the nanotube.The mechanism for this result maybe due to the reaction of metal ions with strong alkali under the hydrothermal condition and further dissolution in water,so there is no metal ions doped into the nanotube.The result of Zn doped TiO2nanopower as starting material to make its corresponding nanotube under the same method also suggests the same mechanism.The photogenerating hydrogen speed of Cu doped TiO2nanopowder is the highest(0.75 μmol·(g·h)-1)compared with those of the nanotubes(0.42 μmol·(g·h)-1,0.25 μmol·(g·h)-1)from the Cu doped TiO2nanopowder and P25 nanopowder.
TiO2;doped;nanotube;photocatalytic
O614.121;O614.41+1
A
1001-4861(2010)05-0875-04
2009-10-26。收修改稿日期:2010-01-28。
国家自然基金(No.20602005,20873015),电子科技大学青年基金重点项目(No.JX0671),四川省科技厅科技支撑项目(No.2009FZ0230),国家大学生创新实验计划资助。
*通讯联系人。 E-mail:cyjia@uestc.edu.cn,yanwei@mail.xjtu.edu.cn
王泽高,男,24岁,在读硕士研究生;研究方向:电子材料与器件。

