以α型氢氧化物前驱体制备LiNi0.8Co0.15Al0.05O2及其电化学性能
陈勃涛
(南开大学新能源材料化学研究所,天津 300071)
以α型氢氧化物前驱体制备LiNi0.8Co0.15Al0.05O2及其电化学性能
陈勃涛
(南开大学新能源材料化学研究所,天津 300071)
本文采用球形Al/Co部分取代α型Ni(OH)2为前驱体成功制备了锂离子电池正极材料LiNi0.8Co0.15Al0.05O2。首先采用氢氧化钠与碳酸钠为沉淀剂合成出Al/Co部分取代α型Ni(OH)2,然后将之与LiOH·H2O混合,最后在氧气气氛中不同温度下热处理8 h,即可得到球形LiNi0.8Co0.15Al0.05O2材料。X射线衍射结果表明,LiNi0.8Co0.15Al0.05O2材料为α-NaFeO2相。扫描电镜结果表明,材料颗粒形貌为球形。热重分析结果表明合成LiNi0.8Co0.15Al0.05O2的主反应温度在700~750℃之间。振实密度测试结果表明,750℃下制备的LiNi0.8Co0.15Al0.05O2材料可达2.2 g·cm-3。恒流充放电结果表明,该材料在0.5 mA·cm-2电流密度下,在3.0~4.3 V间的首次充电容量可达210.3 mAh·g-1,首次放电容量为179.7 mAh·g-1,充放电效率为85.4%。与采用以β-Ni0.85Co0.15(OH)2为前驱体合成的LiNi0.85Co0.15O2和Al掺杂的LiNi0.8Co0.15Al0.05O2相比,尽管其首次放电容量与放电效率都有所降低,但循环性能有所提高,50周期后容量仍为初始容量的89.5%。研究表明,以球形Al/Co部分取代α型Ni(OH)2作为前驱体为球形氧化镍钴铝锂材料的制备提供了一条新的途径。
锂离子电池;LiNi0.8Co0.15Al0.05O2正极材料;球形α型氢氧化物;前驱体;电化学性能
0 引 言
LiNiO2与LiCoO2具有同样的α-NaFeO2型层状结构[1],由于其理论容量与LiCoO2接近,实际容量已达190~210 mAh·g-1,远高于LiCoO2,且其自放电率低、环境友好,被认为是LiCoO2最具竞争力的替代材料之一。但LiNiO2合成条件苛刻、热稳定性较差、易引起安全性问题等而限制其应用。前人研究表明,在LiNiO2中掺杂Co后可以形成LiCoO2和LiNiO2的固溶体LiNi1-xCoxO2。Co的掺入抑制了Ni2+的产生并且能够稳定二维层状结构,使电化学性能得到了改善[2],其中20%~30%的Ni被Co取代的镍钴酸锂材料综合性能最好。除 Co元素外,其它元素如Al[3-4]、Mn[5]、Fe[6]、Sr[7]、Ti[8]和 F[9]等也被发现可以用于提高LiNiO2材料的热稳定性能和安全性能。刘欣艳等[10]采用XRD和EXAFS研究了Al、Co和Mn掺杂对LiNiO2结构的影响,研究显示Al、Co和Mn原子的掺杂减弱了Jahn-Teller畸变,使NiO6八面对称性提高,提高了镍钴酸锂材料的循环性能并有利于改善热稳定性能和耐过充性能。目前Co、Al共掺杂的镍酸锂材料也得到了实际应用,但如何制备得到更高振实密度的材料是其能否最终被市场接受的一个关键因素。
作为前驱体材料的镍氢氧化物属于六方层状结构,以α和β相2种形式存在。β相为有序堆积,层间约为0.46~0.48 nm,α相为无序堆积,层间较大约为0.70~0.80 nm[11]。采用以氨为配位剂的控制结晶法制备β相镍氢氧化物作为前驱体制备高密度球形正极材料是目前工业化生产LiNi1-xCoxO2[12]和LiNi1-x-yCoxMnyO2[13]材料的主要方法,该方法制备出的正极材料密度高,颗粒呈球形,有利于锂离子电池极片的加工。一般情况下,在共沉淀过程中采用二价离子如Co2+部分取代Ni(OH)2中的Ni生成的是β相结构的Ni1-xCox(OH)2。当掺入三价离子如Al3+和Co3+时,为了补偿三价离子引入的多余电荷,阴离子会插入层间以维持电荷平衡,使层间距加大,生成的是α-Ni(OH)2。α-Ni(OH)2在碱性环境中不稳定,当取代量大于20%时才能在碱性环境下稳定存在,当掺杂量小于20%时层间阴离子也相应减少,使α-Ni(OH)2自动转变成β-Ni(OH)2,从而形成α相与β相的混合物。因此,采用此方法合成LiNi1-x-yCoxAlyO2的前驱体Ni1-x-yCoxAly(OH)2十分困难,主要是由于Al3+的掺入会使部分Ni、Co共沉淀氢氧化物由β相转变为α相,从而形成α与β的混合相。在混合相中,晶格有序性变差,导致颗粒失去球形形貌,流动性变差,同时振实密度下降。前驱体振实密度的下降必将导致LiNi1-x-yCoxAlyO2材料振实密度的下降,使材料在电极制作过程中的加工性能下降。为了使Al掺杂后形成的LiNi1-x-yCoxAlyO2材料具有较高的振实密度,就必须使Ni1-x-yCoxAly(OH)2前驱体保持球形形貌。而Al掺杂后易形成α与β相混合的共沉淀物,那么为了使该共沉淀物只保持为单一α相,需采用其它试剂来代替共沉淀法中的氨配位剂或采取更严格的工艺来控制上述球形α型前驱体的制备。清华大学应皆荣等[14]采用了控制pH<9.5来制备球形型Ni0.8Co0.2(OH)2前驱体,进而制备了振实密度达2.6 g·cm-3的LiNi0.8Co0.2O2材料,其首次可逆比容量高达174 mAh·g-1。Wang等[15]报道了通过共沉淀方法制备Ni/Co/Al取代α-Ni(OH)2作为镍金属氢化物电池正极材料。庄玉贵等[16]采用固相法合成了铝钴共掺杂的α-Ni(OH)2,Chen等报道了采用共沉淀方法制备球形的Al取代α-Ni(OH)2作为金属氢化物电池正极材料[17]。但是,采用共沉淀方法制备球形Ni/Co/Al取代α-Ni(OH)2作为Al掺杂镍钴酸锂(LiNi1-x-yCoxAlyO2)的前驱体未见报道。
本文以氢氧化钠与碳酸钠的混合溶液为沉淀剂制备出球形的单一α相的镍、钴、铝共沉淀氢氧化物Ni0.8Co0.15Al0.05(OH)2作为前驱体,与LiOH混合焙烧制备球形的LiNi0.8Co0.15Al0.05O2正极材料。此方法制备出的LiNi0.8Co0.15Al0.05O2材料颗粒呈球形,振实密度高,有助于提高该材料在电极制作过程中的加工性能,是制备掺Al型镍钴酸锂材料的一种新方法。研发结果还表明,通过掺杂Al元素提高了镍钴酸锂材料的稳定性。同时作为本法的对比,以β型Ni0.8Co0.2(OH)2为前驱体制备了 LiNi0.8Co0.15Al0.05O2材料,考查了两者在电化学性能上的差别。
1 实验部分
将硝酸镍(分析纯)、硝酸钴(分析纯)与硝酸铝(分析纯)按照物质的量比为Ni∶Co∶Al=0.8∶0.15∶0.05的比例配制成总浓度为1 mol·L-1的混合溶液。同时,配制2 mol·L-1的NaOH与0.5 mol·L-1的Na2CO3混合溶液。将配制好的镍、钴和铝的硝酸盐混合溶液与氢氧化钠、碳酸钠混合溶液通过蠕动泵泵入到盛有一定量去离子水的反应器中。反应器设有溢流口,溶液充满反应器后从溢流口溢出。共沉淀反应过程中保持强烈搅拌,控制反应pH在10~12之间,在25℃下反应10 h。反应结束后将固液分离,所得产物洗涤后在 80℃下干燥8 h,即可得到球形的α型Ni0.8Co0.15Al0.05(OH)2前驱体。
作为对比研究,制备以球形β-Ni0.85Co0.15(OH)2为前驱体的LiNi0.85Co0.15O2和LiNi0.8Co0.15Al0.05O2。将硝酸镍(分析纯)、硝酸钴(分析纯)按照物质的量比为Ni∶Co=0.85∶0.15的比例配制成为总浓度为2 mol·L-1的混合溶液。配制6 mol·L-1氢氧化钠溶液和1.5 mol· L-1的氨水混合溶液。将硝酸盐溶液与氢氧化钠和氨水混合溶液通过蠕动泵同时加入到盛有去离子水的反应器中,强烈搅拌,控制反应pH=11.0,50℃下反应20 h。反应所得产物经过分离和洗涤,在80℃下烘干得到β-Ni0.8Co0.2(OH)2前驱体。
将α-Ni0.8Co0.15Al0.05(OH)2前驱体与LiOH混合后在 氧 气 气 氛 中 700~850 ℃ 下 焙 烧 得 到LiNi0.8Co0.15Al0.05O2材料。 将 β-Ni0.85Co0.15(OH)2前驱体分作两部分,一部分与LiOH混合后在750℃热处理8 h得到LiNi0.85Co0.15O2,另一部分与硝酸铝(分析纯)按照(Ni+Co)∶Al=0.95∶0.05并与LiOH进行混合,混 合 物 在 750℃下 热 处 理 8 h亦 可 得 到LiNi0.8Co0.15Al0.05O2。
采用X射线衍射(Rigaku 2500PC)分析前驱体Ni0.8Co0.15Al0.05(OH)2和Ni0.85Co0.15(OH)2的物相,采用扫描电镜(JEOL,JSM-6700F)观察粉末材料的微观形貌,采用ST-08型比表面测定仪(北京分析仪器厂)测定材料的比表面,采用热分析仪(NETZSCH DSC 200 F3)测定材料的热稳定性,采用FZS4-4型振实密度测定仪(北京钢铁研究总院)测定粉末振实密度。
将LiNi0.8Co0.15Al0.05O2粉末、乙炔黑和PVdF以质量比8∶1∶1混合后,加入适量NMP充分混匀调成浆料,涂敷在铝箔上,120℃下真空干燥12 h后压片。以金属锂片为对电极,Celgard 2400为隔膜,1 mol· dm-3LiPF6的EC/DEC(1∶1,V/V)溶液为电解液,在手套箱中组装成2032型扣式电池。采用CT2001A LAND电池测试系统对扣式电池进行恒电流充放电循环测试,电流密度为0.5 mA·cm-2,电压范围为3.0~4.3 V。
2 结果与讨论
2.1 微观形貌分析

图1 前驱体扫描电镜照片Fig.1 SEM images of the precursors
图1示出了2种前驱体α-Ni0.8Co0.15Al0.05(OH)2与β-Ni0.8Co0.2(OH)2的扫描电镜照片。从照片中可以看出,二者都具有一定的球形形貌。α-Ni0.8Co0.15Al0.05(OH)2颗粒形貌呈球状或类球状,球形颗粒由细小的六角形片状一次晶粒堆积而成,表面粗糙,分布有大量的孔隙结构。空隙结构的存在和较低的结晶度使α-Ni0.8Co0.15Al0.05(OH)2振实密度较低,仅为0.5~0.8 g· cm-3。通过BET法测定α-Ni0.8Co0.15Al0.05(OH)2比表面积达到65 m2·g-1。多孔性结构和巨大的比表面积可增大与氢氧化锂的接触面积,使接触更加充分,在高温焙烧阶段有利于提高Li+的均匀嵌入和扩散速度,使LiNi0.8Co0.15Al0.05O2的层状结构更加完整。相反,β-Ni0.8Co0.2(OH)2颗粒呈非常规则的球形,表面光滑,其一次晶粒子形貌呈针状,振实密度高,可达到2.0 g· cm-3,但比表面积较小,仅为8.5 m2·g-1。
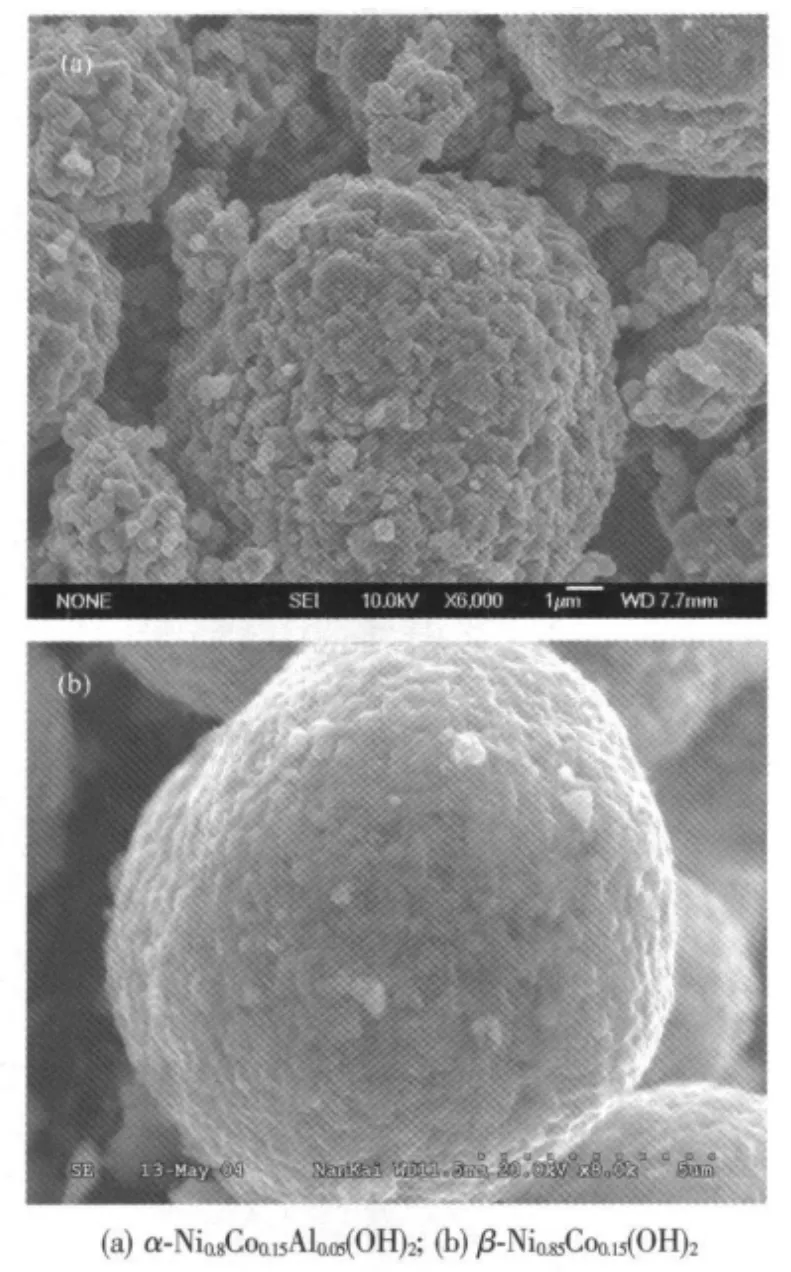
图2 750℃下采用不同前驱体焙烧制备的LiNi0.8Co0.15Al0.05O2材料扫描电镜照片Fig.2 SEM images of LiNi0.8Co0.15Al0.05O2powder synthesized by the different precursors at 750℃
图2给出了以α-Ni0.8Co0.15Al0.05(OH)2和β-Ni0.8Co0.2(OH)2为前驱体在750℃下焙烧制备的氧化镍钴铝锂正极材料。从电镜照片中可以看出,经过焙烧后以α-Ni0.8Co0.15Al0.05(OH)2和 β-Ni0.8Co0.2(OH)2为前驱体制备的氧化镍钴铝锂都保持了一定的球形形貌。然而,从图2a可以看出,以α-Ni0.8Co0.15Al0.05(OH)2为前驱体制备的LiNi0.8Co0.15Al0.05O2材料颗粒表面的一次晶粒较大,晶粒直径大小约为1~1.5 μm。而以β-Ni0.8Co0.2(OH)2为前驱体焙烧制备的LiNi0.8Co0.15Al0.05O2材料颗粒表面的一次晶粒尺寸较小,大多小于1 μm(如图2b)。较小的一次晶粒尺寸有助于缩短Li+脱出/嵌入的路径。正极材料一次晶粒的尺寸大小主要与前驱体一次晶粒尺寸、反应活性以及焙烧温度有关。图2 (a)和(b)显示一次晶粒尺寸的差别有可能是由以下原因引起的。首先α-Ni0.8Co0.15Al0.05(OH)2晶体的生长速度较快,生成的一次晶粒尺寸较大,且呈六角型片状结构,晶粒与晶粒之间有较大的接触面积,高温焙烧时晶粒之间容易凝聚成更大的一次晶粒,而β型氢氧化物晶体生长速度慢,一次晶粒尺寸小,呈针状结构,在高温阶段不易相互凝聚。其次,α型结构的反应活性要大于β型结构,在相同的温度焙烧,前驱体的一次粒子更容易聚集长大。但是,通过控制焙烧温度,可以将一次晶粒尺寸控制在1~1.5 μm范围内,从而对正极材料的电化学性能没有明显的影响。
3.2 热重分析
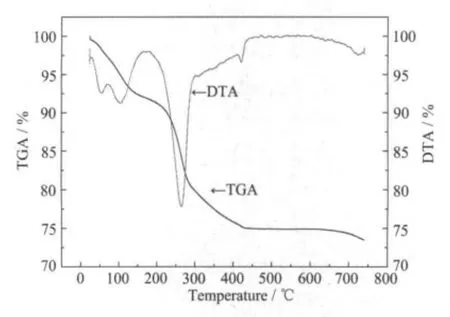
图3 α-Ni0.8Co0.15Al0.05(OH)2前驱体与LiOH混合物的TGA-DTA曲线Fig.3 TGA-DTA curve of the mixture of the precursorα-Ni0.8Co0.15Al0.05(OH)2and LiOH
图3给出了α-Ni0.8Co0.15Al0.05(OH)2与LiOH·H2O混合物的差热和热重曲线。从该图可以看出,50~100℃之间差热曲线上有一个小的吸热峰,该峰可归为混合物内含有的吸附水挥发造成的。温度自100℃升高至200℃过程是一个缓慢失重的过程,对应于α-Ni0.8Co0.15Al0.05(OH)2与LiOH·H2O逐步失去结晶水的过程。随着温度的进一步升高,在265℃左右出现一个强烈的吸热峰,而热重曲线上出现了明显的重量损失,这是由于α-Ni0.8Co0.15Al0.05(OH)2分解失去氢氧根所致。但与文献报道[14]不同的是,在随后的300~400℃之间仍有缓慢的失重出现,但速率降低,至425℃失重才完全停止,这说明Al的加入稳定了α-Ni0.8Co0.15Al0.05(OH)2的晶体结构。在425℃有一个小的吸热峰存在,这是由于LiOH熔融造成的。在425℃后没有明显的热失重。随着温度升高,自625 ℃开始逐步出现重量损失, 说明LiNi0.8Co0.15Al0.05O2材料开始形成,723℃时有一个较小的吸热峰,表明主要反应在700~750℃范围内发生。
2.3 结构分析
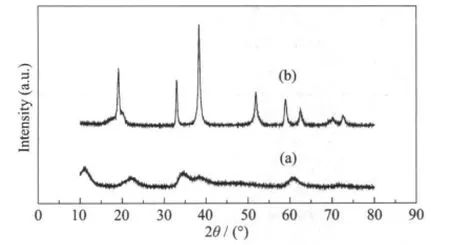
图4 前驱体的XRD图Fig.4 XRD Patterns of the precursors
图4示出了α-Ni0.80Co0.15Al0.05(OH)2与β-Ni0.85Co0.15(OH)22种前驱体的XRD图。从图4a可以看出,α-Ni0.80Co0.15Al0.05(OH)2衍射峰强度很低,说明材料的结晶度很低。该曲线与文献[18-20]报道的相符,具有α型Ni(OH)2结构。从图4b可看出,β-Ni0.8Co0.2(OH)2衍射谱图与文献[21]的XRD图完全相符,衍射峰强度很高,表明材料有很高的结晶度,有明显的层状结构特征,属于β型Ni(OH)2结构。β-Ni(OH)2与α-Ni(OH)2都属于斜方六面体结构,空间群为P3构型。β-Ni (OH)2沿六面体c轴有序排列,层间距为0.46 nm。α-Ni(OH)2沿c轴任意排列层间距为0.74~0.76nm几乎是β-Ni(OH)2的2倍。较大的层间距在热处理过程中有利于 Li+嵌入层间,这也许是 α-Ni0.8Co0.15Al0.05(OH)2有很大的反应活性的原因。
图5是两种前驱体在750℃下热处理8 h后得到的LiNi0.8Co0.15Al0.05O2材料的XRD图。从该图可看出,2种前驱体得到的氧化镍钴铝锂正极材料均具有α-NaFeO2相结构,且XRD图都显示了尖锐而强度高的衍射峰,说明无论α型还是β型前驱体在相同的热处理工艺下都可以得到层状结构完好的氧化镍钴铝锂材料。
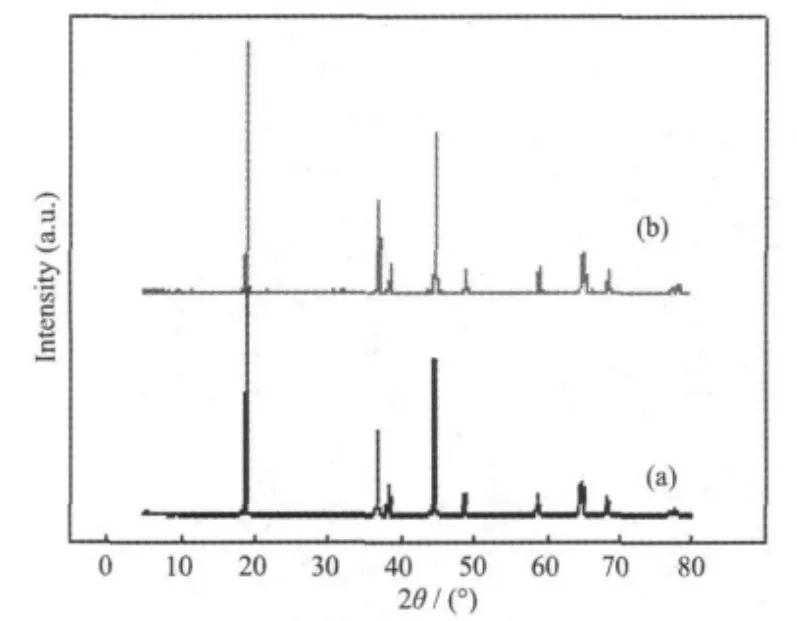
图5 2种前驱体750℃下8 h后得到的LiNi0.8Co0.15Al0.05O2材料XRD图Fig.5 XRD patterns of LiNi0.8Co0.15Al0.05O2powders synthesized at 750℃for 8 h from the two precursors
2.4 电化学性能
图6给出了α-Ni0.8Co0.15Al0.05(OH)2在700℃下焙烧8 h所得的LiNi0.8Co0.15Al0.05O2的初始充放电曲线。首次充电容量为212.5 mAh·g-1,放电容量为180.1 mAh·g-1,首次充放电效率84.7%。
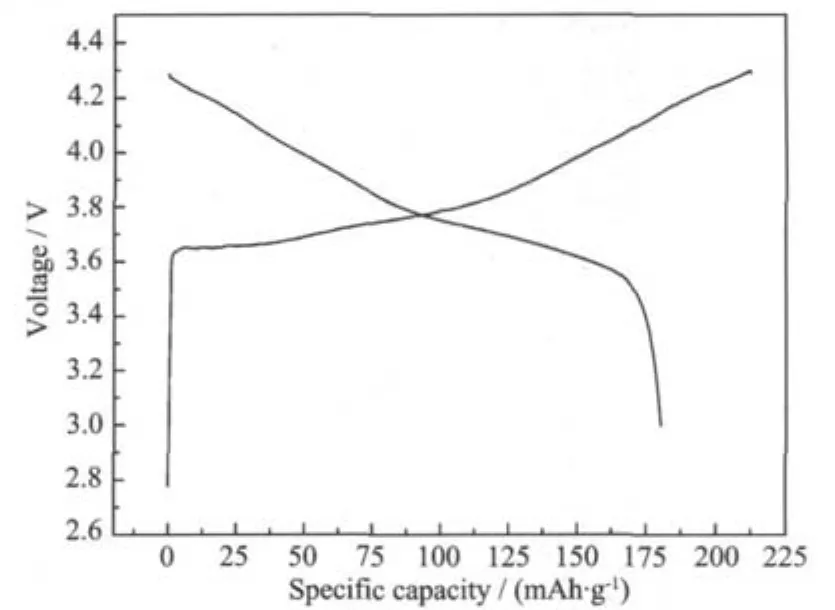
图6 以α-Ni0.8Co0.15Al0.05(OH)2为前驱体制备的LiNi0.8Co0.15Al0.05O2在2032型扣式电池中的首次充放电曲线(700℃热处理8 h) Fig.6 Initial charge/discharge curves of theLiNi0.8Co0.15Al0.05O2material in 2032-type coin cell with the α-Ni0.8Co0.15Al0.05(OH)2as the precursor synthesized at 700℃for 8 h
表1给出了以α-Ni0.8Co0.15Al0.05(OH)2为前驱体在不同热处理温度下首次充放电容量/效率以及振实密度的关系。从该表可以看出,随着热处理温度的上升,LiNi0.8Co0.15Al0.05O2层状结构提高,振实密度提高。但是放电容量也随之下降,在750℃时首次放电效率最高,为85.4%。产生放电容量与放电效率随温度升高而下降的原因可能是随着热处理温度的提高,一次晶粒的尺寸变大,扩大了Li+脱出/嵌入的路径,使首次放电效率下降。β-Ni0.8Co0.2(OH)2为前驱体制备的LiNi0.8Co0.2O2在相同的热处理温度下则表现出较高的放电容量与首次放电效率。这是由于在相同的温度下,β型氢氧化物前驱体致密的颗粒在热处理过程中形成较小的一次晶粒,缩短了Li+扩散的路径,从而提高首次放电效率。同时在相同的热处理温度下,以高密度的β型氢氧化物为前驱体的氧化镍钴铝锂正极材料可以得到较高的振实密度。温度的提升有助于提高以α-Ni0.8Co0.15Al0.05(OH)2为前驱体的LiNi0.8Co0.15Al0.05O2材料的振实密度,但却会使材料的首次放电容量及效率下降,因此在实际应用中应综合考虑这2种因素,优化地选择热处理温度,在保持良好的电化学性能前提下提高材料的振实密度,使其达到较为理想的平衡。我们认为,750℃是一个较为适宜的热处理温度。
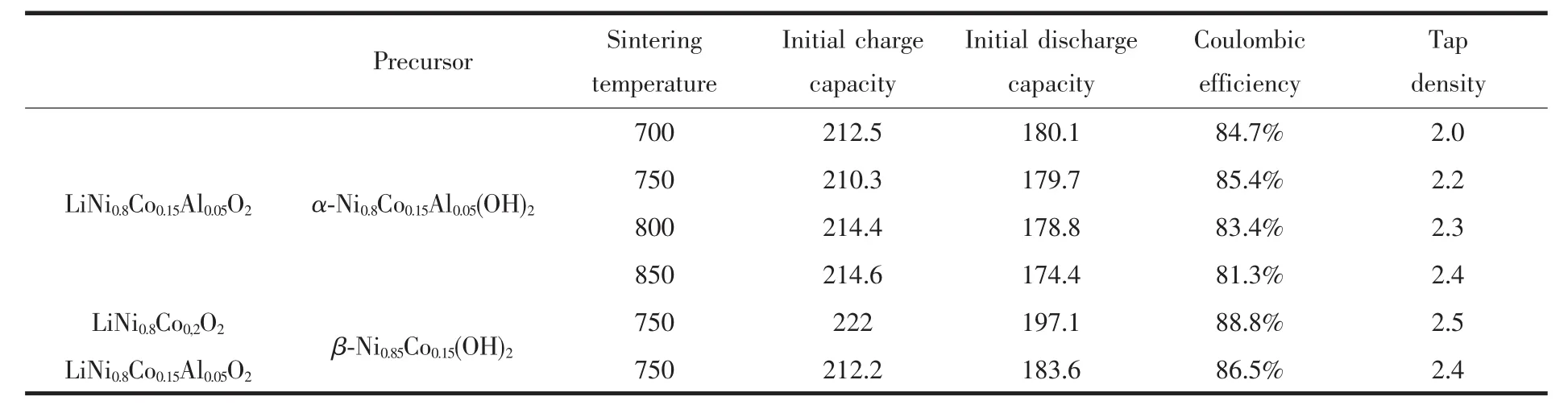
表1 烧结温度与首次充放电性能及振实密度的关系Table 1 Relationship among the sintering temperature,the tap density and the charge-discharge performance of the initial cycle
图7为2种不同前驱体在750℃下热处理8 h后制备的 LiNi0.8Co0.15Al0.05O2和 LiNi0.85Co0.15O2的循环性能曲线。从该图可以看出,由于没有Al的掺杂,LiNi0.85Co0.15O2的结构稳定性差,容量衰减很快,30周期后容量由首次的197.1 mAh·g-1下降为154.3 mAh· g-1,容量保持率仅为78.3%(如图7中曲线c)。以α-Ni0.8Co0.15Al0.05(OH)2为前驱体的 LiNi0.8Co0.15Al0.05O2虽然在首次放电容量上低于 LiNi0.85Co0.15O2和以 β-Ni0.8Co0.2(OH)2为前驱体的 LiNi0.8Co0.15Al0.05O2,但表现出良好的循环性能。首次放电容量为179.7 mAh· g-1,50次循环周期后放电容量为160.8 mAh·g-1,容量保持率高达89.5%,具有良好的充放电循环性能(如图7中曲线 b)。以 β-Ni0.8Co0.2(OH)2为前驱体的LiNi0.8Co0.15Al0.05O2首次放电容量为183.6 mAh·g-1,50次循环周期后为 150.5 mAh·g-1,容量保持率为82.0%(如图7中曲线a)。
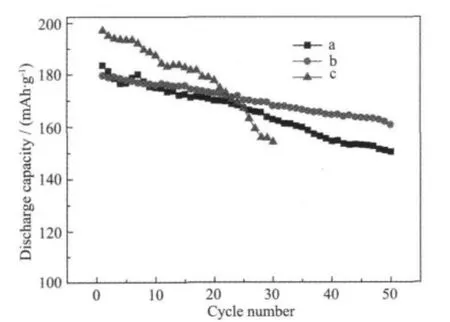
图7 2种不同前驱体制备的LiNi0.8Co0.15Al0.05O2和LiNi0.8Co0,2O2正极材料在2032型扣式电池中的循环性能曲线Fig.7 Cycling performance of the LiNi0.8Co0.15Al0.05O2and LiNi0.8Co0,2O2materials synthesized by the two different precursors in 2032-type coin cells
3 结 论
以氢氧化钠与碳酸钠为沉淀剂在常温下制备了球形的α型Ni0.8Co0.15Al0.05(OH)2,以此为前驱体与氢氧化锂在氧气气氛下经过热处理制备了锂离子电池正极材料LiNi0.8Co0.15Al0.05O2。颗粒形貌呈球形,具有良好的层状晶体结构和电化学循环稳定性。该方法突破了球形氧化镍钴铝锂材料的传统制备方法,为该材料的制备方法开辟了一条新的途径。
[1]Delmas C,Menetrier M,Crouguennec L,et al.Electrochim. Acta,1999,45:243-253
[2]Rougier A,Saadoune I,Gravereau P,et al.Solid State Ionics, 1996,90:83-90
[3]Ohzuku T,Yanagewa T,Kouguchi M,et al.J.Power Sources, 1997,68:131-134
[4]DAI Chang-Song(戴长松),YANG Jun(羊 俊),WANG Dian-Long(王殿龙),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2006,22(11):2011-2017
[5]Neudecker B J,Zuhr R A,Kwak B S,et al.J.Electrochem. Soc.,1998,145(12)
[6]Prado G,Fournes L,Delmas C.J.Solid State Chem.,2001, 159:103-112
[7]Fey G T,Subramanian V,Chen J G.J.Mater.Lett.,2002, 52:197-202
[8]Kim J,Amine K.J.Electrochem.Commun.,2001,3:52-55
[9]Kubo K,Fujiwara M,Yamada S,et al.J.Power Sources, 1997,68:553-557
[10]LIU Xin-Yan(刘欣艳),ZHAO Yu-Juan(赵煜娟),LI Yan (李 燕),etal.ChineseJ.Inorg.Chem.(WujiHuaxueXuebao), 2006,22(6):1007-1012
[11]XIE Jing-Ying(解晶莹),ZHANG Quan-Sheng(张全生),LIU Jian-Feng(刘剑峰),et al.Chinese J.Power Sources(Dian Yuan Ji Shu),1999,23(4):238-244
[12]Chen Y,Wang G X,Tian J P,et al.Electrochim Acta, 2004,50:435-441
[13]Luo X F,Wang X Y,Liao L,et al.J.Power Sources,2006, 158:654-658
[14]YING Jie-Rong(应皆荣),WAN Chun-Rong(万春荣),JIANG Chang-Yin(姜长印).J.Inorg.Mater.(Wuji Cailiao Xuebao), 2001,16(5):821-826
[15]Wang C Y,Zhong S,Bradhurst D H,et al.J.Alloys Compd. 2002,330-302:802-805
[16]ZHUANG Yu-Gui(庄玉贵),LIN Dong-Feng(林东风),CHEN Xiu-Yu(陈秀宇).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(8):1336-1341
[17]Chena H,Wang J M,Pana T,et al.J.Power Sources,2005, 143:243-255
[18]Faure C,Delmas C,Fouassier M,et al.J.Power Sources, 1991,35:249-261
[19]Faure C,Delmas C,Willmann P.J.Power Sources,1991,35: 263-277
[20]Faure C,Borthomieu Y,Delams C,et al.J.Power Sources, 1991,36:113-126
[21]Cressent A,Pralong V,Audemer A,et al.Solid State Sci., 2001,3:65-80
Synthesis of LiNi0.8Co0.15Al0.05O2Cathode Material by Spherical Co/Al-Substituted α-Ni(OH)2as the Precursor and its Electrochemical Performance
CHEN Bo-Tao
(Institute of New Energy Material Chemistry,Nankai University,Tianjin300071)
A LiNi0.8Co0.15Al0.05O2cathode material was successfully synthesized by a spherical Co/Al-substituted α-Ni(OH)2as the precursor and its electrochemical performance was investigated.This precursor was prepared by a coprecipitation method by a NaOH solution containing Na2CO3as the precipitator,then heated with LiOH·H2O at different temperatures for 8 h in an oxygen atmosphere to form LiNi0.8Co0.15Al0.05O2.XRD results showed that the LiNi0.8Co0.15Al0.05O2had an α-NaFeO2phase.SEM results indicated that the particles had spherical morphology.TG and DSC results revealed that the suitable formation temperature of the LiNi0.8Co0.15Al0.05O2material was in the range between 700 and 750℃.The tap density result showed that the LiNi0.8Co0.15Al0.05O2material sintered at 750℃was up to 2.2 g·cm-3.Its initial charge-discharge capacity was 210.3 and 179.7 mAh·g-1at 0.5 mA·g-1,respectively.Although the initial discharge capacity and coulombic efficiency of the LiNi0.8Co0.15Al0.05O2cathode prepared by α-Ni0.85Co0.15Al0.05(OH)2as the precursor was lower than those of the LiNi0.85Co0.15O2and LiNi0.8Co0.15Al0.05O2cathodes prepared by β-Ni0.85Co0.15(OH)2as the precursor,its cyclic behavior was improved,where its discharge capacity still reached 89.5%of its initial one.It suggested that this work provided a new method to prepare LiNi0.8Co0.15Al0.05O2cathode material by α-Ni0.85Co0.15Al0.05(OH)2as the precursor.
lithium-ion battery;LiNi0.8Co0.15Al0.05O2;spherical α-Ni0.8Co0.15Al0.05(OH)2;precursor;electrochemical performance
O614.111;O614.81+3;O614.81+2
A
1001-4861(2010)02-0190-07
2009-10-19。收修改稿日期:2009-12-01。
国家自然科学基金(No.20873072)和天津市应用基础及前沿课题重点项目(No.07JCZDJC02700)资助。E-mail:hb_yang@nankai.edu.cn,Tel:(022)23508405
作者:陈勃涛,男,35岁,硕士,工程师;研究方向:锂离子电池材料。

