胃间质瘤CT征象与恶性程度关系分析
许春苗 曲金荣 周朋利 黎海亮
胃肠间质瘤(gastrointestinal stromal tumors,GISTs)是胃肠道富于表达CD117的梭形、上皮样或多形性细胞的间叶源性肿瘤[1]。由于GISTs自身的复杂性,对其认识至今仍不一致,给诊治带来很多不便。多层螺旋CT可以完整显示GISTs征象,评价其恶性程度,对临床早期诊断和治疗以及评价预后具有重要的指导价值。笔者结合我院自身特色,收集了来源于胃的GISTs的相关资料进行回顾性分析,以期提高对来源于胃的GISTsCT征象及其与恶性程度关系的认识。
1 资料与方法
1.1 一般资料 收集我院2006年1月至2009年4月收治的来源于胃的GISTs 68例,其中男28例,女40例;年龄33~78岁,平均年龄49岁;术后均经病理证实:低度恶性24例,高度恶性44例。所有病例术前均未进行任何化学和放射治疗,手术切除包括全部68例肿瘤组织和距肿瘤5 cm以上的正常组织,并且于离体30 min内取材。
1.2 方法
1.2.1 螺旋CT检查:用GE Lightspeed Ultra多层螺旋CT扫描仪,电压 120 V,电流200 ~260 mAs,层厚5.0 mm。禁食8 h,口服清水500~800 ml;术前68例均行上腹部螺旋CT平扫及增强扫描。取仰卧或俯卧位,先行常规平扫,再使用高压注射器以3.0~4.0 ml/s流率,经肘静脉注入非离子对比剂(优维显或欧乃派克,300 mgI/ml)90~100 ml,注入对比剂后于 35、65、120 s各扫描1次,分别获得动脉期、门静脉期及延迟期图像。
1.2.2 结果判定:采用双盲法,由三位具有五年以上肿瘤放射诊断经验的放射科医生分别阅片、进行CT细节征象分析,并与病理对照。详细记录肿瘤显示的位置、大小、形态、密度及强化特点、浸润的深度及邻近脏器的侵犯、转移淋巴结的有无。
1.3 统计学分析 应用SPSS 11.5统计软件,采用Spearman进行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 低度恶性GISTSs 24例,均为腔内型,CT表现:肿块直径均<5 cm,为向腔内生长的圆形及椭圆形肿块,密度均匀,病灶内见钙化4例(图1),表面出现溃疡16例(图2),增强后CT值净增加10~20 Hu,平均15 Hu,均匀强化16例,内部呈不均匀强化8例。
2.2 高度恶性GISTs 44例,腔内-腔外型4例,腔外型40例,主要CT表现为:肿瘤大小2~16 cm(图3、5),平均9 cm,呈类圆形或椭圆形16例(图6),呈分叶状28例,增强后不均匀强化,CT值净增加15~30 Hu,平均23 Hu,密度不均匀。瘤内见结节状及片状低密度坏死区,12例内部可见有结节状钙化,40例肿块表面出现深浅不一的溃疡,边界清楚16例,边界不清28例,瘤体旁可见成簇状线状排列血管12例,淋巴结肿大的4例(图4)。GISTs的CT征象中肿瘤大小、中心坏死、强化特征、肿瘤形态、边界与恶性程度呈正相关(P<0.01)。见表1。
3 讨论
Mazur和Clark于1983年首次提出了GISTS的概念。后来Miettinen等[2]提出GISTs是指胃肠道既不是典型平滑肌瘤也不是神经鞘瘤的一类间叶性肿瘤,多见于50岁以上患者,男性略多于女性[3]。本组68例病例中,仅12例年龄<50岁,56例年龄>50岁,与文献相符,女性略多于男性,与文献不符,可能与收集例数较少有关。目前认为GISTs是没有真正良性的,“良性”与“恶性”分类应该被描述为“低度恶性”和“高度恶性”更加确切[4]。根据2000年WHO制定的消化系统肿瘤病理学分类,恶性程度的组织学评估必须要基于病变的大小以及核分裂的数量:按照广泛应用的软组织肉瘤分级系统来进行组织学分级,核分裂计数<5/50 HP(高倍镜视野),病灶<5 cm,认为是低度恶性;无论其大小,核分裂计数>5/50 HP或无论其核分裂计数,肿块>10 cm均认为是高度恶性的,肿块>5 cm但核分裂<5个/50 HP认为是具有不确定恶性潜能[5]。

表1 GISTs的CT征象与恶性程度对照

图1 胃底腔内型低度恶性,突入于胃腔内的软组织肿块,内可见斑片状钙化,直径约为3 cm
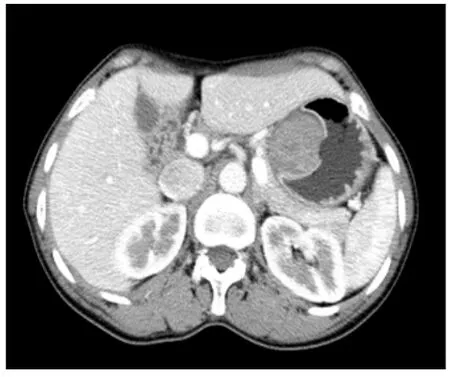
图2 胃底腔内型低度恶性,突入于腔内的软组织肿块,密度均匀,肿块表面可见溃疡

图3、4 为同一病例,胃体腔外型,高度恶性,肝胃间软组织肿块,直径约为3 cm,强化欠均,边界欠清,形态欠规则。腹腔内多发淋巴结肿大

图5 胃底腔外型高度恶性,肝胃间软组织肿块,边界欠清,内可见大片状低密度坏死区及结节状钙化,形态欠规则

图6 胃底腔外型高度恶性,肝胃间软组织肿块,边界欠清,内可见片状低密度坏死,呈圆形,肿块表面可见溃疡
宋亭等[6]认为,低度恶性GISTs在CT上多表现为突向腔内生长的软组织肿块,直径多<5 cm,多呈圆形或类圆形,形态规则,边界清楚,中心坏死无或少见,CT增强多呈均匀强化。高度恶性GISTs的CT表现大多数为腔外肿块,通常体积较大(>5 cm),多呈分叶状,形态不规则,中心坏死、出血及囊变较多,密度不均匀,增强扫描多呈不均匀强化。大部分边缘模糊,与邻近脏器无明确分界。本组24例低度恶性GISTs均为腔内型肿块,直径均 <5 cm,肿块呈圆形,边界清晰,密度均匀,66.7%(16/24)均匀强化,且延迟强化。44例高度恶性的病例,肿块直径>5 cm为36例,仅8例直径<5 cm,明显大于低度恶性的病例肿块;肿块内见大片坏死,实性部分轻度或明显强化,实性部分延迟强化的净增加值高于低度恶性的病例,肿块大多数形态欠规则,边界不清。低度恶性与高度恶性GISTs在肿瘤的大小、中心坏死程度、强化特征、肿瘤形态及边界呈正相关(P﹤0.05)。故笔者认为肿瘤的大小、中心坏死程度及强化特征并结合肿块形态学特征对辨别GISTs的恶性度具有重要意义。
GISTs的钙化并不常见,且常见于恶性 GISTs[7]。Hasegawa等[8]报道的9例中仅1例在手术标本中可见钙化(MRI未能检出),占11.1%(1/9),CT未见显示。本组有4例低度恶性及12例高度恶性的病灶内发现斑片状及结节状钙化,约占23%(16/68),CT均显示清晰,略高于 Hasegawa等[8]的报道,且恶性度不同的病灶内均可见有钙化,不具有统计学意义(P>0.05),与文献不符。据文献报道表面溃疡是高度恶性的指标,然而CT常不能显示,特别是溃疡非常表浅时[9];本组病例中56例肿块表面出现深浅不一的溃疡,低度恶性16例,高度恶性40例,CT均显示明确,且恶性度不同的肿块表面均可出现溃疡,不具有统计学意义(P>0.05),与文献[10]不符。根据此组病例分析笔者认为肿块表面溃疡与GISTs的恶性程度无关,在胃充盈良好的条件下,溃疡常能显示清晰。GISTs很少引起淋巴结转移[8],本组仅4例发现淋巴结肿大,与文献基本相符。对来源于胃的GISTs恶性度的鉴别,笔者认为高度恶性的GISTS具有如下特征:肿瘤大小(直径≥5 cm),肿块呈椭圆形及分叶状,肿块的密度欠均,瘤体内出现大片状坏死囊变区,CT增强扫描显示肿瘤明显不均匀强化,静脉期尤为明显,瘤旁出现成簇状或线状排列的小血管影,肿块边界模糊,有转移等。
总之,肿瘤的恶性程度与CT征象中肿瘤的大小、中心坏死程度、强化特征、肿瘤形态及边界清晰与否相关,仔细分析CT征象可以提高对GISTs的诊断准确性,并为恶性程度的判断提供重要依据,为其的治疗方案提供重要的信息。
1 Rosai J,Ackerman LV.Ackman S surgical pathology.St.Louis:Mosby,1996.645-647.
2 Miettinen M,Monihan JM,Sarlomo-Rikala M,et al.Gastrointestinal stromal tumors/smooth muscle tumor GIST primary in the omentum and mesenteryclinicopatholigic and immunohistochemical study of 26 cases.Am Surg Patho,1999,23:1109-1118.
3 侯英勇,王坚,朱雄增,等.胃肠道间质瘤76例的临床病理及免疫组织化学特征.中华病理学杂志,2002,31:20-25.
4 朱为梅,李正勇,刘海.胃肠间质瘤综述.中国现代临床医学杂志,2007,6:44-46.
5 WHO.肿瘤病理学及遗传学分类消化系统肿瘤(2000).北京:诊断病理学杂志社,2005,6:40-43.
6 宋亭,沈君,郭昊昶,等.胃肠间质瘤的影像学特征与病理学的相关性.中华肿瘤杂志,2007,29:386-391.
7 唐文艳,江魁明,彭娟,等.CT对胃肠间质瘤的诊断价值.放射学实践,2009,24:43-46.
8 Hasegawa S,Semelka RC,Noone TC,et al.Gastric stromal sarcomas:correlation of MR imaging and histopathologic findings in nine patients.Radiology,1998,208:591-595.
9 Rimondini A,Belgrano M,Favretto G,et al.Contribution of CT to treatment planning in patients with GIST.Radiol Med,2007,112:691-702.
10 孟庆贵.胃间质瘤的临床影像学诊断价值.河北医药,2008,30:77-379.

