基于 p值流程图计算水溶液酸碱度的方法
熊言林 余婵娟 马善恒
(安徽师范大学化学与材料科学学院 安徽芜湖 241000)
基于 p值流程图计算水溶液酸碱度的方法
熊言林 余婵娟 马善恒
(安徽师范大学化学与材料科学学院 安徽芜湖 241000)
介绍一种用于酸碱度计算的 p值流程图,学生通过回答流程图上的一系列问题,并找到正确的方程式,即可方便地求解常见溶液 pH的计算问题,而不需要借助计算器。
1 问题的提出
在化学分析时,使用溶液 pH对水溶液酸碱度进行定量分析,它是通过水溶液中 H+或OH-浓度来表示的[1]。pH定义为水溶液中 H+浓度的负对数,即 pH=-lg[H+]。pH的提出,给实际应用和记忆带来了很大的方便,同时也给缺乏计算技能和对数知识的学生带来了解题上的困难。不少同学在解答此类问题时,由于分析不够透彻而经常出错。
在水溶液中,存在着水的电离平衡(H2OH++OH-)。当改变外界的某些条件 (如改变温度、加入其他电解质等)时,该平衡可能被破坏,从而改变了溶液的酸碱性。对于不同的水溶液体系,其酸碱度的计算要考虑多种影响因素,如强酸 (强碱)、弱酸 (弱碱)、各种盐类以及缓冲溶液等,还要考虑电解质本身的电离程度以及阴阳离子的水解情况。这些影响因素给溶液 pH的计算带来了一定的复杂性。实际上,获得 pH最有效又可靠的方法是测量而不是计算,但在实际教学中,教会学生如何获得 pH估值并预测溶液酸碱性强弱仍然是有意义的。
初学者对于复杂的溶液体系,往往分析不清,容易混淆,死记硬背公式更是不可取的方法。鉴于学生在计算水溶液 pH时可能遇到的各种困难,笔者在参考外文资料的基础上,在教学中引入了 Pablo A.Molina的一种不需要借助于计算器就可以快速获得各种复杂溶液 pH近似值的辅助工具——p值流程图[2](见图 1)。
2 p值流程图
对于水溶液的 pH,定义 pH=-lg[H+]。所谓的 p值流程图,就是采用同样的定义方法将所有相关的量都定义为 pX=-lg[X],其中[X]可表示[A](酸的浓度)、[B](碱的浓度)、Ka(弱酸的电离常数)、Kb(弱碱的电离常数)、Kw(水的离子积常数)、[H+]以及[OH-]等,在整个流程图中出现的全部公式均表示为 pX的形式。
3 p值流程图的计算
3.1 p值流程图的计算原理
使用 p值流程图解决溶液酸碱度问题时,A和B部分的浓度要求必须小于或等于1mol/L。
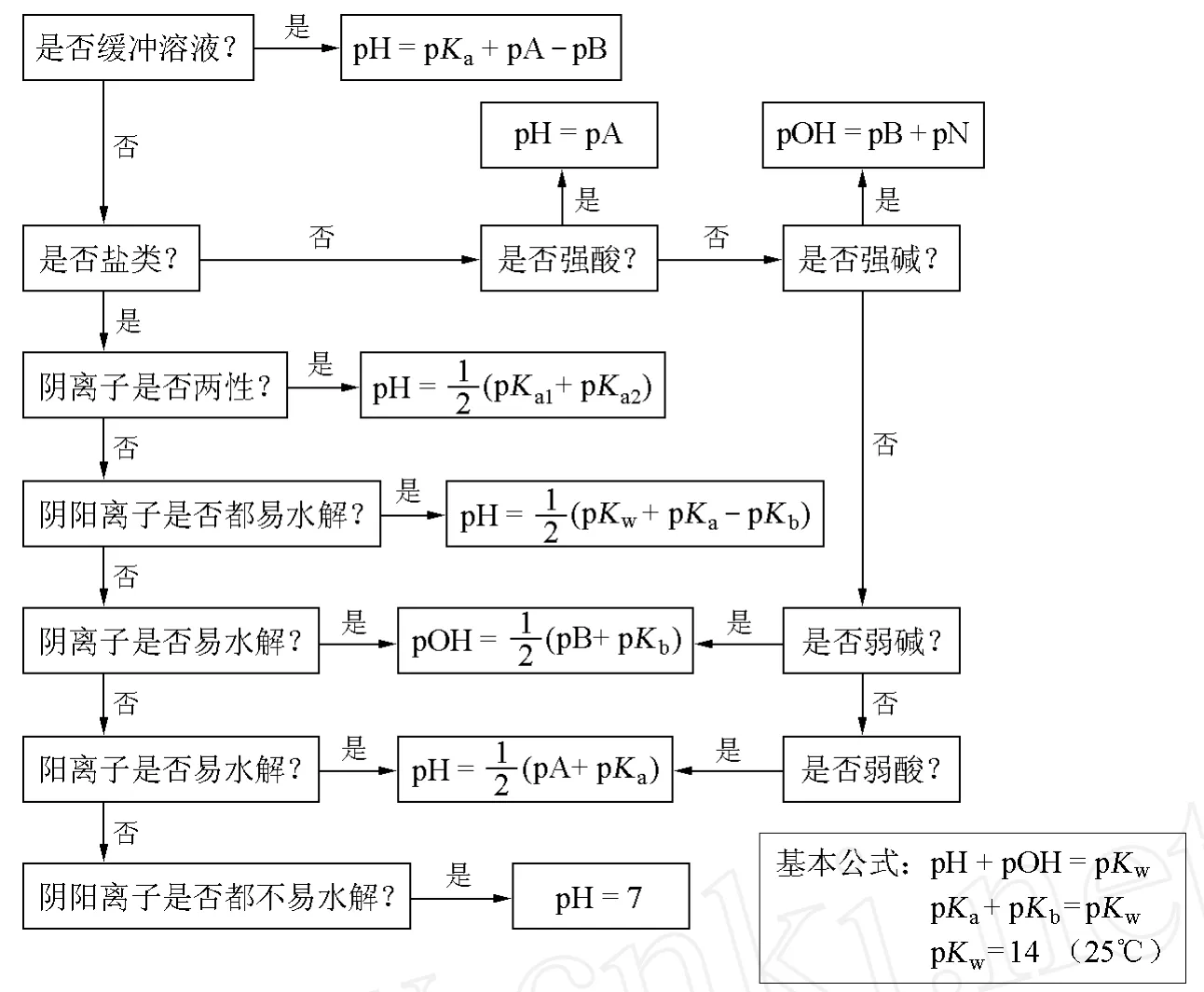
图1 p值流程图
因此,在计算过程中[X]的值可以表示为:

3.2 强酸(强碱)溶液 pH的计算
在强酸强碱溶液中,强酸和强碱完全电离,在浓度较大的溶液中可以忽略水的电离,只有在极稀溶液中,除考虑酸碱本身电离外,还要考虑水电离的 H+或OH-的影响。
对于强酸溶液,p值公式即为:

对于强碱溶液,p值公式即为:

该式类似于式(4),区别在于在强碱溶液公式中引入了一个校正因子 pN,N是指碱化学式中OH-的数目,如Mg(OH)2中含有两个OH-,即N=2。
例如,浓度为 2.50×10-3mol/L的 HCl溶液的 pH计算如下:
pH=pA=3-lg(2.50)=2.6(小数点后保留一位数字)
学生在利用p值流程图计算溶液的酸碱度时,仅需借助于对数函数m-lgm图(如图 2),而不需要计算器就可以解决这些酸碱度计算问题。
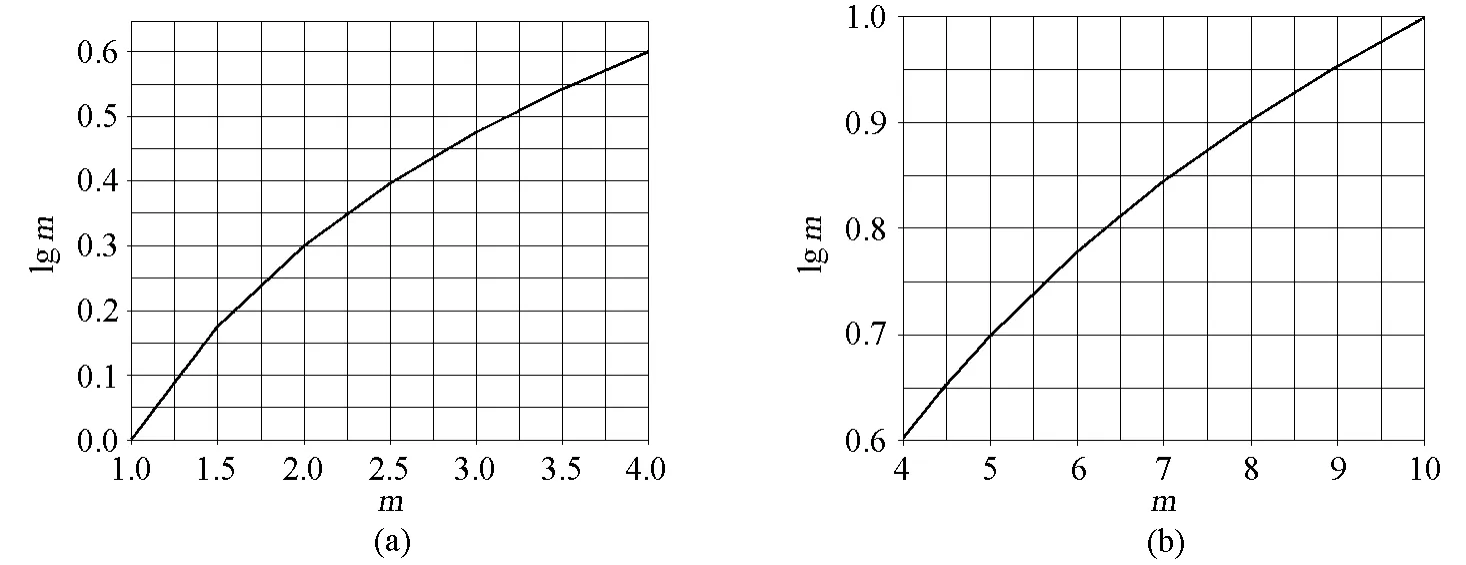
图2 对数函数m-lgm图
3.3 弱酸(弱碱)溶液 pH的计算
不完全电离的弱酸(弱碱)溶液存在电离平衡,其酸碱度的计算可以依据 I CE理论 (初始浓度、变化浓度、平衡浓度),其计算结果的相对误差不大于 5%。由于弱酸(弱碱)的电离程度很小,解题时,会先给学生一个标准让其考虑是否要忽略水的电离影响,通常是利用溶液的初始浓度和弱酸(弱碱)的电离常数之间的比值来判断。对于弱酸溶液,如果[A]/Ka的值大于100,则可忽略水的电离影响而直接使用 p值法;如果[A]/Ka的值小于 80,则必须考虑水的电离部分。(6)、(7)式可在忽略水的电离时,用于计算弱酸和弱碱的 pH近似值。

值得注意的是,因为流程图中假设水的电离可以忽略,所以可以不区别初始浓度 ([A]0或[B]0)和平衡浓度 ([A]eq或[B]eq),仅仅用[A]和[B]来表示浓度。必须告诉学生的是,在实际情况中,初始浓度和平衡浓度并不相等,即[A]0≠[A]eq、[B]0≠[B]eq,所以 (6)、(7)两式计算的值是不精确的。
3.4 酸碱缓冲溶液 pH的计算
酸碱缓冲溶液是指能减缓因外加强酸或强碱以及稀释而引起 pH急剧变化的溶液,一般是由浓度较大的弱酸及其共轭碱所组成。因为缓冲溶液中缓冲剂本身浓度较大,对计算结果不要求很准确,可以采用近似方法进行。p值流程图在缓冲剂中的应用为 Henderson-Hasselbach方程式,如下:

例如,利用 p值流程图计算含有 7.2×10-1mol/L H2PO4-和 5.0×10-1mol/L HPO24-的缓冲溶液的 pH(已知 Ka(H2PO4-)=6.1×10-8)。解析如下:首先,通过式 (3)计算 pKa的值,得pKa=8-lg(6.1)=7.21(如前面所述,学生通过对数函数 m-lgm图 (图 2)可以求得 lg(6.1)的值)。同理,利用 p值流程图可以分别处理[H2PO4-]、[HPO24-],得到 pA=0.14、pB=0.30。最后将值代入式(8),即可得到该缓冲溶液的 pH=7.1。
在 p值流程图中,还给出了两性物质溶液以及弱酸弱碱盐溶液 pH的计算。最后还附加了 3个关于溶液酸碱度计算的基本方程式:
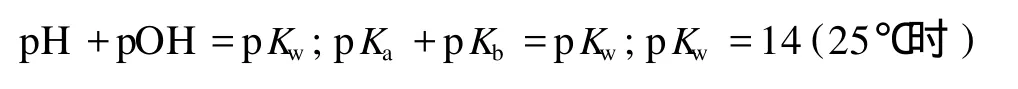
4 p值流程图的计算步骤
p值流程图是根据对水溶液中电解质设置相关的问题,并针对电解质不同的性质所对应的公式绘制的图形。学习者只需要按照箭头的正确指向回答流程图中的问题,并找到合适的方程式,就可以定性和定量地理解 pH。借助于 p值流程图,学生仅仅需要认识酸或碱的种类,会区分化学物质中显酸性的部分 A和显碱性的部分 B,如在乙酸溶液中,CH3COOH为 A; CH3COO-为B。通过流程图中的方程式,可以计算出浓度范围在 1.0~1.0×10-3mol/L之间溶液 pH的估值,计算结果保留为小数点后一位数字。
例 1计算浓度为 2.5×10-2mol/L的NH4Cl溶液的 pH(已知 Ka(NH4+)=5.55×10-10)。

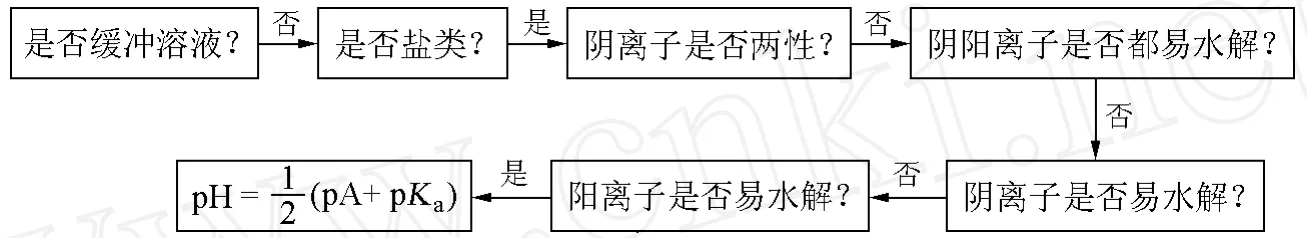
图3 利用 p值流程图计算 NH4Cl溶液的 pH
然后,通过式(3)及对数函数m-lgm图(图 2),即可得到 NH4Cl溶液的 pH=1/2(9.24+ 1.60)=5.4。
5 结语
本文介绍了一种用于解决溶液酸碱度计算的 p值流程图。该流程图结合弱酸、弱碱的近似方程以及其他标准方程,几乎涵盖了化学中可能遇到的所有物质酸碱度 pH的计算。借助于 p值流程图,学生不需要计算器,只要按箭头正确指向的顺序沿着流程图中的问题寻找合适的公式,就可以解决一系列溶液的 pH计算问题。
需要注意的是,使用 p值流程图计算溶液 pH时,要求溶液中只含有单一的电解质或缓冲体系,忽略了水的电离部分,求算的结果只是 pH的近似值,在 p值公式中要求溶液的浓度必须小于或等于 1mol/L。
[1] 武汉大学.分析化学.第4版.北京:高等教育出版社,2000
[2] Pablo A M.Chem Educator,2008,13(4):207
——以大安古河道试验区“古河妈妈”粳米为例

