离子液体中有机物溶解度的QSPR模型分析
潘善飞 胡桂香 吕 杨 邹建卫 俞庆森
(1浙江大学宁波理工学院分子设计与营养工程市重点实验室,浙江宁波 315100; 2浙江大学化学系,杭州 310027)
离子液体中有机物溶解度的QSPR模型分析
潘善飞1,2胡桂香1,*吕 杨1,2邹建卫1俞庆森1,2
(1浙江大学宁波理工学院分子设计与营养工程市重点实验室,浙江宁波 315100;2浙江大学化学系,杭州 310027)
采用偏最小二乘(PLS)分析方法对84个有机物在四种不同的离子液体中的溶解度进行基于VolSurf参数的定量构性关系(QSPR)研究,取得较好的结果.训练集模型对预测集具有良好的预测能力.参数分析表明有机物具有较大体积的亲水区域,对溶解度有利,且有机物与离子液体之间的相互作用能约为-0.84 kJ·mol-1.一定的疏水性对溶解度也是有利因素,当离子液体具有小体积的疏水取代基,有机物具有不对称的局部疏水区域对溶解度有利,当离子液体具有大体积或多个疏水取代基,有机物较高的疏水体积对溶解度有利.多元线性回归(MLR)显示亲水参数W1最重要,表明分子的亲水性是影响有机物在离子液体中溶解的关键因素.
离子液体; 溶解度; 定量构性关系; VolSurf; 偏最小二乘分析; 多元线性回归
离子液体(IL)是由有机阳离子和有机或无机阴离子组成的有机盐,在室温或接近室温时呈液态[1-2]. IL具有热稳定性、低挥发性和强导电性等特殊的物理化学性质[3-5],在化学反应、分离过程、电化学以及环境保护等领域已有广泛应用[6-11].不同的有机物在IL中的溶解度也不相同,因此研究并预测有机物在IL中的溶解度对于开发绿色化学反应及环境保护等具有重要意义.VolSurf[12-15]是一种较新的计算方法,它通过计算分子的三维相互作用场,并采用映像处理方法,把读入或计算得到的三维分子相互作用场转化为容易理解和解释的简单分子参数.本文使用VolSurf方法得到表征有机物三维结构信息的VolSurf参数,采用偏最小二乘分析(PLS)和多元线性回归(MLR)方法建立参数与有机物溶解度之间的定量构性关系(QSPR)模型,并对结果进行比较分析.
1 计算方法
本文共涉及84个有机化合物,均来自文献[2],其结构式见表1.化合物在IL中的溶解度数据以lgL表示,L表示奥斯特瓦尔德溶解系数,无量纲. lgL数值越大,则溶解度越大.溶解度实验值见表2, lgL后的数字分别对应四种IL.IL结构均为烷基咪唑双(三氟甲磺酰)亚胺盐,如图1所示.

图1 四种ILs的结构Fig.1 Structures of the four ILs
在Sybyl 6.8[16]软件中,构建84个化合物的结构式,采用Triops力场,Gasteiger-Hükel电荷,能量收敛标准为0.42 kJ·(mol·nm)-1对化合物进行优化.将优化好的分子采用VolSurf 3.07A/GRID软件计算其三维分子场,在四种不同的IL中均使用水(OH2)与疏水(DRY)两种探针,并在八个不同的能量级上计算探针与目标分子的相互作用,结果共产生62个VolSurf参数.各参数的物理意义详见文献[17].
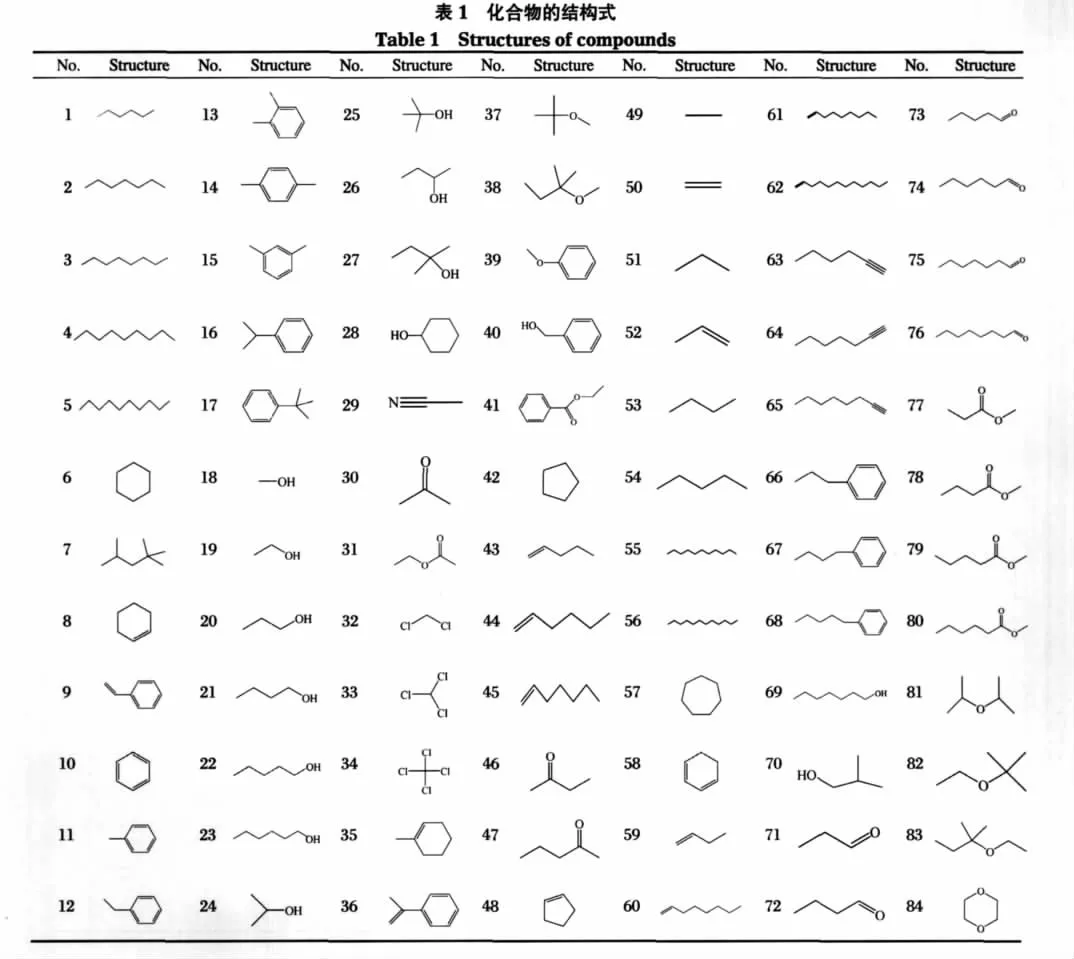

表2 化合物溶解度的实验值、计算值与预测值Table 2 Experimental,calculated and predicted values of compounds′solubilities
采用主成分分析(PCA)和PLS方法对分子的三维结构参数及其与化合物在IL中的溶解度之间的关系进行研究.模型的最佳主成分数用软件自带的留一交叉验证方法(leave-one-out validation)得到,以预测能力q2最大值为最佳主成份.为了提高模型的相关性及预测能力,使用程序自带的部分因子设计(FFD)技术选择有效变量,使变量数下降.建立包括整个样本集的模型1.为了检验模型的预测能力,根据模型1的PLS分析结果,采用软件自带模块中的MDC[19]方法选择子集作为训练集建立模型2,并用模型2对其余化合物的溶解度进行预测.MDC方法能够从所有化合物中选出最具有代表性的化合物,因此可避免模型2与模型1偏离过大.为了探明影响化合物溶解度最重要的三维结构信息,进一步对参数进行多元线性回归分析,并对结果进行分析讨论.
2 结果与讨论
2.1 PLS模型
2.1.1 IL1模型
IL1模型共包括57个化合物.研究中发现化合物29的溶解度为异常值,将其删除进行后续研究. FFD技术使变量数降至58.PCA分析显示,变量信息主要集中在前两个主成分,可以解释61.98%的信息量,第1和第2主成分的信息量分别为43.30%和18.68%.模型1的PLS分析显示,在主成分数为6时,模型的相关性r2=0.98,预测能力q2=0.94,计算标准偏差Sc=0.17,预测标准偏差Sp=0.29.化合物溶解度的实验值和计算值见表2.
根据模型1的结果,采用MDC方法从56个化合物中选出50个分子作为训练集建立模型2,其余6个化合物作为预测集.FFD技术使变量数降至60, PLS分析显示,模型最佳主成分数为8,r2=0.99,q2= 0.95,Sc=0.14,Sp=0.27.模型2中化合物溶解度实验值与计算值/预测值相关性见图2,化合物溶解度的计算值和预测值见表2.模型2对其余6个化合物进行预测,在主成分数为8时,预测结果最好,预测标准偏差为0.25,与模型2的预测标准偏差0.27非常接近,说明预测效果好.

图2 模型2中化合物溶解度的实验值与计算值或预测值之间的相关性(IL1)Fig.2 Relationship between experimental and calculated or predicted values of compounds′solubilities in model 2(IL1)○:training set;●:test set;the line is fitted with the training set.
60个参数及其相关系数如图3所示.各参数意义如下:1-33为水探针OH2产生的参数,依次为V、S、R、G、W1-8、Iw1-8、Cw1-7、Emin1-3OH2、D12OH2、D13OH2、D23OH2;34-54为疏水探针产生的参数,依次为D1-8、ID1-3、ID5-8、Emin1-3DRY、D12DRY、D13DRY、D23DRY;55-58为混合参数,依次为HL1-2、A、CP;59-60为POL和MW.相关系数大于零,表示正相关,同理相关系数小于零表示负相关.柱越长表示相关系数越大,对溶解度的影响越大.下同.

图3 参数在模型2中的相关系数(IL1)Fig.3 Coefficient plot of descriptors in model 2(IL1)
由图3可以看出,除了参数CP与化合物溶解度呈弱的负相关,其余参数均呈正相关.CP为临界堆积参数,定义为:疏水体积/(亲水表面积×疏水长度).绝大部分亲水参数与化合物溶解度呈较高的正相关,表明分子内具有较大体积的亲水区域对化合物溶解度有利,其中W1、W2表现为强的正相关,这提示我们有机物在IL1中溶解时,两者之间的相互作用能与有机物和水探针相互作用的第一、二能级(-0.84,-2.09 kJ·mol-1)相近.与亲水参数相比,疏水参数与化合物溶解度呈较弱的正相关,说明分子内一定的疏水性也对溶解度有利.从图中可以看出,参数ID1-3,Emin3DRY呈较强的正相关,ID为疏水相互作用能矢量参数,是指从分子的质量中心指向疏水区域中心的矢量,数值高,说明分子表面具有不对称的局部疏水区域;数值小,说明分子表面的疏水区或者距离分子的质量中心很近,或者它们在分子相对的两端处于平衡.ID1,2,3与溶解度呈较强的正相关,说明在有机物与疏水探针相互作用的第一、二、三能级上(-0.84,-1.67,-2.51 kJ·mol-1),具有不对称的局部疏水区域的分子在IL1中的溶解度高.这个能级与水探针能级接近.由此可以看出,有机物在IL1中溶解时,两者之间的相互作用能大约为-0.84--2.51 kJ·mol-1,并且化合物与IL1不仅存在大面积的极性相互作用,也存在局部疏水相互作用.Emin3DRY为疏水探针与化合物之间三个局部最小相互作用能之一,该参数与溶解度较强的正相关进一步证实了化合物与IL1之间局部疏水相互作用能的存在.HL1-2为亲水-亲脂平衡参数,数值越高,表示分子内亲水区域较疏水区域大,弱的正相关表示亲水区域较疏水区域大的分子溶解度高.A为两亲矩,是从疏水区域中心指向亲水区域中心的矢量,与溶解度正相关,说明疏水区与亲水区的不平衡性越高,溶解度越大.CP是唯一一个与溶解度呈负相关的参数,说明具有较大的疏水体积对溶解度不利,但大的亲水表面积或者疏水长度对溶解度有利.由此可见,四个混合参数的结论与亲水、疏水参数完全一致.极化率POL和分子量MW不是从三维分子场中计算得到的参数,与所使用的探针的数目和类型无关.POL与分子体积V相关性很高,V, POL,MW均与溶解度呈正相关,说明在一定范围内,大体积、高分子量的化合物在IL1中溶解度高.

图4 模型2中化合物溶解度的实验值与计算值或预测值之间的相关性(IL2)Fig.4 Relationship between experimental and calculated or predicted values of compounds′solubility in model 2(IL2)○:training set;●:test set;the line is fitted with the training set.
2.1.2 IL2模型
IL2模型包括60个化合物.研究中发现化合物29,34的溶解度为异常值,将其删除进行后续研究.变量数为59时,PCA分析显示,前三个主成分可以解释65.94%的信息量,第1、2、3主成分的信息量分别为49.20%、9.51%和7.23%,第一主成分最重要.模型1的PLS分析显示,在主成分数为9时,r2=0.98, q2=0.91,Sc=0.10,Sp=0.23.化合物溶解度的实验值和计算值见表2.
根据模型1的结果,从58个分子中选出50个作为训练集建立模型2,其余8个化合物作为预测集.变量数为60时,PLS分析显示,模型最佳主成分数为9,r2=0.98,q2=0.87,Sc=0.11,Sp=0.27.模型2中化合物溶解度实验值与计算值/预测值相关性见图4,化合物溶解度的计算值和预测值见表2.模型2对其余8个化合物进行预测,在主成分数为9时,预测结果最好,预测标准偏差为0.16,远小于模型2的预测标准偏差0.27,说明预测效果非常好.
60个参数及其相关系数如图5所示.各参数意义如下,1-32为水探针OH2产生的参数,依次为V、S、R、G、W1-8、Iw1-6、Iw8、Cw1-7、Emin1-3OH2、D12OH2、D13OH2、D23OH2;33-54为疏水探针产生的参数,依次为D1-8、ID1-8、Emin1-3DRY、D12DRY、D13DRY、D23DRY;55-58为混合参数,依次为HL1-2、A、CP;59-60为POL和MW.

图5 参数在模型2中的相关系数(IL2)Fig.5 Coefficient plot of descriptors in model 2(IL2)

图6 模型2中化合物溶解度的实验值与计算值或预测值之间的相关性(IL3)Fig.6 Relationship between experimental and calculated or predicted values of compounds′solubilities in model 2(IL3)○:training set;●:test set;the line is fitted with the training set
由图5可以看出,除个别参数外,大部分参数与化合物溶解度呈正相关.对于亲水参数来说,绝大部分与化合物溶解度呈较高的正相关,说明分子内具有较大体积的亲水区域对化合物溶解度有利,其中W1、W2表现为强的正相关,这与IL1结果相同. D23OH2是唯一的负相关亲水参数,该参数为亲水探针与化合物之间第二、第三局部最小相互作用能之间的距离,负相关说明两者之间距离过大对溶解度不利.大部分疏水参数与溶解度呈正相关,其中D6-D8表现为较强的正相关,说明分子的疏水性越强,在IL2中的溶解度越大.ID5-7参数显示出弱的负相关,说明分子具有过高的不对称的局部疏水区域对溶解度不利.HL1-2,A参数与溶解度呈弱的负相关,说明分子内过高的亲水性对溶解度不利.CP与溶解度呈正相关,说明具有较大的疏水体积对溶解度有利.POL和MW均与溶解度呈正相关,这一点与IL1结果相同.
2.1.3 IL3模型
IL3模型共包括52个化合物.研究中发现化合物29的溶解度为异常值,将其删除进行后续研究.变量数为59时,PCA分析显示,变量信息主要集中在前两个主成分,可以解释65.93%的信息量,第1和第2主成分的信息量分别为50.51%和15.42%.模型1的PLS分析显示,在主成分数为6时,r2= 0.98,q2=0.91,Sc=0.19,Sp=0.36.化合物溶解度的实验值和计算值见表2.

图7 参数在模型2中的相关系数(IL3)Fig.7 Coefficients plot of descriptors in model 2(IL3)
根据模型1的结果,采用MDC方法从51个化合物中选出40个分子作为训练集建立模型2,其余11个化合物作为预测集.变量数为50时,PLS分析显示,模型最佳主成分数为5,r2=0.96,q2=0.90,Sc= 0.23,Sp=0.37.模型2中化合物溶解度实验值与计算值(预测值)相关性见图6,化合物溶解度的计算值和预测值见表2.模型2对其余11个化合物进行预测,在主成分数为5时,预测结果最好,预测标准偏差为0.16,远小于模型2的预测标准偏差0.37,说明预测效果非常好.
50个参数及其相关系数如图7所示.各参数意义如下:1-32为水探针OH2产生的参数,依次为V、S、R、G、W1-8、Iw1-8、Cw1-7、Emin1-3OH2、D13OH2、D23OH2;33-45为疏水探针DRY产生的参数,依次为D2-3,D6,D8,ID1-2,ID4-7,Emin1-2DRY,D23DRY;46-49为混合参数,依次为HL1-2、A、CP;50为POL.
比较图7与图3可以发现,两者非常接近.除了参数CP与化合物溶解度呈弱的负相关,其余参数均呈正相关.绝大部分亲水参数与化合物溶解度呈较高的正相关,且W1、W2表现为强的正相关;疏水参数与化合物溶解度也呈正相关,且ID1-2呈较强的正相关;HL1-2、A均与溶解度呈弱的正相关,CP与溶解度呈负相关;POL与溶解度呈正相关.所有结果均与IL1相同,说明有机物在IL1与IL3中的溶解度的影响因素相同.
2.1.4 IL4模型
IL4模型共包括38个化合物.研究中发现化合物29、34的溶解度为异常值,将其删除进行后续研究.变量数为57时,PCA分析显示,变量信息主要集中在前两个主成分,可以解释65.02%的信息量,第 1和第 2主成分的信息量分别为 55.61%和9.41%.模型1的PLS分析显示,在主成分数为5时,r2=0.94,q2=0.82,Sc=0.19,Sp=0.34.化合物溶解度的实验值和计算值见表2.

图8 模型2中化合物溶解度的实验值与计算值或预测值之间的相关性(IL4)Fig.8 Relationship between experimental and calculated or predicted values of compounds′solubilities in model 2(IL3)○:training set;●:test set;the line is fitted with the training set.
根据模型1的结果,采用MDC方法从36个化合物中选出30个分子作为训练集建立模型2,其余6个化合物作为预测集.变量数为54时,PLS分析显示,模型最佳主成分数为4,r2=0.93,q2=0.83,Sc= 0.22,Sp=0.35.模型2中化合物溶解度实验值与计算值(预测值)相关性见图8,化合物溶解度的计算值和预测值见表2.模型2对其余6个化合物进行预测,在主成分数为4时,预测结果最好,预测标准偏差为0.36,与模型2的预测标准偏差0.35非常接近,说明预测效果较好.
54个参数及其相关系数如图9所示.各参数意义如下:1-30为水探针OH2产生的参数,依次为V、S、R、G、W1-8、Iw2-8,、Cw1-7、Emin1-2OH2、D12OH2、D13OH2;31-48为疏水探针DRY产生的参数,依次为D1-8、ID1-7、Emin1-2DRY、D23DRY; 49-52为混合参数,依次为HL1-2、A、CP;53-54为POL和MW.

图9 参数在模型2中的相关系数(IL4)Fig.9 Coefficient plot of descriptors in model 2(IL4)
由图9可以看出,对于30个亲水参数,除了个别表现为极弱的负相关,大部分与溶解度呈正相关,其中W1,W2表现为强的正相关,说明分子内具有较大体积的亲水区域对化合物溶解度有利.对于疏水参数,D5-8表现为强的正相关,说明分子的疏水性越强,在IL4中的溶解度越大;ID5-6参数显示出一定的负相关,说明分子具有过高的不对称的局部疏水区域对溶解度不利,这些均与IL2结果类似.不同的是,D23DRY参数与溶解度呈负相关,说明疏水探针与化合物之间第二、第三局部最小相互作用能之间的距离过大对溶解度不利.HL1-2、A参数与溶解度呈弱的负相关,说明分子内过高的亲水性对溶解度不利;CP与溶解度呈正相关,说明具有较大的疏水体积对溶解度有利,这也与IL2结果相同.另外,POL和MW与溶解度呈正相关.
2.2 MLR模型
在PLS模型中,参数数量较多,为了探明化合物在IL中溶解的主要影响因素,采用MLR中的逐步回归方法对溶解度与模型2中的参数进行建模分析,所得方程列于表3.
从表中可以看出,在四种IL中,影响有机物溶解度的最重要的参数均为亲水参数W1,且均与溶解度呈正相关,表明分子内具有较大体积的亲水区域对化合物溶解度有利,且有机物与IL之间的相互作用能约为-0.84 kJ·mol-1,这点与PLS结果一致.模型中参数之间的相关性见表4,由表可见,各模型参数之间的相关性均小于0.90,说明模型具有较高的稳定性.图10所示为各IL中溶解度最大和最小化合物的W1区域.在IL1中,溶解度最大和最小的化合物分别为69(4.76)和49(-0.06),从图中可以看出,69化合物的W1区域远大于49,有利因素使得69的溶解度远高于49的.IL2中的68(4.71)与54 (1.23);IL3中的40(5.58)与49(-0.17);IL4中的23 (4.41)与1(1.21),W1区域与溶解度情况均与IL1完全相同,进一步验证了W1参数对溶解度的影响程度.

表3 有机物在四种IL中的溶解度的MLR模型Table 3 MLR models of compounds′solubilities in four ILs

图10 四种IL中化合物溶解度最大和最小分子的W1亲水区域Fig.10 Hydrophilic region W1 of compounds with the maximum and minimum solubility in four ILs
2.3 对比分析
在IL1初始建模时发现,化合物29溶解度的预测偏差为2.83,远远大于模型的预测标准偏差0.47,且在其它离子液体中均存在类似情况.因此,在每种IL的PLS模型中,化合物29均作为异常值被删除.这可能是因为29号化合物乙腈是所有化合物中极性最强的物质,在IL中的溶解有别于其它化合物,因此出现较大偏差.化合物34在IL2与IL4的模型中被删除,IL1中缺少34的溶解度数据,而IL3中,虽然34没有被删除,但其偏差0.45远大于计算偏差0.19.这可能是因为34号四氯化碳是对称性好、非极性强的化合物,在IL中的溶解稍有别于其它化合物.

表4 MLR模型中各参数之间的相关性Table 4 Correlation between parameters in MLR models
对比PLS模型可以发现,四种IL中的溶解度的影响因素具有相同之处,如亲水参数基本与化合物溶解度呈正相关,且W1、W2均表现为强的正相关;大部分疏水参数也与化合物溶解度呈正相关; POL、MW与溶解度呈正相关.由此可见,分子内具有较大体积的亲水区域以及适当的疏水区域对化合物溶解度有利,且有机物与IL之间的相互作用能约为-0.84 kJ·mol-1;在一定范围内,分子的极化率与分子量越大,分子在IL中的溶解度越高.但IL不同,影响因素也稍有区别,其中IL1和IL3类似,而IL2和IL4类似.如在IL1,IL3中,疏水参数的最强作用为ID类参数,强调了分子不对称的局部输水区域,且HL1-2、A与溶解度呈正相关,而CP为负相关;在IL2和IL4中,疏水参数的最强作用为D类参数,强调了分子的疏水性能,而部分ID类参数则为负相关,HL1-2,A参数与溶解度呈负相关,而CP为正相关.这可能是由IL的结构引起的.IL3, IL1的3位取代基分别为疏水的乙基,丁基,取代基体积相对较小,但有机物与取代基之间的疏水作用又有利于溶解,因此具有不对称局部输水区域的分子有利于在两种IL中的溶解.而IL2的3位取代基为己基,体积较大,不对称的局部疏水区已经不能满足疏水作用需要,因此,疏水作用重要性增加,使得D与溶解度呈正相关,而ID出现负相关.IL4的3位取代基虽然为小体积乙基,但由于2位甲基的引入,使得疏水作用增加,因此结果与IL2类似.HL1-2、A、CP四个混合参数与溶解度的相关性更进一步证实了在IL1和IL3中化合物具有不对称局部疏水区对溶解度有利,而在IL2和IL4中,化合物具有较大的疏水区域对溶解度有利.
另外,无论是PLS模型还是MLR模型,IL1-3的结果均优于IL4.这可能是因为IL4是1,2-二甲基-3-乙基咪唑双(三氟甲磺酰)亚胺盐,与其它三个IL相比,由于2位甲基的引入,使得咪唑环上氮原子的电荷强度减弱,离子性降低,仅采用亲水探针和疏水探针不足以模拟有机物在其中的溶解情况,从而导致结果稍劣.
3 结 论
对一系列有机物在四种不同的IL中的溶解度进行了QSPR研究,得到了较好的结果,训练集对预测集具有较好的预测能力.PLS模型的参数分析表明,对于四种IL,亲水参数与化合物溶解度呈正相关,且一、二能级的亲水体积为强的正相关,说明分子内具有较大体积的亲水区域对化合物溶解度有利,且有机物与IL之间的相互作用能约为-0.84 kJ· mol-1.有机物在IL中溶解也需具备一定的疏水性,对于具有小体积取代基的IL1和IL3,不对称的局部疏水区域对溶解度有利,而对于具有大体积或多个取代基的IL2和IL4,较高的疏水体积对溶解度有利.POL、MW也与溶解度呈正相关,说明在一定范围内,分子的极化率与分子量越大,分子在IL中的溶解度越高.MLR方法分析表明,在所有的参数中,亲水参数W1是最重要的参数,说明有机物要在IL中溶解,首先具备较高的亲水性能.
1 Jonathan,G.H.;Heather,D.W.;Richard,P.S.;Ann,E.V.;Robin, D.R.Chem.Commun.,1998:1765
2 Alan,R.K.;Minati,K.;Iva,B.S.S.;Svetoslav,H.S.;Dimitar,A. D.;Mati,K.;William,E.A.J.Chem.Eng.Data,2008,53(5): 1085
3 Luís,C.B.;João,N.R.;Joaquim,J.M.;Carlos,A.M.Chem.Eur. J.,2002,8(16):3671
4 Tom,W.Coord.Chem.Rev.,2004,248:2459
5 John,S.W.J.Mol.Catal.A-Chem.,2004,214:11
6 Thomas,W.Chem.Rev.,1999,99(8):2071
7 Zhao,D.B.;Wu,M.;Kou,Y.Catal.Today,2002,74:157
8 Xu,L.J.;Chen,W.P.;Xiao,J.L.Organometallics,2000,19: 1123
9 Richard,A.B.;Pamela,P.;Erin,M.;Charles,A.E.;Charles,L.L.; Philip,G.J.J.Am.Chem.Soc.,2001,123:1254
10 Fuller,J.;Carlin,R.T.;Osteryoung,R.A.J.Electrochem.Soc., 1997,144(11):3881
11 Blanchard,L.A.;Hancu,D.;Bechman,E.J.;Brenneche,J.F. Nature,1999,399:28
12 Sé bastien,R.;Giulia,C.;Giuseppe,E.;Patrick,G.;Alessandra,P.; Pierre-Alain,C.;Bernard,T.J.Mol.Graphics Modell.,2001,19 (6):521
13 Gabriele,C.;Manuel,P.;Wolfgang,G.Eur.J.Pharm.Sci.,2000, 11(Suppl.2):S29
14 Bernard,T.;Andrzej,J.B.Eur.J.Pharm.Sci.,2000,11(Suppl.2): S3
15 Yan,L.F.;Hu,G.X.;Xu,J.;Zhao,W.N.;Yu,Q.S.Acta Phys.-Chim.Sin.,2008,24(12):2249 [颜琳芳,胡桂香,徐 晶,赵文娜,俞庆森.物理化学学报,2008,24(12):2249]
16 SYBYL Molecular Modelling Softwate.Version 6.8.St.Louis, MO:Tripos,2001
17 Cruciani,G.;Crivori,P.;Carrupt,P.A.;Testa,B.J.Mol.Struct.-Theochem,2000,503:17
18 Brian,D.H.;Richard,M.H.;Elizabeth,R.;John,W.Quant.Struct.-Act.Relat.,1996,15:285
QSPR Model Analysis on the Solubility of Organic Compounds in Ionic Liquids
PAN Shan-Fei1,2HU Gui-Xiang1,*LÜ Yang1,2ZOU Jian-Wei1YU Qing-Sen1,2
(1Key Laboratory for Molecular Design and Nutrition Engineering of Ningbo City,Ningbo Institute of Technology, Zhejiang University,Ningbo 315100,Zhejiang Province,P.R.China;2Department of Chemistry, Zhejiang University,Hangzhou 310027,P.R.China)
A quantitative structure-property relationship(QSPR)study on the solubility of 84 organic compounds in 4 different ionic liquids was done based on VolSurf parameters using the partial least square(PLS)statistical method and good results were obtained.The training set model predicts the solubilities of the test set well.An analysis of the VolSurf descriptors show that large volume hydrophilic regions are beneficial for solubility,and the interaction energy is about-0.84 kJ·mol-1between the organic compounds and the ionic liquids.A certain degree of hydrophobicity is also favorable for solubility.When the ionic liquids have a small hydrophobic substituent,an asymmetric partial hydrophobic region in the organic compound is advantageous for solubility.If the ionic liquid has a large hydrophobic substituent,a large hydrophobic region in the organic compound benefits the solubility.Multiple linear regression (MLR)analysisshowsthathydrophilicparameterW1 isthemostimportantparameter,whichindicatesthathydrophilicity is a key factor that influences the solubility of organic compounds in ionic liquids.
Ionic liquid; Solubility; Quantitative structure-property relationship; VolSurf; Partial least square; Multiple linear regression
O641;O645
Received:February 26,2010;Revised:May 11,2010;Published on Web:July 6,2010.
*Corresponding author.Email:hugx@nit.zju.edu.cn;Tel:+86-574-88229517.
The project was supported by the National Natural Science Foundation of China(20803063).
国家自然科学基金(20803063)资助项目
ⒸEditorial office of Acta Physico-Chimica Sinica