硅基芯片表面化学性质对蛋白质固定化的影响
周稳稳 廉 洁 胡科家 高云华 徐 百
(1中国科学院理化技术研究所光化学转换和功能材料重点实验室,北京 100190; 2中国科学院研究生院,北京 100049)
硅基芯片表面化学性质对蛋白质固定化的影响
周稳稳1,2廉 洁1,2胡科家1,2高云华1,*徐 百1,*
(1中国科学院理化技术研究所光化学转换和功能材料重点实验室,北京 100190;2中国科学院研究生院,北京 100049)
制备蛋白质芯片的关键在于将蛋白质固定到芯片表面并保持其生物学活性.本实验中,我们分别采用物理吸附、直接化学固定、加入间隔臂化学固定和生物亲和作用固定的方法将癌胚抗原(CEA)抗体固定到硅基芯片的二氧化硅表面.基于抗原-抗体的特异性相互作用,利用双抗体夹心酶联免疫法(ELISA)评价各种方法固定抗体的效果.实验结果表明,在修饰有氨基的表面采用戊二醛作为偶联试剂固定CEA抗体具有最高的偶联效率,引入多聚赖氨酸(poly-L-lysine)作为间隔臂可以显著增强固定效果,并可进一步降低非特异性吸附.而利用生物亲和作用固定CEA抗体也可获得较好的固定效果,但是非特异性吸附较严重.
蛋白质芯片; 抗体固定; 夹心反应; 酶联免疫吸附分析; 氨基表面; 戊二醛; 多聚赖氨酸
蛋白质芯片可用于研究蛋白质分子之间的相互作用,在分子识别、临床诊断、环境监测、质量控制、高通量和快速检测领域有着广泛的应用前景[1-6].构建蛋白质芯片的基础是将特异性的蛋白质分子(如抗体分子)固定到芯片表面并保持其生物学活性.由于蛋白质在结构上和化学性质上都比DNA更复杂[7-8],在固定到固体表面的过程中容易失活,一般认为这可能是由于固相表面的化学微环境因素导致了蛋白质空间结构的改变[9-11].此外,化学的、物理学的以及结构上的种种差异使得各种蛋白质在固体表面上的固定效率呈现很大差异[12-13].因此对芯片表面蛋白质固定策略的研究是极其重要的.如何在不同的固相表面固定足够多的保持生物活性的蛋白质分子是具有挑战性的工作,也是众多蛋白质组学研究者孜孜追求的目标[14-20],许多研究者开发出各种新颖的蛋白质固定技术,并取得了较好的效果.
表面化学在蛋白质固定中扮演了一个极其重要的角色,各种固定蛋白质的策略都离不开对固相表面的化学修饰.首先需要在固相表面(如硅片、玻片、塑料等)衍生出化学活性的功能团,然后通过化学反应将蛋白质分子(如抗体分子)偶联固定到这种化学活化的固相表面.在这个过程中,如何提高偶联的效率并保持蛋白质分子的生物活性是主要挑战.目前已经有许多不同的表面处理方法和共价偶联方法[12,14-15,21].这些方法大致可以分为四类:(a)直接物理吸附[22-24],如在聚苯乙烯表面和聚赖氨酸表面直接吸附蛋白质分子;(b)直接共价连接[15,25],如在短链氨基、巯基或羧基表面直接偶联蛋白质分子;(c)加入间隔臂共价连接[26-29],即在偶联蛋白质分子之前,先引入一层高分子,通常选择树枝状高分子或具有较好生物相容性的高聚物;(d)利用生物亲和作用固定蛋白质分子[17,30-31],如先将结合蛋白A固定到固相表面,然后再利用它们与免疫球蛋白Fc段的特异性结合固定抗体分子.虽然已经有很多文献报道了上述不同的表面修饰方法,但是很少有文献系统研究这些方法对蛋白质固定化效果的影响.因此,我们设计了一个系统研究方案,研究了在硅基二氧化硅表面不同表面修饰方法对癌胚抗原(CEA)抗体固定的影响,以双抗体夹心酶联免疫法(ELISA)评价CEA抗体的固定效果,以期优化筛选出最佳的抗体固定策略用于蛋白质芯片的进一步开发.
1 实验部分
1.1 试剂和仪器
3-氨基丙基三乙氧基硅烷(APTES,99%),3-巯基丙基三甲氧基硅烷(MPTS,85%,比利时ACROS公司);3-缩水甘油醚氧基丙基三甲氧基硅烷(GPTS, 97%,美国Alfa Aesar公司);对醛基苯甲酸(FBA, 97%),聚苯乙烯(PS,平均分子量25000),多聚赖氨酸(ε-PLL,分子量70-150 kDa),蛋白A(Protein A),蛋白G(Protein G),亲和素(Avidin),生物素(D-Biotin,美国Sigma-Aldrich公司);戊二醛(GA,25%(φ)水溶液),2-吗啉乙磺酸(MES,ultra grade),吐温20(Tween 20,美国Merck公司);1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl,98%),N-羟基琥珀酰亚胺(NHS,98+%),SMCC(4-(N-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯)/sulfo-SMCC(美国Pierce Biotechnology公司);癌胚抗原(CEA,美国Fitzgerald Industries International Inc.公司);抗癌胚抗原包被抗体(CEA Ab),生物素化抗癌胚抗原包被抗体(CEA Ab-Biotin),辣根酶标记抗癌胚抗原标记抗体(CEA Ab-HRP),TMB显色液(北京博迈世纪生物技术有限公司);牛血清白蛋白(BSA,98%),小牛血清,羊抗人IgG纯化抗体(≥95%),蔗糖(≥99%),海藻糖(≥99%,北京欣经科生物技术有限公司);壳聚糖(chitosan,分子量150 kDa,脱乙酰度95%);磷酸盐缓冲液(PBS,3.63 g Na2HPO4·12H2O和0.24 g KH2PO4溶于超纯水并定容至1 L);碳酸盐缓冲液(CB,1.59 g Na2CO3和2.93 g NaHCO3溶于超纯水并定容至1 L);MES缓冲液(MES,15.92 g MES溶于900 mL超纯水,再用NaOH调节pH值到6.5,最后用超纯水定容至1 L);无水乙醇(分析纯),甲苯(分析纯),N,N-二甲基甲酰胺(DMF,分析纯,北京化工厂);其他试剂为市售分析纯或更高级别.
EASY pure LF超纯水系统(美国Barnstead公司);PDC-M型等离子清洗器(成都铭恒科技发展有限公司);ZD-85气浴恒温振荡器(江苏金坛市金城国胜实验仪器厂);JC2000C1全自动接触角仪(上海中晨数字技术设备有限公司);RT-2100C酶标分析仪(深圳市雷杜电子有限公司);微反应池(7.5 mm× 13 mm×5 mm,自制);具有200 nm厚二氧化硅膜的硅片(6.6 mm×10.7 mm×0.75 mm,北京大学微电子学系).
1.2 硅片的前处理
先用无水乙醇和去离子水交替清洗硅片3次,并用氮气流吹干,然后置于等离子清洗器中处理2 min(电压600 V,氧气流量800 mL·min-1),使硅片表面生成一层活性的羟基(接触角<5°).等离子处理后的硅片应立即进行后续的表面化学修饰,因为这些活性的羟基是不稳定的,在空气中容易再次交联形成硅氧桥键[32-33].
1.3 硅片表面不同修饰方法固定抗体
1.3.1 直接吸附抗体
将氧等离子体处理好的硅片浸入到10 mg·mL-1PS的甲苯溶液和10 mg·mL-1PLL的PBS溶液中,置于室温下浸泡过夜,然后分别取出.PS硅片直接甩干;PLL硅片用超纯水润洗5次,并用氮气吹干.然后将两种表面的硅片置于50℃烘箱中烘烤30 min,取出自然冷却至室温.将抗癌胚抗原(CEA)包被抗体(10 μg·mL-1,0.5%(w,质量分数)海藻糖[15,34], CB溶液)分别滴加到两种硅片表面,置于4℃放置过夜(如图1(a)所示).
1.3.2 直接共价连接抗体
将氧等离子体处理好的硅片分别迅速浸入到5%(φ,体积分数)APTES的乙醇溶液,5%(φ,体积分数)GPTS的乙醇溶液,5%(φ)MPTS的乙醇溶液中并置于37℃气浴恒温振荡器反应2 h.反应完成后用无水乙醇清洗5次,并用氮气吹干.其中APTES硅片置于90℃烘箱中烘烤40 min.分别得到氨基硅片,环氧基硅片和巯基硅片.然后用四种方式偶联固定抗体:(1)直接通过环氧基连接抗体,将CEA包被抗体(10 μg·mL-1,0.5%(w)海藻糖,PBS溶液)滴加到环氧基硅片表面,然后置于4℃放置过夜;(2)通过SMCC连接抗体,将巯基硅片浸泡在1 mg·mL-1SMCC的DMF溶液或sulfo-SMCC的PBS溶液中37℃反应1 h,用无水乙醇或PBS清洗干净后将CEA包被抗体(10 μg·mL-1,0.5%(w)海藻糖,PBS溶液)滴加到硅片表面,然后置于4℃放置过夜;(3)通过戊二醛连接抗体,将氨基硅片浸泡在5%(φ)戊二醛的PBS溶液中室温反应1.5 h,PBS清洗干净后将CEA包被抗体(10 μg·mL-1,0.5%(w)海藻糖,PBS溶液)滴加到硅片表面,然后置于4℃放置过夜;(4)通过EDC/NHS活化羧基连接抗体,将氨基硅片浸泡在50 mg·mL-1对醛基苯甲酸的DMF溶液中37℃反应1 h得到羧基化表面,DMF清洗干净后再将羧基硅片浸泡在EDC和NHS的混合溶液中(0.4 mol· L-1EDC+0.1 mol·L-1NHS,pH 6.5,MES溶液)室温反应30 min,4℃冷藏MES溶液清洗干净后再将CEA包被抗体(10 μg·mL-1,0.5%(w)海藻糖,PBS溶液)滴加到硅片表面,然后置于4℃放置过夜(如图1 (b)示).
1.3.3 加入间隔臂共价连接抗体
按照1.3.2节的方法用APTES将硅片表面先修饰成氨基,然后将氨基硅片浸泡在5%(φ)戊二醛的PBS溶液中2 h,PBS清洗干净后将硅片浸入到1 mg·mL-1PLL的PBS溶液(pH 7.4)或1 mg·mL-1壳聚糖的醋酸溶液(pH 6.5)中室温反应6 h,PBS清洗干净后再用戊二醛将表面醛基化,然后将CEA包被抗体(10 μg·mL-1,0.5%(w)海藻糖PBS溶液)滴加到硅片表面,置于4℃放置过夜(如图1(c)示).
1.3.4 利用生物亲和作用固定抗体
按照1.3.3节的方法通过聚赖氨酸和戊二醛将亲和蛋白A/G或亲和素Avidin固定到硅片表面, PBS清洗后再将CEA包被抗体或CEA包被抗体-Biotin滴加到相应的表面,然后置于4℃放置过夜(如图1(d)示).
1.4 抗体芯片的封闭
将各种CEA包被抗体芯片分别浸入到含有10 mg·mL-1BSA的PBS溶液中,置于气浴恒温振荡器上37℃温育1 h,然后分别用0.1%(φ)PBST清洗3次,并浸泡在保护剂(5%(w)蔗糖PBS溶液)中置于4℃待测.其中,通过蛋白A/G亲和固定的抗体硅片(蛋白A/G-CEA抗体硅片)需先用羊抗人IgG抗体进行封闭,然后再用BSA封闭;通过亲和素-生物素亲和固定的抗体硅片(Avidin-Biotin-CEA抗体硅片)需先用D-Biotin进行封闭,然后再用BSA封闭.
1.5 抗体芯片固定效果的酶联评价
为了评价硅片表面固定的抗体的密度和生物学活性,基于抗体的免疫学特性,我们采用抗原抗体分析中常用的酶联免疫夹心反应的方法进行评价(图2).
这一评价方法可以定量地反映硅片上的抗体固定效果,即硅片表面具有生物活性的抗体分布情况.并且可以移植到其他标志物(如荧光标记或磁标记)的分析检测中.具体的操作步骤如下.
1.5.1 抗原抗体的免疫夹心反应
将不同固定方法修饰的抗体芯片(各5片以上)清洗干净后,置于微反应池中,然后加入不同浓度的CEA抗原(200 μL,45%(φ)小牛血清稀释),置于气浴恒温振荡器上37℃温育1 h,反应完成后分别取出用0.1%(φ)PBST清洗3遍.再将硅片放入新的微反应池中,接着再加入CEA标记抗体-HRP(4 μg· mL-1,200 μL,15 mg·mL-1BSA稀释),置于37℃温育1 h,最后分别取出用0.1%(φ)PBST清洗3遍.
1.5.2 显色反应
将免疫反应后的芯片置于新的微反应池中,加入TMB显色液各150 μL,37℃温育15 min后,将显色反应后的溶液移取到96孔酶联板中,再分别加入终止液(2 mol·L-1H2SO4)各50 μL,最后用酶标仪进行比色测试,比色测试应在加入终止液后5 min内完成.


2 结果与讨论
2.1 直接吸附抗体
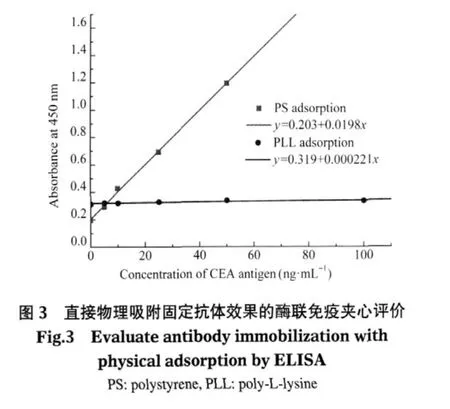
蛋白质之间的吸附作用主要来自于疏水作用、静电作用、范德华力作用、路易斯酸碱力作用以及构象变化和表面附近受限的侧向扩散[13].通过物理吸附的方式直接固定抗体是最经典的抗体固定方式,常用的方法是将抗体吸附到疏水性表面(如聚苯乙烯(PS)表面)或带有高密度电荷的表面(如多聚赖氨酸(PLL)包被的玻片),这种方法具有价格低廉、操作简便的优点.图3是对两种最常用的物理吸附固定抗体方法的测试结果,从图中可以看出,在PS表面随着CEA抗原浓度的增加呈现出较好的线性相关,这说明在PS表面通过疏水相互作用可以固定上大量具有生物活性的CEA抗体,但是却具有较高的非特异性吸附.而在PLL表面则几乎没有免疫响应,这说明通过静电相互作用并未能有效固定CEA抗体.我们认为这可能是因为二氧化硅表面主要为一层电中性的硅羟基或硅氧桥键,很难吸附上电荷富集的PLL,因而没有能够形成一层富集电荷的表面来用于进一步吸附CEA抗体.由于吸附是竞争的和可逆的,因此在后续的免疫反应和多次冲洗过程中,可能造成硅片表面抗体的脱落,进而影响其结果的稳定性和一致性,并且通过物理吸附固定的抗体通常呈现区域聚集状,也具有较高的非特异性吸附,这在高灵敏度的分析检测中是个很严重的问题,因而其应用范围有限.
2.2 直接共价连接抗体
相对于物理吸附法固定抗体,通过氨基、羧基或巯基共价连接的方式可以使得抗体的固定更加稳定.通常的方法是先用硅烷试剂(如APTES、MPTS或GPTS等)在硅片表面衍生出具有化学活性的功能团(如氨基、巯基、羧基、环氧基等),然后再通过各种偶联试剂(如戊二醛、SMCC、EDC/NHS等)将抗体固定到硅片表面.由于固定效率依赖于交联基团的数量和偶联反应的效率,抗体种类的变化和反应条件的波动常常会带来较大影响,因而通过直接共价连接的方式固定抗体的密度常常较低.图4是常用的几种直接共价连接的方式固定抗体的酶联测试结果.从图中可以看出,利用APTES进行硅烷化,戊二醛作为偶联试剂具有最好的固定效果,但是仍然具有较高的非特异性吸附.这可能是因为APTES化的硅片表面形成的是一种致密的毛刷结构,因而具有一定的疏水性,可能带来较高的非特异性吸附.利用SMCC偶联巯基和氨基比通过EDC/NHS活化羧基连接氨基的偶联效果要弱些,这可能是因为EDC/NHS和SMCC较为活泼,在偶联过程中容易失活或逆平衡解离所致.而环氧表面对氨基的直接偶联效果不太好可能是因为环氧基团与氨基的反应在中性条件下较慢所致[35],值得指出的是,环氧基团偶联氨基开环之后会生成一个电中性的亲水羟基,有助于减弱非特异性吸附.

2.3 加入不同的间隔臂共价连接抗体
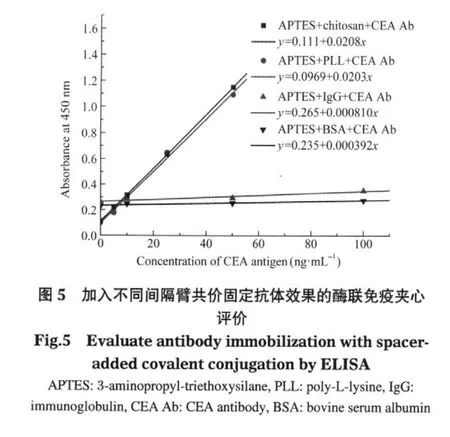
为了提高共价连接固定抗体的效率,考虑在固定抗体之前先在硅片表面引入一层大分子间隔臂,有文献报道大分子间隔臂的引入可以有效地改善固相表面的亲水性和生物兼容性,改善抗原抗体免疫结合时的空间位阻[36-37],提高硅片表面抗体的免疫反应效率.我们比较了常用的蛋白质分子(BSA和IgG)和多氨基聚合物(PLL和壳聚糖),偶联试剂为戊二醛或SMCC,实验结果如图5所示.
从图5中可以很明显地看出,多氨基聚合物的效果远远优于蛋白质分子.这可能是因为多氨基聚合物中含有更多的可以参与反应的活性氨基,因而具有更高的偶联反应效率.多聚赖氨酸(PLL)和壳聚糖(chitosan)均具有很好的固定效果,其中多聚赖氨酸表面具有更低的非特异性吸附,这可能是因为多聚赖氨酸分子内含有许多亲水功能团,可以极大地增强芯片表面的亲水性,从而起到了降低非特异性吸附的作用.
2.4 利用生物亲和作用固定抗体
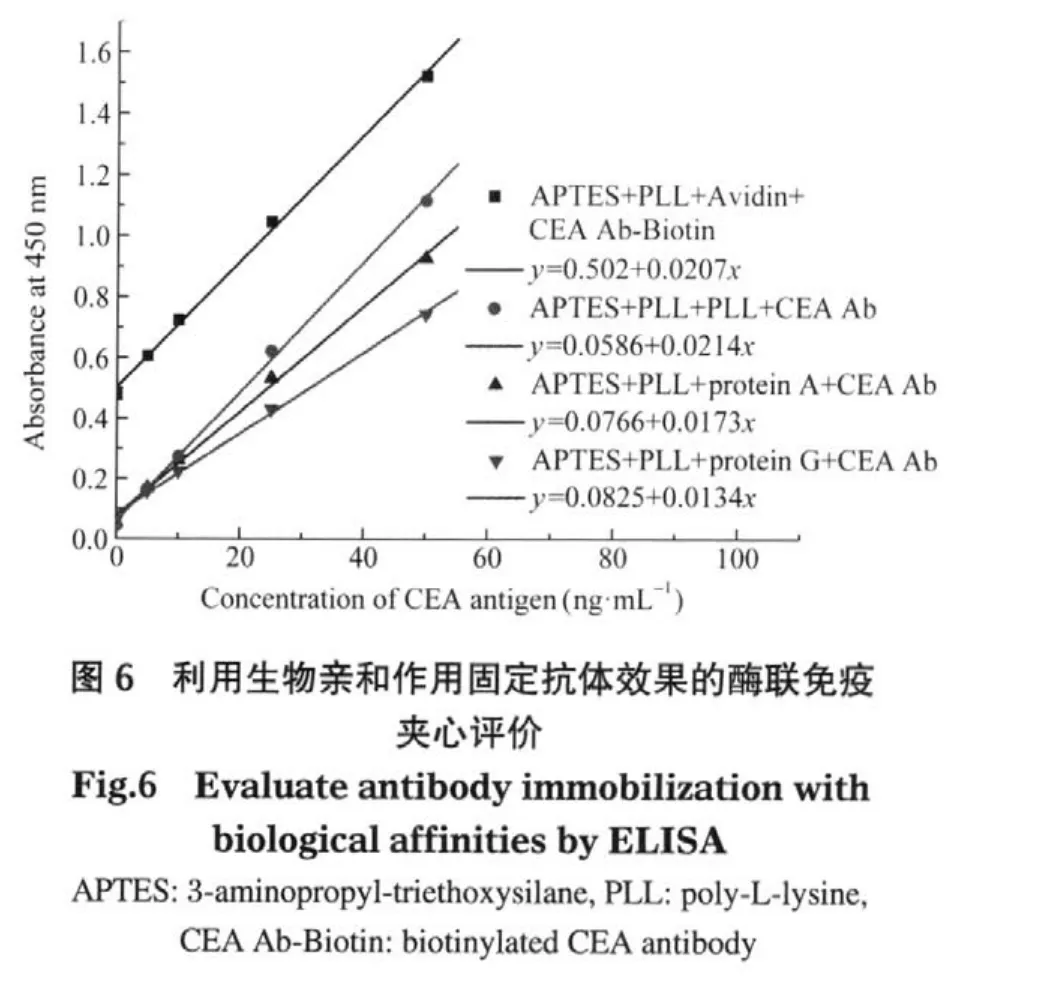
由于参加反应的氨基、羧基或巯基基团与偶联试剂的共价反应是难以控制的,如果交联发生在蛋白质的活性位点上可能会显著降低蛋白质的生物活性.为了进一步提高硅片表面固定抗体的生物活性,并且为了适应各种不同抗体的固定,我们考虑利用生物亲和作用的方式固定抗体.最常用的生物亲和作用有蛋白A/G-IgG抗体(Fc段)亲和作用和Avidin-Biotin亲和作用[17,31,38].在本实验中,我们分别将蛋白A、蛋白G、Avidin分子共价固定到硅片表面,再利用生物亲和作用将CEA抗体(IgG抗体)或CEA抗体-Biotin固定到硅片表面,然后分别进行酶联免疫测试评价抗体固定效果,实验结果如图6所示.
从图6中可以看出,通过生物亲和作用可以有效地固定抗体,并且具有较高的生物活性,这可能是因为蛋白A、蛋白G或Avidin分子承受了固相表面的微环境变化和共价交联的化学变化而非抗体本身,并且借助生物亲和作用可以实现抗体的定向固定,因而最大程度地保留了抗体特异结合位点的生物活性和空间取向[10,17,39-41].同时我们发现,这种利用生物亲和作用固定抗体的方法具有较高的非特异性吸附.这可能是因为这些生物亲和表面不能有效地封闭造成的.特别是Avidin表面,由于固定的是生物素化的包被抗体,而生物素是电子富集的小分子,在抗体上的标记通常是随机并且大量的(一个抗体分子上通常连接有几个到十几个Biotin小分子),因而对后续的CEA标记抗体-HRP分子具有较强的静电吸附作用,解决这个问题的方法之一是对包被抗体进行位点特异性生物素化[42].而共价连接两层聚赖氨酸(PLL)的表面可以进一步提高固定效率和降低非特异性吸附.
3 结 论
实验结果表明,通过共价连接固定抗体可以得到比通过物理吸附更好的固定效果,各种偶联反应中戊二醛对氨基的偶联效率最高.引入含有多功能团的聚合物分子可以提高偶联固定的反应效率,多聚赖氨酸和壳聚糖是很好的氨基放大试剂,可以用于氨基偶联试剂(如戊二醛)的增强固定,减弱非特异性吸附,并且可以增加抗体分子与平面硅片之间的距离,增加固定抗体的柔韧度,改善空间取向,从而提高硅片表面固定抗体的生物活性.对于IgG类型的某些抗体,可以利用蛋白A或蛋白G的亲和作用进行定向固定,最大限度地保持固定抗体的生物活性.
1 Zhu,H.;Snyder,M.Curr.Opin.Chem.Biol.,2001,5:40
2 MacBeath,G.Nat Genet,2002,32(suppl.):526
3 Templin,M.F.;Stoll,D.;Schrenk,M.;Traub,P.C.;Vöhringer,C. F.;Joos,T.O.Trends Biotechnol.,2002,20:160
4 Ng,J.H.;Ilag,L.L.Journal of Cellular and Molecular Medicine, 2002,6:329
5 Wilson,D.S.;Nock,S.Angew.Chem.Int.Edit.,2003,42:494
6 Angenendt,P.Drug Discovery Today,2005,10:503
7 Kusnezow,W.;Hoheisel,J.D.Biotechniques,2002,33(suppl.):14
8 Liotta,L.A.;Espina,V.;Mehta,A.I.;Calvert,V.;Rosenblatt,K.; Geho,D.;Munson,P.J.;Young,L.;Wulfkuhle,J.;Petricoin III,E. F.Cancer Cell,2003,3:317
9 Lutanie,E.;Voegel,J.C.;Schaaf,P.;Freund,M.;Cazenave,J.P.; Schmitt,A.Proc.Natl.Acad.Sci.U.S.A.,1992,89:9890
10 Vijayendran,R.A.;Leckband,D.E.Anal.Chem.,2000,73:471
11 Rossier,J.S.;Gokulrangan,G.;Girault,H.H.;Svojanovsky,S.; Wilson,G.S.Langmuir,2000,16:8489
12 Angenendt,P.;Glökler,J.;Murphy,D.;Lehrach,H.;Cahill,D.J. Anal.Biochem.,2002,309:253
13 Kusnezow,W.;Hoheisel,J.D.J.Mol.Recognit.,2003,16:165
14 Seong,S.Y.Clin Diagn Lab Immunol,2002,9:927
15 Kusnezow,W.;Jacob,A.;Walijew,A.;Diehl,F.;Hoheisel,J.D. Proteomics,2003,3:254
16 Niemeyer,C.M.;Wacker,R.;Adler,M.Nucl.Acids Res.,2003, 31:e90
17 Peluso,P.;Wilson,D.S.;Do,D.;Tran,H.;Venkatasubbaiah,M.; Quincy,D.;Heidecker,B.;Poindexter,K.;Tolani,N.;Phelan,M.; Witte,K.;Jung,L.S.;Wagner,P.;Nock,S.Anal.Biochem.,2003, 312:113
18 Ramachandran,N.;Hainsworth,E.;Bhullar,B.;Eisenstein,S.; Rosen,B.;Lau,A.Y.;Walter,J.C.;LaBaer,J.Science,2004,305: 86
19 Oh,S.J.;Hong,B.J.;Choi,K.Y.;Park,J.W.OMICS,2006,10: 327
20 Iwata,R.;Satoh,R.;Iwasaki,Y.;Akiyoshi,K.Colloids Surf.B, 2008,62:288
21 Hermanson,G.T.Bioconjugate techniques.2nd ed.Rockford, Illinois:Academic Press,2008
22 Haab,B.B.;Dunham,M.J.;Brown,P.O.Genome Biol.,2001,2: 0004.1
23 Stillman,B.A.;Tonkinson,J.L.Biotechniques,2000,29:630
24 Qian,W.;Yao,D.;Yu,F.;Xu,B.;Zhou,R.;Bao,X.;Lu,Z.Clin. Chem.,2000,46:1456
25 MacBeath,G.;Schreiber,S.L.Science,2000,289:1760
26 Piehler,J.;Brecht,A.;Geckeler,K.E.;Gauglitz,G.Biosens. Bioelectron.,1996,11:579
27 Penzol,G.;Armisén,P.;Fernández-Lafuente,R.;Rodés,L.; Guisán,J.M.Biotechnol.Bioeng.,1998,60:518
28 Afanassiev,V.;Hanemann,V.;Wolfl,S.Nucl.Acids Res.,2000, 28:e66
29 Piletsky,S.A.;Matuschewski,H.;Schedler,U.;Wilpert,A.; Piletska,E.V.;Thiele,T.A.;Ulbricht,M.Macromolecules,2000, 33:3092
30 Wilson,D.S.;Nock,S.Curr.Opin.Chem.Biol.,2002,6:81
31 Neubert,H.;Jacoby,E.S.;Bansal,S.S.;Iles,R.K.;Cowan,D.A.; Kicman,A.T.Anal.Chem.,2002,74:3677
32 Gupta,B.;Plummer,C.;Bisson,I.;Frey,P.;Hilborn,J. Biomaterials,2002,23:863
33 Stine,R.;Cole,C.L.;Ainslie,K.M.;Mulvaney,S.P.;Whitman,L. J.Langmuir,2007,23:4400
34 Gibson,T.D.;Woodward,J.R.Protein stabilization in biosensor systems//Biosensors and chemical sensors.Washington,DC: American Chemical Society,1992:40
35 Mateo,C.;Torres,R.;Fernández-Lorente,G.;Ortiz,C.;Fuentes, M.;Hidalgo,A.;López-Gallego,F.;Abian,O.;Palomo,J.M.; Betancor,L.;Pessela,B.C.C.;Guisan,J.M.;Fernández-Lafuente, R.Biomacromolecules,2003,4:772
36 Lee,S.D.;Hsiue,G.H.;Chang,P.C.T.;Kao,C.Y.Biomaterials, 1996,17:1599
37 Kato,K.;Ikada,Y.Biotechnol.Bioeng.,1995,47:557
38 Lee,W.;Oh,B.K.;Bae,Y.M.;Paek,S.H.;Lee,W.H.;Choi,J. W.Biosensors and Bioelectronics,2003,19:185
39 Turková,J.J.Chromatogr.B,1999,722:11
40 Jung,Y.;Lee,J.M.;Jung,H.;Chung,B.H.Anal.Chem.,2007, 79:6534
41 Völimaa,L.Streptavidin——a versatile binding protein for solidphase immunoassays[D].Turku:University of Turku,2008
42 Lue,R.Y.P.;Chen,G.Y.J.;Zhu,Q.;Lesaicherre,M.-L.;Yao,S. Q.Site-specific immobilization of biotinylated proteins for protein microarray analysis//Protein arrays.Totowa:Humana Press Inc., 2004:85
Effect of Surface Chemical Properties of a Silicon Chip on Antibody Immobilization
ZHOU Wen-Wen1,2LIAN Jie1,2HU Ke-Jia1,2GAO Yun-Hua1,*XU Bai1,*
(1Key Laboratory of Photochemical Conversion and Optoelectronic Materials,Technical Institute of Physics and Chemistry, Chinese Academy of Sciences,Beijing 100190,P.R.China;2Graduate University of Chinese Academy of Sciences, Beijing 100049,P.R.China)
The key to constructing a protein microarray is the stable immobilization of proteins and the retention of their biological activities.In this study,immobilization of the carcinoembryonic antigen(CEA)antibody onto a silicon dioxide surface was investigated by physical adsorption,direct chemical covalent conjugation,spacer-added chemical covalent conjugation,and biological affinity interactions.Based on the specific antibody-antigen interactions,the sandwich reaction,enzyme-linked immunosorbent assay(ELISA)was chosen to evaluate various immobilization strategies.The most efficient immobilization strategy was with glutaraldehyde as a coupling reagent between the CEA antibody and the amino surface.The attachment of a spacer-arm comprising poly-L-lysine significantly improved the immobilization efficiency and simultaneously decreased nonspecific adsorption.High immobilization efficiency and stronger nonspecific adsorption were also observed when the CEA antibody was immobilized by bioaffinity interactions.
Protein microarray;Antibody immobilization;Sandwich reaction;Enzyme-linked immunosorbent assay;Amino surface;Glutaraldehyde;Poly-L-lysine
O647
Received:April 22,2010;Revised:July 9,2010;Published on Web:September 3,2010.
*Corresponding authors.GAO Yun-Hua,Email:yhgao@mail.ipc.ac.cn;Tel:+86-10-82543581.XU Bai,Email:nanobioic@gmail.com.
The project was supported by the National Natural Science Foundation of China(20975106),Funds of the Chinese Academy of Sciences for Key
Topics in Innovation Engineering(KJCX2-YW-M15)and Important National Science&Technology Specific Projects,China(2008ZX08012-001).
国家自然科学基金(20975106),中国科学院知识创新工程重要方向项目(KJCX2-YW-M15)及国家重大专项(2008ZX08012-001)资助
ⒸEditorial office of Acta Physico-Chimica Sinica

