酸性镀铜液中硫酸铜的自动电位滴定
丘 山, 丘 圣, 曾家民, 丘星初
(1.中联环保科技开发有限公司,广东番禺 511483;2.江西环境工程职业学院,江西赣州341000)
酸性镀铜液中硫酸铜的自动电位滴定
丘 山1, 丘 圣2, 曾家民1, 丘星初1
(1.中联环保科技开发有限公司,广东番禺 511483;2.江西环境工程职业学院,江西赣州341000)
研究了用自动电位滴定法测定酸性镀铜液中硫酸铜的条件和方法。实验结果表明,在pH=10的氨-铵缓冲介质中,在Ca-EDTA共存下,以EDTA作滴定剂,用钙离子选择性电极作指示电极,以饱和甘汞电极作参比电极,滴定Cu2+,具有明显的电位突跃和清晰的滴定终点,该方法具有较高的准确度和精密度。应用于酸性镀铜液中硫酸铜的分析,方法简便快捷,能在4min内打印出结果。
硫酸铜测定;自动电位滴定法;酸性镀铜液
引 言
酸性镀铜液中硫酸铜的测定,广泛采用以PAN或PAR为指示剂的EDTA滴定法[1]。用EDTA为滴定剂的自动电位滴定法,至今尚未见文献报道。本文研究了自动电位滴定法的滴定条件和分析步骤,实验结果表明,本法简便快捷,更能适应于电镀工业园中大批量样品之分析。
1 测定方法
1.1 仪器和试剂配制
ZDJ-4A型自动电位滴定仪以及与该仪器相匹配的计算机和打印机(上海精密科学仪器有限公司生产)。
pCa-1型钙离子选择性电极;212型饱和甘汞电极;10 mL滴定管。
20.00 g/L硫酸铜标准溶液、7.5 mol/L 氨水溶液、0.05 mol/L Ca-EDTA 溶液,pH=10 氨-铵缓冲溶液,0.05 mol/L EDTA 溶液。
1.2 测定步骤
1.2.1 标准硫酸铜溶液的滴定
准确吸取硫酸铜标准溶液5.00 mL于反应杯中,逐滴加入氨水溶液,直至沉淀出现,随后沉淀又完全溶解,再过量1滴,依次加入Ca-EDTA溶液5 mL,pH=10氨-铵缓冲溶液2.5 mL,最后加水至30 mL,开始搅拌,搅拌速度为40~50 r/min,开始滴定至仪器长鸣声提示后,结束滴定。记录消耗0.05 mol/L EDTA溶液的体积。滴定度(T)按下式计算:
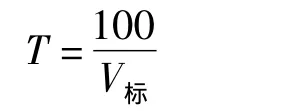
式中:100为5mL标准硫酸铜溶液中硫酸铜质量,mg;V标为滴定标准硫酸铜溶液消耗EDTA溶液的体积,mL。
1.2.2 样品分析
1)待测液的制备 准确吸取镀液样品5.00 mL于50 mL容量瓶中,加水定容,混匀,稀释倍数为10。
2)待测液的滴定 准确吸取待测酸性镀铜溶液5.00 mL于反应杯中,按1.2.1硫酸铜标准溶液的分析步骤滴定。记录消耗0.05 mol/L EDTA溶液体积。
3)分析结果计算

式中:V为待测酸性镀铜溶液消耗0.05 mol/L EDTA溶液的体积,mL;ρ为硫酸铜的质量浓度,g/L。
2 结果和讨论
2.1 滴定的基本原理
通过电极电位的测量进行定量分析的方法,称为电位分析法,加入滴定剂,用电位的变化指示滴定终点的方法,称为电位滴定法。滴定某一种离子时,浸入被滴定溶液中的电极上电位的变化符合该离子浓度的变化,在等当点附近产生电位突跃,此时电极就像指示剂一样指示滴定终点,因而被称为指示电极。本文选用的指示电极是钙离子选择性电极,它只能指示溶液中Ca2+离子质量浓度的变化而不能指示Cu2+离子质量浓度的变化,解决这个问题的关键是被滴定的溶液中加入了Ca-EDTA,在选择pH=10的条件下滴定,由于Cu-EDTA络合物的稳定常数(log K=16.6[2])远大于 Ca-EDTA(log K=10.2[2]),于是试液中加入 Ca-EDTA 溶液后则发生下列反应:

溶液中的Ca2+离子由钙离子选择性电极的电位指示。随着滴定剂的加入直至Cu2+络合完全后,又与上列反应游离出的Ca2+离子反应:
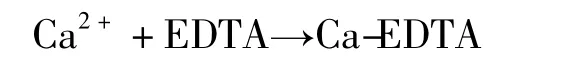
直至Ca2+离子全部被络合,使电极电位产生突跃指示滴定终点滴定曲线反映了这一滴定过程,终点电位突跃明显(滴定曲线图略),表明分析方法可靠。
2.2 Ca-EDTA的加入量
实验结果表明,Ca-EDTA的加入量在5~10 mL对分析结果无影响。进行空白实验时,其空白值也不因加入量不同而有差异。本实验选用Ca-EDTA为5 mL。
2.3 缓冲溶液用量的选择
实验结果表明,pH=10的氨-铵缓冲溶液的用量在1~5mL的范围内滴定结果一致,故实验选取2.5 mL。
2.4 添加剂的影响
实验选用的是安美特公司的酸性镀铜液配方,其添加剂有三种:510A、510B和510MU,按配方比例混合后,进行实验。实验结果表明,添加剂的加入量高达镀液开缸标准质量浓度的3倍时未发现显著影响,超过3倍时呈正干扰。故在配制质控样时加入与开缸标准质量浓度相同的添加剂,以消除其可能产生的影响。
2.5 共存离子的影响
常规的EDTA滴定法,在pH=10的氨-铵缓冲溶液介质中,能与EDTA生成稳定络合物[2]的二价金属离子如 Ca2+、Mg2+、Ni2+、Co2+及 Zn2+等均有正干扰。但在实际生产中,维护较好的酸性镀铜溶液中,这些杂质离子的含量很低,可以忽略不计。至于能与EDTA生成络合物的三价金属离子如Al3+离子和Fe3+离子,可用氟化铵和三乙醇胺掩蔽来消除干扰[1];Fe3+离子还可用氨水使之形成Fe(OH)3沉淀分离除去[1]。共存离子的影响,自动电位滴定法与常规EDTA滴定法相同,但滴定的准确度和精密度却优于常规法。
2.6 指示电极的选择和使用
用EDTA作滴定剂的自动电位滴定法用指示电极代替了常规法的金属指示剂来指示滴定终点,提高了分析的准确度和精密度。文献[3]使用汞电极作指示电极,但溶液中必须有0.001 mmol/L的Hg-EDTA存在,考虑到汞试剂的毒性,不推荐使用。本实验选用pCa-1型钙离子选择性电极作为指示电极,该电极是以二对异辛基苯基磷酸钙为活性材料的PVC膜的离子选择性电极,内充0.1 mol/L CaCl2溶液,参比电极为银/氯化银。该电极如搁置较长时间再使用,应先放在0.001 mol/L氯化钙溶液中活化数小时。每次实验后,应用水吹洗电极表面,以除去吸附的Cu2+和Ca2+。不用时浸泡于0.001 mol/L氯化钙溶液中,以保持活性。参比电极则选用饱和甘汞电极,应经常补充饱和氯化钾溶液。
2.7 滴定管的选用
仪器配有容量分别为10mL和20mL的两种滴定管,其容量允许误差为:10 mL滴定管 ±0.025 mL;20 mL滴定管±0.035 mL。为减少滴定剂在清洗或更换时的消耗和提高分析的准确度,选用10 mL滴定管。
2.8 滴定剂浓度的选择和使用
滴定终点的电位突跃,随滴定剂的浓度增高而增大。为节约滴定剂的消耗。选用c(EDTA)为0.05 mol/L。从滴定曲线来看,滴定电位突跃非常明显,滴定终点清晰。
2.9 滴定时搅拌速度的选择
实验结果表明,EDTA与Cu2+离子的络合反应速度较快,设定搅拌的转速以40~50 r/min为宜。在此条件下,每次滴定需时在4 min以内。
2.10 滴定初始体积的选择
滴定时指示电极的探头必须浸没在被滴定的试液中,同时搅拌珠的旋转又不能触及探头,以免碰伤指示电极。因此待测试液的初始体积设定为30 mL,如待测试液不足30 mL时,则加水补足至30 mL,方可开始滴定。
2.11 准确度和精密度
质控样溶液成分为:200.0 g/L硫酸铜、60 g/L硫酸、10 mL/L 添加剂510 MU、0.5 mL/L 510A、0.5 mL/L 510B。
样品的分析结果见表1。由表1看出,质控样滴定值的相对误差在-0.40%~+0.35%范围内变动,平均值的相对误差仅为0.1%。质控样和镀液样的相对标准偏差(RSD)均小于0.31%。表明本法具有高准确度和精密度。

表1 样品分析结果
3 结论
研究了采用自动电位滴定法测定酸性硫酸铜镀铜溶液中的硫酸铜,实验结果表明:比以PAN或PAR为指示剂的EDTA滴定法更为快捷,方法具有更高的准确度和精密度,更能适应于电镀工业园中大批量镀液分析之需要。
[1] 徐红娣,邹群.电镀溶液分析技术[M].北京:化学工业出版社,2003:77.
[2] 杭州大学化学系分析化学教研室.分析化学手册第二分册[M].(第二版).北京:化学工业出版社,1997:539.
[3] 迪安J A.分析化学手册[M].常文保译.北京:科学出版社,2003:14,57.
Automatic Potentiometeric Titration of Copper Sulfate in Acidic Copper Plating Bath
QIU Shan1,QIU Sheng2,ZENG Jia-min1,QIU Xing-chu1
O657.15
B
1001-3849(2010)11-0042-03
2010-05-04
2010-06-07
——以硫酸铜饱和溶液析出晶体的计算为例

