谷物种子贮藏蛋白的结构、特性及其在谷物利用中的功能
李兴军
(国家粮食局科学研究院,北京 100037)
谷物种子贮藏蛋白的结构、特性及其在谷物利用中的功能
李兴军
(国家粮食局科学研究院,北京 100037)
在谷物成熟种子中,贮藏蛋白占总蛋白的 50%,对种子萌发与粮食储藏、人和牲畜的营养供给、粮食加工的功能特性有重要影响。本文阐述了谷物醇蛋白和球蛋白的结构与特性、合成机制、运输及其在发育种子内的沉积。面筋蛋白决定面包加工小麦品种的特性,介绍了如何调控它们的数量与组成,以改变面团混合特性。这些研究进展对我国谷物育种、储藏及加工品质评价有指导和借鉴意义。
谷物 贮藏蛋白 醇蛋白 面筋蛋白 功能特性 蛋白体
谷物是世界上最重要的粮食作物,年产量超过210亿 t,其中玉米、小麦及稻谷年产量占总产量的85%,大麦、高粱、黍、燕麦及黑麦等产量依次减少。我国大宗谷物年产量约 5亿 t,其中稻谷、小麦、玉米占总产量的 86%。谷物蛋白含量相对豆类来说较低,占种子干重的 10%~15%,但却为全球人和动物提供 20亿 t蛋白,这个数量是高蛋白 (20%~40%)豆类种子的 3倍。除了营养功能外,谷物种子贮藏蛋白还影响其加工利用,尤其是对小麦加工品质。醇蛋白与面团的黏性和延展性有关,其多态性可以作为小麦的指纹,用于品种鉴定、纯度分析及亲缘关系研究[1]。高分子质量 (HMW)麦谷蛋白影响面团弹性,过去的研究集中在高分子质量谷蛋白亚基(HMW-GS),近年来重视研究低分子质量谷蛋白亚基(LMW-GS)的多态性及其与HMW-GS相互作用形成聚合物[2-4]。本文主要对谷物贮藏蛋白的结构、合成调控及在谷物利用中的功能作一概述,以期对我国大宗谷物储藏、加工利用、品质改良及制定科学品质评价标准提供指导。
1 谷物种子贮藏蛋白种类
1745年Beccari首次分离了小麦面筋蛋白 (glu2 ten),之后 250多年人们对谷物种子蛋白进行了系统研究[5]。Osborne(1859~1929)被称为植物蛋白化学之父。他根据植物蛋白的溶解性进行分类,如溶于水的清蛋白,溶于稀盐的球蛋白,溶于醇溶液的醇蛋白,溶于稀酸或稀碱的谷蛋白[5]。他的分类法被广泛地采用。目前普遍将种子蛋白分为贮藏蛋白、结构与代谢蛋白及保护蛋白 3类[5]。种子贮藏蛋白属于Osborne划分的三个不同成分,存在于种子的三种组织中。
1.1 贮藏球蛋白 (Storage proteins)
胚和糊粉层细胞含有贮藏球蛋白。根据沉降系数将球蛋白分为7S和11S两种。一些玉米品种中种子胚细胞内球蛋白易溶于稀盐溶液,沉降系数是 7。它们的氨基酸序列与豆类及其他双子叶植物的 7S vicilins类似或同源,彼此之间有相似的结构和特性[6]。在小麦、大麦及燕麦的胚或糊粉层细胞中也鉴定了相关球蛋白。定性的水稻胚 7S球蛋白与其他植物 7S球蛋白的关系还没有建立。7S球蛋白储存在蛋白体内,功能是仅作为种子贮藏蛋白,它们对正常种子的功能不是必需的,如玉米 7S球蛋白缺乏突变株系能够正常地发芽与生长。与胚乳组织比较,糊粉层和胚组织富有蛋白质,这些组织中的球蛋白对谷物加工特性影响不大。对于小籽粒谷物,糊粉层和胚组织占种子干重的 10%,通过小麦磨粉(milling)、稻谷砻谷 (polishing)、大麦去壳 (pear2 ling)、高粱剥壳 (decortication)等方法除去这些组织后,剩余的胚乳细胞成分供人们消费。玉米胚组织占种子质量的 10%~11%,高含量的蛋白和油是牲畜的营养来源。
一些谷物胚乳细胞中还存在 11S~12S贮藏球蛋白。这些蛋白在燕麦和稻谷中形成重要的胚乳贮藏蛋白,占总贮藏蛋白含量的 70%~80%。它们类似大多数双子叶植物中广泛分布的‘legumin’球蛋白。水稻胚乳贮藏蛋白不易溶于稀盐溶液,被称为‘glutelins’,属于 11S~12S球蛋白家族。11S~12S贮藏球蛋白的组成亚基分子质量约 55 ku,翻译后加工成的酸性肽 (燕麦的为 33 ku,稻谷的为 28~31 ku)和碱性肽(燕麦的为 23 ku,稻谷的为 20~22 ku)通过一个二硫键连接。燕麦球蛋白也类似 legumin,形成六聚体结构,沉降系数是 12。与 legumin相关的小麦贮藏球蛋白叫‘triticins’,存在胚乳中,占种子总蛋白质量的 5%。Triticins包括分子质量为 40 ku的大肽链和分子质量为 22~23 ku的小肽链,形成二聚体结构,不是典型的 legumin六聚体。与大麦和小麦比较,燕麦种子的贮藏球蛋白含量最高,而且必需氨基酸含量高,适合作为饲料。
1.2 贮藏醇蛋白 (Prolamins)
除了燕麦和稻谷外,所有谷物胚乳细胞的重要贮藏蛋白是醇蛋白。这个词语 prolamin依据这些蛋白富含脯氨酸 (proline)和谷酰胺 (glutamine)的氨基氮,不同谷物类型中这两种氨基酸含量之和占醇蛋白的 30%~70%。根据最初定义,醇蛋白溶解于醇的水溶液,如 60%~70%乙醇、50%~55%丙醇或异丙醇。还有一些醇不溶聚合蛋白,但是所有醇蛋白聚合物在还原态时都是醇溶的。醇蛋白分子质量变化范围大,从 10~100 ku。
作为贮藏蛋白,醇蛋白与 7S和 11/12S球蛋白比较,在蛋白质结构上变异较大。麦亚科 (Triticeae,如小麦、大麦及黑麦)和黍亚科 (Panicoideae,如玉米、高粱及黍)的重要醇蛋白类型在系统进化上是独立的。大多数醇蛋白有两个共同的结构特征,一是存在特征区域或结构域,这些结构域彼此之间结构不同,起源可能不同;二是在氨基酸序列中存在一个或多个短肽基序,或存在特定氨基酸残基如甲硫氨酸的重复区块。这些特征解释了一些醇蛋白类型中存在的高比例谷氨酰胺、脯氨酸及其他特异氨基酸(如组氨酸、甘氨酸、甲硫氨酸和苯丙氨酸)。
1.2.1 小麦醇蛋白及醇蛋白家族 (Cereal Prolamin Family)
由于分离的醇蛋白成分复杂和术语专业化,该蛋白的结构和特性较难理解。目前依据代表材料的已知醇蛋白类型氨基酸序列,按照结构与进化关系将麦类(小麦、大麦及黑麦)所有醇蛋白分为富硫 (S -rich)、贫硫 (S-poor)及高分子质量 (HMW)醇蛋白 3大类型 (表 1),富硫类型还有几个亚类型[5]。这种划分方法与谷物化学家划分的小麦多聚物蛋白(谷蛋白)和单聚物蛋白 (醇蛋白)不是一一对应的,因为富硫、贫硫醇蛋白都有单聚物或多聚物态。
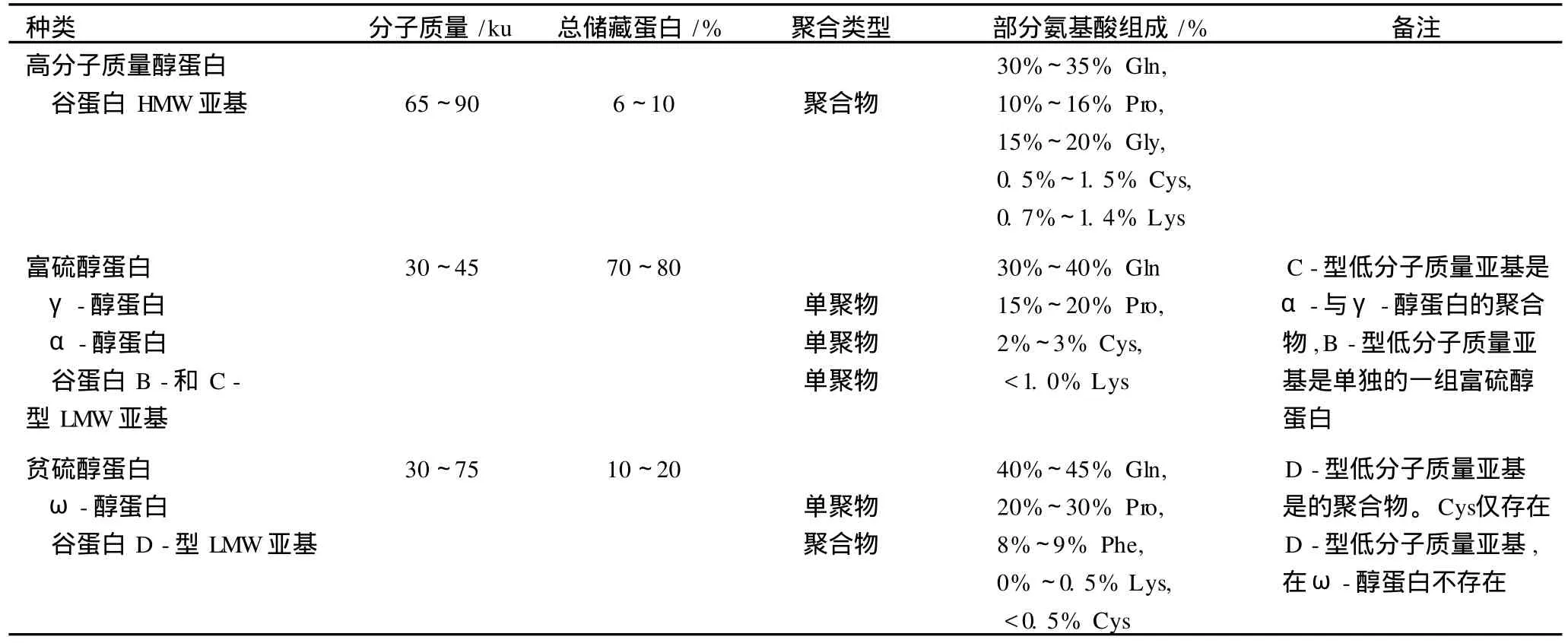
表1 小麦种子醇蛋白类型和特征
图 1是小麦富硫、贫硫及高分子质量醇蛋白的结构。它们全都富含脯氨酸、谷氨酰胺基序的重复序列。富硫与贫硫醇蛋白的重复基序是相关的。富硫醇蛋白与HMW醇蛋白之间的非重复结构域也存在序列相似性,尤其是在保守的半胱氨酸位置及靠近这些半胱氨酸的氨基酸残基。这些对比分析表明,富硫、贫硫及 HMW醇蛋白之间有共同的起源进化关系。广泛地比较玉米醇蛋白(zein)、燕麦和稻谷醇蛋白 (prolamins)、双子叶植物种子2S贮藏清蛋白、谷物种子α-淀粉酶和胰岛素抑制剂、包括脂肪转移蛋白和谷物种子puroindolines在内的LMW富半胱氨酸植物蛋白,发现也存在进化和结构类似关系。于是将这些醇蛋白统称为谷物醇蛋白超级家族 (ce2 real prolamin superfamily)。谷物醇蛋白普遍具有营养功能,但是只有小麦的醇蛋白与加工品质相关。小麦醇蛋白是面筋蛋白(gluten)重要构成成分,面筋蛋白形成面团的黏弹性网络,在小麦加工成面食、面包及其他产品中起重要作用。
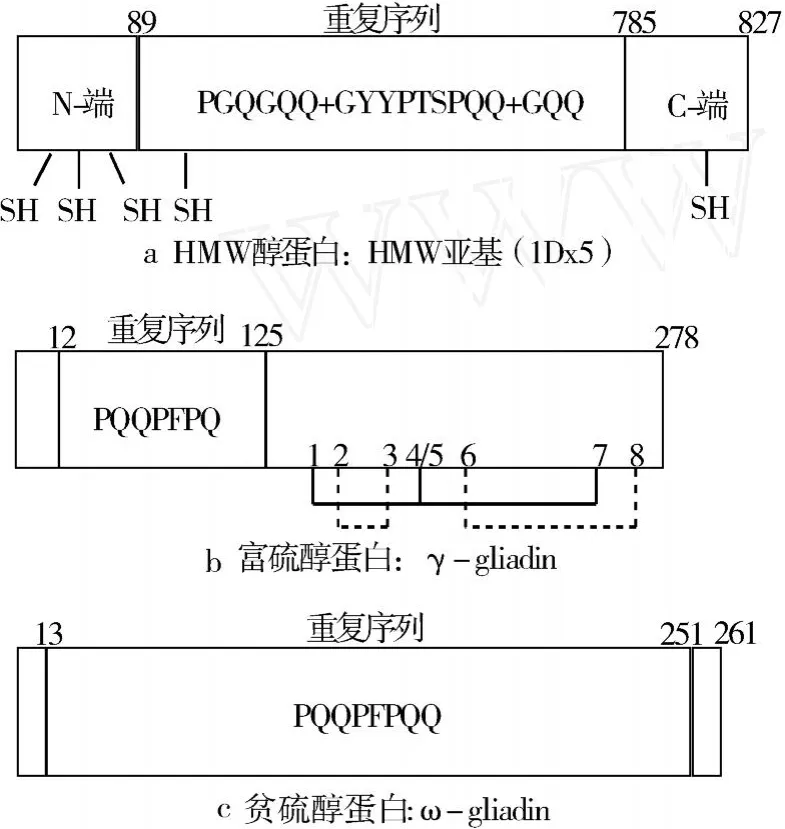
图 1 小麦三种醇蛋白类型
1.2.2 玉米醇蛋白 (prolamins ofmaize)
玉米醇溶蛋白 (zeins)于 1821年从玉米中分离出来,缺乏赖氨酸、色氨酸,但富有谷酰胺、脯氨酸、丙氨酸及亮氨酸。它有凝胶化、黏结及形成膜等特征。玉米醇蛋白与其他黍亚科谷物如高粱、黍的醇蛋白构成一个大类(α-zeins)与几个小类(β-、γ-、σ-zeins)(图 2a)。氨基酸序列对比分析表明,β-、γ-、σ-zeins都是醇蛋白超级家族的成员。γ-zeins含有 2个或 8个 Pro-Pro-Pro-Val-His-Leu的串联重复氨基酸基序,β-和σ-zeins都富有甲硫氨酸,这些甲硫氨酸成簇区域靠近γ-zeins的 C-末端。玉米α-zeins仅仅与黍亚科其他谷物的α-型醇蛋白相似,与其他醇蛋白类型无明显类似关系。SDS-PAGE分子质量分析表明,玉米α-zeins分为19 ku(Z19)和 22 ku(Z22)的两大亚组,它们各自的实际分子质量是 23~24 ku和 26.5~27 ku[7]。这两个亚组包括 20个氨基酸残基的退化重复区,Z19有9个重复区,Z22有 10个重复区 (图 2b)。玉米αzeins每分子仅含有 1~2个半胱氨酸残基,在种子中以单聚物或寡聚物存在,但是β-γ-、σ-zeins都富有半胱氨酸,形成了多聚物。

图2 玉米醇蛋白
2 谷物种子贮藏蛋白的合成与沉积
2.1 贮藏蛋白的合成与沉积
谷物种子贮藏蛋白以分泌方式产生,沉积在单个的蛋白体内。蛋白体的起源、种子贮藏蛋白运输与沉积的机理还不完全清楚。分别位于谷物胚与糊粉层细胞、胚乳细胞的7S和11S贮藏球蛋白,可能按照双子叶植物种子的同源蛋白方式分泌、运输及沉积。它们一般在粗面型内质网 (ER)膜上合成,边翻译边被运输到内质网腔内 (lumen),接着通过高尔基体运输到贮藏球蛋白的液胞中,这些大量存在的球蛋白贮藏液胞不同于发育种子内同时存在的裂解型液胞[8]。贮藏球蛋白这种分类储存的确切机制还没有完全了解,但高尔基体内的物理聚集作用很重要,在电镜下显示电子密集型聚合物,这些聚合物形成浓密小泡的内含物。贮藏球蛋白没有向液胞定向运输的可切除前肽,这种成熟蛋白不含前肽可能有重要意义。
与球蛋白比较,醇蛋白运输与沉积机制了解更少,可能有 2种方式。在玉米、稻谷及其他黍型谷物(如高粱、黍)中,醇蛋白直接在 ER腔内积累,形成ER单层膜包裹的离散蛋白体[9]。在稻谷内存在 2个蛋白体群体,PB-I来自 ER,含有醇蛋白;PB-II来自液胞,含有球蛋白/谷蛋白[10],如图 3a。Okita研究组提出证据,醇蛋白和球蛋白/谷蛋白在各自的ER亚区域合成,醇蛋白的 mRNA被定位到粗面型ER,粗面型 ER与发育着的含醇蛋白的蛋白小体相关。球蛋白/谷蛋白的 mRNA被定位到更特定的潴泡 (cysternal)ER膜[11]。其他证据表明,醇蛋白 mR2 NA能够结合到微管蛋白 (tubulin)和肌动蛋白细胞骨架 (actin cytoskeleton)的特定位点[12]。

图 3 正在发育的谷物籽粒淀粉型胚乳细胞中的蛋白体
与稻谷类似,燕麦胚乳细胞内含有高比例的球蛋白类型贮藏蛋白。在这种情况下,球蛋白与醇蛋白位于同一蛋白体,醇蛋白是染色较轻的内含物(图 3b)。这可能是 ER内的蛋白体 (含有醇蛋白)与液胞内的蛋白体 (含有球蛋白)发生了融合[13]。
玉米、稻谷及 (可能)燕麦醇蛋白在 ER内直接积累,还没有证据表明被运输到液胞。已经证明在小麦、大麦及(可能)黑麦种子内,存在醇蛋白向液胞运输与蛋白体形成两个过程。其证据包括高尔基复合物内醇蛋白的免疫金标记,在 ER内观察到小蛋白体或者与 ER相关的小蛋白体,通过亚细胞分离技术制备了 ER标记酶与蛋白体的结合物,在异源系统中表达野生型和突变体的醇蛋白[14]。结论是,一些醇蛋白(主要是小麦醇蛋白),通过高尔基体运输到贮藏蛋白体的液胞,而其他醇蛋白 (主要是谷蛋白),保留在 ER内。ER内的蛋白体随后以类似自我吞噬(autophagy)的方式被贮藏蛋白的液胞所吸收。在发育小麦种子内蛋白体也包含深染色的内含物即贮藏球蛋白 (triticin,图 3c中 I),它可能通过高尔基体运输到液胞内的蛋白体中[15]。小麦两类蛋白体融合的确切机制还不清楚。事实上,在小麦成熟干种子胚乳细胞内,存在围绕淀粉粒并吞没其他细胞结构残渣的连续蛋白质基质。当小麦粉与水混合形成面团时,这个基质是形成面筋网络的基础。
醇蛋白是保留在 ER内,还是通过高尔基体运输到液胞的机制还不清楚。在这些醇蛋白中均没有找见典型的 ER保持信号肽,即 C-端的四肽 KDEL或HDEL,或者液胞定位序列。在异源系统中分别表达玉米γ-zeins和小麦γ-gliadin,对野生型和突变型分析均表明,富脯氨酸重复序列对醇蛋白保留在 ER内是必需的[16]。可能的是,这些富脯氨酸重复区域形成蛋白质 -蛋白质互作,导致不溶性聚合物的增大,在 ER内直接积累,而不是被运输到高尔基体和液胞[17]。Okita研究组提出不同的机理解释醇蛋白保持在稻谷胚乳细胞的 ER内。这包括与分子伴侣Bip(binding protein,结合蛋白)的互作,Bip结合到初生的醇蛋白多肽,并将该多肽保留在 ER内,直到组装成一个蛋白体[9]。但这个机制对其他谷物还没有提出。
2.2 蛋白体内贮藏蛋白的构建
在发育着的淀粉型胚乳细胞中,燕麦 (图 3b)和小麦(图 3c)的蛋白体呈现球形小泡或不规则小泡两种状态。球形小泡以单层 ER膜包裹,含有醇蛋白;不规则小泡由液泡沉积物形成,含有球蛋白/谷蛋白。这样,分别含有醇蛋白和球蛋白沉积物的两类蛋白体群落最初是易区分的,随后这两类蛋白体就发生了融合,如水稻 (图 3a)。鉴于醇蛋白与球蛋白的结构和特性不同,在胚乳细胞发育初期阶段依据形态,就可以区分含有醇蛋白或球蛋白的蛋白体群落。
由于不同的醇蛋白类型在电镜下显示相似的染色特性,所以蛋白体内不同类型醇蛋白的空间分布还没有阐明。但 Lending等[18]研究显示,蛋白体内玉米醇蛋白 (zeins)类型分布的差异性,与它们在发育胚乳组织中的位置相关。如图 4,亚糊粉层区域幼龄细胞内的蛋白体,主要含有β-和γ-zeins,它们遍及整个蛋白体内。一旦转递到胚乳组织细胞内,这些蛋白体体积增大,中心位置出现含有α-zeins的小腔。这些小腔最终融合成一个连续的α-zeins中心区域,结果是成熟蛋白体中,β-和γ-zeins分布在α-zeins中心区域的周边[19]。
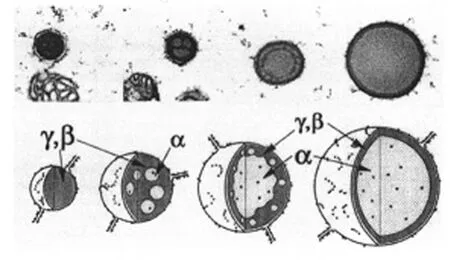
图4 玉米胚乳蛋白体发育的模式。
利用高度特异性α-、β-、γ-zeins抗体,很容易进行玉米胚乳细胞蛋白体发育研究。类似的研究对其他谷物还没有报道。但是用不同小麦醇蛋白(gliadin)组分的研究表明,醇蛋白组分呈空间微相态(microphases)分布,所以能够区分。将纯化的αgliadin与ω-gliadin组分溶解在 70%的乙醇中,分别以 1∶3、1∶1及 3∶1混匀,涂抹到云母 (mica)表面,让溶剂蒸发。在原子力显微镜下分析干膜的表面特性,两个相态的比例约相关于混合组分的比率[20],这说明在小麦胚乳细胞蛋白体中,醇蛋白(gliadin)和谷蛋白(glutenins)可以依据各自的微相态区分,不过在常规电镜下观察不到。
采用异源系统表达试验也表明,各种玉米醇蛋白(zeins)类型的混合物,对正常蛋白体的形成是必要的。转基因烟草中γ-zein表达时,检测到α-zein积累。在烟草中单独表达β-zeins或σ-zeins时,形成了不正常的蛋白体,将两者一起表达时则显示正常的蛋白体[21]。从这些研究中看到,谷物蛋白体形成的机制,不同储藏蛋白类型的作用与构建还需要研究。
2.3 淀粉型胚乳组织内醇蛋白的空间分布
在发育着的谷物胚乳组织内,糊粉细胞连续平周分裂,幼龄细胞就出现在亚糊粉层,老龄细胞存在胚乳组织的中心部位。在小种子谷物和黍亚科中,亚糊粉层细胞几乎不含有淀粉粒,而且淀粉粒比胚乳组织中心部位细胞中的小,但是这些亚糊粉层细胞含有高比例的蛋白。就整个小麦胚乳组织,每个细胞内总蛋白含量变化不大。对玉米,在亚糊粉层和胚乳组织外层细胞,蛋白体中富有β-zeins、γzeins,但α-zeins含量较低,α-zeins均一地分布在整个胚乳组织。这种分布有助于玉米胚乳细胞中蛋白体的发育形成。尽管大麦及(可能)小麦胚乳组织内醇蛋白分布存在差异,但是这个现象的产生机制还不清楚。这两个物种的亚糊粉层细胞富有蛋白质,对大麦进行免疫标记和去壳分析表明,这些蛋白质主要是富硫和贫硫醇蛋白(主要是B-和 C-hor2 deins),HMW醇蛋白 (D-hordeins)大量存在在亚糊粉层下胚乳细胞[22]。大麦和小麦胚乳组织中醇蛋白这种分布对籽粒加工利用很重要,由于D-hordeins是凝胶蛋白的主要成分,它限制了大麦发芽期间胚乳变化,而小麦谷蛋白的同源 HMW亚基是弹性 (elasto2 meric)聚合物的重要成分,在面包及其他食品加工利用中起支撑作用。
3 醇蛋白基因表达的调控
醇蛋白基因表达主要在转录水平进行调控,既是组织特异性发育调控,在种子发育中后期的胚乳组织中专一表达;也是营养调控的,对种子中硫和氮的可利用性反应敏感。对硫的反应,醇蛋白基因表达机制还不清楚。在小麦、大麦及黑麦中已经鉴定了一个基序,它参与富硫、贫硫醇蛋白基因表达对氮的反应。这个基序(N-基序或氮元件)位于高度保守的醇蛋白盒基因 (prolamin box)中[23]。醇蛋白盒基因,有时也叫胚乳元件,是第一个醇蛋白基因调节序列。通过比较分析几个小麦醇蛋白 (gliadins)和大麦醇蛋白(hordeins)基因的起动子,鉴定了这个醇蛋白盒基因。这个醇蛋白盒基因序列 (长 30 bp)是5’-TGACATGTAA AGTGAATAAG ATGAGTCATG,在转录起始位点上游 300 bp处 (刚开始称为 -300元件)。它 3′端保守的N-基序序列,在富硫醇蛋白基因中是G(A/G)TGAGTCAT,在贫硫醇蛋白盒基因中以反义互补形式存在。该 N-基序与酵母氮信号途经元件 (有时称为 GCN4-like基序,GLM)GCN4的转录因子结合位点有相似性。醇蛋白盒基因中第2个高度保守的基序序列是TGTAAAGT,被称为胚乳基序或者 E基序[24]。
将构建的大麦富硫醇蛋白(B-hordein)启动子/氯霉素乙酰转移酶 (chloramphenicol acetyl transfer2 ase,CAT)报告基因转化烟草,结果显示醇蛋白盒基因中含有功能性启动子区域[25]。Hammond-Kosack等[24]表明醇蛋白盒基因具有自身的调节作用。Müller等[23]采用同源基因瞬时表达系统,用基因枪法将大麦贫硫醇蛋白 (C-hordein)启动子/β-葡萄糖醛酸酶 (β-glucuronidase,GUS)构建导入培养的大麦胚乳细胞。这个试验证明了 E基序和N基序是独立的元件,在低氮水平时N基序抑制基因表达;当氮水平充足时N基序与 E基序、其他上游元件相互作用产生高水平基因表达。
Hammond-Kosack等[24]利用体内足迹法和凝胶滞缓试验分析表明,醇蛋白盒基因内 E基序、小麦低分子质量谷蛋白亚基基因启动子上游的较远序列,结合一个公认的转录因子 ESBF-Ⅰ。第二个公认的转录因子 ESBF-II在基因表达量最大之前结合N-基序。第三个公认的转录因子 SPA识别N基序。综合这些结果,N-基序是富硫和贫硫醇蛋白基因氮调节机制的一个重要元件。它需要与 E基序相互作用,这两个基序一起构成了醇蛋白盒基因。但是,不是所有醇蛋白基因都含有醇蛋白盒基因,例如玉米醇蛋白 (zein)基因启动子含有一个高度保守的 15 bp元件,充当组织特异性表达的增强子。这个 15 bp的元件含有序列TGTAAAG,类似 E基序,但缺乏 N基序。γ-zein醇蛋白启动子中存在N-基序,与 E-基序是分开的,它的功能还不清楚[26]。
完整的醇蛋白盒基因也不会出现在小麦 HMW醇蛋白基因启动子中。HMW醇蛋白基因启动子含有一个重要调节元件,序列是 5’-GTTTTGCAAA GCTCCAATTG CTCCTTGCTT ATCCAGCT。这个 38 bp的序列在所有 HMW醇蛋白启动子中是高度保守的,起始位置在 -185到 -189[27]。这个元件包含TGCAAAG序列,类似玉米 zein基因中存在的 E基序TGTAAAG序列,但它不含有类似 N基序的序列。HMW醇蛋白基因启动子上游到增强子之间的序列对应部分N和 E基序序列,这些序列的缺失不会明显影响启动子活性,至少在转基因烟草中驱动报告基因表达。
4 种子贮藏蛋白与谷物加工利用
4.1 作为混合饲料成分
谷物种子贮藏蛋白是人和动物食用植物蛋白的主要来源。谷物种子的总蛋白含量是种子干重的10%~15%,其中贮藏蛋白占总蛋白含量的一半,对种子利用特性有重要影响。除过燕麦和稻谷外,醇蛋白是大多数谷物的重要贮藏蛋白成分,但是它缺乏必需氨基酸赖氨酸、亮氨酸、色氨酸 (尤其对玉米)。对猪、禽等动物长期喂养这些谷物,就导致这些必需氨基酸缺乏。因此将谷物与含有这些氨基酸的大豆、油料种子、鱼粉等相结合,作为混合饲料。谷物富有含硫氨基酸,赖氨酸含量低,苜蓿种子则相反,将两者混合就可以达到必需氨基酸互补。
4.2 种子萌发与粮食储藏
如何避免种子衰老和陈化问题是种子生理学和粮食储藏学研究的重要课题。种子活力与种子萌发时胚贮藏蛋白降解速率、新蛋白合成是一致的,不同活力的玉米胚吸胀 24 h的蛋白质合成能力及贮藏蛋白降解程度,可作为衡量玉米种子活力的生化指标[28-29]。我国辽宁省出土的、在地层中保存约 1450年的古莲子,在人工处理下能够发芽与开花。除了它坚硬的种子外壳阻止水、空气进入外,贮藏蛋白及其他蛋白受到最小的损伤而使种子保持活力[30]。
4.3 面筋蛋白与小麦加工品质
谷物蛋白对其加工食品的功能特性有重要影响。除过稻谷外,大宗谷物都以加工品被消费,多数小麦通过磨粉除去胚芽 (胚)和麸皮 (包括果皮、种皮、珠心层及糊粉层),成为小麦粉。小麦粉来源淀粉型胚乳细胞,含有大量的淀粉和面筋蛋白。小麦粉之所以能够加工成面包、面条、蛋糕、饼干及面食等,在于其种子贮藏蛋白的特性与其他谷物不同。这些蛋白质沉积在胚乳细胞内散布的蛋白体,在种子成熟后期蛋白体在细胞内结合形成一个连续的基质网络。当小麦粉与水混合形成面团时,小麦粉粒子中的面筋蛋白集合在一起在面团中形成连续的网络。这个网络赋予面团黏结性、弹性及延展性。这些特性使得面筋蛋白网络被酵母发酵释放的 CO2所膨大,产生色亮、多孔瓤面包结构。所有小麦类型都能够加工成面包,但是面包品质差异甚大,这种差异与小麦品种、生长环境及二者互作的遗传差异有关。与北美、南/中欧干热地区比较,英国、北欧生产的小麦面筋较弱,加工面包时需要与强筋小麦混合。
250多年来,小麦面筋蛋白黏弹特性形成的机制一直是研究的热点,由于它与改良小麦加工利用特性有关。决定面团强度的最重要因子是一些谷蛋白形成聚合物的能力,谷蛋白聚合物由链间二硫键所稳定,分子质量可以达到 1×104ku。已经明确了高分子质量谷蛋白亚基(HMW-GS),对大分子聚合物的形成重要作用。强筋面团(高度黏弹性)就含有高比例的 HMW-GS聚合物。对这个原理的认识是Payne[31]发现的,HMW醇蛋白 (即 HMW-GS)成分的等位变异,与欧洲面包小麦加工品质的差异呈相关性。HMW-GS占总面筋蛋白的8%~12%,它们诠释了欧洲小麦面包加工品质变异的 45%~70%。之后其他学者都证实了这个相关性,于是HMW-GS的结构与特性被详细地研究。由于谷蛋白聚合物较低的溶解性,缺乏结晶结构,所以对其结构分析较困难。HMW-GS能够形成具有弹性的聚合物网络,在与其他谷蛋白亚基、醇蛋白相互作用中,它提供支撑作用。链间二硫键对这个网络起稳定作用,特别是在重复结构域的谷氨酰胺残基之间形成的链间氢键(图 1),对弹性材料形成很重要[32]。谷蛋白超过一定的分子质量分布,其肽链才能形成弹性[33],较大的谷蛋白聚合物的分子质量分布造成富有弹性的面团,改善了面包的加工特性。面筋蛋白生物物理学特性形成的意义还不清楚,作为种子贮藏蛋白,不知道它们呈现黏弹性的目的是什么。可能的是,决定这些特性的分子间相互作用在发育着的种子中开始建立,从种子发育中期胚乳细胞分离的蛋白体,含有二硫键连接的谷蛋白聚合物,这些聚合物被证明具有黏弹性。蛋白二硫异构酶催化 ER内面筋蛋白之间二硫键形成,分子伴侣(Bip)在建立其他蛋白与面筋蛋白相互的确切作用,还不肯定。
4.4 调控 HMW麦谷蛋白亚基表达与改良小麦加工品质
六倍体面包小麦 (Triticum aestivumL.,2n=6x =42,AABBDD)是麦类中唯一适合加工发酵烘焙产品。编码 HMW-GS基因位点Glu-1位于第 1部分同源染色体长臂上,而ω-醇蛋白基因位点 Glu-1和LMW-GS基因位点Glu-1连锁位于短臂上。在第 6部分同源染色体的短臂上还有醇蛋 Glu-1基因位点[34-35]。面包小麦加工品质主要由 HMW-GS决定,有6个基因编码 HMW-GS,两个基因为一组连锁位于基因组 A、B及D的 Glu-1位点。这些位点中每组连锁基因分别编码高、低分子质量的X-型和 Y-型亚基。由于基因沉默,Glu-A1编码 0~1个亚基,Glu-B1编码 1~2个亚基,Glu~D1编码 2个亚基,所以面包小麦品种仅存在 3~5个 HMWGS。1Bx、1Dx及 1Dy亚基存在所有面包小麦品种, 1Ax或 1By亚基仅存在一些品种中。所有表达亚基在 SDS-PAGE电泳中根据相对迁移率编号为 2个或 2个以上等位基因编码产物,如 1Dx2与 1Dx5亚基是等位基因编码产物,1Dx5亚基在 SDS-PAGE中迁移率大。而且,编码的 X-型和 Y-型亚基以“等位基因对”产物形式遗传,如亚基 1Dx2+1Dy12与 1Dx5+1Dy10是等位基因产物。于是,基因表达及编码蛋白的这种等位变异对面团强度产生数量和质量影响。数量效应与基因表达相关,尤其在 Glu-A1位点,1Ax亚基 (1A1或 1A23)的基因表达量增加,HMW-GS蛋白总量可以增加 2%[36]。质量效应的差异还不清楚,但认为与等位表达蛋白的不同结构与特性有关,如在 Glu-D1基因位点,与广泛存在的等位基因产物 1Dx2+1Dy12、1Dx3+1Dy12及1Dx4+1Dy12比较,1Ax1+1Ay23、1Bx17+1By18、1Dx5+1Dy10亚基相关于优质的面包加工品质。许多HMW-GS编码基因已经从面包小麦分离,它们编码 1Ax(1,23)、1Bx(7,17)、1By(9)、1Dx(2,5)及 1Dy(10,12)亚基[34],这使得通过遗传工程改良小麦加工特性变得容易。
过去十多年里报道了在面包小麦品种表达HMW-GS基因,采用其自身的启动子,或者另一HMW亚基基因的启动子,被转 HMW-GS基因的表达量接近或超过了内在基因的表达量。利用亚基1Dx5基因启动子驱动编码β-葡萄糖醛酸酶的UidA报告子基因在小麦表达,证明了被转基因的表达仅限于胚乳组织。同时在温室和田间对转基因小麦试验中,分析了 HMW-GS基因对面团强度的影响[37-38]。在 Glu-A1位点基因发生沉默的株系表达 1Ax1亚基,增加了面团强度,改善面包品质能够达到内源 1Ax1亚基表达的水平。将 1Ax1亚基基因转入不含有该基因的BobWhite小麦,转基因小麦中HMW-GS 1Ax1亚基含量,是种子总蛋白的 0.6%~2.3%,以总 HMW-GS量计最高达到 71%[39]。1Dx5和 1Dy10共同表达的株系小麦粉混合时间 (即面团强度)显著地增加。如果缺乏 1Dy10亚基表达,仅表达 1Dx5的株系 (欧洲小麦品种存在)产生不可预测的结果:小麦粉不能吸水,在揉混仪 (Mixgraph)中不能形成正常的面团,揉混仪曲线是扁平的,烘烤的面包体积小、质地色深。进一步分析表明,面筋蛋白显示高比例的不溶性谷蛋白聚合物,流变学特性类似加入转谷氨酰胺酶后面筋蛋白的交联增加。亚基 1Dx5不同于所有其他 X-型亚基,在于氨基酸序列中多了一个半胱氨酸残基,这导致在谷蛋白聚合物内或者之间,尤其在缺乏亚基 1Dy10时,发生不寻常的高水平交联。这就解释了谷蛋白聚合物的不溶性,不能发生正常的水合作用。1Ax1亚基的表达分析也表明遗传改良能够产生面团强度增加的小麦品种。对目前欧洲优良面包小麦品种,采用直接转化,或者杂交渗入模式小麦株系的基因,都能够改良面团强度[40]。一些HMW-GS基因和LMW-GS基因已经转化到面包 (Triticum aestivum)和面食 (Triticum turgidum)小麦品种。
HMW-GS与面包小麦加工品质明显有关,可以选择它们作为小麦品质遗传改良的早期筛选标记。此外,由于LMW-GS与醇蛋白编码基因是连锁的,一些醇蛋白可以作为小麦品质改良的遗传标记。我国学者对 113个小麦品系 (冬小麦品种国产 81个、澳大利亚 4个,春小麦品种国产 9个、国外 23个)鉴定面团强度和面包加工品质相关的醇蛋白亚基,发现 Gli-D1位点连锁基因编码的ω-醇蛋白亚基 15 +16可以作为小麦加工品质改良的筛选标记[41]。
5 结语
谷物贮藏蛋白对种子品质形成及利用特性有重要作用。了解这些蛋白质的结构、生物物理学特性及其在种子内合成、运输和沉积的生物学机制,对通过遗传工程改良谷物加工利用品质有指导意义。由于小麦 HMW-GS等位基因是紧密连锁的,利用常规育种方法操作它们就很困难。鉴定和克隆这些HMW-GS基因,通过遗传转化的方法将与面包加工品质相关的基因导入优良栽培品种。早期的工作是研究增加小麦醇蛋白和谷蛋白亚基表达的转基因技术,主要是探索异源系统表达技术,对表达蛋白的结构与功能涉及较少[42],而且转基因操作主要针对易于转化的模式材料(如BobWhite小麦),不是针对高产的小麦栽培品种。近来已经开始将转入模式材料的基因通过常规育种技术渗入优良栽培品种[40]。在逐步认识我国小麦资源醇蛋白和麦谷蛋白等位基因构成特性的基础上,分析它们与小麦加工利用品质的关系,在育种中充分利用这些优质基因,是一个重要的研究内容。
尽管大量研究证实通过遗传工程调控小麦面筋蛋白的结构与特性是可行的,但是现有小麦面筋蛋白结构与功能资料积累还不能可靠地预测试验结果。用编码面包小麦HMW-GS的基因转化其他面筋蛋白的野生型和突变株系,能够分析特定 HMWGS的功能与结构特征,产生特性改变的株系。如缺乏D基因组的六倍体小黑麦 (X Triticosecale,2n=6x =42,AABBRR),排除了第 1部分同源染色体长臂上的 Glu-D1位点和短臂上的 Gli-D1及 Glu-D3位点,以及第 6部分同源染色体短臂上的 Gli-D2位点。将黑麦 (Secale cerealeLinn,RR)R基因组 (携带第 1部分同源染色体长臂上的 Sec-3位点和短臂上的 Sec-1位点,以及第 2部分同源染色体长臂上的Sec-2位点)移位到小黑麦,降低了小黑麦面包加工品质[43]。将面包小麦第 1部分同源染色体长臂移位到小黑麦第 1部分同源染色体长臂,以 Glu-D1d (亚基 5+10)等位基因代替 Sec-3位点,再进一步移位短臂上的 Gli-D1及 Glu-D3位点到小黑麦第1部分同源染色体短臂上,小黑麦品质有改善的趋势,但面包加工品质变化不明显[44]。开展这些工作有利于丰富麦类种质资源,为小麦粉加工过程中面筋调配提供原料。
我国食用小麦历史悠久,馒头、水饺、面条等蒸煮食品加工技术优良、加工品种繁多,不足之处是需要进口面包和饼干小麦。我国小麦品种中 Gli-D1f、Gli-A2f、Gli-B2g及 Gli-D2g醇蛋白等位基因、Glu-1Bb(1Bx7+1By8)、Glu-1Bc(1Bx7+1By9)、Glu-D1a(1Dx2+1Dy12)HMW-GS等位基因 (或亚基)高频率发生,缺乏欧美品种中高频率发生的Gli-B2c、Gli-B1b、Gli-A2b、Glu-A1c(1Ax1+ 1Ay23)、Glu-D1d(1Dx5+1Dy10)等位基因[45-46],这有利于开展食品蒸煮与烘焙的机理研究。结合粮食界已确定的一系列小麦品质评价国家标准,如优质小麦 -强筋小麦 (GB/T17892-1999)、优质小麦-弱筋小麦 (GB/T17893-1999)、专用小麦品种品质(GB/T17320-1998)等,从种子储藏蛋白与加工工艺角度,不断完善这些国家标准及我国小麦品质的评价体系。
[1]董超华,徐如宏,张庆勤.小麦醇溶蛋白和谷蛋白研究进展[J].山地农业生物学报,2003,22(2):164-168
[2]赫俊杰,何盛莲,陈军营.小麦种子储藏蛋白研究进展[J].河南农业大学学报,2004,38(3):249-254
[3]陈豫,曲乐庆,贾旭.水稻种子储藏蛋白及其基因表达[J].遗传,2003,25(3):367-372
[4]唐建卫,刘建军,张平平,等.储藏蛋白组分对小麦面团流变学特性和食品加工品质的影响[J].中国农业科学, 2008,41(10):2937-2946
[5]Shewry PR,Casey R.Seed proteins[M].Dordrecht:Kluwer Academic Publishers 1999
[6]Kriz AL.7S globulins of cereals[M]//Shewry PR,Casey R.Seed proteins,Dordrecht:Kluwer Academic Publishers, 1999:477-498
[7]Shewry PR,Tatham AS.The prolamin storage proteins of ce2 real seeds:structure and evolution[J].BiochemicalJournal, 1990,267:1-12
[8]Kermode AR,Bewley JD.Synthesis,processing and deposi2 tion of seed proteins:the pathway of protein synthesis and deposition of the cell[M]//Shewry PR,Casey R.Seed pro2 teins,Dordrecht:KluwerAcademic Publishers,1999:807-841
[9]Muench DG,Ogawa M,Okita T W.The prolamins of rice [M]//Shewry PR,Casey R.Seed proteins,Dordrecht:Klu2 werAcademic Publishers,1999:93-108
[10]Yamagata H,Tanaka K.The site of synthesis and accumula2 tion of rice storage proteins[J].Plant and Cell Physiology, 1986,27:135-145
[11]Li X,FranceschiV,Okita T W.Segregation of storage protein mRNAs on the rough endoplas mic reticulum membranesof rice endosper m membrane[J].Cell,1993,72:869-879
[12]Muench DG,Wu Y,Coughlan SJ,et al.Evidence for a cy2 toskeleton-associated binding site involved in prolamine mRNA localization to the protein bodies in rice endosperm tissue[J].Plant Physiology,1998,116:559-569
[13]Lending CR,Chesnut RS,Shaw KL,et al.I mmunolocaliza2 tion of avenin and globulin storage proteins in developing en2 dosperm ofAvena sativa L[J].Planta,1989,178:315-324
[14]Bechtel DB,W ilson JD,Shewry PR.I mmunocytochemical localization of thewheat storage protein triticin in developing endosper m tissue[J].Cereal Chemistry,1991,68:573-577
[15]Galili G.The prolamin storage proteins ofwheat and its rela2 tives[M]//Larkins BA,Vasil IK.Cellular and molecular biology of plant seed development,The Netherlands:Kluwer Academic Publishers,1997:221-256
[16]Altschuler Y,Galili G.Role of conserved cysteines of a wheat gliadin in its transport and assembly into protein bodies in Xenopus oocytes[J].Journal ofBiological Chem2 istry,1994,269:6677-6682
[17]Shewry PR.The synthesis,processing and deposition of glu2 ten proteins in the developingwheat grain[J].Cereal Foods World,1999,44:587-589
[18]Lending CR,Larkins BA.Changes in the zein composition of protein bodies duringmaize endosperm development[J]. The Plant Cell,1989,1:1011-1023
[19]Coleman CE,Herman EM,Takasaki K,et al.The maizeγ -zein sequestersα-zein and stabilizers its accumulation in protein bodies of transgenic tobacco endosperm[J].The Plant Cell,1996,8:2335-2345
[20]McMaster TJ,MilesMJ,WannerbergerL,et al.The identi2 fication ofmicrophases in mixedα-andγ-gliadin protein fil ms investigated by atomic forcemicroscopy[J].Journalof Agricultural and Food Chemistry,1999,47:5093-5099
[21]Bagga S,AdamsH,Rodriquez FD,et al.Co-expression of the maizeσ-andβ-zein genes results in stable accumu2 lation ofσ-zein in ER-derived protein bodies formed by β-zein[J].The Plant Cell,1997,9:1683-1696
[22]TecsiL,Darlington HF,HarrisN,et al.Patterns of protein deposition and distribution in developing and mature barley grain[C]//Barley genetics,V III.Proceedings of the 8th International Barley Genetics Symposium.Adelaide,Aus2 tralia,2000,2:266-268
[23]MüllerM,Knudsen S.The nitrogen response of a barley C -hordein promoter is controlled by positive and negative regulation of the GCN4 and endosperm box[J].The Plant Journal,1993,4:343-355
[24]Hammond-KosackMC,Holds worthMJ,BevanMW.In vi2 vo footprintingof a low molecularweight glutenin gene(LM2 WG-1D1)in wheat endosperm[J].The EMBO Journal, 1993,12:545-554
[25]Marris DG,Gallois P,Copley J,et al.The 5’flanking re2 gion of a barleyB hordein gene controls tissue and develop2 mental specific CAT expression in tobacco plants[J].Plant MolecularBiology,1988,10:359-366
[26]Coleman CE,Larkins BA.The prolamins of maize[M]// Shewry PR,Casey R.Seed proteins,Dordrecht:KluwerAc2 ademic Publishers,1999:109-139
[27]Shewry PR,Tatham AS,Halford NG.The prolamins of the Triticeae[M]//Shewry PR,Casey R.Seed proteins.Dor2 drecht:KluwerAcademic Publishers,1999:35-78
[28]刘军,黄上志,傅家瑞.不同活力玉米种子胚萌发过程中蛋白质的变化[J].热带亚热带植物学报,1999,7:65-69
[29]王文军,景新明.种子蛋白质与蛋白组的研究[J].植物学通报,2005,22(3):257-266
[30]Shen-Miller J,MudgettMB,Schopf JW,et al.Exception2 al seed longevity and robust growth:ancient sacred lotusfrom China[J].American Journal of Botany,1995,82: 1367-1380
[31]Payne PI.Geneticsofwheat storage proteins and the effectof allelic variation on bread-making quality[J].Annual Re2 view of Plant Physiology,1987,38:141-153
[32]Belton PS.On the elasticity of wheat gluten[J].Journal of Cereal Science,1999,29:103-107
[33]Macritchie F.Physicochemical properties of wheat proteins in relation to functionality[J].Advance in Food Nutrition and Research,1992,36:1-87
[34]Shewry PR,Jones HD,Halford NG.Plant biotechnology: transgenic crops[J]Adv Biochem Engin Biotechnol 2008, 111:149-186
[35]段淑娥.小麦麦谷蛋白亚基及其基因的研究进展[J].西安文理学院学报,2007,10(3):69-75
[36]BlechlAE,Anderson OD.Expression of a novel high-mo2 lecular-weight glutenin subunit gene in transgenic wheat [J].Nature Biotechnology,1996,14:875-879
[37]Popineau Y,Deshayes G,Lefebvre J,et al.Prolamin aggre2 gation,gluten vicoelasticity and mixing properties of trans2 genic wheat lines expressing 1Ax and 1Dx high molecular weight glutenin subunit transgenes[J].Journal of Agricul2 tural and Food Chemistry,2001,49:395-401
[38]RakszegiM,Békés F,Lang L,et al.Technological quality of transgenic wheat expressing an increased amount of a HMW glutenin subunit[J].Journal of Cereal Science, 2005,42:15-23
[39]Altpeter F,VasilV,SrivastavaV,et al.Integration and ex2 pression of the high-molecular-weight glutenin subunit 1Ax1 into wheat[J].Nature Biotechnology,1996,14: 1155-1159
[40]Field JM,Bhandari D,Bonet A,et al.Introgression of transgenes into a commercial cultivar confirms differential effects of HMW subunits 1Ax1 and 1Dx5 on gluten proper2 ties[J].Journal of Cereal Science,2008,48:457-463
[41]Wang AL,Gao LY,Li XH,et al.Characterization of two 1D-encodedω-gliadin subunits closely related to dough strength and pan bread-making quality in common wheat (Triticum aestivumL.) [J].Journal of Cereal Science, 2008,47:528-535
[42]Tamás L,Shewry PR.Heterologous expression and protein engineering ofwheat gluten proteins[J].Journal of Cereal Science,2006,43:259-274
[43]Lukaszewski AJ.Breeding behaviour of the cytogenetically engineered wheat-rye translocation chromosome 1RS.1BL [J].Crop Science,2001,41:1062-1065
[44]Martinek P,VinterováM,Bure˝ováI,et al.Agronomic and quality characteristicsof triticale(XTriticosecaleW ittmack) with HMW glutenin subunits 5+10[J].Journal of Cereal Science,2008,47:68-78
[45]毛沛.小麦遗传资源 HMW麦醇溶蛋白亚基组成及其与面包烘烤品质关系的研究 [J].中国农业科学:增刊, 1995,28:22-27
[46]晏月明,茹岩岩,余建中.中国小麦品种醇溶蛋白 Gli-1和 Gli-2编码位点等位基因组成分析 [J].农业生物技术学报,2000,8(1):23-27.
Cereal Seed Storage Proteins:Structure, Property and Role in Grain Utilization
Li Xingjun
(Academy of the State Administration of Grains,Beijing 100037)
Storage proteins account for 50%of the total protein in mature cereal grains,and play role on grain nutrition for human and livestock and on grain properties relative with seed ger mination,grain storage and food pro2 cessing.The structures and properties of prolamin and globulin storage proteins of cereals and their mechanis ms of synthesis,transportation and deposition in the developing seeds are introduced.The role of gluten proteins ofwheat in deter mining bread making quality,and how to manipulate their amount and composition to change dough-mixing property is also demonstrated.This review is suggestive for cereal breeding,grain storage and grain processing quality valuation.
cereal,storage protein,prolamin,gluten,functional property,protein body
Q51 文献标识码:A 文章编号:1003-0174(2010)05-0105-10
国家粮科院科研业务费(ZX0708012),国家教育部留学归国启动基金(Z1006)
2009-05-20
李兴军,男,1971年出生,副研究员,博士,粮食生理生化

