沙棘叶多糖的提取工艺及抗氧化作用的研究
包怡红,秦 蕾,王 戈
(1.东北林业大学林学院,黑龙江哈尔滨 150040; 2.中共黑龙江省委办公厅,黑龙江哈尔滨 150007)
沙棘叶多糖的提取工艺及抗氧化作用的研究
包怡红1,秦 蕾1,王 戈2
(1.东北林业大学林学院,黑龙江哈尔滨 150040; 2.中共黑龙江省委办公厅,黑龙江哈尔滨 150007)
以沙棘叶多糖得率为指标,通过单因素及正交实验,对水提、微波辅助及超声波辅助三种提取方法进行比较,超声波辅助法的最佳提取条件为:液固比60∶1,超声波功率700W,超声波作用时间 40min。在此条件下,超声波法的最佳提取率为 7.50%,高于微波法的最佳提取率 7.05%和水提法的最佳提取率 6.24%。实验结果表明:沙棘叶多糖具有一定的体外抗氧化能力,其中当多糖浓度为 1200μg/mL时,对·的清除率比同浓度的VC还高 18.92%。
提取,多糖,沙棘叶,体外抗氧化
1 材料与方法
1.1 材料与仪器
沙棘叶 俄罗斯大果沙棘,采于黑河市林业局;石油醚、氯仿、正丁醇、丙酮、乙醇、硫酸亚铁 天津市东丽区天大化学试剂厂;苯酚、浓硫酸、邻苯三酚、铁氰化钾 天津市耀华化学试剂有限责任公司;其余试剂 均为国产分析纯;总抗氧化活性(T-AOC)试剂盒 南京建成生物工程研究所。
722S可见分光光度计 上海精密科学仪器有限公司;HHS型电热恒温水浴锅 上海博迅实业有限公司医疗设备厂;JY92-2D超声波细胞粉碎机 宁波新芝生物科技股份有限公司;WD800(MG-5531SD)微波炉 乐金电子 (天津)电器有限公司; SHB-3旋转蒸发仪 郑州杜甫仪器厂;T6-新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;TDL-40B-W台式低速大容量离心机 湖南星科科学仪器有限公司;ALPHA1-2冷冻干燥机 德国CHR IST公司。
1.2 实验方法
1.2.1 沙棘叶多糖的提取工艺流程 沙棘叶→粉碎、过筛(60目)→石油醚脱脂→微波或超声波辅助处理→水浴浸提→脱蛋白→脱色→透析→浓缩→醇沉→冷冻干燥→沙棘叶多糖(备用)
1.2.2 葡萄糖标准曲线的制作 采用苯酚 -硫酸法[4]。
1.2.3 总还原糖含量的测定 准确吸取 1.0mL提取液于 100mL容量瓶中,加蒸馏水定容;取 2.0mL稀释液于试管中,加入 6%的苯酚 1.0mL,98%的浓硫酸5.0mL,静置 10min后摇匀,室温放置 20min,然后在490nm波长处比色,通过标准曲线方程计算多糖含量及提取率。

1.2.4 单因素及正交实验设计
1.2.4.1 水提法 水提法以液固比、提取温度和提取时间为单因素,分别研究各单因素的不同水平对多糖得率的影响。在单因素实验的基础上,按 L9(33)进行正交实验,以确定其最佳提取工艺条件。
1.2.4.2 微波辅助法 微波辅助法以液固比、微波作用时间、微波功率为单因素,分别研究各因素的不同水平对多糖得率的影响。在单因素实验的基础上,按L9(33)进行正交实验,以确定其最佳提取工艺条件。
1.2.4.3 超声波辅助法 超声波辅助法以液固比、超声波功率、超声波作用时间为单因素,分别研究各因素的不同水平对多糖得率的影响。在单因素实验的基础上,按L9(33)进行正交实验,以确定其最佳提取工艺条件。
1.2.5 沙棘叶多糖体外抗氧化指标的测定
1.2.5.1 清除羟自由基 (·OH)能力的测定[5-6]在10mL的试管中依次加入 6mmol/L的 FeS O4溶液 1mL, 6mmol/L的 H2O2溶液 1mL,浓度为 200~1000μg/mL的待测溶液 1mL,摇匀,静置 10min,再加入 6mmol/L的水杨酸溶液 1mL,摇匀,静置 30min后于 510nm波长处测其吸光度。

式中:A1为空白对照的吸光度;A2为无水杨酸时加入待测液的吸光度;A3为加入待测液的吸光度。
1.2.5.2 总抗氧化活性 (T-AOC) 根据总抗氧化能力试剂盒测定。定义在 37℃时,每分钟每毫升样品使反应体系的吸光度(OD)值每增加 0.01时,为一个总抗氧化能力单位U。
1.2.5.3 超氧阴离子 (O2-·)清除率的测定[7]采用邻苯三酚自氧化法测定。在试管中依次加入 4.5mL 0.1mol/L Tris-HCl(pH8.2,内含 2mmol/L EDT A)缓冲溶液,4.2mL双蒸水,于 25℃恒温 20min后,加入25℃预热过的0.3mL 3mmol/L邻苯三酚溶液,迅速摇匀,在波长 325nm波长处每 30s测定一次吸光度,计算线性范围内每分钟吸光度的增值,此即为邻苯三酚的自氧化速率A0。
沙棘叶多糖 (对照 VC)抗氧化活性测定按上述操作,加入邻苯三酚前,先加入一定量多糖溶液,并减少同体积双蒸水,其它操作均与上述相同,所测吸光度为Ai。
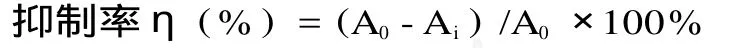
1.2.5.4 总还原力的测定[8]采用铁氰化钾法测定。在 2.5mL 0.2mol/L磷酸缓冲溶液 (pH 6.6)中加入2.5mL 1%的铁氰化钾溶液和 1mL样品。混合物在50℃水浴中反应 20min后,迅速冷却并加入 2.5mL 10%的三氯乙酸,混匀后以 3000r/min离心 10min。取 1mL上清液加入 0.2mL 0.1%的三氯化铁溶液混匀,再加入 1mL蒸馏水摇匀,以蒸馏水调零,在700nm波长处测定吸光度。
2 结果与分析
2.1 葡萄糖标准曲线的绘制
称取葡萄糖 0.020g于 500mL容量瓶中定容,即为葡萄糖标准溶液,取 2.0mL蒸馏水作为空白样,依次取 0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8mL葡萄糖标准溶液,用蒸馏水补足 2.0mL,在 9个样品中加入 6%的苯酚 1.0mL,98%的浓 H2SO45.0mL,静置 10min后摇匀,室温放置 20min,然后在 490nm波长处比色,结果如图1所示。
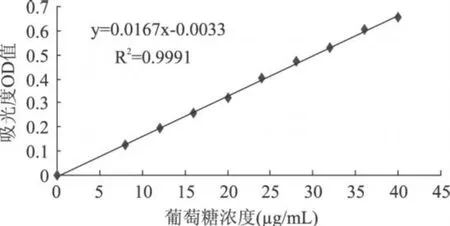
图 1 葡萄糖溶液标准曲线
2.2 三种提取方法的比较结果分析
2.2.1 水提法工艺条件的确定
2.2.1.1 水提法单因素实验结果 如图 2所示,液固比对沙棘叶多糖提取率的影响最大,多糖得率随着液固比的增加而增加,当液固比为 50∶1时,多糖得率为 5.44%,之后其变化趋于稳定,此时多糖成分已基本溶出;随着提取温度的升高,多糖得率也在逐渐增加,当提取温度为 90℃时,多糖得率达到 5.49%,之后其变化趋于稳定;当提取时间大于 3h时,多糖得率的增加也已不再明显。
2.2.1.2 水提法正交实验结果 为了获得最佳工艺条件,利用正交“均衡分散”的特点,根据单因素实验结果,按 L9(33)进行正交实验设计,结果如表 1所示。

图 2 水提法各因素对沙棘叶多糖得率的影响
由表 1可知,3个因素对多糖得率的影响中,液固比的影响最为显著,其次是提取温度和提取时间。最佳提取工艺条件为A3B2C3,即液固比 60∶1,提取温度 90℃,提取时间 4h,经验证实验,测得样品多糖含量为 6.24%,证实为最优组合。

表 1 水提法正交实验设计及结果分析
2.2.2 微波辅助提取法工艺条件的确定
2.2.2.1 微波辅助法单因素实验结果 如图 3所示,多糖得率随着液固比的增加而增加,当液固比大于50∶1时,多糖得率的变化已基本稳定,说明此时沙棘叶中的水溶性多糖已基本溶出;当微波作用时间为3.5min时,多糖得率达 7.03%,之后继续延长微波作用时间,由于反应容器不密闭,高温使部分溶剂挥发,故导致提取率随之下降;当微波功率为 480W时,多糖得率增加到 7.03%,其后随着功率的增加,溶剂挥发也过多,使液固比降低,故多糖得率也随之下降。
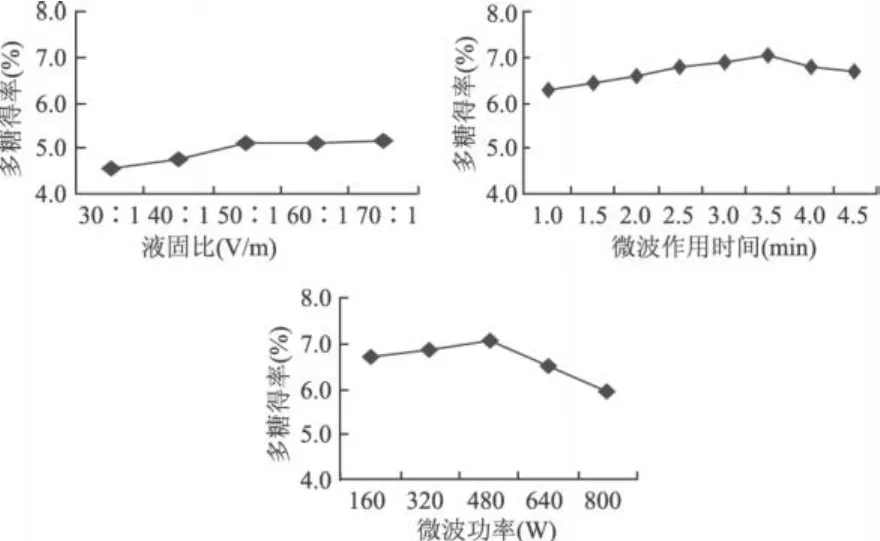
图 3 微波辅助法各因素对沙棘叶多糖得率的影响
2.2.2.2 微波辅助法正交实验结果 由表 2可知,3个因素对多糖得率的影响依次为:微波功率 >液固比 >微波作用时间。此法的最佳提取工艺条件为A1B2C2,正是正交实验设计中的第二组合,即液固比40∶1,微波作用时间 3.5min,微波功率 480W,此条件下多糖得率为 7.05%,证实为最优组合。
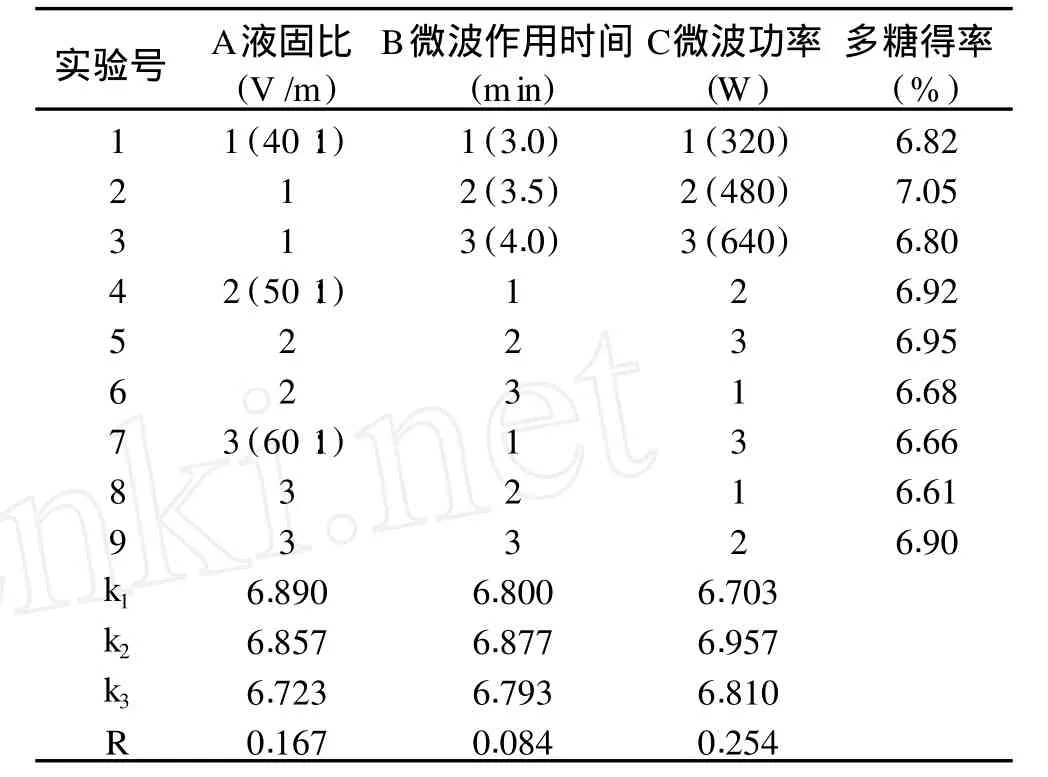
表 2 微波辅助法正交实验设计及结果分析
2.2.3 超声波辅助提取法工艺条件的确定
2.2.3.1 超声波辅助法单因素实验结果 如图 4所示,沙棘叶多糖的得率随着液固比的增加而增加,当其达到 50∶1时,原料中的水溶性多糖已基本溶出,其后随着液固比的增加,多糖得率的变化已基本平稳;在超声波功率为 600W时,多糖的得率达 7.36%,之后随着作用功率的增加,多糖得率开始下降,这是由于超声波产生的空化、震荡作用,虽可加强细胞内物质的释放、扩散及溶解,但过大的超声波功率也可使部分多糖发生降解[9-10];超声波作用时间对多糖得率的影响最小,多糖得率随着其增加而增加,当作用时间超过 40min时,多糖得率的增加幅度已减小。

图 4 超声波辅助法各因素对沙棘叶多糖得率的影响
2.2.3.2 超声波辅助法正交实验结果 为了获得最佳工艺条件,利用正交“均衡分散”的特点,根据单因素实验结果,按L9(33)进行正交实验设计,结果如表3所示。
由极差分析可知,3个因素对多糖的影响依次为:液固比 >超声波功率 >超声波作用时间。最佳提取工艺条件为A2B2C2,即液固比 50∶1,超声波功率600W,超声波作用时间 40min,经验证实验测得此条件下的多糖得率为 7.50%,证实为最优组合。

表 4 沙棘叶多糖及VC的还原力测定结果

表 3 超声波辅助法正交实验设计及结果分析
2.2.4 三种提取方法的结果比较 见图 5。

图 5 三种提取方法的多糖得率的比较
2.3 沙棘叶多糖体外抗氧化指标的测定结果分析
2.3.1 清除羟自由基能力的结果分析 如图 6所示,浓度为 200~2000μg/mL的沙棘叶多糖对·OH的清除率随其浓度的增加而增加,2000μg/mL的多糖溶液对·OH的清除率为 90.09%,明显接近于同浓度的VC溶液的·OH清除率 99.72%。沙棘叶多糖对·OH具有很强的清除作用,说明它具有一定的体外抗氧化活性。

图 6 不同浓度沙棘叶多糖及VC对·OH的清除作用
2.3.2 总抗氧化活性 (T-AOC)的结果分析 如图 7所示,沙棘叶多糖的总抗氧化能力随其浓度的增加而增加,在浓度为 2000μg/mL时抗氧化能力已达到86.33U/mL,但是明显小于同浓度的 VC抗氧化能力252.96U/mL。
2.3.3 清除超氧阴离子能力的结果分析 如图 8所示,沙棘叶多糖对·的清除率随其浓度的增加而增加,在 1000μg/mL时已达到 98.65%,高于同浓度的VC对·的清除率 70.27%,当浓度大于 1200μg/mL时清除率达到 100%,说明沙棘叶多糖具有很高的清除率。
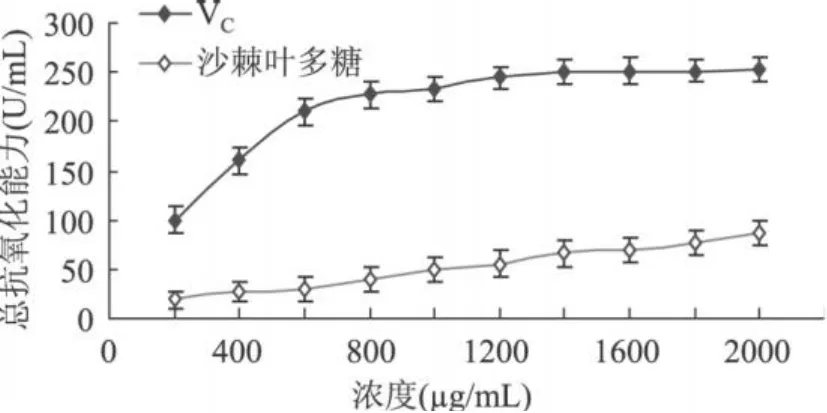
图 7 不同浓度沙棘叶多糖及VC的总抗氧化能力
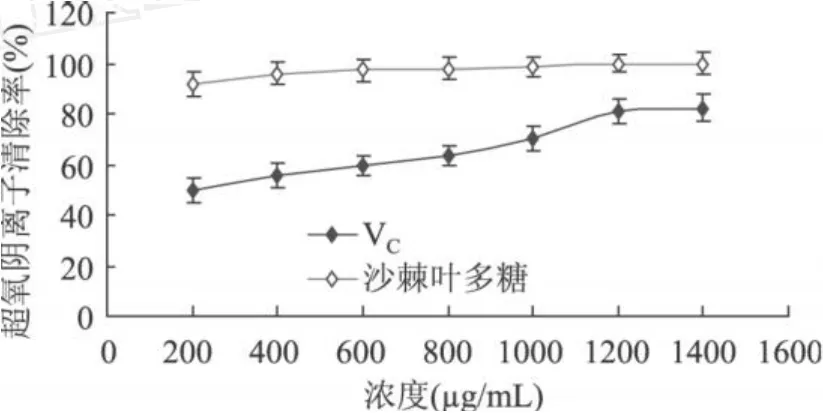
图 8 不同浓度沙棘叶多糖及VC对·的清除作用
2.3.4 还原力测定的结果分析 如表 4所示,浓度为200~2000μg/mL的沙棘叶多糖的还原力随其浓度的增加而增强,但变化不大,而且明显低于同浓度的VC溶液的还原力。虽然 2000μg/mL沙棘叶多糖的还原力比 200μg/mL的VC溶液还要略低一些,但已表明沙棘叶多糖具有一定的还原力。
3 结论
3.1 水提取法的最佳工艺条件为:液固比 60∶1,浸提温度 90℃,浸提时间 4h,经验证实验测得样品多糖得率为 6.24%,各因素对多糖得率的影响顺序为:液固比 >提取温度 >提取时间。
3.2 微波辅助提取法的最佳工艺条件为:液固比40∶1,微波作用时间 3.5min,微波功率 480W,此条件下多糖得率为 7.05%,各因素对多糖得率的影响顺序为:微波功率 >液固比 >微波作用时间。
3.3 超声波辅助提取法的最佳工艺条件为:液固比60∶1,超声波功率 700W,超声波作用时间 40min,此条件下多糖得率为 7.50%,各因素对多糖得率的影响顺序为:液固比 >超声波功率 >超声波作用时间。
3.4 本实验中沙棘叶多糖的四项体外抗氧化能力均随其浓度的增加而增加,与同浓度的 VC溶液相比,具有明显的总抗氧化能力和清除·OH的能力,其中对·的清除作用比同浓度的 VC溶液还高18.92%,还原力虽比同浓度的 VC溶液低,但已表明沙棘叶多糖具有一定的体外抗氧化能力。
[1]杨芳 .沙棘的研究进展[J].第一军医大学分校学报,2004, 27(1):79-80.
[2]马桔云,程明,战丹 .沙棘化学成分的研究进展[J].黑龙江医药,2003,14(3):208-209.
[3]熊丙全,余东,袁军,等 .中国沙棘属植物资源及其开发利用现状[J].中国野生植物资源,2004,23(2):25-26.
[4]张水华 .食品分析 [M].北京:中国轻工业出版社,2006: 115-124.
[5]李艳伏,徐怀德,陈金海,等 .木瓜蛋白酶酶解核桃粕蛋白产物抗氧化活性研究[J].中国食品学报,2008,8(5):8-14.
[6]CHEN H X,ZHANG M.Antioxidant activities of different fractions of polysaccharide conjugates from green tea(Cam ellia Sinensis)[J].Food Chemistry,2008(106):559-563.
[7]邹国林,桂兴芬,钟晓凌,等 .一种 SOD的测活方法[J].生物化学与生物物理进展,1986(4):71-73.
[8]徐怀德,殷金莲,陈沁 .甲鱼酶解产物抗氧化功能的研究[J].中国食品学报,2007,7(4):26-27.
[9]YANGB,J IANG YM.Effects of ultrasonic extraction on the physical and chemical properties of polysaccharides from longan fruit pericarp[J].Polymer Degradation and Stability,2008(93): 268-272.
[10]MANCIER V,LECLERCQ D.New flowmetric measurement methods of power dissipated by an ultrasonic generator in an aqueous medium[J].Ultrasonics Sonochemistry,2007,14(2): 99-106.
Study of extraction and antioxidant of polysaccharide fromH ippohae rham noidesL.leave
BAO Y i-hong1,QIN Lei1,WANG Ge2
(1.College of Forest,Northeast ForestUniversity,Harbin 150040,China; 2.GeneralOffice of the CPC Heilongjiang Province Committee,Harbin 150007,China)
Taking the ra te of p olysaccha ride from Hipp ohae rham noides L.leaves as eva lua tion index,and through s ing le fac tor and orthogona l tes ts,the three m e thods of extrac tion:wa te r,m ic rowave-ass is ted and ultrasonicass is ted,we re comp a red.The results showed the bes t ultrasonic-ass is ted extrac tion ra te of7.50%,highe r than the m ic rowave m e thod the bes t ra te of7.05% and wa te r m e thods the bes t ra te of6.24%.The bes t cond itions of ultrasonic extrac t m e thods we re as follows:liquid-solid ra tio60∶1,the ultrasonic p owe r700W,ultrasonic t im e 40m in.The p olysaccha ride extrac ted from Hipp ohae rham noides L.leave had ce rta in deg ree antioxidant cap ac ities in vitro,for examp le,when the concentra tion of p olysaccha ride was1200μg/mL,the rem ova l effec t towa rds· was of highe r than VCby18.92%。
extrac tion;p olysaccha ride;Hipp ohae rham noides L.leave;antioxidant in vitro
TS201.2
A
1002-0306(2010)01-0286-05
沙棘 (Hippophae rham nosidesL.)属于胡颓子科沙棘属植物,落叶灌木或小乔木,又名沙枣、酸柳。我国华北、西北、西藏、云南等地均有分布,是沙棘资源最丰富的国家[1]。沙棘是较好的绿化植物,同时也具有较高的营养价值,它主要体现在食品开发和药品开发等方面[2]。沙棘油是各种生命活性物质的浓缩物,在现代医学中有广泛用途;沙棘茎皮可提取抗癌物质;沙棘花是很好的蜜源等。目前,我国沙棘的加工工艺和设备都相对简单,随着沙棘产品数量的日益扩大,其不被重视和利用的沙棘叶和沙棘粕等也越来越多。近年来除少量供药用外,大量用于多种保健饮料的配制[3]。尽管如此,关于沙棘叶中多糖的研究仍报道很少,为此,本实验对沙棘叶水溶性多糖的提取进行了研究,对比了水提、微波辅助及超声波辅助三种提取方法的提取效果,且对其体外抗氧化能力进行研究,旨在为进一步研究沙棘叶多糖的构效关系提供依据。
2009-10-26
包怡红 (1970-),女,教授,博士后,研究方向:林副产品深加工与食品微生物资源开发利用。

