转谷氨酰胺酶交联乳蛋白对新鲜干酪特性的影响
卢晓明,王培根,任发政,陈尚武
(中国农业大学,食品科学与营养工程学院,教育部、北京市功能乳品重点实验室,北京 100083)
转谷氨酰胺酶交联乳蛋白对新鲜干酪特性的影响
卢晓明,王培根,任发政,陈尚武*
(中国农业大学,食品科学与营养工程学院,教育部、北京市功能乳品重点实验室,北京 100083)
利用转谷氨酰胺酶(TG)交联酪蛋白,研究其对新鲜干酪凝乳的成分和质构特征的影响。结果表明,TG能够加速凝乳发酵过程,提高乳中蛋白质和脂肪的回收率,并显著降低了乳清中的蛋白含量,对凝乳的质构特征也具有明显修饰作用。但与凝乳酶同时作用时,TG酶对凝乳的修饰作用不显著。
转谷氨酰胺酶(TG),凝乳酶,干酪,质构
1 材料与方法
1.1 材料与设备
新鲜牛奶 北京三元有限公司;酪蛋白 Sigma; TG酶 日本味之素公司;发酵剂、凝乳酶 丹尼斯克北京公司;其它试剂 均为分析纯。
DK-8B电热恒温水槽、DNP型电热恒温培养箱、DHG型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;DYY-12型电脑三恒多用电泳仪 北京市六一仪器厂;干酪模具 自制;质构仪 T MS-PRO,美国;pH211精密酸度计 意大利哈纳科仪公司; KDY-9830凯氏定氮仪 北京市恩贝特机电技术研究所。
1.2 实验方法
1.2.1 TG对乳蛋白的交联处理 转谷氨酰胺酶(活力 100U/g)用蒸馏水溶解,制成 0.1g/mL酶溶液;酪蛋白用 8mol/L尿素溶解。转谷氨酰胺酶交联处理温度为 37℃,交联酶活为 0.6U/g蛋白,交联时间为0~8h,每 1h为间隔。
1.2.2 干酪制作 新鲜牛奶分为四组,酸凝对照组、TG处理组、凝乳酶处理组和 TG与凝乳酶共同作用组,分别记作 CL、TG、RN和 TR。各组牛奶在 63℃, 30min巴氏杀菌,冷却到 32℃。添加直投式发酵剂,主要成分为 Lactococcus lactis subsp.lactis和 L.lactis subsp.Crem oris。在 32℃发酵 2h后,分别在 TG和 RN组添加 TG酶 (0.6U/g)和凝乳酶 (0.2mL/L),TR组则同时添加 TG和凝乳酶。pH4.6时切割,拍乳清,装模成型。
1.2.3 干酪理化参数分析 干酪和乳清中蛋白含量采用凯氏定氮法测定,蛋白系数为 6.38;干酪脂肪采用有机溶剂提取法(王志清,1983);水分含量测定采用烘箱干燥法。
1.2.4 发酵速率测定 各组样品加入发酵剂后于恒温培养箱内 32℃发酵,每 0.5h用酸度计测各组凝乳的 pH,不重复取样,样品重复三次。
1.2.5 干酪质构特性测定 采用质构仪在室温(20±2℃)进行测定,样品形状为高度 10mm直径10mm的圆柱体,用取样器从干酪中心部位取样,在室温下放置 30min。使用直径 25mm的圆柱形探头,进行两次循环垂直压缩,压缩速率为 60mm/min,压缩变形为 50%。质构特征曲线如图 1所示。可以测得干酪的硬度、弹性、内聚性和粘着性,以及由此计算出的胶粘性和咀嚼性。每组样品重复六个试样。

图 1 两次垂直压缩循环质构特征曲线
1.2.6 SDS-PAGE电泳 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)采用垂直电泳仪进行。浓缩胶浓度为4%,用 125mmol/L pH6.8的 Tris-HCl缓冲液配制,分离胶浓度为 15%,用 380mmol/L pH8.8 Tris-HCl缓冲液配制,含 0.1%(w/v)SDS。浓缩胶电压 90V,分离胶电压 110V。用考马斯亮蓝 R250染色,甲醇和醋酸混合液脱色。
1.2.7 数据处理 采用 SPSS16.0软件 (SPSS Inc.,美国)的一般线性模型进行方差分析。邓肯氏多重检验确定数据间的差异,显著水平为 P≤0.05。
2 结果与讨论
2.1 TG酶对酪蛋白的交联作用
转谷氨酰胺酶对酪蛋白交联作用的 SDS-PAGE电泳结果如图 2所示,37℃时 8h内,TG对酪蛋白具有明显的交联作用,作用 1h后κ-酪蛋白条带明显减弱,2h以后出现了清晰的大分子聚合物条带,α-和β-酪蛋白条带也逐渐减弱,说明已经形成了分子间或分子内的交联作用。由于κ-酪蛋白位于酪蛋白的外层,这种交联也首先从κ-酪蛋白开始进行。干酪从开始到排乳清的时间一般为 2~8h,因此,在干酪制作过程中,能够通过添加 TG酶使酪蛋白发生交联,从而影响其凝乳过程。

图 2 TG酶在 37℃下对酪蛋白作用0~8h的 SDS-PAGE电泳条带
2.2 TG酶对凝乳发酵速率的影响
各组凝乳发酵速率如图 3所示,对照组 (CL)仅为乳酸菌发酵,发酵速率缓慢,显著低于其它三组,添加 TG酶能够明显提高发酵速率,表明酪蛋白交联作用更利于乳酸菌发酵,但其低于凝乳酶作用的凝乳,凝乳酶水解酪蛋白暴露出疏水基团,使酪蛋白凝聚加速了发酵过程。TG和凝乳酶同时作用的凝乳其发酵速率与凝乳酶单独作用时无显著性差异(P>0.05),可以表明当 TG和凝乳酶同时作用时,凝乳酶处于优势,对酪蛋白的水解作用一定程度上抑制了 TG对酪蛋白的交联作用。
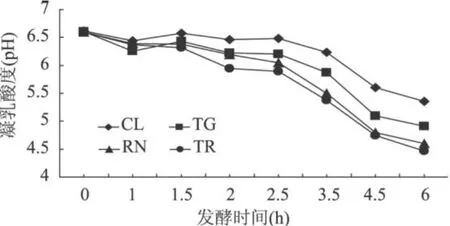
图 3 TG和凝乳酶添加对凝乳发酵速率的影响
2.3 TG和凝乳酶对干酪化学指标的影响
各组处理制得干酪的化学指标如图 4所示,凝乳酶处理的凝乳水分含量显著低于其它各组,脂肪和蛋白含量显著高于其它各组(P≤0.05)。添加 TG酶和同时添加 TG、凝乳酶对干酪的脂肪、蛋白含量没有明显提高,但提高了干酪的水分含量,TG酶对酪蛋白的交联增加了凝乳的持水性,Faergemand和Qvist(1997)也在研究中表明,酪蛋白交联能够增强酸凝形成的凝胶的乳清结合性能。TG酶单独处理能够增加凝乳干物质中的蛋白含量,说明蛋白质的回收率得到了提高,与对照组和凝乳酶单独处理组比较,干物质中的脂肪含量也得到了提高。由图 5可知,TG酶处理的干酪乳清中蛋白含量显著低于其它各组(P≤0.05),表明 TG酶处理能够减少乳清蛋白在干酪制作中的损失,可能由于酪蛋白的交联作用形成的网络结构使一部分乳清蛋白保留在凝乳中,也可能是乳清蛋白本身在 TG作用下与酪蛋白发生了交联。但 TG和凝乳酶共同作用并不能降低乳清蛋白的排出,反而在一定程度上增加了乳清蛋白的损失,可以认为在凝乳酶存在条件下,TG酶不能产生很好的交联效果,因此也不能获得较好的乳清结合性能以及乳清蛋白的存留。

图 4 TG酶和凝乳酶处理的新鲜干酪蛋白、脂肪、水分及干物质中脂肪和蛋白含量

图 5 TG和凝乳酶处理对乳清中蛋白含量的影响
2.4 TG和凝乳酶处理对新鲜干酪质构的影响
TG酶作用的凝乳在硬度、胶黏性、咀嚼性和粘着性上显著低于对照组凝乳(图 6),这可能与其水分含量较高有关。有研究表明,凝乳硬度随水分含量升高而降低 (Everard et al,2006;Bhaskaracharya& Shah,1999),胶粘性 =硬度 ×内聚性,硬度降低直接导致胶粘性降低。凝乳酶单独处理获得的干酪在硬度、胶粘性和粘着性上与对照组无显著性差异,只是咀嚼性低于对照组,咀嚼性 =硬度 ×内聚性 ×弹性,咀嚼性随弹性而降低,而弹性的降低可能是由于其较低的水分含量。TG酶和凝乳酶同时作用时,凝乳硬度、胶黏性和咀嚼性均为四组中最低,这可能是由于 TG对蛋白质起到交联作用,而凝乳酶是将酪蛋白水解,两者共同作用下,蛋白质不能形成致密的网状结构,因此质构参数下降。图 7为各组凝乳的内聚性和弹性,有研究表明,蛋白和脂肪含量对内聚性影响较大,而水分含量对内聚性则没有显著影响(Bhaskaracharya&Shah,1999),蛋白和水分对弹性具有重要影响 (Bhaskaracharya&Shah,1999)。TG酶作用的凝乳内聚性和弹性在四组中最高,可能由于酪蛋白的交联作用使得蛋白的网络结构较紧凑致密,而其较高的水分含量也是弹性特征明显的原因。但 TG和凝乳酶同时作用与凝乳蛋白作用比较,内聚性和弹性没有显著性差异,均低于对照组,再次表明在凝乳酶存在条件下,TG酶对酪蛋白的交联作用不明显,在质构特征上不具有明显的修饰作用。
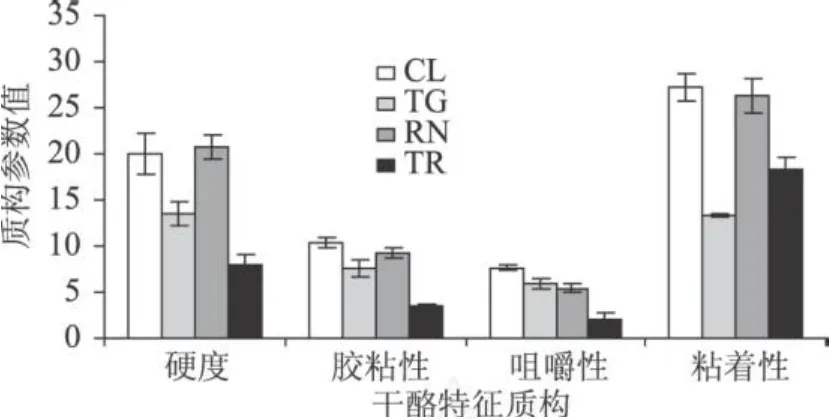
图 6 TG和凝乳酶处理的新鲜干酪硬度、胶粘性、咀嚼性和粘着性变化
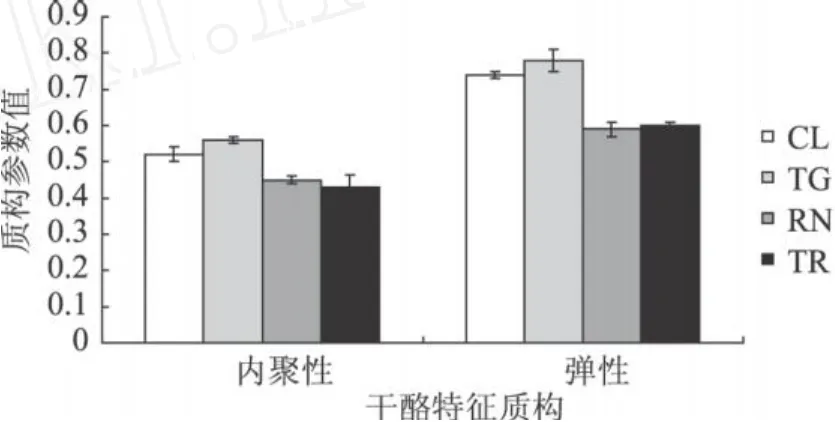
图 7 TG和凝乳酶处理的新鲜干酪内聚性和弹性变化
3 结论
转谷氨酰胺酶对酪蛋白的交联作用对于新鲜干酪的化学成分和质构有显著影响。TG在 37℃2h即对酪蛋白产生明显的交联作用,产生大分子聚合物,交联作用首先发生在位于酪蛋白表层的κ-酪蛋白。TG酶作用能够加速凝乳发酵过程,提高乳中蛋白质和脂肪的回收率,同时能够增加乳清结合能力,降低乳清中的蛋白含量,提高乳清蛋白的利用率。转谷氨酰胺酶处理的新鲜凝乳硬度、胶粘性和粘着性较低,但增加了凝乳的内聚性和弹性,这与其修饰后凝乳的化学成分变化有关。但在凝乳酶作用下,TG对酪蛋白的交联作用不明显,对凝乳成分和质构的修饰程度不显著。
[1]郭本恒 .干酪[M].北京:化学工业出版社,2003:35-37.
[2]王志清 .乳和乳制品国际检验法—干酪及加工干酪制品脂肪含量的测定 (标准法)[S].北京地区畜牧与饲料科技情报网,1983.
[3]Bhaskaracharya R K,N P Shah.Texture evaluation of commercialmozzarella cheese[J].Aust J Dairy Technol,1999, 54:36-40.
[4]Bönisch M P,Heidebach T C,Kulozik U.Influence of transglutaminase protein cross-linking on the rennet coagulation of casein[J].Food Hydrocolloids,2008,22:288-297.
[5]De Jong,GA H,KesslerH G.Application of reaction kinetics to the denaturation of whey proteins in heated milk[J]. Milchwissenschaft,1988,43:3-7.
[6]Everard C D,D J O’callaghan,T V Howard,et al. Relationships be tween sensory and rheological measurements of texture in maturing commercial Cheddar cheese over a range of moisture and pH at the point of manufacture[J].J Texture Stud, 2006,37:361-382.
[7]Færgemand M,Qvist K B.Transglutaminase:Effect on rheological properties,microstructure and permeability of set style acid skim milk gel[J].Food Hydrocolloids,1997,11:287-292.
[8]Jaros D,Partschefeld C,Henle T,et al.Transglutaminase in dairy products:Chemistry,physics,application[J].J Texture Stud, 2006,37:113-155.
[9]Kashiwagi T,Yokoyama K,Ishikawa K,et al.Crystal structure of microbial transglutaminase fromStreptoverticilliummobaraense [J].J Biological Chemistry,2002,277:44252-44260.
[10]Sharma R,Lorenzen P C,Qcist K B.Influence of transglutaminase treatment of skim milk on the formation ofε-(γ-glutamyl)lysine and the susceptibility of individual proteins towards crosslinking[J].IntDairy J,2001(11):785-793.
Effectoftransglutaminaseproteincross-linking onthecharateroffreshcheese
LUXiao-ming,WANGPei-gen,RENFa-zheng,CHENShang-wu*
(KeyLaboratoryofFunctionDairyMinistryofEducationandBeijingCity,CollegeofFoodScience andNutritionalEngineering,ChinaAgriculturalUniversity,Beijing100083,China)
Using transglutaminase(TG)tocross-link thecasein,theeffecton thecomposition and textural characterizeofresultedcheeseswasstudied.TheresultsindicatedthatTGpromotedthefermentationprocessand increasedtherecoveryofproteinandfat.TheproteininwheydecreasedsignificantlywithTGtreated.TheTGhad importanteffecton the texturalpropertiesofresulted cheese.Buttherewasminorinfluence ofTG on the compositionandtexturalpropertieswhenrennetpresented.
transglutaminase;rennet;cheese;texture
TS252.53
A
1002-0306(2010)01-0179-04
在干酪生产过程中,干酪凝胶的形成是至关重要的,而凝乳酶的利用则是干酪生产中的一个基本步骤。一般来讲,通过添加凝乳酶使酪蛋白胶束形成凝胶的机制主要有三个阶段:在第一阶段中,凝乳酶水解 80%~90%的κ-酪蛋白分子;酪蛋白胶束形成副酪蛋白胶束,分子间斥力降低,疏水作用加强,有利于絮凝的发生;副κ-酪蛋白胶束聚合在一起,形成三维网络结构,乳清析出。凝胶的表现形态、质构特性对干酪奶的感官和功能品质都有重要影响,凝乳的形成受许多因素的影响,如 pH、钙离子浓度、乳的热处理方式等 (Bönisch,2008)。同时分子间疏水基、离子键、共价键等对于蛋白质凝胶体系的形成发挥着重要的作用,改变共价键的数目和强度都会使蛋白质的凝胶性能发生转变,而转谷氨酰胺酶对酪蛋白的交联作用也能够引起凝乳的变化。转谷氨酰胺酶(TG)是一种酰基转移酶,能够将相同或不同蛋白质分子残基的谷氨酸和赖氨酸进行交联,形成分子间的或分子内的交联与聚合,形成新的共价键(Kashiwagietal,2002)。而在乳蛋白中酪蛋白具有TG酶作用的良好底物特征。κ-酪蛋白分子位于酪蛋白胶束的表面,其中有四个谷氨酸残基能够作为潜在的交联位点,从而使κ-酪蛋白能够被 TG酶交联(Sharmaetal,2001)。TG对食品蛋白的交联存在着广泛的作用,如酪蛋白、大豆分离蛋白、谷朊蛋白、乳清蛋白等都可以作为 TG作用的底物。TG酶可直接对蛋白质凝胶胶束表面蛋白进行交联,还可将胶束间蛋白进行交联。已经有研究表明,通过 TG酶交联酪蛋白能够达到对产物质构的高度修饰(DeJong, 2002;Jarosetal,2006)。TG交联乳蛋白的研究较多,但将 TG用于酶凝新鲜干酪的研究并不多见。本文研究 TG和凝乳酶用于新鲜干酪的作用比较,旨在研究 TG交联和凝乳酶的相互作用对新鲜干酪理化指标、凝乳特征、产率以及质构特性的影响。
2009-03-31 *通讯联系人
卢晓明(1982-),女,博士研究生,研究方向:乳蛋白结构与干酪加工技术。
科技部十一五支撑计划(2006BAD04A06)。

