冠状动脉旁路移植术中出血回收方式对血液保护的影响
常 昕,李 欣,刘 燕,陈小中,徐美英,郭 震,徐凌峰
冠状动脉旁路移植术(oronary artery bypass grafting surgery,CABG)是冠心病的重要治疗手段之一。在体外循环(cardiopulmonary bypass,CPB)下行 CABG术时,由于血液与异物表面接触、外科手术导致组织因子释放以及缺血-再灌注损伤等因素,难以避免不同程度的凝血紊乱和炎性反应激活。已有证据表明,术野的血液由于接触了组织创面而被高度激活[1],而将这部分血液洗涤后再回输可避免加重全身炎症反应。本研究的主要目的即观察将术野出血洗涤后回输的血液保护效果。
1 资料与方法
1.1 患者选择 选取 2009年4月至 2010年4月上海市胸科医院在 CPB下行 CABG的患者。患者入选条件为:年龄 <80岁,体重 >50 kg,首次接受心脏手术,临床证据未发现脑、肝、肺、肾器质性疾病,无心脏瓣膜病变,左室射血分数 >30%,均为冠脉三支病变,移植血管桥均为左乳内动脉和大隐静脉,数量 3~4支。按照住院号尾数单双号随机将患者分成对照组和研究组,共收集 31例。
1.2 临床经过 患者接受常规麻醉诱导,肝素化前抽取桡动脉血标本,各检测指标作为术前基础值。肝素化剂量为 3 mg/kg,激活凝血时间(ACT)值大于 300 s后进行 CPB插管,均为右房-主动脉插管,ACT值 480 s后开始 CPB。转流中维持 ACT值在480 s以上,维持鼻咽温度和膀胱温度在 32~34℃。心肌保护方法为采用 20℃4:1含血停搏液间断灌注,每次间隔 20 min,灌注方法为顺灌与逆灌相结合。通过主动脉根部吸引完成左心减压。转流中维持红细胞比容(Hct)在 0.24以上,否则输入悬浮红细胞。主动脉阻断钳开放后进行桥血管近端吻合。完成桥血管移植后,如血流动力学平稳、内环境稳定则逐渐脱离 CPB,用鱼精蛋白中和肝素。
所有患者均使用血细胞回收机(cell-saver,Cellsaver 5,Haemonetics Braintree,MA,USA)。对于对照组,ACT>400 s时,将所有术野出血吸引回 CPB系统,直到鱼精蛋白中和;ACT达到 400 s前和给予鱼精蛋白后的术野出血吸引至 cell-saver,洗涤后回输。对于研究组,将所有术野出血回收到cell-saver进行洗涤;根据需要输入洗涤后的红细胞悬液;待 CPB结束后将残余机血导入 cell-saver洗涤后再回输给患者;如术中血液回收超过 1 000 Ml,或者患者容量丢失已经造成血流动力学的不稳定可能,则将术野出血直接回收入 CPB系统,保证患者安全,并将该病例从研究组中脱离,此种情况共发生 2例。患者手术结束进入 ICU后,继续观察各项临床指标及实验室检查指标至术后 24 h。
1.3 数据采集 分别于 CPB前、CPB结束鱼精蛋白中和后及术后 18 h抽取血标本,测定血浆游离血红蛋白(FHb)、红细胞数(RBC)、血小板数(Plt)和肿瘤坏死因子 α(TNF-α)(ELISA法)。于 CPB前及鱼精蛋白中和后用 Sonoclot全血凝血和血小板功能分析仪(Sienco. Inc,USA)测定 ACT,凝血速率(clotting rate,CR)和血小板功能(platelet function,PF)。分别于 CPB前及术后 12 h、术后 24 h进行血气分析,由血气分析仪计算氧合指数(oxygen index,OI)和肺泡-动脉氧分压差(alveolar-arterial oxygen tension gradient,A-a DO2)。记录术后 24 h出血量及悬浮红细胞输入量。记录 ICU停留时间并查询 ICU期间医疗费用。将 CPB前各指标的测定数据作为基础值。
1.4 统计学处理 采用 SAS 9.13统计软件。正态分布数据以均数 ±标准差(±s)表示,组间比较采用独立样本 t检验。非正态分布数据以“中位数(最小值-最大值)”表示,组间比较采用 Wilcoxon秩和检验。P<0.05为有显著性差异。
2 结 果
两组患者的年龄、体重及各项测定指标的基础值均无显著性差异(P>0.05),见表1,表2和表3。鱼精蛋白中和后的 FHb在研究组 0(0~0.5)g/L明显低于对照组 0.5(0~1)g/L(P<0.05),术后 18 h FHb研究组 0(0~0)g/L和对照组 0(0~1.2)g/L无组间差异(P>0.05)。TNF-α在CPB前、鱼精蛋白中和后及术后 18 h分别记为TNF1,TNF2及 TNF3,取比值 TNF2/TNF1及TNF3/TNF1作组间比较,TNF3/TNF1在研究组明显低于对照组(P<0.05),见表2。术野出血的洗涤未影响凝血功能指标(ACT,CR,PF)和术后出血量和悬浮红细胞输入量;术后 RBC和 Plt、两组患者术后肺换气功能指标(OI及 A-a DO2)、ICU停留时间及费用无明显差异(P>0.05)见表3,表4和表5。研究组有一例因骨膜出血而二次手术止血,其余患者未有二次手术。
3 讨 论
冠心病的研究一直是世界医学研究的热点。随着我国人民生活水平的提高,饮食习惯的改变和社会心理因素的影响,冠心病发病率逐渐升高。CABG是治疗冠心病的重要方法之一。该手术目前主要有两种方式:在心脏不停跳的情况下进行--即非体外循环冠状动脉旁路移植术(off-pump coronary artery bypass grafting,OPCAB),或在 CPB下进行。与CPB下 CABG相比,OPCAB避免了血液与大面积异物表面接触、避免了心肌血运阻断以及非生理的平流灌注等,理论上可降低全身炎症反应及重要器官系统的并发症,早期的试验研究非常支持 OPCAB[2]。随着临床数据的积累,近年来更多的大规模随机对照研究发现,与 CPB下 CABG相比,OPCAB因心脏不停跳使桥血管的吻合难度增加,术后的桥血管远期通畅率较低[3],对神经系统的保护作用不明显[4],同时手术操作可能造成血流动力学的较大波动,从而影响组织灌注。因此在 CPB下行CABG正在得到越来越多的认可。
表1 两组患者年龄、体重及部分指标基础值(±s)

表1 两组患者年龄、体重及部分指标基础值(±s)
组别 年龄 体重 RBC Plt ACT CR PF FHb(岁) (kg) (×1012/L) (×109/L) (s) (singal/min) (g/L)对照组 60.0±9.3 67.0±8.7 4.2(3.8~5.6) 187.5±40.4 257(103~499) 14.4±14.5 1.2±1.0 0(0~0.3)研究组 61.9±8.4 62.8±6.7 4.5(3.1~5.8) 200.6±38.3 172(131~732) 13.4±9.7 0.7±0.6 0(0~0.2)
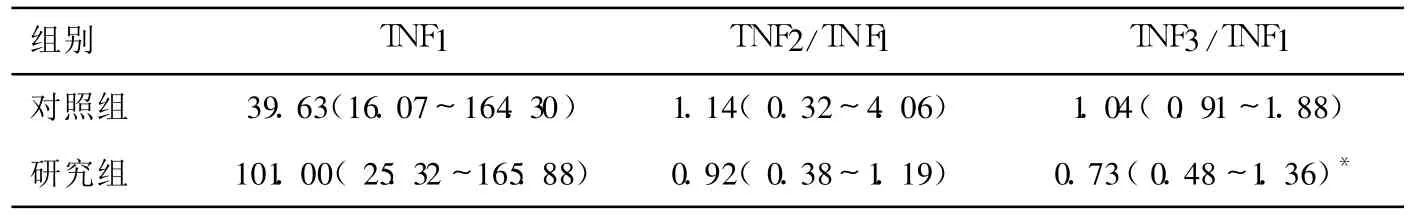
表2 两组患者各时间点的 TNF-α(×10-15 g/L)变化情况
表3 两组患者各时间点的OI和A-a DO2(mm Hg,±s)
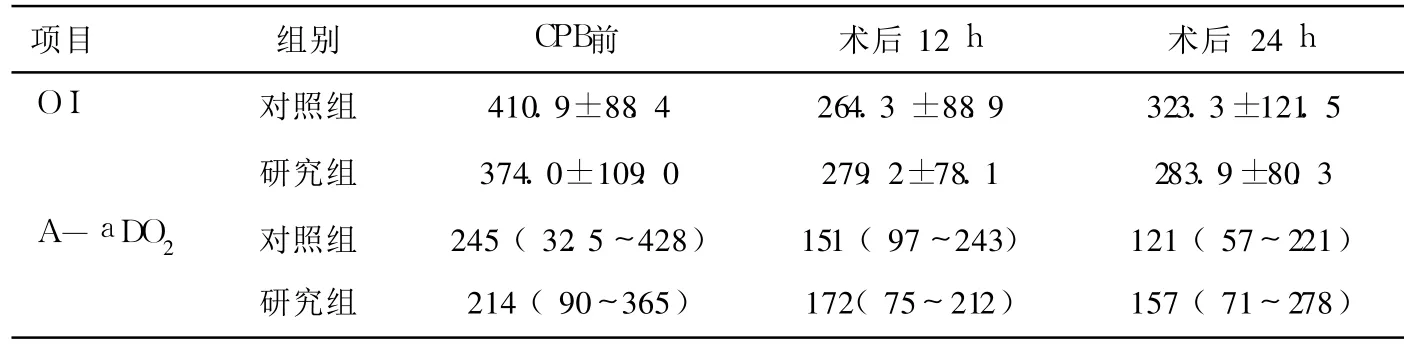
表3 两组患者各时间点的OI和A-a DO2(mm Hg,±s)
OI 对照组 410.9±88.4 264.3±88.9 323.3±121.5研究组 374.0±109.0 279.2±78.1 283.9±80.3 A-a DO2 对照组 245(32.5~428) 151(97~243) 121(57~221)研究组 214(90~365) 172(75~212) 157(71~278)
表4 术后18 h的RBC,Plt及鱼精蛋白中和后的凝血功能指标(±s)
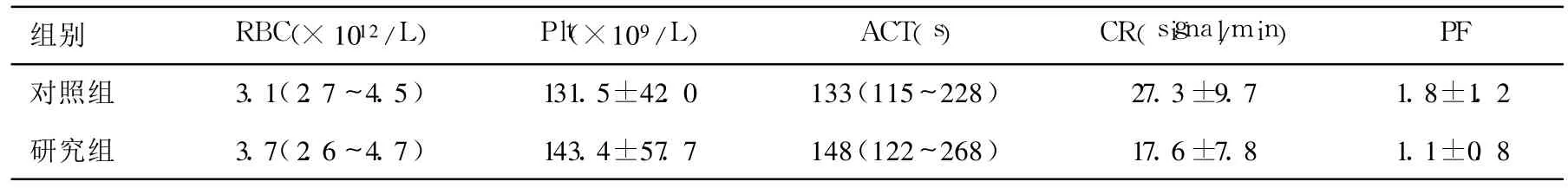
表4 术后18 h的RBC,Plt及鱼精蛋白中和后的凝血功能指标(±s)
对照组 3.1(2.7~4.5) 131.5±42.0 133(115~228) 27.3±9.7 1.8±1.2研究组 3.7(2.6~4.7) 143.4±57.7 148(122~268) 17.6±7.8 1.1±0.8
表5 术后出血、输血情况及 ICU停留时间、费用(±s)

表5 术后出血、输血情况及 ICU停留时间、费用(±s)
研究组 895(325~4830) 1(0~5) 67(41~235) 20349.7±3279.5对照组 895(275~2232) 1.5(0~6) 66(42~92) 24183.9±7494.9
CPB技术经过近 60年的发展,已经取得很大的进步,但在一些关键问题上仍有改进的空间,如血液保护及全身炎症反应的控制。据中国生物医学工程学会体外循环分会统计,2009年我国心脏手术量约17万台。2007年我国心脏手术量约 13.6万台,2003年~2005年间手术量每年增长约 15%[5]。对心脏手术围术期的管理如果不能做到精益求精,并发症将同样是一个不小的数目。CPB期间因血液与大面积非血管内皮表面接触激活、脏器的缺血再灌注损伤、外科手术导致的组织因子释放及血细胞的机械性破坏等导致了凝血和炎症反应激活,从而导致或加重器官损伤[6]。目前国际上相关基础与临床科研重点即针对以上因素,如:人工材料表面涂层技术,微创外科技术,通过药物、机械性手段和免疫技术抑制全身炎症反应等。其中,针对手术创面的组织因子释放这一环节,有研究认为通过收集与创面接触的血液、将其洗涤后再回输可减轻血液的激活[7]。
在常规 CPB心脏手术中,术野出血通过“心外吸引(cardiotomy suction)”由一个血泵吸引至静脉回流罐。实际上,心包腔及胸腔内的血液与血管内血液并不相同。这些术野内的血液可能含有组织碎片、微气泡以及脂肪颗粒等。除此之外,外科操作造成的组织创伤导致组织因子释放,组织因子激活导致外源性凝血途径迅速激活,释放凝血酶和纤维蛋白[8]。与中心静脉采取的血样比较,心包腔内血液的组织因子抗原和其他凝血指标明显增高[1]。凝血的激活也促进了炎症反应的进行,心包腔内血液含高浓度的炎性标志物如白介素 6、白介素 8和 TNF-α[8]。与常规使用“心外吸引”相比,将心包腔内的血液洗涤,可使术后的 FHb、C反应蛋白、多形核白细胞弹性蛋白酶及白介素 6显著降低[9]。此外,血液与组织创面的接触也导致的血小板的激活--发生黏附与脱颗粒,释放血管活性物质。这些术野血液进入循环后,除可引起补体 C3a,TNF-α,白介素 6的显著升高[10],还导致外周血管阻力的降低,且降低程度与血液中的炎性因子浓度成正相关,而使用 cell-saver处理血液可改善这种情况[11]。在本研究中,研究组的 TNF2/TNF1及 TNF3/TNF1均较低,其中 TNF3/TNF1与对照组有显著差异。在 CPB后炎性反应的高峰时段内 TNF-α较低,证实了洗涤术野出血对减轻机体炎症反应有一定的效果。本研究所监测的指标中,CR反映纤维蛋白形成的速率,间接反映纤维蛋白原的水平,正常为15~45 clot signal/min;PF反映血小板功能,由分析仪的电脑软件依据血液的纤维蛋白多聚体形成后凝血收缩的强度及速度计算出的相对值,其正常值 1.5~4.0;OI及 A-aDO2主要反应肺获取氧的能力。两组患者在 CPB停止后的 ACT,CR,PF以及术后 18 h的 Plt、OI没有显著组间差异,即凝血功能、血小板数量和功能以及肺功能未受到明显影响。
术野内血液除受组织创面的影响,也受到“心外吸引”的影响。“心外吸引”的管道与 CPB主循环管道不尽相同,其吸引血液的同时也在吸引空气,管道内的血液为湍流状态,受到很高的剪切应力,这部分血液的细胞最容易受到破坏,机械性溶血较明显。高浓度的 FHb可导致血小板功能障碍和肾小管损伤[8]。在本研究中,研究组在 CPB结束后的 FHb明显低于对照组,证明“心外吸引”是 CPB中游离血红蛋白的重要来源,而 cell-saver可将其有效去除。
将术野内的血液洗涤可有效去除组织碎片、脂肪颗粒、激活的白细胞[12]、炎性因子及破坏的血细胞及等,是一种较简便的方法。但 cell-saver也存在一定局限性,其吸引的过程仍存在负压、气血界面和血液湍流,在血液被离心洗涤前已有一定的破坏,离心洗涤后仅保留了红细胞成分,血浆等其他成分被抛弃。若洗涤的血液过多,则会相应的丢失较多的血浆成分,这也是该方法在心内直视手术中应用受限的原因。本研究进行中,有两例手术因操作中发生快速大量出血而放弃使用 cell-saver;当洗涤的血液较多(如 800~1000m l)且患者自身血容量较小时,反而会补充较多的异体血浆。在缺乏精确的监测(如血小板计数、纤维蛋白原水平或血栓弹力图)时,输血浆的指征仅凭医生经验判断,因此本研究未统计血浆用量。
两组患者的凝血功能、肺功能及 ICU时间、费用等未表现明显差异,说明在本研究中 cell-saver的使用对血液保护和炎症反应的影响仍然有限。本研究的局限性在于:样本量较小;不是双盲设计;对一些因素控制仍存在很大困难:如手术医生、麻醉医生及输注血浆的指征等。曾有一项包含了 266例患者的随机双盲对照研究对比了使用和不使用 cellsaver处理术野出血的术后输血情况及神经系统并发症,发现使用 cell-saver组的术后出血量和输血量较多,两组患者的术后认知功能及生活质量无差异,使用经颅多普勒探测到的栓子数无差异[13]。这些说明 CPB损伤因素的作用机理是复杂和相互交织的,单纯针对一点的保护措施也许难以充分发挥作用,综合使用多种改善 CPB生物相容性的手段可能使血液保护及其他器官保护的效果更确切。
本研究为开展进一步试验打下了基础,可增加样本量、选择固定的手术医生和麻醉医生、控制每种血液制品的输入指征等,或加用进一步的血液保护措施,如微型 CPB,探索多种保护措施的联合应用是否能使血液保护的效果更加确切。
[1]Philippou H,Adami A,Davidson SJ,et a l.Tissue factor is rapidly elevated in plasma collected from the pericardial cavity during cardiopulmonary bypass[J].Thromb Haemost,2000,84(1):124-128.
[2]Raja SG,Berg GA.Impact of off-pump coronary artery bypass surgery on systemic inflammation:currentbest availableevidence[J].JCard Surg,2007,22(5):445-455.
[3]Parolari A,Alamanni F,Polvani G.Meta-analysis of randomized trials comparing off-pump with on-pump coronary artery bypass graft patency[J].Ann Thorac Surg,2005,80(6):2121-2125.
[4]Van Dijk D,Spoor M,Hijman R,et al.Cognitive and cardiac outcomes 5 years after off-pump vs on-pump coronary artery bypass graft surgery[J].JAMA,2007,297(7):701-708.
[5]赵明霞,龙村,杨舒娅.中国体外循环状况调查分析报告[J].中国胸心血管外科临床杂志,2008,15(6):454-457.
[6]Wan S,LeClerc JL,Vincent JL.Inflammatory response to cardiopulmonary bypass:mechanisms involved and possible therapeutic strategies[J].Chest,1997,112(3):676-692.
[7]Aldea GS,Soltow LO,Chandler WL,et al.Lim itation of thrombin generation,platelet activation,and inflammation by elimination of cardiotomy suction in patients undergoing coronary artery bypass grafting treated with heparin-bonded circuits[J].JThorac Cardiovasc Surg,2002,123(4):742-755.
[8]Lau K,Shah H,Kelleher A,et al.Coronary artery surgery:cardiotomy suction or cell salvage[J]?J Cardiothorac Surg,2007,2:46.
[9]Skrabal CA,Khosravi A,Choi YH,et al.Pericardial suction blood separation attenuates inflammatory response and hemolysis after cardiopulmonary bypass[J].Scand Cardiovasc J,2006,40(4):219-223.
[10]Westerberg M,Bengtsson A,Jeppsson A.Coronary surgery without cardiotomy suction and autotransfusion reduces the postoperative system ic inflammatory response[J].Ann Thorac Surg,2004,78(1):54-59.
[11]Westerberg M,Gabel J,Bengtsson A,et al.Hemodynam ic effects of cardiotomy suction blood[J].J Thorac Cardiovasc Surg,2006,131(6):1352-1357.
[12]Dai B,Wang L,Djaiani G,etal.Continuousand discontinuous cell-washing autotransfusion systems[J].JCardiothorac Vasc Anesth,2004,18(2):210-217.
[13]Rubens FD,Boodhwani M,Mesana T,et al.The cardiotomy trial:a random ized,double-blind study to assess the effect of processing of shed blood during cardiopulmonary bypass on transfusion and neurocognitive function[J].Circulation,2007,116(11 Suppl):I89-I97.

