葡萄糖酸内酯对猪肉肌原纤维蛋白功能性的影响
王 宇,孔保华*,李明清,夏秀芳,刘 骞
(东北农业大学食品科学学院,黑龙江 哈尔滨 150030)
葡萄糖酸内酯对猪肉肌原纤维蛋白功能性的影响
王 宇,孔保华*,李明清,夏秀芳,刘 骞
(东北农业大学食品科学学院,黑龙江 哈尔滨 150030)
在猪肉肌原纤维蛋白中添加不同质量分数(0.5%、1.0%、1.5%、2.0%)的葡萄糖酸内酯(GDL),研究其对肌原纤维蛋白乳化能力和凝胶性的影响。结果显示,添加GDL能显著提高肌原纤维蛋白的乳化性和乳化稳定性(P<0.05),但是不同添加量之间差异不显著;凝胶白度随GDL添加量的增加呈下降趋势;0.5%以下添加量对凝胶保水性没有显著影响,0.5%以上的添加量会大幅提高保水性;除凝胶黏附性随GDL质量分数增加而下降外,凝胶硬度、胶黏性和回弹性都在GDL添加量0~1.0%之间有不同程度的下降,然后随着GDL质量分数增大而升高。综合来看,1.5%的GDL添加量对猪肉肌原纤维蛋白的功能性有较好的改善作用。
肌原纤维蛋白;葡萄糖酸内酯;凝胶
猪肉中肌原纤维蛋白(myofibrillar proteins,MP)占总蛋白质的50%~55%,对猪肉加工品质起决定性影响[1-2]。在加热的过程中肌原纤维蛋白通过下面两步典型的变化形成凝胶。第一步发生在30~50℃的温度范围内,第二步在50℃以上发生。第一步包括肌球蛋白头部的聚集,研究人员通过电子显微镜观察发现,提纯后的肌球蛋白经不同温度处理,在30℃加热30min时加热对肌球蛋白没有影响;在35℃加热30min时,大部分肌球蛋白仍保持完整的结构,即具有自己单独的头部,少数形成了新的结构,如两个肌球蛋白分子会通过头部结合形成二聚体;在40℃加热30min后,肌球蛋白分子单体已经很少存在,仅存的单体的头部也已经发生聚合;50℃加热会进一步加剧肌球蛋白凝集,此时已经很难分辨出肌球蛋白的尾部;当加热到60℃时,肌球蛋白形成较大的球状凝集,尾部全部消失。第二步主要是肌球蛋白螺旋结构的改变,疏水基团相互作用,形成网状结构[3]。单独的肌动蛋白不能形成凝胶,但是和肌球蛋白一起加热时,会更好的促进肌球蛋白形成凝胶,使凝胶质地紧密,硬度较大,气孔较少[4]。
葡萄糖酸内酯(glucono-δ-lactone,GDL),又名葡萄糖醛酸内酯或葡醛内酯,是一种用途十分广泛的食品添加剂。一般用作豆腐凝固剂[5],还有作为奶类胶凝剂或者作为酸化剂使用。研究表明,在产品中添加2%乳酸和0.125% GDL即可有效抑制李斯特菌的生长[6]。Hong等[7]研究了GDL在重组肉中的作用效果,发现GDL对肉色起重要作用,并能增强重组肉的结合力。GDL在人体内可分解产生葡醛酸,葡醛酸能与体内含有羧基的有害物质结合形成无毒或低毒的葡醛酸结合物由泌尿系统排出。同时可降低肝淀粉酶的活性,降低肝糖原含量,起保护肝脏及解毒作用[8]。但目前国内外关于GDL和肌肉蛋白(主要是肌原纤维蛋白)相互作用的研究还比较少。
本研究拟采取不同的加热温度和不同的GDL添加量处理猪肉肌原纤维蛋白,测定处理后肌原纤维蛋白的乳化能力和凝胶性,探讨加热条件下GDL与肌原纤维蛋白的相互作用,为GDL应用于肉制品提供参考。
1 材料与方法
1.1 材料与试剂
宰后经过解僵成熟24h猪背最长肌 北大荒肉业;葡萄糖酸内酯(GDL) 北京索莱宝科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
TA-XT plus 型质构分析仪 英国Stable Micro System公司;TU-1800紫外-可见光分光光度计 北京普析通用仪器公司;冷冻离心机 上海分析仪器公司;DK-98-1型电热恒温水浴锅 天津泰斯特仪器有限公司;色差计 上海申光仪器厂;IKA-T18型匀浆机 德国IKA公司。
1.3 方法
1.3.1 肌原纤维蛋白提取
肌原纤维蛋白提取方法参考Liu等[9]方法并略作修改,取猪背最长肌,剔除脂肪和结缔组织,切成1cm3小块,加入4倍体积缓冲液(10mmol/L Na3PO4、 0.1mol/L NaCl、2mmol/L MgCl2和 1mmol/L EGTA,pH7.0),匀浆60s,2000×g冷冻离心15min,取沉淀重复上面步骤两次,得到粗提的肌原纤维蛋白。然后取此沉淀加入4倍体积的0.1mol/L NaCl溶液,匀浆60s ,2000×g冷冻离心15min,重复此操作一遍,取沉淀加4倍体积的0.1mol/L NaCl溶液,匀浆60s,4层纱布过滤,用0.1mol/L HCl调节pH6.0,2000×g冷冻离心15min,沉淀即为提纯的肌原纤维蛋白,4℃冷藏备用。以上操作均在4℃条件下进行。用双缩脲法以标准牛血清白蛋白为标准蛋白测定肌原纤维蛋白含量。
1.3.2 乳化性和乳化稳定性
乳化性和乳化稳定性参考Pearce等[10]的浊度法并略作改动,量取2mL的玉米油和8mL的蛋白样品溶液(用不同质量分数的GDL溶液稀释蛋白质量浓度到2mg/mL),置于直径2.5cm离心管中,速度设置为4,约15000r/min),立即倒入30cm×50cm玻璃称量瓶中,从距离瓶底0.5cm处取50μL新鲜的乳化液分散到5mL 0.1% SDS溶液中,在波长500nm处以0.1% SDS为空白测量其吸光度。静置10min,以上述方法测量乳化液在静置10min后的吸光度。乳化性和乳化稳定性计算公式如下:
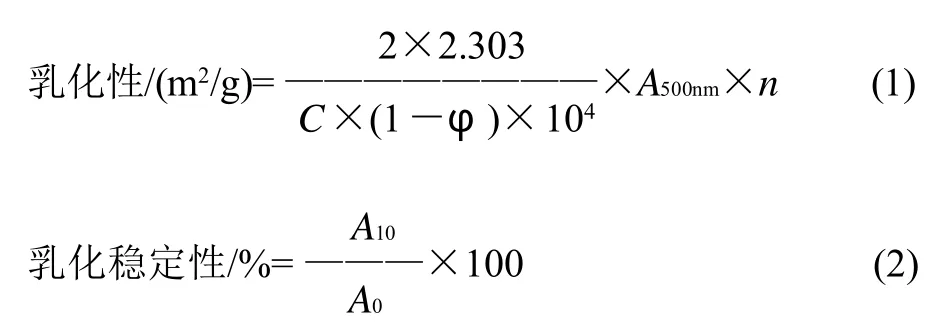
式中:A500nm为波长500nm处的吸光度;φ为油相体积分数(φ=20%);C为蛋白质质量浓度(2mg/mL);A0、A10为乳状液在0min和10min的吸光度;n为稀释倍数(即 5mL/50μL=100)。
1.3.3 制备凝胶
用不同质量分数的GDL溶液(0.5%、1.0%、1.5%和2.0%)稀释肌原纤维蛋白质量浓度至40mg/mL,室温下保持2h取15mL加入到30cm×50cm玻璃称量瓶中,盖上盖子,从25℃开始水浴加热到70℃(升温速度为1℃/min),并在70℃条件下保温20min,立即取出放入冰浴中30min,4℃保存过夜。
1.3.4 凝胶保水性测定
凝胶保水性参考Kocher等[11]的方法修改后进行测定。测量前在室温(22±2)℃条件下放置30min。取5g不同的凝胶样品加入离心管(直径30mm)中,3000×g离心15min,去除离心出的水分,称量凝胶质量。计算公式如下:
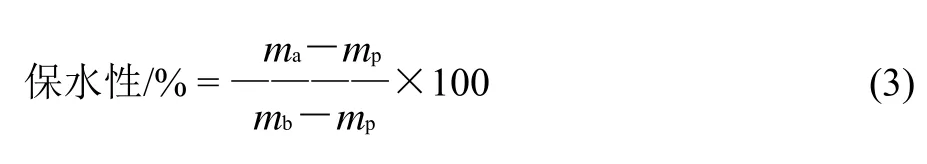
式中:ma为离心后凝胶质量;mp为离心管质量;mb为离心前凝胶质量。
1.3.5 凝胶质构的测定
采用质构分析仪进行质构分析。测定前将肌原纤维蛋白凝胶在室温(22±2)℃条件下放置30min,然后将待测样品连同称量瓶置于平台上固定好,以测定凝胶的硬度和黏附性等。参数如下:探头型号选择P/0.5,测试前速度2mm,测试速度1mm,测试后速度2mm,下压距离为凝胶高度的40%,触发力为5g[12]。测定指标包括硬度:指第一次穿冲样品时的压力峰值;黏附性:第一次咀嚼动作中负峰的面积,也就是克服样品与探头之间黏性作用所施用的功作为黏附性的量值;胶黏性:计算公式为第二次穿冲的用功面积除以第一次的用功面积的商值;回弹性:在第一次穿刺中的“收回”阶段的面积同下压穿刺阶段面积的商。
1.3.6 凝胶白度测定
凝胶的白度值用色差计测定,计算公式参考Zhu等[13]方法计算,其中L、a和b值分别为亮度指数、色调和彩度指数,L=0为黑色,L=100为白色,正a值越大,颜色越接近红色,负a值越小越接近绿色;+b值越大,颜色越接近黄色,-b值越小颜色越接近蓝色[14]。凝胶白度计算公式如下:
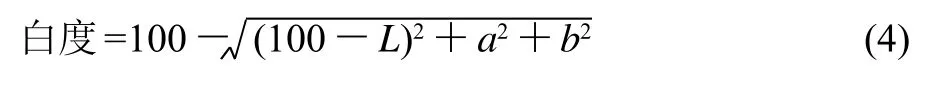
1.3.7 统计分析
全部实验重复3次,每次取3个平行,每次重新提取肌原纤维蛋白,数据采用Statistix 8.0 (Analytical Software Inc., USA)线性模型处理数据并进行方差分析(ANOVA)。用Duncan比较法进行差异性检验,ANOVA显著(P<0.05)。
2 结果与分析
2.1 不同GDL质量分数对肌原纤维蛋白乳化性和乳化稳定性的影响
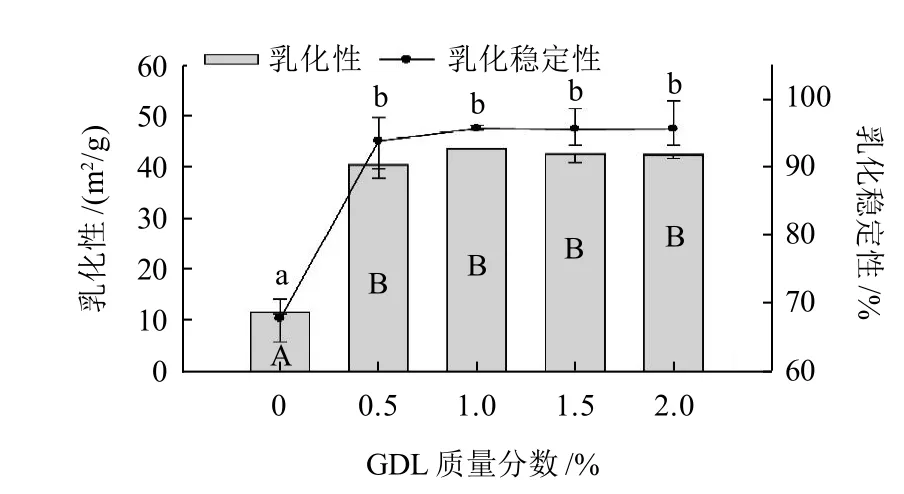
图 1 不同质量分数GDL对肌原纤维蛋白乳化性和乳化稳定性的影响Fig.1 Effect of GDL on EAI and ESI of myofibrillar protein
由图1可以看出,添加GDL的样品明显比空白样品有高的乳化性和乳化稳定性(P<0.05)。但是添加量的不同没有显著影响。这可能是因为GDL增加了肌原纤维蛋白和油脂之间的交联作用,将肽分子固定在油-水界面上,导致表面张力降低,增加了乳化能力[15]。
2.2 不同GDL质量分数对肌原纤维蛋白凝胶白度和保水性的影响
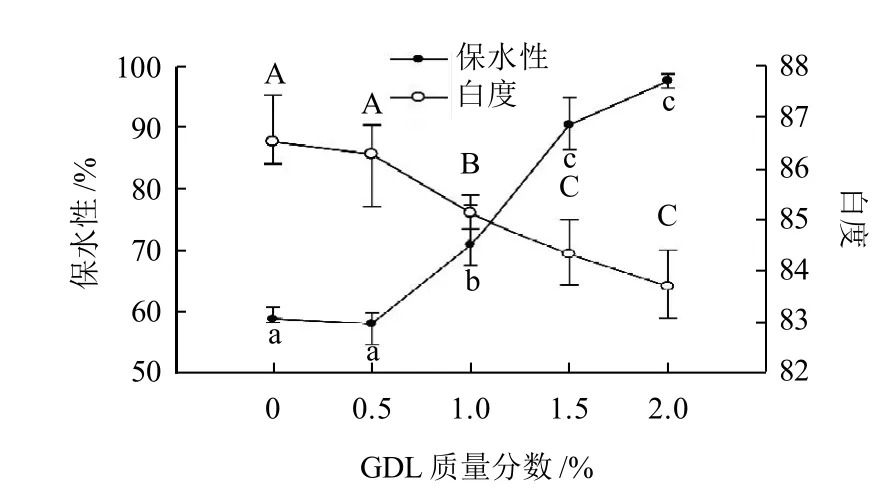
图 2 不同质量分数GDL对肌原纤维蛋白凝胶白度和保水性的影响Fig.2 Effect of GDL on whiteness and WHC of myofibrillar protein gelation
由图2可知,肌原纤维蛋白凝胶白度随GDL质量分数增加而逐渐降低,但只在GDL质量分数超过1.0%后有显著影响(P<0.05);保水性随GDL质量分数增加而增加,同样是从1.0%质量分数开始有显著差异。凝胶白度的降低可能是由于蛋白在酸性条件下,空间结构改变,发生变性,造成凝胶白度值下降。Hwang等[16]的实验表明鱼糜凝胶的白度变化与蛋白变性程度关联,Hong等[7]的研究表明,添加0.25%、0.5%和0.75% 的GDL会导致重组猪肉pH值快速下降,保水性降低,但黏结强度随GDL质量分数增加而增大。凝胶白度下降的原因可能和保水性的增加有关系,因为水分含量会对凝胶颜色造成一部分影响。Faustman等[17]也报道了高的水分含量会导致肉色变深。水在肌肉中的存留,主要依靠水和蛋白质之间电荷的相互作用、氢键作用和毛细管作用,由于GDL对pH值的降低作用,导致肌原纤维蛋白偏离等电点(肌原纤维蛋白的pI约为5.5),表面所带电荷数增加,从而增加了蛋白质分子间的静电斥力,使网状结构松弛,可容纳更多的水分,增强了保水性。
2.3 不同GDL质量分数对肌原纤维蛋白质构特性的影响
本实验测定了肌原纤维蛋白凝胶的硬度、黏附性、胶黏性和回弹性。肉眼观察不同GDL添加量的凝胶发现,随GDL质量分数增大,凝胶由低质量分数时的纯白色变为有些透明,组织状态由低质量分数时的松软细腻变为较硬的有颗粒状的凝胶。如图3所示,凝胶硬度、胶黏性和回弹性在GDL质量分数为0%到1.0%的范围内呈现降低趋势,在1.0%到2.0%的GDL质量分数范围内为上升趋势。0%、0.5%和1.0% GDL添加量对硬度和胶黏性无显著影响(P>0.05),但1.5%和2.0% GDL添加量影响显著(P<0.05)。黏附性则随着GDL质量分数增加而一直降低,但仅1.5%和2.0% GDL添加量才有显著影响(P<0.05)。这可能是质量分数越高,pH值降低越多,导致蛋白在加热后变性加剧,蛋白内部各种化学键的断裂导致黏附性的降低。这与Ioanna等[18]用GDL处理牛奶和山羊奶得出的结果一致,Davilae等[19]研究了不同pH4.5、6.0和7.5时对猪血浆蛋白热诱导凝胶的影响,发现随着pH值的降低,蛋白的热稳定性和凝胶点都在降低。
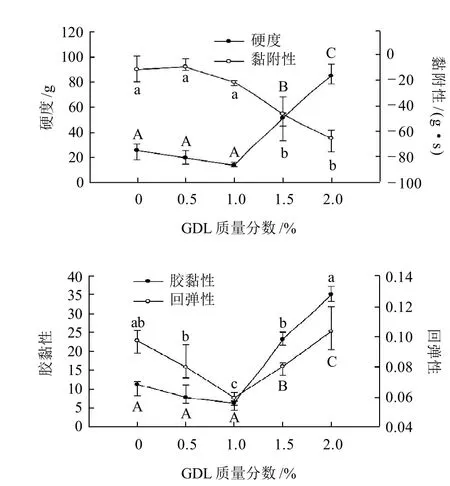
图 3 不同质量分数GDL对肌原纤维蛋白凝胶硬度、黏附性、胶黏性和回弹性的影响Fig.3 Effect of GDL on hardness, adhesiveness, gumminess and resilience of myofibrillar protein gelation
3 结 论
通过在猪肉肌原纤维蛋白中添加不同质量分数的GDL,由实验结果可知,0.5%~2.0%质量分数的GDL可以显著提高肌原纤维蛋白的乳化性和乳化稳定性并降低其凝胶的白度值;0.5%质量分数以上的GDL提高了肌原纤维蛋白的保水性;1.0%添加量以下对肌原纤维形成的凝胶物理结构没有改善作用,1.0%以上可以增加凝胶的硬度、胶黏性和回弹性,实验中的各个质量分数都降低了凝胶的黏附性。本实验只是在单一温度(70℃)下进行,其他加热温度条件还有待于进一步研究。
[1] 孔保华, 马俪珍. 肉品科学与技术[M]. 北京: 中国轻工业出版社, 2003:60-67.
[2] TORNBERG E. Effects of heat on meat proteins - implications on structure and quality of meat products[J]. Meat Science, 2005, 70(3):493-508.
[3] SHARP A, OFFER G. The mechanism of formation of gels from myosin molecules[J]. Journal of the Science of Food and Agriculture, 1992, 58(1): 63-73.
[4] YASUI T, ISHIOROSHI M, SAMEJIMA K. Heat-induced gelation of myosin in the presence of actin[J]. Journal of Food Biochemistry, 1980,4(2): 61-78.
[5] 岳振峰, 吴晖. D-葡萄糖酸-δ-内酯在食品工业中的应用[J]. 食品科技, 1998(6): 32-33.
[6] QVIST S, SEHESTED K, ZEUTHEN P. Growth suppression of Listeria monocytogenes in a meat product[J]. International Journal of Food Microbiology, 1994, 24(1/2): 283-293.
[7] HONG G P, KO S H, CHOI M J, et al. Effect of glucono-δ-lactone and κ-carrageenan combined with high pressure treatment on the physicochemical properties of restructured pork[J]. Meat Science, 2008, 79(2):236-243.
[8] 王德法. D-葡萄糖醛酸-δ-内酯的开发和应用[J]. 安徽化工, 2001(4): 21-22.
[9] LIU G, XIONG Y L. Contribution of lipid and protein oxidation to rheological differences between chicken white and red muscle myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry, 1996, 44(3):779-784.
[10] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins:Evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723.
[11] KOCHER P N, FOEGEDING E A. Microcentrifuge-based method for measuring water-holding of protein gels[J]. Journal of Food Science,1993, 58(5): 1040-1046.
[12] CHIN K B, GO M Y, XIONG Y L. Konjac flour improved textural and water retention properties of transglutaminase-mediated, heat-induced porcine myofibrillar protein gel: Effect of salt level and transglutaminase incubation[J]. Meat Science, 2009, 81(3): 565-572.
[13] ZHU Kerui, KANU P J, CLAVER I P, et al. A method for evaluating hunter whiteness of mixed powders[J]. Advanced Powder Technology,2009, 20(2): 123-126.
[14] 邵懿, 冷冻竹荚鱼(trachurus trachurus)凝胶特性的研究[D]. 青岛: 中国海洋大学, 2008.
[15] CAESSENS P W J R, GRUPPEN H, SLANGEN C J, et al. Functionality of β-casein peptides: Importance of amphipathicity for emulsionstabilizing properties[J]. Journal of Agricultural and Food Chemistry,1999, 47(5): 1856-1862.
[16] HWANG J S, LAI K M, HSU K C. Changes in textural and rheological properties of gels from tilapia muscle proteins induced by high pressure and setting[J]. Food Chemistry, 2007, 104(2): 746-753.
[17] FAUSTMAN C, CASSENS R G. The biological basis for discoloration in fresh meat: a review[J]. Journal of Muscle Foods, 1990(1): 217-243.[18] IOANNA V E B. Preliminary studies on the gelation processes of fermented and gdl-acidified bovine and caprine milk systems[J]. International Journal of Dairy Technology, 1995, 48(4): 112-116.
[19] DVILA E, PARS D, CUVELIER G, et al. Heat-induced gelation of porcine blood plasma proteins as affected by pH[J]. Meat Science, 2007,76(2): 216-225.
Effect of Glucono-δ-lactone on Functional Properties of Porcine Myofibrillar Protein
WANG Yu,KONG Bao-hua*,LI Ming-qing,XIA Xiu-fang,LIU Qian
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
The emulsion and gelation capabilities of myofibrillar protein (MP) during the addition of glucono-δ-lactone (GDL)at various concentrations (0.5%, 1.0%, 1.5% and 2.0%) were investigated. Results showed that the emulsion and gel capabilities were greatly improved by GDL (P<0.05) and no significant difference among different doses was observed. The whiteness of gel exhibited a decrease due to the increasing concentration of GDL. Meanwhile, the addition amount of GDL exhibited an obvious effect on water-holding capacity (WHC). No obvious effect of GDL with the addition less than 0.5% on WHC was observed; in contrast, a significant improvement of WHC was determined due to the addition of GDL ranged within 0.5%—2.0%. In addition, the hardness, gumminess and resilience exhibited a reduction while the addition of GDL was ranged within 0.5%—1.0% and then exhibited an increase while the addition of GDL was ranged within 1.5%—2.0%. However, the adhesiveness exhibited a decrease at all conditions. Based on the comprehensive analysis, the best functional property of MP was achieved by the addition of 1.5% GDL.
myofibrillar protein (MP);glucono-δ-lactone (GDL);gelation
TS251.51
A
1002-6630(2010)09-0067-04
2009-09-19
黑龙江省杰出青年基金项目(JC200702);国家公益性行业(农业)科研专项(200903012-02)
王宇(1985—),男,硕士研究生,研究方向为畜产品加工。E-mail:foodneau@126.com
孔保华(1963—),女,教授,博士,研究方向为畜产品加工。E-mail:kongbh63@hotmail.com

