胶州湾某水域蛤蜊(Ruditapes philippinarum)、牡蛎(Crassostrea ariakensis)中的雌激素含量
周昕,王江涛,谭丽菊,赵志超
1.中国海洋大学海洋化学理论与工程技术教育部重点实验室,青岛266100
2.青岛科技大学化工学院,青岛266042
胶州湾某水域蛤蜊(Ruditapes philippinarum)、牡蛎(Crassostrea ariakensis)中的雌激素含量
周昕1,2,王江涛1,*,谭丽菊1,赵志超2
1.中国海洋大学海洋化学理论与工程技术教育部重点实验室,青岛266100
2.青岛科技大学化工学院,青岛266042
为了探讨海洋贝类对环境中雌激素的富集情况,采用液-液萃取和固相萃取方法提取了胶州湾李村河入海口蛤蜊、牡蛎和底泥中的雌酮(E1)、雌二醇(E2)、雌三醇(E3)和雌炔醇(EE2),并用GC-MS方法测定了上述4种物质的含量,此外还采用暴露实验方法研究了蛤蜊吸收底泥中雌激素物质的影响因素.测定结果显示,该水域中蛤蜊全组织中E1含量为0.45~5.20ng·g-1,E2含量为nd~4.34ng·g-1,E3和EE2未检出;牡蛎体内的E1、E2和E3含量分别为4.64~29.66、2.16~7.20和0.96~7.96ng·g-1,EE2未检出;底泥中E1、E2和E3含量分别为0.43~2.36、nd~0.59、0.52~1.13ng·g-1,EE2未检出.蛤蜊和牡蛎体内的雌激素物质含量高于其栖息的底泥.暴露实验结果显示,随着底泥中雌激素物质含量的增加或暴露时间增加,蛤蜊体内雌激素物质的含量增加,贝类可吸收并富集底泥中的雌激素物质.
蛤蜊;牡蛎;雌激素;萃取;GC-MS
1 引言(Introduction)
天然雌激素如雌酮(E1)、雌二醇(E2)、雌三醇(E3)和合成化合物雌炔醇(EE2)目前已在各种水体中被广泛检出(Lguchi et al.,2001;Tilton et al.,2002),例如英国某表层水中E2水平达到27ng·L-1,EE2水平达到5.1ng·L-1(Ying et al.,2002),中国深圳某污水排放口海水中雌激素物质总量达260~300ng·L-1(Lee et al.,2006).实验室研究结果显示,E2和EE2的雌激素活性较大,水中含有0.1ng·L-1的EE2就可使某些敏感生物出现内分泌异常(Lange et al.,2002;Andersen et al.,2003).据布鲁尼尔大学研究人员调查发现,流经伦敦的泰晤仕河中出现的两性同体鱼,是口服避孕药中的雌激素物质通过污水流入河中的结果(徐俊康,2003);黄河鲈幼体在性分化期间吸收了雌激素物质处理的浮游生物卤虫幼体会产生功能性性逆转(Stewart et al.,2001).
水中双壳类软体动物也能够累积其周边环境中的甾体雌激素(Tarrant et al.,2001;Le Curieux-Belfond et al.,2005).较高水平的E2等雌激素物质已经出现在蛤蜊等双壳类软体动物体内(Janer and Porte,2007;Gauthier-Clerc et al.,2006).蛤蜊等软体动物体内含有雌二醇受体(Köhler et al.,2007;Lafont et al.,2007),某些雌激素物质会导致贝类的DNA受损(Gagné et al.,2002).目前对双壳类软体类动物体内雌激素水平研究较多的是贻贝(Mytilus edulis)(Ortiz-Zarragoitia and Cajaraville,2006),其次是扇贝,而蛤蜊(Ruditapes philippinarum)和牡蛎(Crassostrea ariakensis)的研究相对较少(王海艳等,2007).本文采用萃取和GC-MS法对青岛李村河-胶州湾海口区域的牡蛎、蛤蜊及蛤蜊生长的底泥中的雌激素物质进行提取和测定,通过暴露实验研究蛤蜊对底泥中雌激素物质的吸收,以期为了解胶州湾双壳类动物体内雌激素物质水平提供基础依据.
2 材料与方法(Materials and methods)
2.1 仪器
菲尼根TRACE MC GC-MC仪,GC112-A气相色谱仪(上海分析仪器厂).0.25mm I.D.×30m×0.25μm DB-5石英毛细管柱.
2.2 试剂
N-甲基-N-三甲基硅基-三氟乙酰胺(MSTFA,美国Sigma-Aldrich公司).雌二醇(17β-estradiol,C18H24O2,纯度≥97%,美国Aldrich公司),雌三醇(estriol,C18H24O3,HPLC级,纯度≥97%,Fluka试剂,美国),雌酮(estrone,C18H22O2,HPLC级,纯度≥97.0%,Fluka试剂,美国),雌炔醇(17α-ethynyl estradiol,C20H24O2,HPLC级,纯度≥98%,Sigma试剂,美国).正-25碳烷烃(C25,色谱标准,Fluka试剂,美国).正-20碳烃(C20,色谱标准,上海试剂一厂),角沙烷(C30,色谱标准,英国,上海化学试剂采购供应站试剂厂分装),SUPELCO LC-18小柱(填料100mg,50mm×5mm I.D.Fluka试剂,美国).0.45μm纤维素膜.无水甲醇、正己烷、乙酸乙酯和吡啶均为分析纯,二氯甲烷、氯仿为色谱纯.实验用混合雌激素标准溶液浓度为:E3=7.92mg·L-1,E2=20.4mg·L-1,E1=20.3mg·L-1,EE2=13.28mg·L-1.其他试剂浓度:C25=18.6mg·L-1,C20=600mg·L-1,C30=152mg·L-1.
2.3 样品的收集
暴露实验用蛤蜊样品购于集贸市场.用于现场研究的蛤蜊样品采自胶州湾青岛李村河入海口海滩.海水落潮后,将蛤蜊从海滩底泥中挖出.蛤蜊的长度均为2~2.5cm.3、4、5月各采集一次蛤蜊样品.同时采集蛤蜊所栖息的海泥.4月的牡蛎样品采自李村河-胶州湾海岸礁石表面(落潮后采集),牡蛎长度为6cm.5月采集的深海牡蛎样品长度为8cm(渔民提供).生物样品均为活体贝类.上述采集的生物样品和底泥样品立即密封并置于-20℃冰冻保存.
2.4 贝类组织中雌激素的提取与测定
取6枚冰冻蛤蜊或牡蛎,去壳后,取其全组织称重.捣碎后,加入40mL甲醇(Le Curieux-Belfond et al.,2001;Hartmann and Steinhart,1997)和10mL pH=7.4的0.2mol·L-1的磷酸钠盐缓冲溶液(Gagné et al.,2002;Gauthier-Clerc et al.,2006),匀浆15min.离心分离出混合物中的固体.将液体倒入分液漏斗中,然后用20mL正己烷对该液体萃取两次(Hartmann and Steinhart,1997),弃去上层的正己烷溶液.将剩余溶液倒入烧杯中,在40℃水浴中,用氮气吹至液体量为10mL.在该液体中加入50mL去离子水,用C-18小柱过滤,流速为1~2mL·min-1.加入20mL水清洗烧杯两次,再将该水过柱.氮气吹出小柱中的水,用1:6:6的甲醇:二氯甲烷:正己烷混合液洗脱小柱上的物质.收集洗脱液,在40℃下用氮气吹干溶剂(任进民和侯艳宁,2004).
在残渣中加入20μL C30作内标,用二氯甲烷将小烧杯中的残渣转移到反应瓶中.用弱氮气流吹溶剂至干.在该残渣中加入50μL吡啶(Liu et al.,2004)和50μL N-甲基-N-三甲基硅基三氟乙酰胺(MSTFA),在室温下放置30min.然后在反应瓶中再加入50μL正己烷和50μL MSTFA硅烷化试剂,在100℃烘箱中加热40min.冷却后对样品的硅烷化衍生物进行气相色谱分析.气相色谱分析程序为:初始温度80℃(保持2min),后以10℃·min-1的速度升温至250℃(保持15min),再以1℃·min-1的速度升至260℃,保持20min.采用无分流进样.实际样品用GC-MS法测定,进样2μL.质谱测定质量扫描范围从25~550.根据雌激素标准样品的保留时间和扫描特征离子的m/Z进行定性分析,用雌激素的分子离子峰面积(Quintana et al.,2004)及内标法对样品中的雌激素含量进行定量分析.雌激素物质含量用鲜重计.
2.5 底泥中4种雌激素(E1、E2、E3、EE2)的提取与测定
取冰冻干燥的底泥样品于150mL锥形瓶中,加入含有甲醇、乙酸乙酯、二氯甲烷(Jurgens et al.,1999)、正己烷(体积比为3:4:3:6)的混合萃取液20mL,密封后用超声波萃取20min.静止沉降后,将上层清液转移到小烧杯中.分别用10mL萃取液将上述萃取过的样品再萃取两次,每次20min,将该萃取液均并入小烧杯中.在40℃下,用氮气吹干溶剂.在残渣中加入少量二氯甲烷使残渣溶解,再加入300mg柱层析硅胶与溶液混合,待溶剂挥发后,将混有样品的硅胶转移至塑料小柱中.将该小柱与C18柱(用C20、C25处理)相连,用100mL去离子水从硅胶小柱到C18小柱淋洗(Kuster et al.,2004),流速为1~2mL·min-1.取下C18柱,用氮气吹出其中的水分.柱上样品洗脱及样品的衍生化处理同2.4节.用GC-FID法进行测定,进样4μL.底泥中雌激素物质含量以干重计.
2.6 回收率与工作曲线的测定
将含有E1、E2、E3和EE2的混合标准样品溶液喷入匀浆过的蛤蜊肉样中,或加入到筛过的干燥底泥样品中,搅拌均匀.分别用上述方法对蛤蜊或底泥样品中的4种雌激素进行提取和衍生化,然后进行色谱分析.取等量上述4种雌激素标准样品,衍生化后直接进行色谱分析.所得结果用于回收率计算.蛤蜊全组织中4种雌激素的回收率(n=5)为80%~90%,相对标准偏差为±5~19%.底泥样品中的4种雌激素的提取回收率(n=3)为80%~120%,标相对准偏差为±10~17%.取5份不同浓度的4种混合雌激素标准溶液(E1、E2、E3、EE2的含量在0.1~3μg),按前述方法进行硅烷化,用GC-MS或GC-FID法测定工作曲线.在0.1~3μg浓度范围内E1、E2、E3和EE2的内标工作曲线的线性相关系数在0.993~0.996之间,FID方法的检出限在2~8μg·kg-1之间,MS方法的检出限在1~3μg·kg-1样品之间(信噪比S/N=3)(周昕等,2006).
2.7 蛤蜊暴露实验
在培养皿中依次加入400g底泥、少量海水和一定量的混合雌激素(含E1、E2、E3、EE2)标准溶液,将该混合物搅拌均匀.取6枚市售活蛤蜊,将其埋入上述底泥中.培养基中混合标准雌激素的加入量分别为100、150和200μL,暴露实验温度为10、20和30℃,蛤蜊暴露在底泥中的时间为6、12和24小时(h).将暴露实验温度、暴露时间和暴露雌激素量设计成三因素三水平正交实验(设计方案见表1).按表1方案分别进行实验.暴露实验后,取出蛤蜊并洗去其表面泥土,密封后将其置于-20℃冰冻.按前述方法对暴露蛤蜊中的4种雌激素测定.同时测定该市售蛤蜊中的雌激素含量用于对照.
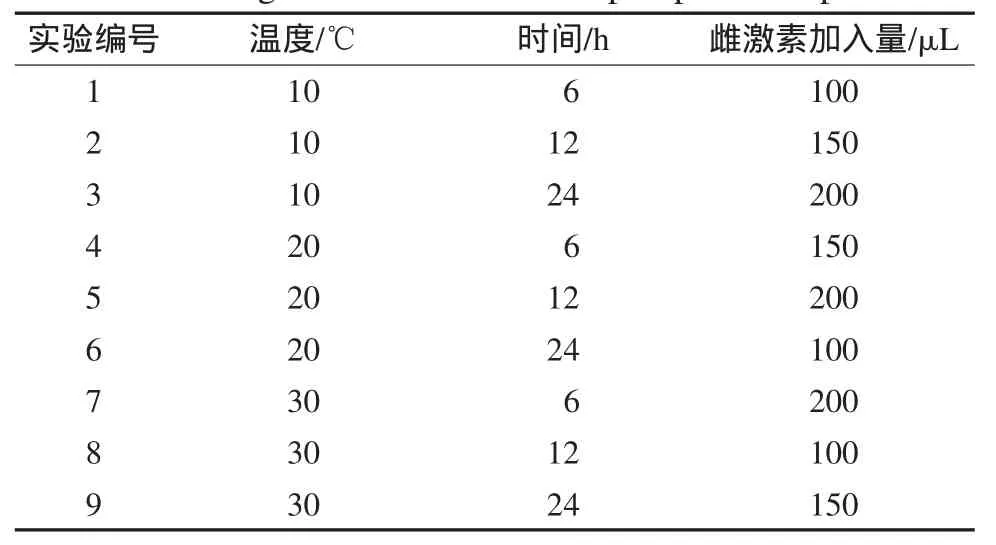
表1 蛤蜊暴露实验设计正交表Table 1Design matrix used in clamp exposure experiment
3 结果与分析(Results and analysis)
3.1 蛤蜊暴露
暴露实验条件对蛤蜊体内4种雌激素物质水平的影响如图1所示.结果表明,暴露在含有4种雌激素底泥中的蛤蜊,其全组织中的相关雌激素的浓度远高于对照试验组(E1=0.03,E2=0.30,EE2=0,E3=0,Ai/As%·g-1),说明在培养实验中,蛤蜊吸收了底泥中的雌激素物质,这与Champeau和Narbonne(2006)报道结果一致.

将蛤蜊暴露正交实验结果进行级差分析,暴露温度、暴露雌激素的量及暴露时间对蛤蜊吸收底泥中4种雌激素的综合影响列于表2.

表2 暴露实验条件对蛤蜊体内4种雌激素水平的综合影响Table 2Complex effects of conditions of exposure experiment on levels of estrogens in exposed clams
测定结果表明(见表2或图1),当暴露温度从10℃高到30℃时,蛤蜊体内雌激素物质E2、EE2、E3的含量呈下降趋势.说明温度较高时,蛤蜊对底泥中的雌激素物质的吸收作用减弱,或蛤蜊体内对雌激素物质的降解作用增加.这种结果类似于贻贝(M.edulis)体内E1和E2的含量在2月份高于12月份的情况(Gauthier-Clerc et al.,2006).与前者相反,随暴露实验温度升高,蛤蜊体内E1的含量增加,但增加的幅度不大.除了E1有较强的脂溶性外,软体动物体内的代谢作用可以将E1和E2互相转化(Janer and Porte,2007).所以暴露蛤蜊体内E1的增加可能与E2降解作用的增强有关.
暴露正交实验结果还表明,蛤蜊暴露在底泥的时间延长,其体内雌激素物质E1、E2、EE2的含量增加,说明蛤蜊会持续吸收底泥中的某些雌激素物质并在体内累积.然而,在实验条件下,蛤蜊体内E3的水平呈下降趋势,说明蛤蜊对极性较强的E3吸收的少.这与Lai等(2002)的生物浓缩预测模型中E3具有较小的浓缩因子结论相一致.
当培养基质中4种雌激素物质的量增加时,试验蛤蜊体内的E2、EE2、E3的水平增加,表明底泥中雌激素物质的量增加,生物组织对其吸收增加.但是,暴露蛤蜊体内E1的水平呈下降趋势.尽管E1的总量变化不大,但软体动物体内可能存在生物代谢平衡作用(Berg and Kuss,1991;Janer and Porte,2007).
可见,蛤蜊能够吸收并累积底泥中的雌激素物质.暴露时间长或暴露量大都会使蛤蜊对雌激素的累积量增加,但对不同雌激素物质的吸收和累积程度不同.
3.2 蛤蜊和牡蛎体内的雌激素现场调查
3.2.1 蛤蜊中雌激素物质含量
测定结果见表3.蛤蜊样品全组织中含有E1和E2,E3和EE2未检出,其中E1的含量在0.45~5.20ng·g-1之间,E2的含量在nd~4.34ng·g-1之间,E1含量高于E2.据文献报道,蛤蜊(Ruditapes decussate)全组织中E2含量小于0.01ng·g-1,软壳蛤蜊(M.arenaria)的生殖腺体中的E2含量为0.1~1ng·g-1(Janer and Porte,2007).本研究的测定结果均高于文献值.尽管不同类型的蛤蜊的内在结构和代谢水平可能不同,但这些蛤蜊体内雌激素含量的差别与栖息的环境水域中的污染物质水平有关.测定结果还显示,从3月到5月,随环境温度的升高,蛤蜊体内的E1含量增加,E2含量下降,这与暴露实验结果一致.说明蛤蜊体内的雌激素水平受到了环境因素的影响.
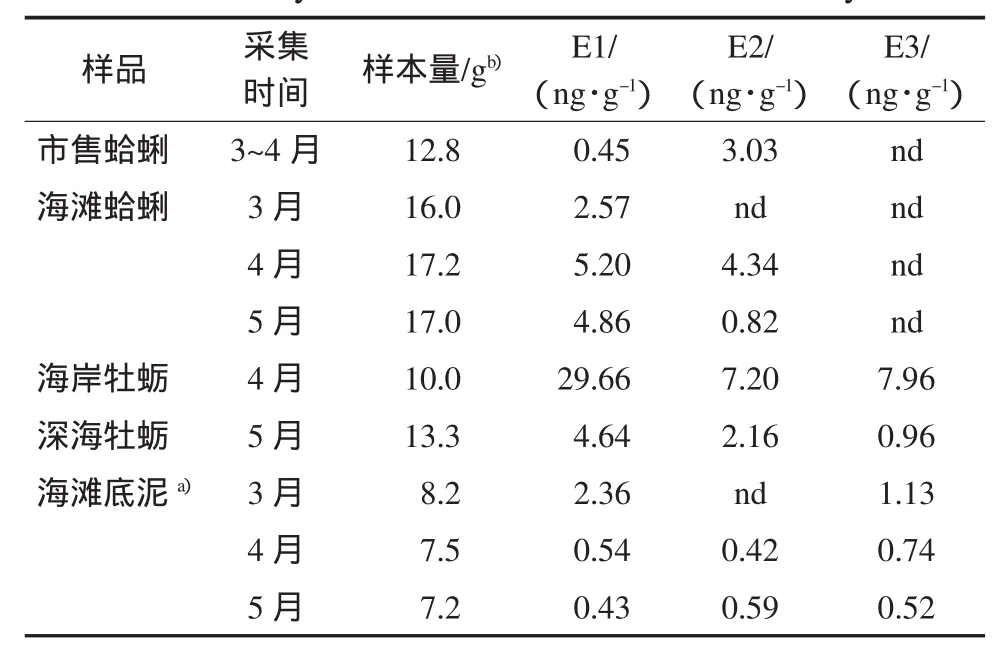
表3 胶州湾底泥、蛤蜊及牡蛎中雌激素物质含量(平均值)Table 3Average contents of estrogens in whole tissus in clam or oyster and bedmud from Jiaozhou Bay
3.2.2 牡蛎样品中雌激素物质含量
在测定的两组牡蛎样品中,均含有E1、E2和E3,EE2未检出,它们的含量分别为,E1:4.64~29.66ng·g-1,E2:2.16~7.20ng·g-1,E3:0.96~7.96ng·g-1.其中,E1的含量高于E2和E3,E2与E3的水平相近.文献报道中,牡蛎(Crassostrea gigas)整体组织中的E1和E2的含量分别为0.3和1.5ng·g-1,生殖腺体中的E1含量为0.01~1ng·g-1,E2含量为0.1~10ng·g-1(Janer and Porter,2007;Gauthier-Clerc et al.,2006).可见牡蛎样品中的E1和E2的测定值均比文献报道值高,并且E1的含量高于E2,这与文献相反.此外,在被测牡蛎的组织中发现有E3,这些物质可能来自于海水或底泥环境.测定结果还表明,海岸牡蛎体内雌激素的水平明显高于深海牡蛎.
3.2.3 底泥中雌激素物质含量
底泥中含有E1、E2和E3,EE2未检出,其中E2的水平为nd~0.59ng·g-1,E1为0.43~2.36ng·g-1,E3为0.52~1.13ng·g-1.该结果高于Jurgens等(1999)的报道值(E1=1.5~33,E2=0.7~16,E3=8.43ng·kg-1),低于德国某河底泥雌激素的测定值(<0.05~22.8μg·kg-1)(Ternes et al.,2002).底泥中3种雌激素物质的水平随环境温度的升高而下降,这与4、5月份蛤蜊体内雌激素的测定值一致(见表3).与海滩底泥中E1和E2的水平相比,栖息在该底泥中的蛤蜊全组织中的相应的雌激素水平较高,这说明蛤蜊吸收并累积了底泥中的雌激素物质.根据Lai等(2002)的生物浓缩雌激素预测模型,E1、E2和E3的logBCF(BCF:底栖生物浓缩因子)分别为2.31、2.71和1.82,因此蛤蜊组织对环境中的雌激素物质的累积量还是较小的.
3.2.4 不同贝类样品中被测雌激素的水平
测定结果显示,市售蛤蜊体内E1的含量低于海滩蛤蜊中的,E2含量低于或与海滩蛤蜊中的相近.其原因可能是市售活蛤蜊均放在洁净海水中浸泡了一定时间,使蛤蜊体内的雌激素物质被浸出而含量下降(Specker and Chandlee,2003).深海牡蛎体内的E1和E2的水平与蛤蜊的相近,说明这两种贝类对雌激素物质的吸收、代谢或累积能力相近.然而,据文献报道,牡蛎生殖腺体中E2的含量是蛤蜊的10倍(Janer and Porter,2007),扇贝(Patinopecten yessoensis)的生殖腺体中的E2含量与其类似(0.1~10ng·g-1),而贻贝全组织中E2的水平高达0.04~10ng·g-1,其生殖腺体的E1含量为31.9ng·g-1,E2含量为0.04~162ng·g-1(Janer and Porter,2007;Gauthier-Clerc et al.,2006),我们测定的海岸牡蛎全组织中的E1的含量远高于深海牡蛎的.可见,不同类型的双壳类软体动物体内的E1和E2的水平有较大的差异.除了这些生物体内的代谢水平不同外,可能还与对环境中的污染物的吸收和累积作用能力有关,或与环境中的污染物的含量有关.
Andersen L,Holbech H,Gessbo A,Norrgren L,Petersen G I.2003.Effects of exposure to 17α-ethinylestradiol during early development on sexual differentiation and induction of vitellogenin in zebrafish(Danio rerio)[J].Comparative Biochemistry and Physiology Part C:Toxicology&Pharmacology,134(3):365-374
Berg F D,Kuss E.1991.Urinary-excretion of catecholestrogens,2-methoxyestrogens and“classical estrogens”throughout the normal menstrual cycle[J].Archives of Gynecology and Obstetrics,249(4):201-207
Champeau O,Narbonne J F.2006.Effect of tributyltin and 17βestrodiol on immune and lysosomal systems of the Asian clam Corbiculafluminea(M.)[J].EnvironmentalToxicologyand Pharmacology,21(3):323-330
Gagné F,Blaise C,Pellerin J,Gauthier-Clerc S.2002.Alteration of the biochemical properties of female gonads and vitellins in the clam Mya arenaria at contaminated sites in the Saguenay Fjord[J].Marine Environmental Research,53(3):295-310
Gauthier-Clerc S,Pellerin J,Amiard J C.2006.Estradiol-17 and testosterone concentrations in male and female Mya arenaria(Mollusca bivalvia)during the reproductive cycle[J].General and Comparative Endocrinology,145(2):133-139
Hartmann S,Steinhart H.1997.Simultaneous determination of anabolicandcatabolicsteroidhormonesinmeatbygas chromatography-mass spectrometry[J].Journal of Chromatography B:Biomedical Sciences and Applications,704(1-2):105-117
Janer G,Porte C.2007.Sex steroids and potential mechanisms of non-genomic endocrine disruption in invertebrates[J].Ecotoxicology,16(1):145-160
Jurgens M D,Johnson A C,Williams R J.1999.In fate and behavior of steroid oestrogens in rivers[R].A scoping study R&D Technical Report No.P161.UK:Environment Agency
Köhler H R,Kloas W,Schirling M,Lutz I,Reye A L,Langen J S,Triebskorn R,Nagel R,Schönfelder G.2007.Sex steroid receptorevolutionandsignallinginaquaticinvertebrates[J].Ecotoxicology,16(1):131-143
Kuster M,de Alda M J L,Barceló D.2004.Analysis and distribution of estrogens and progestogens in sewage sludge,soils and sediments[J].TrAC Trends in Analytical Chemistry,23(10-11):790-798
Lafont R,Mathieu M.2007.Steroids in aquatic invertebrates[J].Ecotoxicology,16(1):109-130
Lai K M,Scrimshaw M D,Lester J N.2002.Prediction of the bioaccumulation factors and body burden of natural and synthetic estrogens in aquatic organisms in the river systems[J].The Science of the Total Environment,289(1-3):159-168
Lange I G,Daxenberger A,Schiffer B,Witters H,Ibarreta D,
Meyer H H D.2002.Sex hormones originating from different livestock production systems:fate and potential disrupting activity in the environment[J].Analytica Chimica Acta,473(1-2):27-37
Le Curieux-Belfond O,Fievet B,Séralini G E,Mathieu M.2005.Short-term bioaccumulation,circulation and metabolism of estrediol-17β in the oyster Crassostrea gigas[J].Journal of Experimental Marine Biology and Ecology,325(2):125-133
Le Curieux-Belfond O,Moslemi S,Mathieu M,Séralini GE.2001.Androgen metabolism in oyster Crassostrea gigas:evidence for 17-HSD activities and characterization of an aromatase-like activity inhibited by pharmacological compounds and a marine pollutant[J].Journal of Steroid Biochemistry&Molecular Biology,78(4):359-366
Lee Y C,Wang L M,Xue Y H,Ge N C,Yang X M,Chen G H.2006.Natural estrogens in the surface water of Shenzhen andtheSewagedischargeofHongKong[J].Humanand Ecological Risk Assessment,12(2):301-312
Lguchi T,Watanabe H,Katsu Y.2001.Developmental effects of estrogenic agents on mice,fish,and frogs[J].Hormones and Behavior,40(2):248-251
Liu R,Zhou J L,Wilding A.2004.Simultaneous determination of endocrine disrupting phenolic compounds and steroids in water by solid-phase extraction-gas chromatography-mass spectrometry[J].Journal of Chromatography A,1022(1-2):179-189
Ortiz-ZarragoitiaM,CajaravilleMP.2006.Biomarkersof exposure and reproduction-related effects in mussels exposed to endocrine disruptors[J].Archives of Environmental Contamination and Toxicology,50(3):361-369
Quintana J B,Carpinteiro J,Rodríguez T,Lorenzo R A,Carro AM,CelaR.2004.Determinationofnaturalandsynthetic estrogens in water by gas chromatography with mass spectrometric detection[J].Journal of Chromatography A,1024(1-2):177-185
Ren J M,Hou Y N.2004.Determination of neurosteroids in rat brainregionsbyliquidchromatography/negativeatomspheric pressure ionization mass spectrometry[J].Chinese Journal of Chromatography,22(6):575-578(in Chinese)
Specker J L,Chandlee M K.2003.Methodology for estradiol treatment in marine larval and juvenile fish:uptake and clearance in summer flounder[J].Aquaculture,217(1-4):663-672
Stewart A B,Spicer A V,Inskeep E K,Dailey R A.2001.Steroid hormone enrichment of Artemia nauplii[J].Aquaculture,202(1-2):177-181
Tarrant A M,Atkinson M,Atkinson S.2001.Uptake of estrone fromthewatercolumnbyacoralcommunity[J].Marine Biology,139(2):321-325
TiltonF,BensonWH,SchlenkD.2002.Evaluationof estrogenic activity from a municipal wastewater treatment plant with predominantly domestic input[J].Aquatic Toxicology,61(3-4):211-224
Wang H Y,Guo X M,Liu X,Zhang G F,Zhang S P,Xu F S.2007.Classification of“Jin jiang”oysters in China[J].Marine Sciences,3(9):85-86(in Chinese)
Ying G G,Kookana R S,Ru Y J.2002.Occurrence and fate ofhormoneteroidsintheenvironment[J].Environment International,28(6):545-551
ZhouX,WangJT,ZhaoZC.2006.Determinationof estrogens in environment water from Qingdao city by GC-FID or GC-MS[J].Analysis and Testing Technology and Instruments,12(2):104-108(in Chinese)
中文参考文献
任进民,侯艳宁.2004.高效液相色谱-质谱法测定大鼠不同脑区的硫酸酯型神经甾体[J].色谱,22(6):575-578
周昕,王江涛,赵志超.2006.GC法测定青岛某水体中雌激素含量[J].分析测试技术与仪器,12(2):104-108
徐俊康.2003.环境污染与“阴胜阳衰”[J].家庭中医药,(4):34-35
王海艳,郭希明,刘晓,张国范,张素萍,徐风山.2007.中国近海“近江牡蛎”的分类和订名[J].海洋科学,3(9):85-86◆
Estrogens in Clam(Ruditapes philippinarum)and Oyster(Crassostrea ariakensis)from Waters in Jiaozhou Bay
ZHOU Xin1,2,WANG Jiang-tao1,*,TAN Li-ju1,ZHAO Zhi-chao2
1.Key Laboratory of Marine Chemistry Theory and Technology,Ministry of Education,Ocean university of China,Qingdao 266100
2.College of Chemical Engineering,Qingdao University of Science and Technology,Qingdao 266042
In order to study the estrogen adsorption of shellfish in aquatic environment,the levels of estrogens,such as estrone(E1),estradiol(E2),estriol(E3)and ethynyl estradiol(EE2)in clams,oyster and sediment from the mouth of the Licun River in Jiaozhou Bay were determined by GC-MS after the estrogens were extracted by liquid or solid-phase extraction.Factors affecting absorption of clams to estrogens in sediment were studied by exposure them to sediment spiked estrogens.Results showed that levels of estrogens in whole tissue of calm were 0.45~5.20ng·g-1for E1 and nd~4.34ng·g-1(wet weight)for E2,respectively and those in oyster were 4.64~29.66 for E1,2.16~7.20 for E2 and 0.96~7.96ng·g-1(wet weight)for E3,respectively.Contents of E1,E2 and E3 in sediment were 0.43~2.36,nd~0.59,0.52~1.13ng·g-1(dry weight).Contents of estrogens in clams and oysters were higher than those in sediment.Also,contents of estrogens in clams increased with increasing contents of estrogens spiked in sediment and exposure time.So,the estrogens in sediment could be absorbed and enriched by the two kinds of shellfish.
calm;oyster;estrogens;extraction;GC-MS
1 January 2009accepted20 February 2009
1673-5897(2010)1-123-07
X834,X503.22
A
2009-01-01录用日期:2009-02-20
山东省自然科学基金项目(No.Y2006E10)
周昕(1956—),女,博士研究生,E-mail:qust-zhou@163.com;*通讯作者(Corresponding author),E-mail:jtwang@ouc.edu.cn
王江涛(1967—),教授、博士生导师,主要从事海洋中的碳循环及生物地球化学过程、海洋富营养化、海洋有机地球化学及海洋中的活性物质等方面的研究工作.

