基于共价色谱分离的含半胱氨酸肽段富集策略
米 薇, 王 晶, 应万涛, 贾 伟, 蔡 耘, 钱小红*
(1.中国计量科学研究院生物能源环境所,北京100013;2.蛋白质组学国家重点实验室,北京蛋白质组研究中心,北京放射与辐射医学研究所,北京102206)
基于共价色谱分离的含半胱氨酸肽段富集策略
米 薇1, 王 晶1, 应万涛2, 贾 伟2, 蔡 耘2, 钱小红2*
(1.中国计量科学研究院生物能源环境所,北京100013;2.蛋白质组学国家重点实验室,北京蛋白质组研究中心,北京放射与辐射医学研究所,北京102206)
多维色谱分离、串联质谱分析技术已在蛋白质组研究中得到广泛应用。然而生物样品的蛋白质以及全酶切肽段具有高度的复杂性,这严重干扰了蛋白质高通量、规模化的分析。通过标签肽段富集进行样品预分离可以降低体系的复杂程度。本文建立了一种基于共价色谱技术选择性分离富集含半胱氨酸肽的方法,从而降低了样品体系的复杂程度。首先以牛血清白蛋白(BSA)的酶切肽段为模型,对富集条件进行了优化和考察,并在此基础上通过5种蛋白质酶切肽段混合物的富集对该方法进行了验证。结果证明此方法的重现性好,富集效率高,富集特异性好,能有效地富集鉴定含半胱氨酸肽段。所建立的方法在复杂体系的蛋白质组研究中具有广泛的应用前景,为复杂样品的蛋白质高通量、自动化、规模化鉴定和定量研究提供了实用技术。
共价色谱;液相色谱-串联质谱;含半胱氨酸肽;富集;蛋白质组
Abstract:Automated multidimensional liquid Chromatography-tandem mass spectrometry(LCMS/MS)is routinely applied in large scale proteome profiling.How ever global proteome analysis remains a technical challenge due to the issues associated with sample complexity by tryptic digestion.The application of tag containing pep tide enrichment approach for sample pre-separation could reduce the complexity of protein digest.Here,we demonstrated a simple and highly efficient cysteine-containing pep tide enrichment method using a thiol specific covalent resin.The cysteine-containing pep tides from the tryptic digests of the complex proteinmixtures were selected by covalent Chromatography based on thiol-disulfide exchange,identified by mass spectrometry.The strategy was firstly optimized and evaluated by using the tryptic pep tides of bovine serum album in(BSA).Then the method was applied with a relatively complicated sample from a five standard protein mixture.The results of these studies show that the enrichment method of cysteine-containing pep tides is highly specific,efficient and reproducible.The effectiveness of this method in reducing the sample complexity and improving the identification of peptides by mass spectrometry has enabled high-throughput,automatic and large-scale qualitative and quantitative proteome analyses.
Key words:covalent Chromatography;liquid Chromatography-tandem mass spectrometry;cysteine-containing pep tides;enrichment;proteome
蛋白质组学的基本目标是尽可能地鉴定到生物体所表达的全套蛋白质。随着电喷雾电离(ESI)[1]和基质辅助激光解吸电离(MALD I)[2]等质谱技术的发展和完善,质谱在蛋白质组研究中发挥着重要的作用,使高通量分析生物体的蛋白质组成成为可能。但生物体蛋白质的高度复杂性严重干扰了质谱鉴定,因此有必要对生物样品进行预分离以降低其复杂程度。
二维电泳(2D E)是分离复杂蛋白质混合物最常用的技术,但它不能有效分离分子质量过大或过小、等电点过高或过低、疏水性极强的蛋白质,这使其应用受到一定的限制[3]。基于多维色谱分离-串联质谱分析的鸟枪法(Shotgun)为蛋白质组学的研究提供了强有力的手段[4,5],其基本技术路线是先对蛋白质溶液进行全酶切,再根据肽段的电荷、疏水性等特点,通过多维毛细管液相色谱分离后对产生的复杂肽段混合物进行质谱鉴定。这种方法自动化程度高、通量高,对疏水和低丰度的蛋白质没有歧视效应,弥补了2D E分离蛋白质的技术缺陷。
然而蛋白质全酶切大大增加了肽段混合物的复杂程度[6],所以需要在肽段水平上对样品进行预分离以降低肽段混合物的复杂程度。最常用的策略之一是采用标签肽分离技术来降低肽段混合物的复杂程度并减少待分析肽段的数目[7-9]。之所以可以采用这样的策略是因为在数据库和搜索软件的帮助下,鉴定一个蛋白质并不需要对其所有肽段进行鉴定,具有高度序列特异性的一个肽段往往就可以作为标签肽用于其蛋白质的鉴定。通过选择性分离含低丰度氨基酸残基的肽段,可以大大降低肽段混合物的复杂程度[10],从而提高标签肽的相对丰度及被鉴定的机会。
统计分析表明,酵母中有91.6%的蛋白质含有半胱氨酸残基,而只有9.3%的酶切肽段含有半胱氨酸残基;对人的Sw iss-Prot数据库分析表明,有97.3%的蛋白质含有半胱氨酸残基,而只有22.5%的酶切肽段含有半胱氨酸残基。由此表明,基于含半胱氨酸肽富集的高特异性方法可以降低肽段混合物的复杂程度以及样品的动态范围,从而降低高丰度和低丰度肽段的共流出对低丰度肽段所产生的质谱抑制效应,有利于低丰度蛋白质的鉴定。但对于不含有半胱氨酸的蛋白质和肽段,该方法具有缺陷性,但数据库分析表明这部分蛋白质不到10%,因此通过含半胱氨酸肽富集进行蛋白质鉴定的策略已被广泛应用于蛋白质组研究。Aebersold等[11]使用“同位素编码亲和标签”(ICAT)试剂,通过亲和柱选择性地分离富集含半胱氨酸的肽段,使分析体系得以简化。Johnson等[12]通过二硫键的交换反应可逆地将生物素标记到蛋白质的半胱氨酸残基上,从而亲和纯化了含半胱氨酸肽段。Gevaert等[13]采用对角线色谱法(com bined fractional diagonal Chromatography,CO FRAD IC)策略,在蛋白质酶切前用Ellm an’s试剂标记半胱氨酸残基,通过含巯基的肽段因脱去疏水性基团而缩短保留时间,从而可以选择性富集含半胱氨酸的肽段。D ai等[14]利用过甲酸氧化反应使半胱氨酸肽段带上磺酸基,再通过阳离子交换色谱来富集含半胱氨酸肽。然而这些纯化方法还存在一些不足,例如依赖于生物素亲和纯化的富集方法在去除非特异性肽段吸附方面还存在问题:一些生物素化的半胱氨酸肽无法从亲和素上洗脱造成回收率降低。另外,通过化学修饰改变半胱氨酸疏水性、电荷的富集方法不仅需要色谱分离进行辅助,而且对肽段的化学修饰会造成肽段二级质谱图的复杂性,不便于标记肽段的序列分析。
本文建立了一种基于巯基-二硫键交换反应共价色谱富集含半胱氨酸肽的方法。这种富集方法简单、高效、特异性好,富集过程无副反应,不会使含半胱氨酸肽带上易于碎裂的片段。以牛血清白蛋白(BSA)及5种标准蛋白质混合物为样本对该方法进行了优化和考察,结果表明,该方法能有效地富集肽段混合物中含有半胱氨酸的肽段,从而降低了肽段混合物的复杂程度,使其能用于复杂样本中含半胱氨酸肽高通量的富集,因此在蛋白质组学研究中具有一定的应用前景。同时,我们对富集过程中丢失的一些半胱氨酸肽段进行了研究,对这些肽段的疏水性进行了统计分析,证实富集过程中一些极亲水和极疏水性的肽段容易丢失,但这与体系的复杂程度无关,只与肽段的属性相关。这一结果为采用巯基-二硫键交换共价色谱富集含半胱氨酸肽的研究策略提供了参考信息。
1 实验部分
1.1 材料与仪器
离心柱(HandeeTMM ini-Sp in Colum n,带螺旋帽、填料塞、Luer-Lok接头,900μL)、三(2-羧乙基)磷盐酸(tris-(2-carboxylethyl)-phosphine,TCEP)购自Pierce公司巯丙基琼脂糖凝胶6B(Thiopropyl Sepharose6B)、三羟甲基氨基甲烷(Tris)和尿素均购自GE公司。二硫苏糖醇(dithiothreitol,D TT)、碘乙酰胺(iodoacetamide,IAA)、甲酸(FA)购自美国Acros公司。胰酶(修饰、测序级)购自美国Prom ega公司,三氟醋酸(TFA)购自Fluka公司,乙腈(ACN)购自Fisher公司,色谱纯水由美国M illipore公司的纯水设备制备。BSA、核糖核酸酶A(RNAS1)、溶菌酶(LYSC)、鸡卵清蛋白(OVAL)、三磷酸甘油醛脱氢酶(GAPDH)等标准蛋白质均购自Sigm a公司;其他试剂均为国产分析纯。
(2) WIFI指纹定位被称为位置指纹是因为各位置点的WIFI信号被认为是唯一的,通过比对“指纹”可更精准地定位目标位置。定位方式的优点是定位准确,准确率可在1 m范围内,只需连入商圈WIFI即可定位,不受室内环境的影响;缺点是需手机连入WIFI网络,对于部分需认证用户的WIFI网络,在连入过程中需进行密码验证。
电喷雾-线性离子阱-傅里叶变换离子回旋共振质谱仪(ESI-LTQ-FTICR,美国Therm o Finnigan公司),毛细管液相色谱仪为Agilent1100系统,包括一台自动上样系统、一台上样泵(含一个十通阀)和一台二元洗脱泵(Agilent公司)。高速低温离心机(德国Heraeus公司);真空冰冻干燥机(SC100A Speedvac Plus,美国Therm o Savant公司);Sartorius B P211d分析天平(瑞士Sartorius公司)。
1.2 实验方法
1.2.1 蛋白质酶切肽段的制备
蛋白质酶切:分别取BSA和蛋白质混合样品,加入溶液(50mmol/L Tris缓冲液(pH8.2),8 mol/L尿素,10mmol/L TCEP),于37℃下变性还原1h;将样品用20mmol/L Tris缓冲液(pH8.2)稀释10倍,然后按照1∶50(质量比)加入胰酶,于37℃下酶切过夜。酶切完成后用C18SPE脱盐柱(1 mL,100m g,美国Supelco公司)对酶切肽段混合物进行脱盐。
肽段还原:在脱盐后的肽段中加入20μL5 mmol/L D TT(含有50mmol/L Tris缓冲液(pH 7.5),1mmol/L乙二胺四乙酸(ED TA)),于37℃下还原30m in,反应完成后用缓冲液(50mmol/L Tris,pH7.5,1mmol/L ED TA)稀释5倍。
1.2.2 巯丙基琼脂糖凝胶6B共价色谱富集含半胱氨酸肽段
共价色谱柱的装填:称取33m g的巯丙基琼脂糖凝胶6B填料粉末,用水浸泡15m in,然后将其转入离心柱中(1g填料粉末的最终体积为3mL);用50倍离心柱体积的水清洗,再用50倍柱体积的偶联缓冲液(50mmol/L Tris,pH7.5,1mmol/L ED TA)冲洗。操作过程中要进行脱气:溶液采用充氮的方法进行脱气,巯丙基琼脂糖凝胶6B填料用真空脱气。
含半胱氨酸肽的富集:肽段在巯丙基琼脂糖凝胶6B柱上保留2h,轻轻振荡。低速离心离心柱,收集流出组分。然后依次用清洗缓冲液(50mmol/L Tris缓冲液(pH8.0),1mmol/L EDTA)、2mol/L NaCl溶液,80%ACN/0.1%TFA溶液、清洗缓冲液各0.5 mL洗涤巯丙基琼脂糖凝胶6B柱。
含半胱氨酸肽段的洗脱:共价色谱柱中加入100μL20mmol/L D TT(含有50mmol/L Tris缓冲液(pH8.0),1mmol/L ED TA),在室温下还原30m in,然后离心,收集洗脱液;柱中再加入100μL 80%ACN/0.1%TFA溶液洗脱;合并洗脱液,并在其中加入80mmol/L的IAA,于暗处烷基化30 m in;真空冻干,供液相色谱-串联质谱(LC-MS/MS)分析。
LC分离:流动相A为2%乙腈溶液(含0.1%甲酸);流动相B为80%乙腈溶液(含0.1%甲酸)。洗脱梯度:0-50m in,2%B-40%B;50-60m in,40%B-100%B;60-65m in,100%B;然后用100%A平衡15m in。上样体积为20μL,流速为300nL/m in。毛细管液相色谱仪所用毛细管色谱柱为自填C18反相柱(75μm×100mm,5μm)。
从反相色谱柱流出的洗脱组分直接进入质谱仪,由纳升级电喷雾接口喷出。电喷雾电压1.8 kV,离子传输毛细管温度200℃;串联质谱分析采用一级质谱的数据依赖二级质谱扫描模式(data dependent MS/MS scan),依次选取一级质谱中离子强度最强的5个离子进行诱导碰撞解离(CID)二级串联质谱。采用动态排除(dynam ic exclusion)功能,设置排除时间为0.5m in。二级串联质谱母离子窗口为4u,归一化碰撞能量为35%;质谱的一级全扫描范围是m/z400~2 000。
1.2.4 数据库检索
采集的原始文件首先通过B ioW orks3.2软件转换为dta文件,然后通过脚本程序m erge.p l将dta文件合并成m gf文件。使用M ascot(版本1.9)检索m gf文件。检索参数:数据库为Sw iss-Prot D atabase;半胱氨酸烷基化修饰(+57.021 4u)、甲硫氨酸(M et)氧化(+15.99u)设置为可变修饰。最大漏切位点为1个,一级母离子的质荷比误差为0.002%,二级碎片离子的质荷比误差0.8u。肽段用Protparam软件(http://au.expasy.org/tools/p rotparam.htm l)进行疏水性分析。
2 结果与讨论
2.1 方法的原理
该方法富集含半胱氨酸肽段的原理如图1所示:巯丙基琼脂糖凝胶6B会与溶液中含有巯基基团的物质反应生成二硫化物,并且释放出2-巯基吡啶(2-thiopyridone)。因此肽段中半胱氨酸的巯基会与凝胶配基共价结合形成二硫键,从而实现对含半胱氨酸肽段的选择性富集,通过对富集色谱柱的洗涤去除不含有半胱氨酸的肽段以及释放出来的2-巯基吡啶,富集在柱上的含半胱氨酸肽段通过加入还原剂D TT洗脱[15,16]。由于肽段与凝胶配基是共价结合,形成了牢固的复合物,因此可以采用严苛的清洗条件洗去以离子、疏水相互作用而非特异性结合的肽段组分,保证了富集的专一性和特异性。

图1 基于巯丙基琼脂糖凝胶6B共价色谱富集含半胱氨酸肽的原理Fig.1 Princip le for en richment of cyste ine-con ta in ing pep tides based on cova len t ch rom a tograp hy by Th iop ropyl Sepha rose6B
2.2 含半胱氨酸肽段的富集和鉴定
2.2.1 方法的优化与考察
首先以标准蛋白质BSA为研究对象进行方法的优化和考察。肽段样品在富集之前需要保持半胱氨酸的巯基处于还原状态,所以在蛋白质酶切时不能进行烷基化。但这可能会影响到蛋白质的酶切,因为蛋白质的空间位阻会造成酶切不完全或者漏切位点过多,导致生成的肽段片段较大,从而影响含半胱氨酸肽段的富集。因此我们优化了蛋白样品的变性条件,对蛋白质的酶切效率进行了评价。我们考察了溶液1(50mmol/L Tris缓冲液(pH8.2),8 mol/L尿素)、溶液2(50mmol/L Tris缓冲液(pH 8.2),8mol/L尿素,10mmol/L TCEP)和溶液3(50mmol/L Tris缓冲液(pH8.2),8mol/L尿素,SDS0.5%,10mmol/L TCEP)的变性还原效果。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)的分析结果显示溶液2和3均能使蛋白质酶切完全,本文实验采用简单体系的溶液2进行蛋白质样品的变性还原。
该富集方法的关键是含半胱氨酸肽中的自由巯基与巯丙基琼脂糖凝胶6B共价结合生成二硫键。由于巯基很活泼,在空气中很容易被氧化,因此在肽段脱盐后进行富集之前需要在肽段中加入低浓度的还原剂D TT,以保证肽段中半胱氨酸的巯基处于还原状态。另外,为了防止肽段中的巯基被溶液中的空气氧化,富集过程中要进行脱气。
分别取10,20,50,100μg BSA溶于100μL水中,然后分别对其进行富集。结果表明,20μg以上的BSA中85%以上的含半胱氨酸肽能被富集,低于20μg的BSA中被检测到的含半胱氨酸肽数量显著降低,这表明富集带有半胱氨酸肽段的BSA最低质量浓度约为0.2μg/μL,因此本文实验中每次取20μg的BSA溶于100μL水中进行富集实验。
2.2.2 BSA酶切肽段的富集
对巯丙基琼脂糖凝胶6B柱的流出组分、清洗缓冲液的洗脱组分进行收集,然后用ESI-LTQ-FTICR串联质谱仪进行分析。结果(见表1)显示,流出组分和清洗缓冲液的洗脱组分中均没有检测到含半胱氨酸肽段,说明富集柱能充分富集含半胱氨酸肽段,从而达到与不含半胱氨酸肽段分离的目的。理论上BSA有25个含有半胱氨酸的肽段,该方法富集到22个,富集率达到88%。与BSA的理论酶切肽段数相比,采用该方法富集后将样品的复杂程度降低了一半,从图2中能直观地看出富集的效果。另外,在洗脱组分中没有检测到不含半胱氨酸的肽段,说明该富集方法的特异性好。由于含半胱氨酸肽段与巯丙基凝胶之间是牢固的共价结合,因此可以采用苛刻的洗涤条件,这也是该富集方法的优势之一。分别用清洗缓冲液、高浓度的盐溶液以及加入TFA的有机溶剂进行清洗,可充分去除富集柱上非特异性吸附的肽段。为了考察该方法的重复性,进行了平行实验(完全相同的富集流程),获得的3批数据(见表1中BSA的3次实验数据)中,3次富集到的半胱氨酸肽段分别为22,22,21个,并且都没有检测到不含半胱氨酸的肽段。该方法富集鉴定到的肽段不仅置信水平为95%,而且含有的半胱氨酸残基具有高度的序列特异性,使鉴定结果可靠。结果表明,该方法能高效、特异性地富集BSA中含半胱氨酸肽段。

表1 BSA和5种蛋白质混合物酶切肽段含半胱氨酸肽的富集结果Table1 Results of cysteine-containing peptides isolated from tryptic digests of BSA and a complex of five p ro te ins

图2 (a,c,e)未经富集与(b,d,f)经巯丙基琼脂糖凝胶6B柱富集后的BSA酶切肽段中含半胱氨酸肽段的质谱鉴定比较Fig.2 Comparison of RPLC-LTQ-FT analyses of cysteine-con taining peptides of BSA tryptic digests(a,c,e)without and(b,d,f)with enrichment by Thiopropyl Sepha rose6B
2.2.3 5种蛋白质混合物酶切肽段的富集
为了确保目前适用于简单标准蛋白质BSA中含半胱氨酸肽段的富集方法在复杂的实际样品中可以有效应用,我们又将其应用在相对较复杂的5种蛋白质混合物含半胱氨酸肽段的富集实验,考察其在这个体系中的富集效率和特异性。平行实验2次,分别富集到36个和35个含半胱氨酸肽(见表1),占理论含有半胱氨酸肽段总数(45个)的80%。同样,洗脱组分中没有检测到不含半胱氨酸的肽段,只在流出组分中分别检测到OVAL和GAPDH的1个含半胱氨酸肽段。实验结果表明,巯丙基琼脂糖凝胶6B分离富集半胱氨酸肽段的方法在较复杂的样品中也同样有效。BSA理论上含半胱氨酸肽段占理论酶切肽段总数的45%,5种蛋白质混合物中理论含半胱氨酸肽段占理论酶切肽段总数的36%,说明体系越复杂这种选择性富集含半胱氨酸肽段的方法越能提高标签肽的相对丰度及被鉴定的机会,大大降低肽段混合物的复杂程度。另外,这种利用巯丙基琼脂糖凝胶6B对含半胱氨酸肽富集的方法与之前文献报道的相关富集研究结果[17]相比,富集效率和特异性都要好一些。
2.2.4 肽段理化属性对富集结果影响的分析
我们发现,在含半胱氨酸肽富集实验中,有一小部分含半胱氨酸肽段丢失(见表2),表2中列出的5种蛋白质混合物酶切肽段的富集实验中丢失的BSA含半胱氨酸肽,在BSA酶切肽段的几次平行富集实验也没有鉴定到,这种丢失可能与体系的复杂程度无关,而与肽段的理化属性相关。我们对富集到的含半胱氨酸肽以及丢失的含半胱氨酸肽的疏水性和肽段的相对分子质量进行了统计分析,图3结果显示富集过程中丢失的肽段是一些高亲水性的小肽和高疏水性的肽段(椭圆圈出部分)。我们推测这种丢失可能与富集过程中的反相色谱脱盐有关,高亲水性含半胱氨酸肽特别是小肽在富集过程中可能没有被吸附在柱上而直接流出脱盐柱,而高疏水性的肽则可能由于疏水性强而没有被洗脱下来,导致样品中有些含半胱氨酸肽没有被检测到。
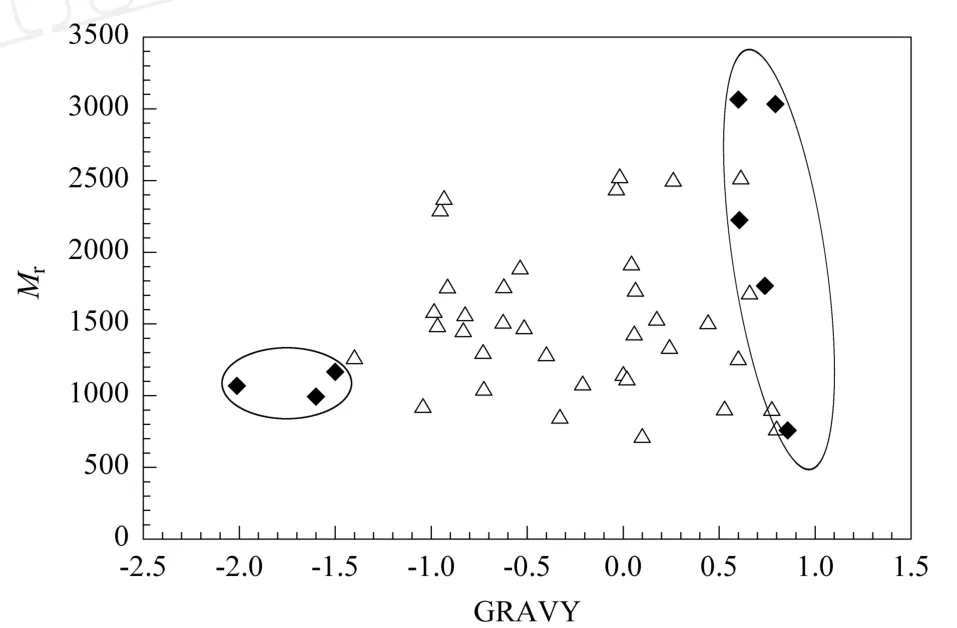
图3 富集到的含半胱氨酸肽以及丢失的含半胱氨酸肽的疏水性和肽段的相对分子质量(Mr)相关图Fig.3 Relationship be tween relative molecular mass(Mr)and GRAVY(grand ave rage of hydrop a thicity)scores of theidentified and nonidentified cysteine-containing peptides

表2 富集样品中没有鉴定到的标准蛋白质中含有的半胱氨酸肽段Tab le2 Non-identified cysteine-containing pep tides from the enrichment experiments
3 结论
本文建立了一种基于巯丙基琼脂糖凝胶6B共价色谱技术选择性分离富集含半胱氨酸肽段的方法。首先以BSA酶切肽段为模型,对富集条件进行了优化和考察,并在此基础上通过5种蛋白质酶切肽段混合物对该富集方法进行了验证。结果证明,该方法的重现性好,富集效率高,富集率达80%以上,富集特异性好,对含半胱氨酸肽有非常好的选择性。因此本方法可以有效地富集鉴定含半胱氨酸肽段,且在复杂体系的蛋白质组研究中具有广泛的应用前景,为复杂样品的蛋白质自动化、规模化鉴定和定量分析提供了实用技术。另外,我们发现富集实验中丢失了一些高亲水性和高疏水性的肽段,推测这种丢失可能与富集过程中的反相色谱脱盐有关,在以后的研究中若减少富集过程中的脱盐步骤,或者加入有机改性剂增强高亲水肽的保留以及高疏水性肽的洗脱,可能会更加提高该方法的富集效率。
[1] Dom on B,Aebersold R.Science,2006,312(5771):212
[2] M ueller D R,Voshol H,W aldt A,et al.Subcell B iochem,2007,43:355
[3] Rabilloud T.Electrophoresis,2009,30(Supp l1):S174
[4] washburn M P,Wolters D,Yates J R3rd.Nat B iotechnol,2001,19(3):242
[5] M otoyam a A,Yates J R3rd.Anal Chem,2008,80(19):7187
[6] Zhang H,Yan W,Aebersold R.CurrOp in Chem B iol,2004,8(1):66
[7] Cao D,Zhou C X,Zhang Y J,et al.Chinese Journal of Chromatography(曹冬,周春喜,张养军,等.色谱),2009,27(2):158
[8] Sui S H,W ang J L,Lu Z,et al.Chinese Journal of Chromatography(隋少卉,王京兰,卢庄,等.色谱),2008,26(2):195
[9] M einnel T,Giglione C.Proteom ics,2008,8(4):626
[10] Betancourt L,Gil J,Besada V,et al.J Proteom e Res,2005,4(2):491
[11] Gygi S P,Rist B,Griffin T J,et al.J Proteom e Res,2002,1(1):47
[12] Shen M,Guo L,W allace A,et al.Mol Cell Proteom ics,2003,2(5):315
[13] Gevaert K,Ghesquiere B,Staes A,et al.Proteom ics,2004,4(4):897
[14] Dai J,Wang J,Zhang Y,et al.Anal Chem,2005,77(23):7594
[15] Liu T,Qian W J,Chen W N,et al.Proteomics,2005,5(5):1263
[16] Wang S,Regnier F E.J Chromatogr A,2001,924(1/2):345
[17] Gygi S P,RistB,Gerber S A,et al.Nat Biotechnol,1999,17(10):994
Enrichment strategy of cysteine-containing peptides based on covalent chromatography
MIWei1,WANG Jing1,YING Wantao2,JIA Wei2,CAI Yun2,QIAN Xiaohong2*
(1.Department of Biology,Energy and Environment,National Institute of Metrology,Beijing 100013,China;2.State Key Laboratory of Proteomics,Beijing Proteome Research Center,Beijing Institute of Radiation Medicine,Beijing 102206,China)
O658
A
1000-8713(2010)02-0108-07
*通讯联系人:钱小红,研究员,博士生导师.Tel:(010)80705055,E-m ail:qianxh1@yahoo.com.cn.
国家重点基础研究发展计划项目(No.2007CB914104)、国家自然科学基金项目(Nos.20735005,20635010)、国家科技重大专项项目(No.2008ZX08012-003)和国家重点实验室基金项目(2008ZX10207).
2009-12-18
DO I:10.3724/SP.J.1123.2010.00108

