表面活性剂沉淀鱼精蛋白及复溶回收过程研究
刘 琳,付朝霞,刘俊果,*,杜立业,赵紫华
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省发酵工程技术研究中心,河北 石家庄050018;3.河北科技大学科研处,河北 石家庄 050018)
表面活性剂沉淀鱼精蛋白及复溶回收过程研究
刘 琳1,2,付朝霞3,刘俊果1,2,*,杜立业1,赵紫华1
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省发酵工程技术研究中心,河北 石家庄050018;3.河北科技大学科研处,河北 石家庄 050018)
采用两种阴离子型表面活性剂:十二烷基硫酸钠(SDS)和2-乙基己基琥珀酸酯磺酸钠(AOT)沉淀鱼精蛋白并用极性有机溶剂从沉淀中复溶回收鱼精蛋白。结果表明:SDS可以完全沉淀鱼精蛋白,而表面活性剂AOT最高只能沉淀75.02%的鱼精蛋白;极性有机溶剂的种类及辅助无机盐的添加量,对从鱼精蛋白-表面活性剂难溶复合物中回收鱼精蛋白有很大的影响;对于SDS-鱼精蛋白复合物,正丙醇为最佳回收剂,鱼精蛋白最高回收率可达83.33%;对于AOT-鱼精蛋白复合物,丙酮为最佳回收剂,鱼精蛋白最高回收率达到85.71%。回收后的鱼精蛋白抗菌活性同原始鱼精蛋白相比没有明显变化。
鱼精蛋白;表面活性剂;沉淀;纯化
Abstract:The precipitation and recovery of protamine was investigated using ionic surfactants as precipitating ligands and polar organic solvents as recovery agents. Ionic surfactant such as sodium dodecyl sulfate (SDS) exhibited a complete removal of protamine; however, sodium di-(2-ethylhexyl) sulfosuccinate (AOT) exhibited only 75.02% removal of protamine. In addition,an obvious effect of organic solvent and salt amount on the recovery of protamine from its precipitate. As for SDS-protamine precipitate,n-propanol was the optimal solvent with protamine recovery rate of more than 83.33%. As for AOT-protamine precipitate, acetone was the optimal solvent with protamine recovery rate of more than 85.71%. Compared with original protamine, no significant change in antibacterial activity of recovered protamine was observed.
Key words:protamine;surfactant;precipitation;purification
从传统的观点来看,表面活性剂是一种蛋白质变性剂。然而据文献报道,用表面活性剂在一定条件下与木聚糖酶[1]、胰凝乳蛋白酶[2]、溶菌酶[3]等蛋白质形成沉淀,从而沉淀蛋白质,然后用某些有机溶剂溶解复合物,再在溶剂中添加一些无机盐,可以使蛋白质重新沉淀下来,而表面活性剂仍然溶解于有机溶剂中。采用表面活性剂沉淀法提取的蛋白质,水复溶性好,活性基本可以保持。与反胶团法萃取蛋白相比,它具有表面活性剂用量少的优点[1-4]。围绕表面活性剂沉淀法提取蛋白质的研究报道很少,尚需进一步深入。鱼精蛋白是一种富含精氨酸的碱性蛋白,相对分子质量大约在4000~10000之间,其中鲑鱼的鱼精蛋白为4070[5],而鲤鱼的鱼精蛋白大约为15320[6]。在食品工业上可以作为天然防腐剂使用[7-11],临床上可以作为胰岛素的载体,延长胰岛素的半衰期,还用于肝素注射过量引起的出血。本实验针对表面活性剂沉淀鱼精蛋白及其复溶回收过程展开研究,以探索采用表面活性剂沉淀法提取鱼精蛋白的可行性。
1 材料与方法
1.1 材料、试剂与仪器
鲑鱼硫酸鱼精蛋白 上海楷洋生物技术有限公司。
十二烷基硫酸钠(SDS,化学纯) 天津市光复精细化工研究所;2-乙基己基琥珀酸酯磺酸钠(AOT,分析纯) 美国Sigma公司。
752型紫外-可见分光光度计 上海光谱仪器有限公司;HYG-IIB型摇瓶柜 上海欣蕊自动化设备有限公司;SW-CJ-2FD型洁净工作台 苏净集团安泰公司制造;H1650型高速台式离心机 长沙湘仪离心机仪器有限公司。
1.2 方法
1.2.1 考马斯亮蓝法测定鱼精蛋白质量浓度
配制考马斯亮蓝试剂以及约0.25mg/mL鱼精蛋白溶液,按下述方法绘制标准曲线:分别取0.25mg/mL鱼精蛋白溶液0、40、80、120、160、200μL于试管中,然后加去离子水至200μL。分别加入5mL考马斯亮蓝溶液,混匀,静置10min,在595nm处比色,以吸光度为横坐标,鱼精蛋白质量浓度为纵坐标,绘制标准曲线[12]。线性回归方程为y=0.1853x-0.0046,回归系数R2为 0.9923。
1.2.2 鱼精蛋白抑菌活性的测定[13-14]
以枯草芽孢杆菌为检测菌。配制牛肉膏蛋白胨液体培养基:牛肉膏0.6g、蛋白胨2g、NaCl 1g、水200mL、调pH7.4~7.6;其固体培养基的配制:增加琼脂4g。
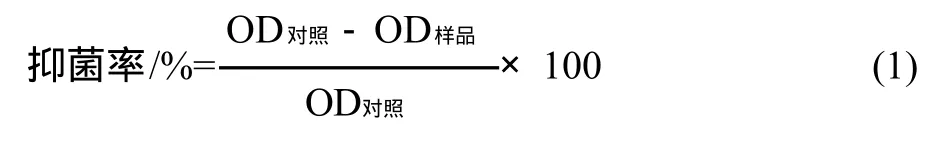
以100mL三角瓶,装入18.5mL液体培养基,加入1.5mL菌悬液(对照组为去离子水),再加入2mL蛋白质样品水溶液,混匀后在37℃恒温培养箱中以180r/min振荡培养24h。取培养液,在波长600nm处比色,以OD600nm表示细胞量[13-14]。抑菌率的计算如式(1),重复性实验结果表明抑菌率测定的相对误差为7%。
1.2.3 表面活性剂AOT、SDS沉淀鱼精蛋白
将鱼精蛋白溶于去离子水中,配成1.15mg/mL的蛋白溶液。将0.5~20mL SDS溶液(2mmol/L)或0.5~12mL AOT溶液(3mmol/L)加入到5mL蛋白溶液中,充分振荡后静置反应30min,10000r/min离心5min,收集上清液。取上清液200μL,测定鱼精蛋白的质量浓度,继而算出沉淀率。同时检测沉淀过程中pH值的变化。
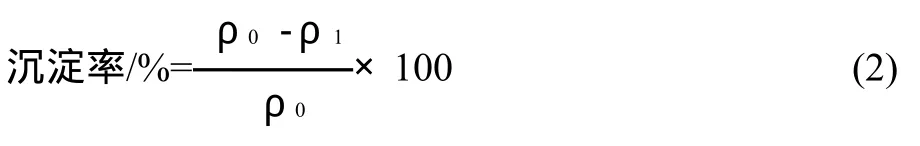
式中:ρ0为初始鱼精蛋白质量浓度;ρ1为上清液中残留的鱼精蛋白质量浓度。
1.2.4 蛋白质-表面活性剂沉淀中回收鱼精蛋白
取5mL的蛋白溶液(1.15mg/mL),加入一定体积的表面活性剂溶液,充分振荡后反应30min,于10000r/min离心5min,弃去上清液,取沉淀,加入一定体积有机溶剂(丙酮、95%乙醇或正丙醇),充分混匀,8000r/min离心10min,取上清液,加入一定量的氯化钠或硫酸钠溶液(0.1mol/L)。充分振荡反应10min,再于10000r/min离心5min,然后倒掉上清液,得沉淀即为提取后的鱼精蛋白。用去离子水将其复溶。取溶液1mL稀释适当倍数,测定鱼精蛋白质量浓度。鱼精蛋白质量浓度的测定误差约为3%,蛋白质沉淀率的误差为

1.2.5 鱼精蛋白抑菌活性回收率的测定
选取质量浓度为0.15mg/mL左右的鱼精蛋白溶液原溶液与回收溶液,测定其抑菌率。由于实验过程中回收蛋白溶液和原始鱼精蛋白溶液的体积相等,因此抑菌活性回收率的计算见式(4)。抑菌活性回收率的相对误差为

2 结果与分析
2.1 表面活性剂AOT、SDS沉淀鱼精蛋白
2.1.1 表面活性剂加入量对鱼精蛋白沉淀率的影响
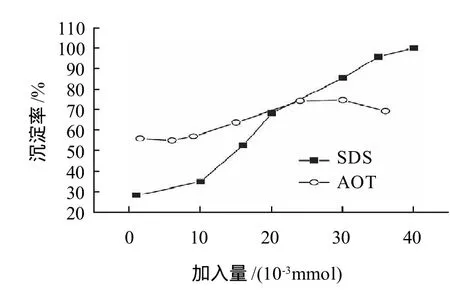
图1 SDS、AOT加入量对鱼精蛋白沉淀率的影响Fig.1 Effect of SDS/AOT ratio on precipitation of protamine
从图1可以看出,随SDS加入量的增多鱼精蛋白的沉淀率增加,并且能够达到100%;随AOT加入量的增多鱼精蛋白的沉淀率先增大然后又减小,最高沉淀率达到75.02%;较低浓度的AOT与蛋白质反应就可得到较高的沉淀率,1.5×10-3mmol AOT就可得到56.26%的沉淀率,而1.6×10-2mmol SDS才能得到53.03%的沉淀率。
分析认为,表面活性剂引起蛋白质沉淀,可能是由于当表面活性剂浓度在极低(小于0.1mmol/L)到接近CMC(临界胶团浓度)之间时,蛋白质分子结合了一定的SDS或AOT后,中和了蛋白质所带的相反符号的电荷,并同时引入了疏水链(表面活性剂的烷基链),大大降低了水化能,同时蛋白质分子上的SDS/AOT疏水基团之间存在疏水性相互作用,导致大量蛋白质相互聚集而产生沉淀[15-16]。
2.1.2 SDS、AOT加入量对鱼精蛋白溶液pH值的影响
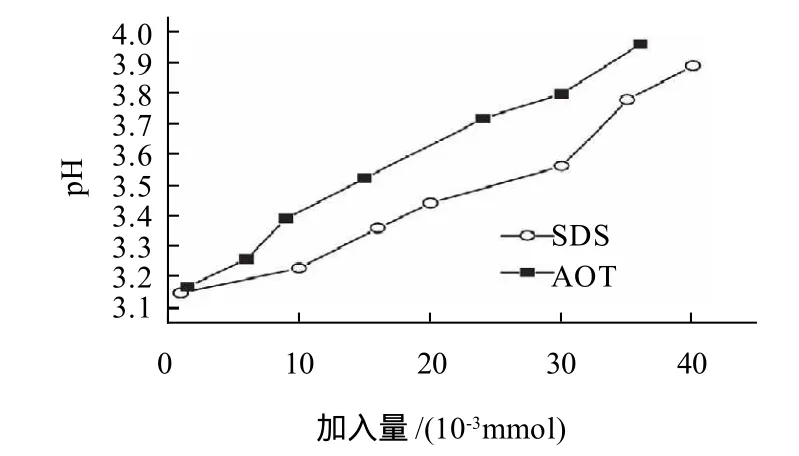
图2 SDS-AOT加入量对上清液pH值的影响Fig.2 Effect of SDS-AOT ratio on pH of supernatant after reaction
从图2可以看出,随着SDS、AOT加入量的增大沉淀量增多,上清液的pH值逐渐升高,最高达到3.89左右。
实验中使用的是硫酸鱼精蛋白,为强酸弱碱盐,其水溶液呈酸性。当只加入少量表面活性剂时溶液的pH值较小,接近3.15。随着鱼精蛋白沉淀量的增加,游离的鱼精蛋白减少,溶液的pH值也随着逐渐上升。
2.2 回收鱼精蛋白
2.2.1 不同回收剂对蛋白质回收率的影响
从SDS-鱼精蛋白难溶复合物中回收鱼精蛋白时,以正丙醇作为回收剂,将正丙醇加入到沉淀物中并充分振荡以后沉淀物完全溶解,加入NaCl后有片状悬浮物生成,离心后管底有较多沉淀物,离心除去上清液,加入水后沉淀物完全溶解;以丙酮作为回收剂,丙酮加入到沉淀物中并充分振荡以后只有少量沉淀物溶解,加入NaCl后沉淀物也无明显变化,再次离心去除丙酮加入水溶解时沉淀物还是不能完全溶解。以95%乙醇作为回收剂,乙醇加入到沉淀物中并充分振荡以后沉淀物完全溶解,加入NaCl后有微量悬浮物,离心后管底有少量沉淀物,倒去丙酮后,加入去离子水,沉淀物完全溶解;而从AOT-鱼精蛋白难溶复合物中回收鱼精蛋白,过程与前面类似,以正丙醇作为回收剂,正丙醇加入到沉淀物中并充分振荡以后沉淀物完全溶解,加入NaCl后有少量悬浮物生成,离心后管底有少量沉淀物,去正丙醇加入水后沉淀物完全溶解。以丙酮作为回收剂,丙酮加入到沉淀物中并充分振荡以后沉淀物完全溶解,加入NaCl后有片状悬浮物生成,离心后管底有较多沉淀物,去丙酮加入水后沉淀物完全溶解。
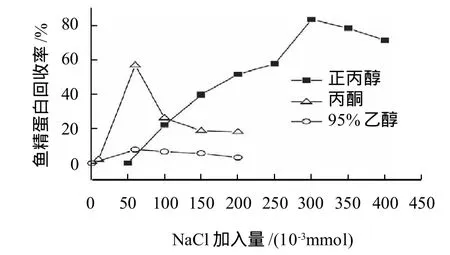
图3 回收剂种类对 SDS-鱼精蛋白难溶复合物回收率的影响Fig.3 Effect of organic solvent species on recovery rate of protamine from SDS/protamine precipitate
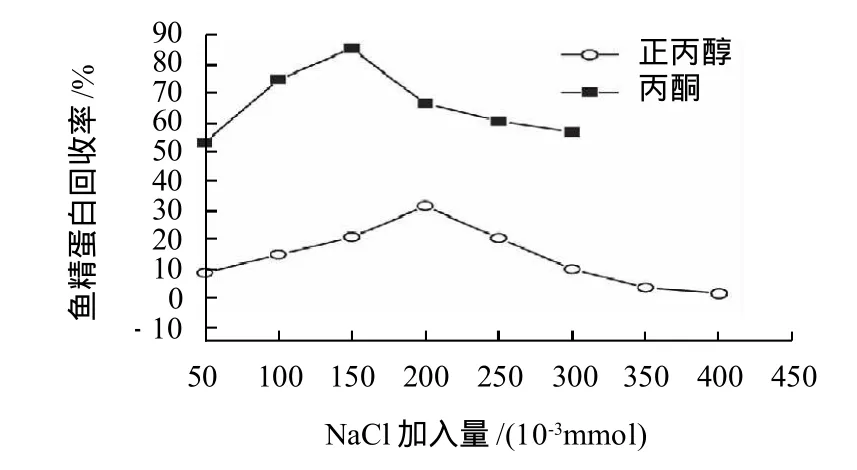
图4 回收剂种类对AOT-鱼精蛋白难溶复合物回收率的影响Fig.4 Effect of organic solvent species on recovery rate of protamine from AOT/protamine precipitate
从图3可以看出,对于SDS-鱼精蛋白难溶复合物,正丙醇为最佳回收剂,鱼精蛋白最高回收率可达83.33%;以95%乙醇作为回收剂时的回收率最高值为7.908%;丙酮作为回收剂的最高回收率也只能达到56.68%。从图4可知,对于AOT-鱼精蛋白难溶复合物,丙酮为最佳回收剂,最高回收率达到85.71%,而以正丙醇作为回收剂最高回收率只达到32.19%。辅助无机盐的添加量对蛋白质的回收有显著的影响。无机盐的加入是为了平衡有机相中的电荷,破坏难溶复合物之间的静电力,从而使蛋白与表面活性剂分离。
回收鱼精蛋白的方法是使表面活性剂-鱼精蛋白难溶复合物溶解于有机溶剂中,然后加入盐使鱼精蛋白从有机溶剂中沉淀出来,而表面活性剂留在有机相中。沉淀出来的蛋白质很容易通过过滤或离心从有机相中分离,而表面活性剂通过简单的蒸馏就可回收[2]。当SDS溶液加入到鱼精蛋白溶液中并充分振荡后溶液出现乳白色沉淀;随SDS加入量的增加乳白色沉淀增加,溶液的乳白色减弱,溶液越来越澄清透明。而AOT加入到鱼精蛋白溶液中并充分振荡后溶液中出现的沉淀量较少,随AOT加入量的增多沉淀量也随之增加。实验中发现,当用丙酮作为回收剂时,SDS-鱼精蛋白难溶复合物不能完全溶解于丙酮中;换用95%乙醇做回收剂,虽能够完全溶解难溶复合物,但加入盐离心后只有微量鱼精蛋白析出;正丙醇既能完全溶解难溶复合物,加盐离心后也能使鱼精蛋白分离出来;丙酮可像正丙醇那样使AOT-鱼精蛋白难溶复合物完全溶解,然而,加入盐后鱼精蛋白更容易从丙酮中析出。因此,作为SDS-鱼精蛋白难溶复合物最好的回收剂是正丙醇,而作为AOT-鱼精蛋白难溶复合物最好的回收剂是丙酮。
2.2.2 回收剂中加入不同种类的盐对蛋白回收率的影响
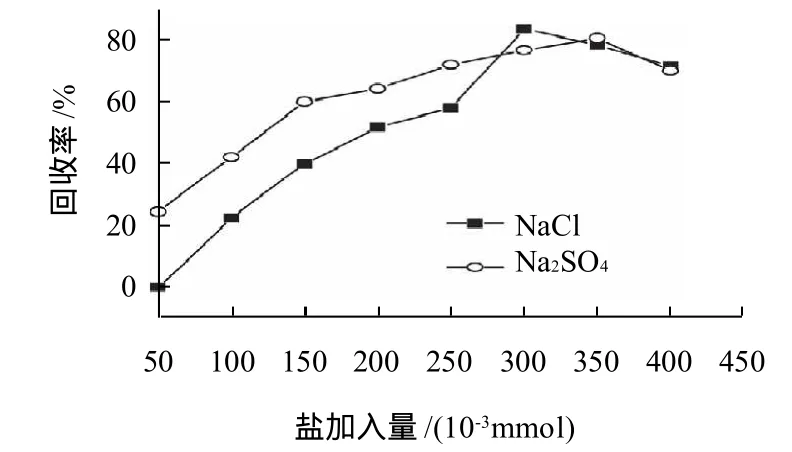
图5 不同盐对SDS-鱼精蛋白难溶复合物中鱼精蛋白回收率的影响Fig.5 Effect of salt on recovery rate of recovery rate of protamine from SDS/protamine precipitate
从经济角度考虑,国内少有AOT,故使用SDS表面活性剂沉淀鱼精蛋白。由图5可知,无论使用氯化钠还是硫酸钠都可使回收率达到80%以上,对鱼精蛋白回收率的影响相差不大。随盐加入量的增多回收率升高,当加入0.30mmol的盐溶液时,回收率最高,继续提高加盐量,会导致鱼精蛋白回收率下降。
2.2.3 回收后鱼精蛋白抑菌活性测定
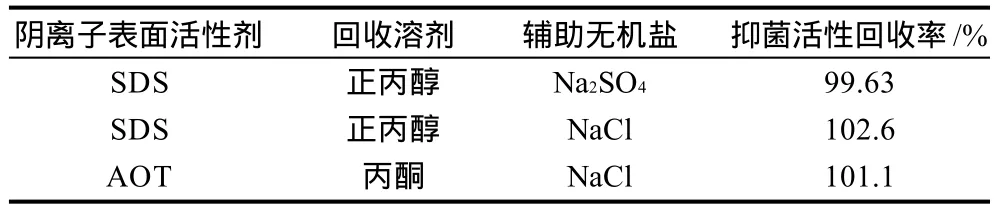
表1 鱼精蛋白抑菌活性回收率Table 1 Antibacterial activity of recovered protamine studied using various organic solvents
表1是3种不同方式制得3种蛋白回收液与原蛋白溶液的抑菌活性比较,考虑到抑菌活性回收率的相对误差为9.8%左右,而3种鱼精蛋白回收液的极差为3%,所以认为回收后的蛋白质抑菌活性与初始的鱼精蛋白相比没有明显变化。
3 结 论
研究SDS、AOT沉淀鱼精蛋白的效果,并用极性有机溶剂从沉淀中复溶回收鱼精蛋白。结果表明:SDS可以完全沉淀鱼精蛋白,而表面活性剂AOT最大只能沉淀75.02%的鱼精蛋白。极性有机溶剂的种类及辅助无机盐的添加量,对从鱼精蛋白-表面活性剂难溶难溶复合物中回收鱼精蛋白有很大的影响。对于SDS-鱼精蛋白难溶复合物,正丙醇为最佳回收剂,鱼精蛋白最高回收率可达83.33%。对于AOT-鱼精蛋白难溶复合物,丙酮为最佳回收剂,鱼精蛋白最高回收率达到85.71%。回收后的鱼精蛋白抗菌活性同原始鱼精蛋白相比,没有明显变化。这些结果说明,采用表面活性剂沉淀提取鱼精蛋白从技术角度是完全可行的。以此为基础,本实验室将进一步研究采用表面活性剂沉淀法从鲤鱼鱼精蛋白粗提液中纯化提取鱼精蛋白。
[1] SHIN Y O, WAHNON D, WEBER E M, et al. Selective precipitation and recovery of xylanase using surfactant and organic solvent[J]. Biotechnology and Bioengineering, 2004, 86(6):698-704.
[2] SHIN Y O, RODIL E, VERA J H. Surfactant precipitation and polar solvent recovery ofα-chymotrypsin and ribonuclease-A[J]. Biochemical Engineering Journal, 2004, 17(2):91-97.
[3] SHIN Y O, WEBER M E, VERA J H. Reverse micellar extraction and precipition of lysozyme using sodium di (2-ethylhexyl) sulfosuccinate[J]. Biotechnol Progress, 2003, 19(3):928-935.
[4] 刘俊果, 刑建民, 畅天狮, 等. 反胶团萃取分离纯化纳豆激酶[J]. 科学通报, 2006, 51(2):133-137.
[5] JOAN CALLANAN M, CARROLL W R, MITCHELL E R. Physical and chemical properties of protamine from the sperm of salmon(Oncorhynchus tschawytscha).Ⅱ. preparation and characterization[J].Journal of Biological Chemistry, 1957, 229:279-287.
[6] 徐明生, 陈锦屏, 上官新晨. 鲤鱼抗菌精蛋白的分离纯化及鉴定[J].食品工业科技, 2004, 25(10):51-54.
[7] GILL T A, SINGER D S, THOMPSON J W. Purification and analysis of protamine[J]. Process Biochemistry, 2006, 41(8):1875-1882.
[8] 李燕, 汪之和, 王麟, 等. 鱿鱼鱼精蛋白的抑菌作用及在保鲜中的应用[J]. 食品科学, 2004, 25(10):80-84.
[9] 王陆玲, 金明晓, 韩红梅, 等. 鱼精蛋白抑菌效果及在肠肉制品中的应用研究[J]. 食品科学, 2007, 28(12):215-217.
[10] 刘红玉, 姜学芬, 崔洪斌. 大马哈鱼鱼精蛋白的提取及抑菌作用的研究[J]. 食品科学, 2007, 28(2):37-39.
[11] POTTER R, TRUELSTRUP H L, GILL T A. Inhibition of foodborne bacteria by native and modified protamine:importance of electrostatic interactions[J]. Food Microbiol, 2005, 103(1):23-34.
[12] CHAN J K, THOMPSON J W, GILL T A. Quantitative determination of protamines by coomassie blue G assay[J]. Anal Biochem, 1995, 226(1):191-193.
[13] 赵利, 谢俊杰, 黄梅芳, 等. 鱼精蛋白的提取及抑菌作用初探[J]. 江西农业大学学报, 1999, 21(4):543-545.
[14] 杜荣茂, 詹太华. 鱼精蛋白抗菌特性及毒性[J]. 食品工业, 2003(3):11-13.
[15] 李学刚, 董佳里. 蛋白质吸附表面活性剂的两种测定法研究[J]. 西南农业大学学报, 1997, 19(1):6-9.
[16] 刘静, 徐桂英. 表面活性剂与蛋白质相互作用的研究进展[J]. 日用化学工艺, 2003, 33(1):29-32.
Surfactant Precipitation and Recovery of Protamine
LIU Lin1,2,FU Zhao-xia3,LIU Jun-guo1,2,*,DU Li-ye1,ZHAO Zi-hua1
(1. College of Bioscience and Bioengineering, Hebei University of Science and Technology, Shijiazhuang 050018, China;2. R&D Center for Fermentation Engineering of Hebei Province, Shijiazhuang 050018, China;3. Department of Scientific Research, Hebei University of Science and Technology, Shijiazhuang 050018, China)
TQ932
A
1002-6630(2010)13-0056-04
2009-11-12
河北省教育科学研究计划项目(2006315);河北科技大学学科建设项目(2006JC-13)
刘琳(1982—),男,硕士研究生,研究方向为生物分离工程。E-mail:lll3316693@163.com
*通信作者:刘俊果(1968—),女,副教授,博士,研究方向为生物分离工程。E-mail:happyliu1997@yahoo.com.cn

