可降解L-苹果酸和柠檬酸菌株的筛选及鉴定
王立芳,张 微,文连奎*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
可降解L-苹果酸和柠檬酸菌株的筛选及鉴定
王立芳,张 微,文连奎*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
从葡萄园土壤中分离得到一株可降解L-苹果酸和柠檬酸的菌株,通过对其进行降酸能力实验,测得该菌株对12g/L的L-苹果酸和柠檬酸的降解率分别达到93.17%和92.08%。对菌株进行形态学、生理生化鉴定及rDNA-ITS(internal transcribed spacer,内转录间隔区)序列分析,鉴定该菌株为伊萨酵母属(Issatchenkia)陆生伊萨酵母种(I.terricola)。对其生物学特性进行研究,发现其最适生长温度为30℃,最适生长pH值为2.0~5.5。经传代培养10代,其降酸性能和生长特性仍较稳定。
降解;L-苹果酸;柠檬酸;筛选;鉴定
Abstract:A strain (named S8) degrading bothL-malic acid and critic acid was isolated from the soil of the wineyard in Jilin Agricultural University. The abilities of this strain to degrading 12 g/LL-malic acid and critic acid solutions were measured, and deacidification rate was 93.17% forL-malic acid and 92.08% for critic acid. Based on the morphological, physiological and biochemical identification and the rDNA-ITS (internal transcribed spacer) sequence analysis, this stain was classified asIssatchenkia terricola. The investigation of its biological characteristics showed that the optimal temperature and pH for its growth were 30 ℃ and 2.0-5.5, respectively. After passaging of 10 generations, the acid-degrading ability and growth characteristics of this strain were still stable.
Key words:degradation;L-malic acid;critic acid;screening;identification
L-苹果酸又名L-2-羟基丁二酸,主要存在于苹果、葡萄和不成熟的山楂等果实中[1];柠檬酸又名枸橼酸,主要存在于柠檬、柑橘、菠萝、山楂等果实中[2];目前均在食品、化妆品、医疗等领域[3-4]广泛应用。但是用含酸量高的果实生产的果酒会有酸涩感、品质下降[5-7];此外,L-苹果酸和柠檬酸生产企业排放的废弃物酸度太高,对环境造成了严重污染,必须进行降酸才能达到国家规定的排放标准[8],因此,在实际生产中对L-苹果酸和柠檬酸进行降解具有重要意义。
目前关于苹果酸降酸微生物的报道主要是粟酒裂殖酵母和乳酸菌。粟酒裂殖酵母发酵能力较弱,且会产生不良气味[9]。苹果酸-乳酸发酵在实际生产中操作不易控制,且乳酸菌易引起果酒的多种病害[10]。近年来,科学家致力于降酸基因克隆方面的研究[11-12],取得了很大成就,但仍有不少问题有待于进一步研究。利用微生物降解柠檬酸的报道还很少,赵玉平等[13]以柠檬酸为唯一碳源,筛选到一株能有效降解山楂汁中柠檬酸的菌株。在目前的研究中,尚未见报道能同时对L-苹果酸和柠檬酸进行降解的微生物,本研究从葡萄园土壤中筛选既能降解L-苹果酸又能降解柠檬酸的菌株,旨在为L-苹果酸或柠檬酸的降解提供指导。
1 材料与方法
1.1 材料与试剂
1.1.1 采样
土壤样品取自吉林农业大学葡萄园。
1.1.2 培养基
富集培养基(WL营养培养基):酵母浸粉0.4g、胰蛋白胨 0.5g、KH2PO40.055g、KCl 0.0425g、无水CaCl20.0125g、FeCl30.00025g、MgSO40.0125g、MnSO40.00025g、L-苹果酸按需加入,蒸馏水100mL;分离培养基(WL营养琼脂培养基):酵母浸粉0.4g、胰蛋白胨0.5g、KH2PO40.055g、KCl 0.0425g、无水CaCl20.0125g、FeCl30.00025g、MgSO40.0125g、MnSO40.00025 g、琼脂2g、L-苹果酸按需加入,蒸馏水100mL,L-苹果酸配成溶液与其他培养液分别灭菌后混合倒平板;保藏培养基:YPD培养基;菌落形态观察用培养基:PDA培养基;生理生化鉴定用各培养基均参考文献[14]方法制备。
1.1.3 试剂及试剂盒
L-苹果酸(分析纯) Bio Basic 公司;柠檬酸(分析纯)北京北化精细化学品有限责任公司;AxyPrep基因组DNA小量抽提试剂盒 爱思进生物技术有限公司;DNA MarkerDL2000、引物ITS1和ITS4、即用PCR扩增试剂盒、UNIQ-10柱式PCR产物回收试剂盒 上海生工生物工程服务有限公司。
1.2 方法
1.2.1 降酸菌的筛选与分离
富集:将土壤加入无菌生理盐水充分振荡,取适量静置后的上清液加入到以L-苹果酸为唯一碳源的富集培养基中,30℃,150r/min培养24h后,移取适量菌液转接入L-苹果酸质量浓度4g/L新鲜富集培养基中培养,连续转接5次,同时L-苹果酸质量浓度由4、6、8、10g/L逐渐递增到12g/L。
筛选:取适量富集菌液,用无菌生理盐水进行梯度稀释,选择10-4、10-5、10-6三个稀释度,分别吸取50μL稀释液涂布于L-苹果酸质量浓度为 12g/L的分离平板培养基上,每个稀释度涂布3个平板,30℃倒置培养48h。
分离纯化:将筛选得到的单菌落用涂布平板法进行多次分离纯化,获得的纯化菌株再分别接种到以柠檬酸为唯一碳源的WL培养基中培养,测定各菌株对柠檬酸的降解能力。经10次传代培养后,测定其对L-苹果酸和柠檬酸降解的稳定性。
酸度测定采用高效液相色谱法[15],降酸率以L-苹果酸或柠檬酸降酸前后的质量浓度差与降酸前质量浓度的百分比表示。
1.2.2 降酸菌的形态及生理生化鉴定
对菌株进行形态学观察及生理生化鉴定,具体方法参照《真菌鉴定手册》[16]。
1.2.3 降酸菌的分子生物学鉴定
参照文献[17]方法对菌株的5.8S rDNA-ITS序列进行分析。
1.2.3.1 总DNA提取
利用AxyPrep基因组DNA小量抽提试剂盒进行总DNA的提取。
1.2.3.2 PCR扩增
5.8 S rDNA-ITS序列扩增引物采用真菌通用引物[18],上游引物为ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,下游引物为ITS4:5′-TCCTCCGCTTATTGATATGC-3′。PCR反应体系为:双蒸水22μL,2×PCR Master 25μL,引物ITS1 和ITS4(20μmol/L)各1μL,模板DNA 1μL。扩增条件:94℃ 10min;94℃ 30s,55℃ 30s,72℃1min,30个循环;72℃延伸10min。
1.2.3.3 PCR产物检测、纯化与测序
扩增完毕后,取5μL的PCR产物与1μL 6×Loading buffer混合,加样于1.0%的琼脂糖凝胶点样孔中进行电泳。电泳后,在紫外透射仪下进行检测,若扩增成功,则有亮带出现。产物经UNIQ-10柱式回收试剂盒回收纯化后由上海生工生物工程服务有限公司完成测序。
1.2.3.4 同源性分析
将ITS序列与Genbank中核酸数据库(http://www.ncbi.nlm.nih.gov/blast)进行Blast比对分析,找出与目的基因序列同源性最高的菌株,确定菌株的种类。
1.2.4 降酸菌的生长特性
用WL培养基,设置不同水平的温度(24~34℃,pH5.0)、pH值(1.5~6.0,最适温度),于150r/min振荡培养48h。通过测定培养液的OD600nm值,分析两因素对菌株生长的影响。经传代培养10代后,以同样方法测定其生长特性的稳定性。
2 结果与分析
2.1 降酸菌的降酸能力
将分离纯化得到的菌株进行降酸能力实验,得到一株对L-苹果酸和柠檬酸降解能力都很强的菌株,命名为S8。以1%的接种量将菌浓度为2×107CFU/mL的S8菌株依次接种于含有4、6、8、10、12、14、16、18、20g/L的L-苹果酸(柠檬酸)为唯一碳源的WL营养培养基中,150r/min振荡培养48h后测定其对不同质量浓度L-苹果酸(柠檬酸)的降解率,结果如图1所示。
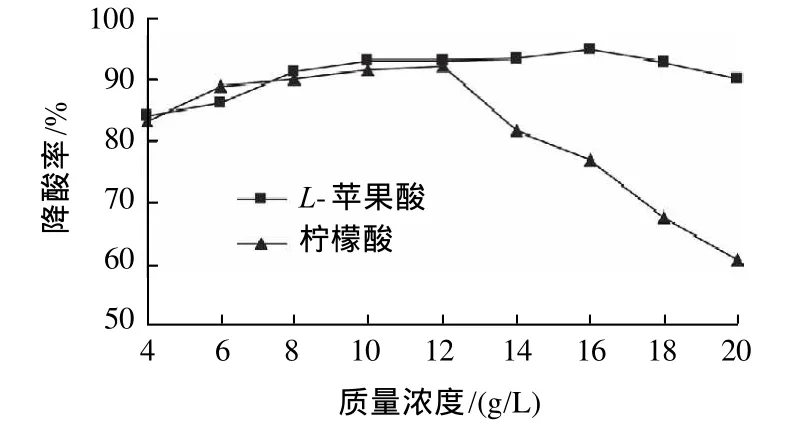
图1 菌株对不同质量浓度L-苹果酸和柠檬酸的降解率Fig.1 Degradation rates of strain S8 to different concentrations ofL-malic acid and critic acid
由图1可见,在4~12g/L范围内,菌株对L-苹果酸和柠檬酸的降解能力相差不大;当超过12g/L时,菌株对L-苹果酸的降解能力变化不大,但对柠檬酸的降解能力却明显减弱,这说明柠檬酸质量浓度大于12g/L时,已不利于降酸酶发挥作用,L-苹果酸则对其影响不大。菌株对12g/L的L-苹果酸和柠檬酸的降解率分別达到93.17%和92.08%,其对12g/L以下的柠檬酸和20g/L以下的L-苹果酸降解率均达80%以上。经传代培养10代后,测得其降酸性能仍较稳定。
2.2 降酸菌的形态及生理生化特性鉴定
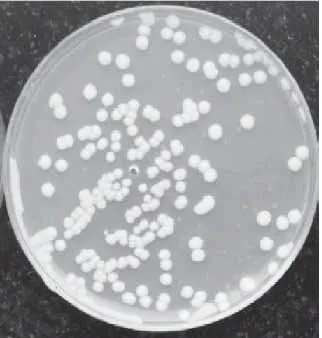
图2 S8菌株在PDA培养基上的菌落形态Fig.2 Colony morphology of strain S8 cultured on PDA medium
菌株在马铃薯琼脂培养基上的形态如图2所示,菌落为乳白色,呈圆形,大而厚,菌落质地均匀,表面光滑、湿润、黏稠,容易挑起,边缘整齐,中间稍微凸起,不透明,有面包发酵气味。细胞形态如图3所示:细胞呈椭圆形,繁殖方式为多边出芽生殖。
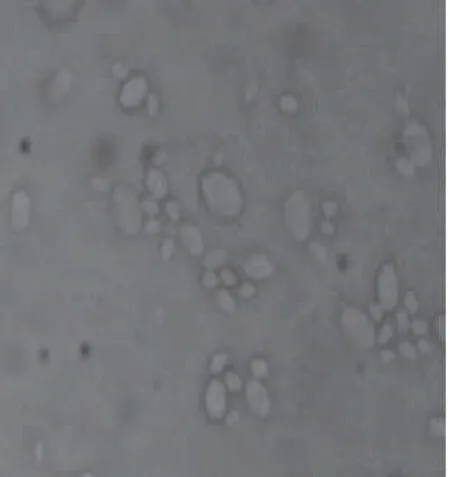
图3 细胞形态观察(×400)Fig.3 Cell morphology of strain S8 (×400)

表1 生理生化实验结果Table 1 Physiological and bicochemical properties of strain S8
对S8菌株进行生理生化实验,结果如表1所示。菌株发酵葡萄糖既产酸又产气,发酵D-木糖、乳糖只产酸不产气,发酵甘露醇既不产酸也不产气,能利用油脂、柠檬酸盐、硝酸盐,具有H2O2活性,不能水解淀粉,不能液化明胶,分解葡萄糖不产生有机酸和乙酰甲基甲醇,不能分解色氨酸产生吲哚,对氨基酸没有脱氨和脱羧作用,分解含硫氨基酸或无机硫化物不释放SO2,不具有氧化酶活性。参照《酵母菌的特征与鉴定手册》[19],S8菌株的形态特征和生理生化特征与陆生伊萨酵母(I.terricola)几乎完全相同。
2.3 分子生物学鉴定
2.3.1 PCR产物检测与序列测定

图4 菌株PCR产物电泳图Fig.4 Agarose gel electropherogram of PCR product of strain S8
将纯化后的PCR扩增产物进行电泳,在紫外灯照射下观察结果如图4所示,样品条带出现在250bp和500bp之间,大小为400bp左右。
2.3.2 同源性分析
将菌株的5.8S rDNA-ITS序列与GenBank中的核酸数据库(http://www.ncbi.nlm.nih.gov/blast)进行Blast比对分析,同源性超过99%的菌株如表2所示。

表2 5.8S rDNA-ITS序列基因组相似菌株Table 2 Analysis of homology amongIssatchenkiastrains based on 5.8S rDNA-ITS sequence
由表2可见,与菌株同源性超过99%的菌株均为陆生伊萨酵母(Issatchenkia terricola),由此鉴定S8菌株为伊萨酵母属(Issatchenkia)陆生伊萨酵母种(I. terricola)(Genbank登录号为HM355830)。
2.4 降酸菌的生长特性
2.4.1 最适生长温度
由图5可知,培养温度在26~34℃时,S8菌株均可生长,但30℃时菌体生物量最大,因此选择30℃为S8菌株的最适生长温度。

图5 培养温度对菌株生长的影响Fig.5 Effect of culture temperature on growth of strain S8
2.4.2 最适生长pH值

图6 培养液pH值对菌株生长的影响Fig.6 Effect of medium pH on growth of strain S8
由图6可知,在pH2~5.5范围内菌体数量较多且相差不大,而在pH<2和pH>5.5时菌体数量均开始减少,因此选择最适生长pH值为2~5.5。经10次传代培养后,其生长特性仍较稳定。
3 结 论
经过富集、筛选、分离纯化,得到一株既能降解L-苹果酸又能降解柠檬酸的菌株,对其进行形态学、生理生化特征及5.8S rDNA-ITS序列分析,鉴定该菌株为伊萨酵母属(Issatchenkia)陆生伊萨酵母种(I. terricola)。通过降酸能力测定,其对12g/L以下的柠檬酸和20g/L以下的L-苹果酸降解率均达80%以上。对该菌株生物学特性进行初步研究,其最适生长温度为30℃,最适生长pH值为2.0~5.5。
[1] SWEETMAN C, DELUC L G, CRAMER G R, et al. Regulation of malate metabolism in grape berry and other developing fruits[J].Phytochemistry, 2009, 70(11/12):1329-1344.
[2] POPOVA T N, PINHEIRO de CARVALHO M A. Citrate and isocitrate in plant metabolism[J]. Biochimica et Biophysica Acta, 1998, 1364(3):307-325.
[3] SOO Y M, SOON H H, TAE Y K, et al. Metabolic engineering ofEscherichia colifor the production of malic acid[J]. Biochemical Engineering Journal, 2008, 40(2):312-320.
[4] 吴军林, 吴清平, 张菊梅.L-苹果酸的生理功能研究进展[J]. 食品科学, 2008, 29(11):692-695.
[5] REDZEPOVIC S, ORLIC S, MAJDAK A, et al. Differential malic acid degradation by selected strains ofSaccharomycesduring alcoholic fermentation[J]. International Journal of Food Microbiology, 2003, 83(1):49-61.
[6] HUSNIK J I, VOLSCHENK H, BAUER J, et al. Metabolic engineering of malolactic wine yeast[J]. Metabolic Engineering, 2006, 8(4):315-323.
[7] VOLSCHENK H, VILJOEN M, GROBLER J, et al. Engineering pathways for malate degradation inSaccharomyces cerevisiae[J]. Nature Biotechnology, 1997, 15:253-257.
[8] 高卫卫, 杜金华, 韩伟, 等. 产朊假丝酵母利用有机酸的研究[J]. 食品与发酵工业, 2008, 34(12):117-121.
[9] 刘延琳, 蒋思欣, 李华, 等. 苹果酸-乳酸发酵基因的克隆及其在酵母中的表达[J]. 中国生物工程杂志, 2003, 23(5):27-30.
[10] LIU S Q. A review:Malolactic fermentation in wine-beyond deacidification[J]. Journal of Applied Microbiology, 2002, 92:589-601.
[11] BAUER R, VOLSCHENK H, DICKS L M T. Cloning and expression of the malolactic gene ofPediococcus damnosusNCFB1832 inSaccharomyces cerevisiae[J]. Journal of Biotechnology, 2005, 118(4):353-362.
[12] LIU Yanlin, LI Hua. Intergrated expression of theOenococcus oeni mleAgene inSaccharomyces cerevisiae[J]. Agricultural Sciences in China,2009, 8(7):821-827.
[13] 赵玉平, 杜连祥, 刘丽丽, 等. 降解山楂汁中柠檬酸酵母菌的筛选及其降解特性研究[J]. 微生物学报, 2004, 44(2):235-239.
[14] 刘慧. 现代食品微生物学实验技术[M]. 北京:中国轻工业出版社,2006:268-271.
[15] 冯德明, 张洋, 赵惠明, 等. 反相高效液相色谱法测定黄酒中的有机酸[J]. 中国酿造, 2009(3):157-161.
[16] 魏景超. 真菌鉴定手册[M]. 北京:科学出版社, 1979:129-136.
[17] 燕勇, 李卫平, 高雯洁, 等. rDNA-ITS序列分析在真菌鉴定中的应用[J]. 中国卫生检验杂志, 2008, 18(10):1958-1961.
[18] WHITE T J, BRUNS T, LEE S. Analysis of phylogenetic relationships by amplification and direct sequencing of ribosomal RNA genes[M]//INNIS M A, GELFAND D H, SNINSKY J J, et al. PCR protocols:A guide to methods and applications. NewYork: Academic, 1990:15-22.
[19] BAMETT J A, PAYNE R W, YARROW D. 酵母菌的特征与鉴定手册[M]. 胡瑞卿, 译. 青岛:青岛海洋大学出版社, 1991:61.
Screening and Identification of a Strain DegradingL-Malic Acid and Critic Acid
WANG Li-fang,ZHANG Wei,WEN Lian-kui*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Q93.331
A
1002-6630(2010)21-0279-04
2010-07-05
吉林省科技厅重点项目(20090228)
王立芳(1984—),女,硕士研究生,主要从事食品微生物及生物技术研究。E-mail:lifang9110@163.com
*通信作者:文连奎(1962—),男,教授,博士,主要从事长白山野生资源的开发利用研究。E-mail:wenliankui@163.com

