食品与机体中的移动通讯网络
庞广昌,陈庆森,胡志和,谢军波
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
食品与机体中的移动通讯网络
庞广昌,陈庆森,胡志和,谢军波
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
在总结近年来有关食品胃肠黏膜信号通路研究的基础上,根据现代免疫学的研究成果,提出机体中存在着移动细胞之间的通讯网络的假说,该假说认为:细胞因子网络实际上就是移动通讯网络的信号传递系统;机体中的移动细胞可以依赖细胞因子,通过自分泌、旁分泌进行局部通讯;通过内分泌进行远距离全局性通讯;通过和固定细胞之间的信号交流和胃肠道黏膜、神经内分泌系统进行高密度的通讯联系,从而形成一个“无线”和“有线”之间相互协调的通讯网络;在这个通讯网络中,细胞通过受体及其信号传递、级联放大系统接受并通过基因表达与调控定量放大这些细胞信号,从而发挥生命活动;而细胞因子和趋化因子等信号分子则通过循环系统在固定和移动细胞之间传递信号,分子之间互不干涉,在极低的浓度下通过相应的细胞发挥通讯媒体的作用。作者通过研究发现:功能性食品正是通过改变这个复杂的通讯网络发挥其生物功能。这一理论和研究方法的建立将有可能从根本上改变功能性食品如何发挥生物功能的评价方法和标准。
细胞通讯;细胞因子网络;趋化因子;无线通讯网络;功能性食品
Abstract:A new hypothesis of cellular wireless communication networks was proposed on the basis of current research achievements in the field of immunology, which were summarized from gastrointestinal mucous receptor pathways of foods. In this hypothesis, cytokine network was a signal transduction system during cell communications. The cells especially for leukocytes can communicate with each other in networks by a manner of paracrine or autocrine. In addition, the cells can also execute long-distance whole communication through the autocrine mode. A coordinated communication network between wireless and wire communications was established through cellular communication between gastrointestinal mucous and neuroendocrine system. In this communication network, cells accepted gene expression and quantitative regulation of cellular signal amplification through receptors, signal transduction and cascade system. However, the cytokine and chemokine can accomplish the signal transduction through circulatory system among cells without mutual interference even at the condition of low concentration. Functional foods can change the complex communication networks to realize their biological functions. Therefore,the establishment of this theory and research method will have the potential to alter functional foods.
Key words:cell communication;cytokine network;chemokine;wireless communication network;functional food
神经网络是人类发现最早的有线通讯网络,已经得到了充分研究与关注,并取得了举世瞩目的进展。但是,机体中存在着大量不断移动的细胞,如红细胞、白细胞等。它们在心脏的不断跳动和驱动下周而复始、川流不息,执行着重要的营养和氧气运输、免疫防御、维护机体自身稳定、能量供给与氧化还原平衡、代谢网络调控、“吐故纳新”等重要的基础生命活动。显然,复杂的基础生命活动需要一个复杂的通讯网络,而这个网络难以仅仅通过神经网络来完成,原因很简单:它们是不断移动的细胞系统!不论从哪个角度来判断,该循环系统的细胞之间,以及这些细胞和固定的细胞之间,必定存在着一个复杂的无线(移动)通讯网络。而且这个通讯网络和神经网络交织在一起形成机体复杂而协调的整体通讯系统。
1 细胞因子网络构成了移动细胞(及其与固定细胞)的通讯网络
干扰素和细胞因子(cytokine,CK)的发现,使科学家意识到生命系统中存在着一系列小分子质量的蛋白质,它们在机体的免疫防御和细胞活性调节中发挥重要作用。特别是科学家在面对病毒束手无策时,发现了干扰素,它能在病毒入侵时诱导细胞合成、分泌并作用于其他细胞,从而干扰病毒在细胞中的繁殖。与此同时,科学家还发现干扰素对多种肿瘤也具有抑制作用。于是细胞因子的发现与研究成了免疫学、细胞的分子生物学和生物制品学研究的焦点。
然而,另一方面科学家也发现,细胞因子的作用似乎十分复杂,往往一种细胞因子具有相当多的生物活性,而且新的活性还在不断被发现,可以毫不夸张地说:一种细胞因子的生物功能可以用数万字来描述。甚至有些细胞因子的生物活性似乎存在着自相矛盾,例如白细胞介素-6,它既是一种重要的炎症细胞因子,又似乎具有抗炎症作用。所以有人提出了细胞因子网络的概念:亦即:细胞因子通过诱导自身的合成和抑制、或者其他细胞因子的合成和抑制、或者其受体拮抗和协同作用,从而构成一个由自分泌、旁分泌和内分泌相互协调的网络,进行极其复杂的调节作用。
关于细胞因子网络的描述是从何时开始的?有谁提出来的却很少有人提及。根据目前所查阅的资料,至少在2000年就有人使用“细胞因子网络(cytokine network)”一词[1]。但是,胞因子如果离开细胞是不可能构成网络的。因为构成网络的要素是:一种细胞因子必须和两种以上的细胞因子相互作用;同时,也必须两种细胞因子同时可作用于一种细胞因子。细胞因子之间是不能直接进行相互作用的,只能通过细胞表面的受体,通过细胞的信号放大作用,然后产生细胞之间的相互作用。很显然,细胞因子本身不能构成网络,或者说细胞因子只能通过细胞构成细胞之间的通讯网络。因此,细胞因子网络,实际上是指细胞通过细胞因子形成的通讯网络。这个网络的主体是细胞而不是细胞因子,细胞因子只是细胞通讯网络的介导者或者信号分子。
已经发现了数以百计的细胞因子,其特点是:绝大多数CK为低分子质量糖蛋白,以单体形式存在;常以旁分泌或自分泌形式作用于邻近细胞或细胞自身;多种细胞都有产生CK的能力,如活化的免疫细胞、基质细胞和某些肿瘤细胞等;CK作用的多向性,即一种细胞可产生多种CK,而一种CK又可由多种细胞产生;CK的功能没有特异性,也不受MHC的限制;功能的高效性,即在pmol/L的水平就能发挥作用;多效性,即一种CK可作用于多种细胞,产生多种效应;重叠性,即多种CK可对同一细胞产生相同或相似的效应,而且发现这些细胞因子通过多种细胞的自分泌、旁分泌和内分泌构成一个复杂的网络,虽然不知从何时开始,人们已经称此网络为细胞因子网络,但是事实上,根本不存在一个离开细胞而独立存在的所谓细胞因子网络,这一点从细胞因子的功能和属性不难看出,所以应该称此为细胞通讯网络,细胞因子通过机体循环构成了细胞通讯网络的信号传递系统。随着有关细胞因子研究的不断拓展,使相关的数据库得到了极大的丰富,这不仅为相关的研究提供了分子生物学基础,也为生物医药研究、应用与开发开辟了极其广阔的空间。
根据目前的研究报道,最早对这个以细胞因子作为信号分子所形成的细胞通讯网络进行建模和分析的是Frankenstein等[2],他们通过对细胞因子的数据库进行查询与分析,建立起一个复杂的细胞通讯网络如图1所示。

图1 细胞通讯网络Fig.1 Cell communication network
根据目前所公布的网的密度(前14名),免疫细胞之间通过细胞因子所形成的通讯网络的密度达到0.61,比猴脑的神经通讯密度0.15高得多,见表1。
从表1可见,和当今社会中的通讯一样,移动通讯的密度和地位必然大于固定(有线)通讯,笔者所在实验室研究认为:在机体中,尽管在固定细胞之间由神经纤维构成了复杂的神经网络,但是其对机体的作用还是明显小于由细胞因子所构成的移动通讯网络,甚至小于由细胞因子所构成的移动细胞和固定细胞之间的通讯网络。而且还应该注意到,细胞因子不仅构成了移动细胞之间的通讯网络,而且也构成了移动细胞和固定细胞之间的通讯联系。换言之,实际上细胞的自分泌、旁分泌和内分泌以细胞因子、趋化因子和激素为信号分子,在构成移动细胞之间的“无线”通讯网络的同时,也和固定细胞以神经纤维构成的“有线”通讯网之间相互连接和协调,从而构成了整个机体复杂而协调的通讯网络如图2所示。

表1 目前所公布的网的密度(前14名)Table 1 The first 14 communication densities in published networks

图2 机体移动通讯和有线通讯之间的交互接入示意图Fig.2 Input points of wire and wireless communications
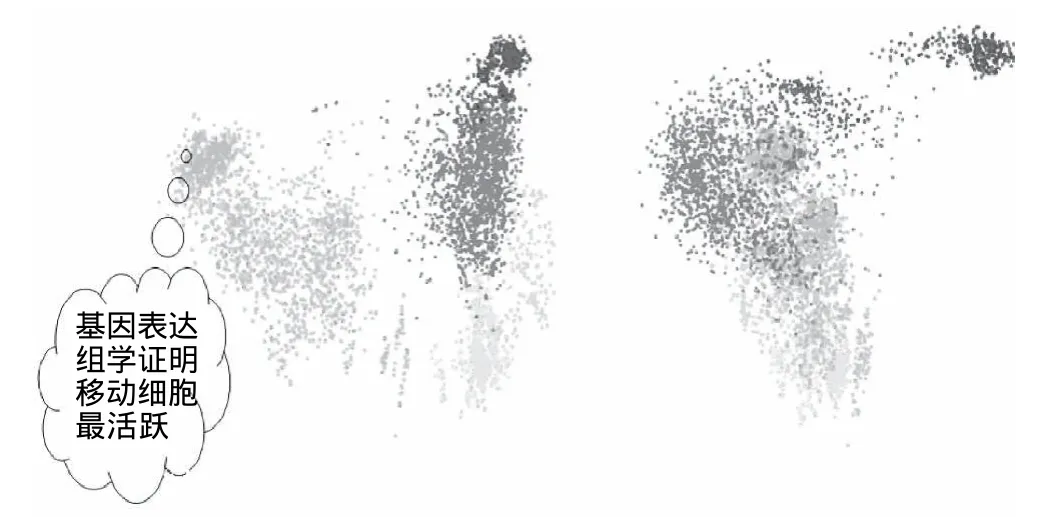
图3 基因表达组点状图Fig.3 Dot map of gene expression
如图3所示,基因表达组学证明:血液发生系统的细胞基因组表达最为活跃。图中绿色点所示血液发生的细胞;固相组织用红色点所示;黄色为细胞系;淡蓝色为未完全分化的细胞;深蓝色是肌肉组织;红色为脑组织。
2 移动细胞定向移动的动力学及其分子基础
除细胞因子网络构成了移动细胞的通讯网络之外,当免疫细胞遭遇入侵、自身突变、衰老和损伤细胞时如何通过旁分泌和内分泌与其周围和远程细胞进行通讯,又是通过一个什么样的分子机制吸引或者招募它们定向移动到靶位点?
其实,科学家早就发现,在免疫系统中存在着一系列可以招募免疫细胞向炎症部位定向移动的分子,并称此为趋化因子(chemokines)[3-4]。由于这种趋化作用同时也在免疫细胞归巢、定向移动、迁移和癌细胞的转移等过程中发挥重要作用,所以已经成为目前免疫学和医药学研究的焦点之一。
2.1 细胞定向移动的分子基础
所谓趋化因子就是激发白细胞趋化性的小分子分泌性蛋白质,是可受化学诱导物及细胞因子调节,并能刺激细胞趋化运动的一类细胞因子。依照保守的半胱氨酸残基,可分为[5]:1)α趋化因子,含有保守的半胱-X-半胱(C-X-C)模体,主要是激发中性粒细胞趋化性;2)β趋化因子,含有相邻的半胱氨酸残基(C-C),主要吸附单核细胞、嗜酸性粒细胞、嗜碱性粒细胞;3)γ趋化因子,仅含有一对半胱氨酸残基,激发淋巴细胞趋化性(即淋巴细胞趋化因子);4)δ趋化因子,含有一个半胱-X-X-X-半胱(C-X-X-X-C)模体,其作用仅局限于脑部,并被锚定在膜上。所有受体都是G蛋白偶联受体[6]。
另一类在细胞移动中发挥作用的重要分子是黏附蛋白(adhesion protein),它们主要存在于细胞外基质中的与细胞黏附有关的一类蛋白质,当细胞遇到入侵时,激活和释放细胞因子和趋化因子,在其传播途径中激活黏附蛋白的表达和活性,在细胞的黏附、细胞的定向滚动、增殖、分化等活动中发挥重要作用[7-8]。大量研究结果证明这3种分子相互配合,促使和调节免疫细胞的定向移动。其中黏附蛋白可能还有导引免疫细胞循环和细胞归巢的作用[9]。这里还可以大胆推测:黏附蛋白在中医,特别是针灸学的经络构成中可能也发挥重要作用。当然这只是一个猜想,需要进行深入的研究和证明[10]。
2.2 移动细胞通讯的传递途径
毫无疑问,机体是一个有组织、器官所组成的复杂的热力学非平衡系统,所以移动的细胞必须遵守一定的规则进行移动,就像交通网络一样。显然,细胞因子、趋化因子的传播可以,也只能通过血液和体液所构成的循环系统来传递,它们的传递遵守物理和热力学规律。其动力也只能来自于心脏跳动所带来的动力输送系统,这包括营养的运输(相当于《黄帝内经》中的“营”气),也包括信号分子的传递,如细胞因子、趋化因子等。这里需要强调的是:这些信号分子的传输途径,既然它们只能遵守物理化学定律,通过机体的循环系统进行传递,所以在理论上,应该可以通过对循环系统中的信号分子,例如:激素、细胞因子和趋化因子的测定及时定量地检测机体中细胞之间的通讯情况。与此不同的是,移动细胞,特别是免疫细胞则可以,也不应该受循环系统所规定的路线的限制,因为它们既是发挥生命活动的基本单位,本身又是一个可以通过代谢,消耗葡萄糖和能量(ATP)提供动力的(耗散结构)动力系统。特别是对于免疫细胞,它们的防御功能要求其不仅在循环系统中发挥作用,更要在机体的周围和每一个角落里发挥防御、自稳定和免疫监视作用。所以它们可以不断地再循环(免疫细胞再循环),周而复始,营周不息,就像《皇帝内经》中的“卫气”一样。而且一旦在任何一个部位发生炎症,它们就可以通过沿血管壁滚动,定向移动到这个部位,这似乎和《黄帝内经》的“气到病所”相一致。根据目前的研究证据,可以总结出移动细胞及其信号分子传递的基本途径,如图4、5所示。

图4 移动细胞通讯的传递途径Fig.4 Transmission pathways of mobile cell communications
趋化因子是当机体遇到入侵或者侵害等情况时所分泌的一种细胞因子,不同的趋化因子可以吸引不同的细胞趋向炎症部位。由于其在招募、活化和细胞定向移动中发挥重要作用,已经成为免疫学家所关注的重要研究领域。特别是近来的研究表明,癌症的转移、细胞的归巢作用等与趋化因子的作用密切相关,所以其分子生物学研究和趋化机制得到了深入的研究[11-14]。趋化因子对不同细胞的趋化作用和信号传递途径,如图6、7所示[15]。

图5 白细胞如何寻址(黏附蛋白?)滚动到炎症部位示意图Fig.5 Diagram of leukocytes to address inflammatory sites

图6 趋化因子和细胞因子协同作用使相应的细胞移动到炎症部位Fig.6 Leucocytes move to inflammatory sites by cooperation between chemokines and cytokines
如图7所示,作为正常免疫系统功能的一部分,趋化因子是白细胞定向移动的关键组分,在免疫系统的层次网络、发育和免疫监视中发挥特殊作用。趋化因子也作为生长、发育、分化和白细胞活化以及刺激这些细胞发挥多种效应的激活因子,例如:整合素激活、趋化作用、释放反应性氧、颗粒性酶的释放等。

图7 趋化因子发挥作用的信号途径Fig.7 Signal pathways of chemokines
2.3 黏附蛋白及其在细胞定向移动中的作用
淋巴细胞从循环募集到目标组织是一个高度调节的过程,依赖一系列黏附分子的相继作用,需经历贴壁,滚动(rolling);趋化因子对整合素的激活(activing);整合素介导的淋巴细胞牢固黏附(adhereing);淋巴细胞于高内皮静脉(high-endothelial venules,HEV)内皮细胞间隙的游出。该过程涉及到一系列归巢受体、地址素及趋化因子的级联作用[16]。各亚群的具体归巢步骤有所不同[17-22]。一类黏附蛋白也被认为是一种淋巴细胞归巢受体,主要包括选择素家族的L-选择素[23]、整合素家族的α4 β7和淋巴细胞功能相关抗原LFA-1(αL β2)等。其与相对应的地址素相互识别、相互作用可介导淋巴细胞与内皮细胞间的黏附和游出过程。另一类黏附蛋白被称为地址素:L-选择素、α4 β7和LFA-1的配体(地址素)分别为黏膜地址素细胞黏附分子-1(mucosal addressin cell adhesion molecule-1,MAdCAM-1)和细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)/血管细胞黏附分子-1(vascular adhesion molecule-l,VCAM-l),均属于免疫球蛋白超家族(immunoglobulin super family,IgSF),具有与Ig相似的结构特征。外周淋巴结地址素(peripheral lymph node addressin,PNAd)是一种特殊形式的MAdCAM-1,即为碳水化合物抗原决定簇修饰的MAdCAM-1。其作用如图8~10所示。
如图8所示,白细胞黏附级联作用是一系列的有次序黏附和激活作用,最终实现白细胞从毛细血管中挤出,在那里,白细胞趋向炎症部位发挥作用。这一按次序的级联黏附和激活作用至少有5步:捕捉(capture)、滚动(rolling)、缓慢滚动(slow rolling)、紧密黏附(firm adhesion)和转移(transmigration)出毛细血管。这五个步骤都是白细胞招募所必需的,因为阻断其中的任何一步就会强烈地减少白细胞在炎症部位的聚集。这一过程可以平行地在同一毛细血管中对不同的细胞进行转移,互不干扰。

图8 白细胞黏附级联作用Fig.8 Leukocyte adhesion cascade

图9 白细胞的滚动及作用机制Fig.9 Rolling mechanisms of leukocytes
如图9所示,白细胞通过其表面的为容貌上的各种配体和毛细血管壁上的黏附蛋白相互识别并结合,促使其向炎症部位滚动并在适合的位点挤出毛细血管。
如图10所示,黏附蛋白通过和移动细胞多个步骤的相互作用促进细胞的滚动:a.白细胞的招募用毛细血管末端小静脉(post-capillary venule)模型进行图示说明:1)开始附着,2)低速滚动,3)通过局域表达的趋化因子来捕捉和激活白细胞的整合素(integrin),4)转移出。b.液体剪切力。在小静脉中,可以检测出它对瘤体的剪切力以抛物线速度形式出现,在血管壁的速度最小,而在血管中心的流速最大。瘤体剪切力也可以直接活化内皮细胞和T细胞(即图中的EC和BM)[24]。

图10 黏附蛋白的移动通讯机制Fig.10 Mobile communication mechanisms of adhesion protein
3 食品对机体通讯网络的作用
3.1 消化道是机体最重要的信息和物质交换系统
消化道黏膜系统是机体与外界接触面积最多的系统,其面积大约在400m2,而体表面积则只有1.8m2。已经有大量证据表明,肠黏膜淋巴组织是机体最大的免疫系统,即消化道相关淋巴组织(gut-associated lymphoid tissue,GALT)。它是由肠系淋巴结(mesenteric lymph nodes,MLN)、派依尔氏结(Peyer's patches,PP)、隔离的淋巴囊泡(isolated lymph follicles)和大量散布在小肠上皮固有层(lamina propria)中的淋巴细胞构成。派依尔氏结是小肠黏膜内淋巴系统最集中的组织,也是肠腔中的抗原和循环中的淋巴细胞之间相互作用的基础性诱导之处。PP通过一个单层上皮细胞和小肠内腔隔离开,这层单层上皮细胞中含有一种特殊的上皮细胞被称为微皱折细胞(microfold cells,M细胞)。M细胞是专门用来从小肠内腔吸收抗原并将其跨黏膜转运到上皮下面形如圆屋顶的区域[25]。然后这些抗原由抗原提呈细胞(APC)吸收,它们再继续将这些抗原处理并提呈给PP中的T-细胞。滤泡中心的这些T-细胞由于抗原的提呈作用而被激活、分化并成熟。接着,它们便经过输出淋巴腺迁移到肠系淋巴结,然后再进入胸导管,最后进入循环系统。在循环系统中,这些激活了的T-细胞在黏附分子的帮助下返回到肠黏膜免疫系统的效应部位,或者滚动到炎症部位产生免疫应答。在这里,它们作为效应细胞,分泌细胞因子并介导特异的获得性免疫防御作用[26]。可见,肠黏膜系统既是激活机体先天免疫和获得性免疫的信号系统,又是免疫防御系统的关键部位。机体正是通过这一重要的信息和物质交换系统“认识”周围环境,也正是通过这一“巨大”表面积和机体“外部”进行物质和信息交流。
3.2 肠上皮细胞和树突细胞在信息交流中发挥关键作用
血源性树突细胞(pDCs)是产生I-型干扰素的专职细胞,同时,这些细胞也在受到激活后迁移到淋巴组织,在这里它们搭建起先天免疫和获得性免疫的桥梁。应用悬液芯片技术(multianalyte profiling,MAP),Decalf等[25]已经绘制出关键性趋化因子和细胞因子在pDC激活所产生的应答图式,自分泌型IFN的作用,以及对先天免疫细胞的旁分泌作用(例如单核细胞和常规的DCs)。有趣的是,他们鉴定出4个有区别的由Toll样受体所启动的细胞因子/趋化因子回路。他们的研究证实,应用MAP技术可以系统研究细胞因子的网络特征,以及深入研究某一细胞类型是如何与其他炎症细胞活性形成一体化的。而且,这也可以用来帮助评价pDC颉抗剂对某些疾病的治疗效果。

图11 胃肠黏膜和上皮细胞在移动通讯和信号传递中的作用Fig.11 Role of gastrointestinal mucosa and epithelial cells in communication and signal transduction
如图11所示,肠道中的细菌、微生物和食物等抗原可以通过TLRs等复杂的受体系统,通过细胞因子和趋化因子向体内传递各种信号,从而调节机体的免疫系统、生理系统和代谢,从而构建起机体和食品之间的信息交流的平台。
3.3 食品和机体的通讯网络
自2005年以来,笔者所在实验室系统研究了食品对机体细胞因子网络的作用及其规律[27-37]。为了能够得到真实的数据,必需首先确定实验方法和条件:1)基点必须放在口服(也就是吃)上,因为食品是用来吃的,而不是注射的或者灌服的。2)取样必需在伦理允许的框架内,而且采样方便;3)尽量不要通过致病模型来研究,因为食品不是用来治病的,至少不适用于临床治疗,即使功能性食品也是用来保护机体健康的;4)不仅人和动物不同,同一种食品对不同的人亦不同,甚至同一个人在不同的状态下对同一种食品的反应也不同,所以只有对同一个人在相同的条件下连续两天的实验数据进行比较,才能最大限度地反映出食品的作用。5)人类食品应该是多样化的,而不应该是单一的。任何单一化的食品都不利于食用者的身心健康,更不能长时间只食用同一种食品,因为依照中国传统中医药和食品保健理论,长期食用单一的食品就会因为食品的偏性造成机体的偏性,而机体的偏性恰恰是致病的根源。所以从这个意义上来说,笔者反对通过动物实验来推测人类本身,更反对通过实验动物数十天食用同一种食品来判断这种食品的功能作用,认为这样所得出的实验结果往往反映的是由于长期食用该食品所造成的机体的偏性。
为了优化实验方案,首先必须弄清楚当食品食入后,间隔多少时间采集血液样品才能反映出食品作用的最大效果。或者说,如果食品的确通过细胞因子变化和机体进行信息交流,那么食品食用后多长时间机体的细胞因子变化最大呢?在认真查阅了国内外相关资料的基础上,发现所有的实验中有关食用后取样的时间间隔五花八门,几乎没有任何规范,更没有什么科学依据,于是利用可诱发机体炎症反应的脂多糖(LPS),用实验家兔作为实验动物进行了口服、腹腔注射、静脉注射3种不同途径所造成的实验动物外周血中细胞因子消长规律的研究。实验结果证明:口服LPS所产生的细胞因子变化最大的时间分布在2~4h,显然,这和本实验室的实践经验是相符的,食品经过胃的排空到肠道,经过消化和吸收的时间范围应该分布2~4h之间。另一个问题是:食品食入后是否真的能显著改变机体外周血中细胞因子浓度?经过近5年多的实验结果证明这是肯定的。第3个问题是:这些细胞因子的变化能说明什么问题?可以说,当本实验室发现酪蛋白酶解肽可以使所测定的33种细胞因子中的8种具有显著性变化时感到兴奋不已。但是,如何分析这些酪蛋白酶解肽的功能呢?是对显著变化的细胞因子的功能进行分析和总结吗?可是一种细胞因子的功能就可以用数万字来描述,而且它们的作用正如以前所描述的,往往一种细胞因子具有多效性,而不同的细胞因子有时则具有同效性,怎么描述?于是必需弄清楚到底细胞因子起作用的主体是什么?是细胞因子本身,还是细胞因子必须通过不同的细胞起作用?事实上,生物活性分子的作用,其实并不是它自身的作用,而是这些分子通过细胞起作用,所以才有同一种细胞因子可以通过不同的细胞发挥不同的作用。也就是说,发挥生物学作用的不是分子,而是细胞!在进行分子生物学研究和分析时,不可忽略的是,细胞才是发挥生物功能的基本单位!
然而,不同的细胞因子通过作用于不同细胞所形成的功能也是异常复杂的,而且由于它们复杂的相互作用,使得其作用的整体结果表现为非线性。为了能够分析其总体效应,利用现代通讯网络技术,成功地构建了食用某种食品后机体的细胞通讯网络变化,可以系统反映细胞因子的变化所导致的细胞通讯网络的变化。以酶解酪蛋白多肽为例,经过志愿者口服采集口服前后的同一个人的血清进行比较,用SPSS11.5进行t检验,对具有显著性变化的细胞因子总结如表2所示。

表2 口服酪蛋白酶解肽前后具有显著性变化的细胞因子Table 2 Significantly changed cytokines in cells before and after oral administration of polypeptides
从表2可以看出,GRO浓度的变化量极其显著(P<0.001),MIP-1β和IL-1ra在实验组和对照组血清中的浓度具有显著差异(P<0.01),EGF、TNF-α、TGF-α、IL-2和GM-CSF的两组浓度值具有显著差异(P<0.05)。
根据这些具有显著性变化的细胞因子,可以从目前最权威的数据库中查出产生这些细胞因子的细胞和这些细胞因子作用的靶细胞,然后根据它们的相互作用指出这些细胞通过细胞因子相互作用的网络,如图12所示。

图12 服用酪蛋白复合多肽后细胞通讯网络图Fig 12 Communication networks of cells after administration of compound polypeptides at high dosage
显著降低的相互作用用黑色表示,其粗细程度则根据细胞因子变化的显著性,经过量化和归一化处理得出。
由图12可知,酪蛋白酶解肽的总体作用是下调机体的免疫活性,这显然和传统认识是相反的,与植物非营养成分则十分接近。如果对其中的各种细胞的“输入”和“输出”信号进行积加,即可以得出服用酪蛋白酶解肽对各种细胞的综合效应,从而可以对食用酪蛋白酶解肽的综合效应进行评价。显然,在得到任何一个人的血象时,即可以凭借这一综合效应进行科学配餐,以矫正这个人的“偏性”。
在此基础上,对20种传统食品通过多名志愿者进行了39种细胞因子的测定,分别依据食用这些食品的细胞因子变化情况绘制出了细胞通讯网络变化图。这些结果基本上与中国人的祖先根据经验所作出的阴阳属性相符。这是十分令人兴奋的,所有这些实验结果正在整理,尚未发表。
4 细胞通讯网络方法的应用前景
如上所述,由于科学家对分子生物学研究的过分追捧,使得很多有关分子生物学功能的表述忽略了一个基本事实:细胞是生命活动的主体,生物活性分子只能通过细胞才能发挥生物活性。例如干扰素,很多文献都将其描述为具有抗病毒和抗肿瘤作用等多种生物活性,甚至可以毫不夸张地说:其功能的详细描述可能需要数以万计的文字。但是从逻辑上说,干扰素可以通过不同的细胞发挥多种生物功能。实际上,离开细胞,干扰素只不过就是一种中等分子质量大小的蛋白质,既不能抗病毒,更不能抗肿瘤。其复杂的生物活性正是由于在不同的状况下作用于不同的细胞所造成的。可见,当试图描述某种分子的生物活性的时候,万万不可离开发挥生命活动的主体——细胞,否则就会由于失去生命活动的主体而带来混乱。就像不知何时已经广泛使用了细胞因子网络一词那样,一旦需要绘出一张细胞因子网络图时,却不可能离开细胞。因为细胞因子只是细胞通讯网络的信号分子。
Frankenstein等[2]和本实验室的研究表明:细胞因子网络实际上就是移动细胞之间以及移动细胞和固定细胞之间所形成的无线通讯网络。这个网络不仅连接了机体有线(神经纤维)和无线(细胞因子、激素等)通讯系统,而且在母亲和胎儿之间的通讯联系中也发挥着决定性作用。显然,这些信号分子是通过血液和体液循环来传递信号的,细胞表面的受体,特别是胃肠黏膜表面的受体实际上保证了这些信号在极低浓度下传输,在细胞接收到这些信号之后定量地放大这些信号,使细胞作出恰当的响应。这些信号分子的单体(至少大部分如此)性质和互不干涉恰恰构成了其作为信号分子的必要条件。
强调这些信号分子通过血液和体液传输的重要目的之一是:人们可以通过测定外周血中这些信号分子的变化情况来判断机体的通讯状况,特别是当人们想了解不同食品对机体的通讯作用时,只要测定外周血中这些信号分子(例如:细胞因子、趋化因子、激素等)的变化,既可以对其通讯的变化作出科学的判断,换言之,血液和体液中的信号分子是了解机体无线通讯状态的最佳对象。
总结现代分子生物学、细胞生物学和免疫学的相关研究结果,人们可以基本上得出结论:细胞因子、趋化因子和激素是机体无线通讯网络的主体信号分子;而黏附蛋白则构成了以白细胞为主体的可移动细胞定向移动、归巢和趋化性的“路标”。
本实验室近年来的大量实验表明,机体的胃肠黏膜系统存在着复杂的受体系统,它们构成了食品和机体进行通讯和信息交流的基础,食入的食品除了给机体提供基本营养物质以外,的确存在着复杂的和机体之间的信息交流。这种信息交流可以通过外周血中的细胞因子、趋化因子和激素的变化反映出来,因此可以通过这些测定来评价食品的功能作用,指导人们进行科学饮食。
值得注意的是:这些信息可以仅仅来自对(2mL)外周血的采集与测定,其科学依据是:细胞移动通讯介质-细胞因子和趋化因子是通过血液和体液循环系统进行传递的。通过测定这些信号分子及其所产生的细胞通讯网络的变化,至少人们可以进行下列研究。1)食品对细胞通讯网络的综合作用及其效应;2)食品对不同细胞,特别是对移动细胞的具体作用模式和强度;3)食品对移动细胞、固定细胞的作用及其与机体移动通讯和神经网络通讯的综合作用规律;4)移动和神经网络通讯之间的接入点及其细胞;5)各种细胞在该过程中的作用;6)这些通讯所涉及的信号通路及其作用模式。
显然,这些信息对于食品的功能评价以及指导人们的饮食实践具有重要的参考价值,而且其测定也不需要付出多大的代价,这不像很多疾病,特别是癌症研究中碰到的两难境地:一方面要攻克人类疾病的治疗,而另一方面还必须将实验研究控制在伦理框架之内。因为人们绝不可以违背人类伦理道德,直接用人类来诱发疾病进行治疗实验。然而食品则不同,食品是用来保证人体正常生理活动和健康的基础,它不需要应用致病的动物模型,而且似乎也不应该那样做,因为总体来说,食品不是用来治病的。本文所提出的理论、观点和方法恰恰适合于这一研究目的。在这里,人们可以通过“吃”来评价食品的功能,只需要口服之后2mL血的贡献!经验告诉人们:不同的人吃同一种食品的作用都可能是不一样的,难道能完全相信动物的实验结果吗?
[1] FANTUZZI L, CONTI L, CRISTINA GAUZZI M, et al. Regulation of chemokine/cytokine network duringin vitrodifferentiation and HIV-1 infection of human monocytes:possible importance in the pathogenesis of AIDS[J]. Journal of Leukocyte Biology, 2000, 68:391-399.
[2] FRANKENSTEIN Z, ALON U, COHEN I R. The immune-body cytokine network defines a social architecture of cell interactions[J].Biology Direct, 2006, 1:32(15pages).
[3] ZLOTNIK A, YOSHIE O. Chemokines:a new classification system and their role in immunity[J]. Immunity, 2000, 12:121-127.
[4] MOSER B, WOLF M, WALZ A, et al. Chemokines:multiple levels of leukocyte migration control[J]. Trends Immunol, 2004, 25:75-84.
[5] MELLADO M, CARRASCO Y R. Imaging techniques:New insights into chemokine/chemokine receptor biology at the immune system[J].Pharmacology & Therapeutics, 2008, 119(1):24-32.
[6] NOMIYAMA H, OSADA N, YOSHIE O. The evolution of mammalian chemokine genes[J]. Cytokine & Growth Factor Reviews, 2010, 21(4):253-262.
[7] LOU J, YAGO T, KLOPOCKI A G, et al. Flow-enhanced adhesion regulated by a selectin interdomain hinge[J]. J Cell Biol, 2006, 174:1107-1117.
[8] PHAN U T, WALDRON T T, SPRINGER T A:Remodeling of the lectin-EGF-like domain interface in P- and L-selectin increases adhesiveness and shear resistance under hydrodynamic force[J]. Nat Immunol,2006, 7:883-889.
[9] ALON1 R, LEY K. Cells on the run:shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells[J]. Current Opinion in Cell Biology, 2008, 20:525-532.
[10] 庞广昌. 食品免疫论[M]. 北京:科学出版社, 2008.
[11] DOMANSKAA U M, KRUIZINGA R C, den DUNNEN W F, et al. The chemokine network, a newly discovered target in high grade gliomas[J].Critical Reviews in Oncology Hematology, 2010, doi:10.1016/j.critrevonc.2010.07.006.
[12] SILVA1 T A, GARLET G P, FUKADA S Y, et al. Chemokines in oral inflammatory diseases:Apical periodontitis and periodontal disease[J]. J Dent Res, 2007, 86(4):306-319.
[13] BORRONI E M, MANTOVANI A, LOCATI M, et al. Chemokine receptors intracellular trafficking[J]. Pharmacology & Therapeutics, 2010,127:1-8.
[14] LAZENNEC G, RICHMOND A. Chemokines and chemokine receptors:new insights into cancer-related inflammation[J]. Cell, 2010, 16(3):133-144.
[15] GOUWY M, STRUYF S, PROOST P, et al. Synergy in cytokine and chemokine networks amplifies the inflammatory response[J]. Cytokine& Growth Factor Reviews, 2005, 16:561-580.
[16] SALMI M, JALKANEN S. Lymphocyte homing to the gut:attraction,adhesion, and commitment[J]. Immunol Rev, 2005, 206:100-113.
[17] MORA J R, von ANDRIAN U H. T-cell homing specificity and plasticity:new concepts and future challenges[J]. Trends Immunol, 2006, 27:235-243.
[18] MARELLI-BERG F M, CANNELLA L, DAZZI F, et al. The highway code of T cell trafficking[J]. J Pathol, 2008, 214:179-189.
[19] MARELLI-BERG F M, OKKENHAUG K, MIRENDA V. A two-signalfor T cell trafficking[J]. Trends Immunol, 2007, 28:267-273.
[20] KRUGER K, MOOREN F C. T cell homing and exercise[J]. Exerc Immunol Rev, 2007, 13:37-54.
[21] TANAKA T, UMEMOTO E, MIYASAKA M. Lymphocyte trafficking and immunesurveillance[J]. Nihon Rinsho Meneki Gakkai Kaishi, 2006,29(6):359-371.
[22] SPERANDIO M. Selectins and glycosyltransferases in leukocyte rollingin vivo[J]. FEBS J, 2006, 273:
[23] ALPER J. Searching for medicines sweet spot[J]. Science, 2001, 291(5512):2338-2343.
[24] NEUTRA M R, FREY A, KRAEHENBUHL J P. Epithelial M cells:gateways for mucosal infection and immunization[J]. Cell, 1996, 86:345-348.
[25] MOWAT A M, VINEY J L. The anatomical basis of intestinal immunity[J]. Immunol Rev, 1997, 156:145-166.
[26] DECALF J, FERNANDES S, LONGMAN R, et al. Plasmacytoid dendritic cells initiate a complex chemokine and cytokine network and are a viable drug target in chronic HCV patients[J]. J Exp Med, 2007,204(10):2423-2437.
[27] 庞广昌, 陈庆森, 胡志和. 食品是如何通过细胞因子网络控制人类健康的(Ⅰ)[J]. 食品科学, 2006, 27(5):258-264.
[28] 庞广昌, 陈庆森, 胡志和. 食品是如何通过细胞因子网络控制人类健康的(Ⅱ)[J]. 食品科学, 2006, 27(6):260-270.
[29] 于立芹, 庞广昌. 乳酸对主要发炎和抗炎细胞因子的影响[J]. 食品科学, 2007, 28(12):439-442.
[30] 黄栩林, 庞广昌, 杨静静. Trpi免疫调节功能的研究[J]. 食品科学,2008, 29(4):381-385.
[31] 庞广昌. 中华饮食文化和食品科学探源[J]. 食品科学, 2009, 30(3):11-20.
[32] 张郢, 庞广昌, 于立芹, 等. 胰岛素样生长因子-1对胃肠道黏膜免疫信号的调节作用[J].食品科学, 2009, 30(17):289-291.
[33] 李扬, 庞广昌, 于立芹, 等. 牛初乳中的IgG对肠黏膜免疫系统调节的初步研究[J]. 食品科学, 2009, 30(17):297-301.
[34] 庞广昌, 于立芹, 郭丽, 等. 食品发挥非营养生物功能的胃肠黏膜信号通路[J]. 食品科学, 2009, 30(19):319-326.
[35] 王连芬, 庞广昌, 米小媛. 螺旋藻蛋白水解物对小鼠血清中细胞因子的影响[J]. 海洋科学, 2008, 32(10):51-55.
[36] 于立芹, 庞广昌, 李珍珍. 普洱茶对主要发炎和抗炎细胞因子的影响[J]. 食品科学, 2008, 29(7):428-431.
[37] 王连芬, 庞广昌, 白玉. 螺旋藻蛋白的胃蛋白酶酶解肽对细胞因子的影响[J]. 食品科学, 2008, 29(10):563-567.
Wireless Communication Networks between Food and Human Body
PANG Guang-chang,CHEN Qing-sen,HU Zhi-he,XIE Jun-bo
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce,Tianjin 300134, China)
R151.41
A
1002-6630(2010)21-0001-09
2010-09-26
国家自然科学基金项目(30871951)
庞广昌(1956—),男,教授,博士,研究方向为食品生物技术、食品免疫、乳品安全等。E-mail:pgc@tjcu.edu.cn

