络合萃取法分离发酵液中丙酸
冯小海,陈 飞,姚 忠,章 燕,徐 虹
(1南京工业大学食品与轻工学院材料化学工程国家重点实验室,江苏 南京 210009;2宁波市药品检验所,浙江 宁波 315040)
研究开发
络合萃取法分离发酵液中丙酸
冯小海1,陈 飞1,姚 忠1,章 燕2,徐 虹1
(1南京工业大学食品与轻工学院材料化学工程国家重点实验室,江苏 南京 210009;2宁波市药品检验所,浙江 宁波 315040)
利用络合萃取法对模拟溶液和发酵液中的丙酸分离进行研究。络合剂、稀释剂筛选结果表明:选用甲基三辛基氯化胺(MTAC)为络合剂、正辛醇为稀释剂时,萃取受pH值和无机阴离子影响较小,对丙酸具有较高的选择性。以1.2 mol/L的MTAC为萃取有机相,有机相/水相(体积比)为3的条件下,萃取15 min即能达到平衡;该系统适用于较高浓度丙酸发酵液萃取,经4级萃取丙酸萃取率达86.2%。
丙酸;络合萃取;甲基三辛基氯化胺
丙酸是一种重要的三碳平台化合物,丙酸及其衍生物广泛应用于谷物保存、橡胶、油漆等领域[1-2]。近年来,生物发酵法生产丙酸由于原料可再生、对环境温和而受到了广泛的关注[3-4]。丙酸生产效率低和产物分离困难是发酵法生产丙酸过程中的面临的主要问题[5-6]。随着新型丙酸生产技术的的开发,特别是固定化技术和丙酸成套装置的应用,丙酸生产效率得到了较大提高[6-13]。但是,由于存在乙酸、琥珀酸等副产物[10],丙酸分离的难度较大,至今未能取得突破性进展,极大地限制了生物基丙酸的工业化,因此开发新型生物基丙酸分离工艺迫在眉睫。
丙酸的提取方法主要包括离子交换法和络合萃取法[5,14-17]。与离子交换法相比,络合萃取法对于包括丙酸在内的有机酸分离具有高效性,是近年来较为活跃的研究领域之一[15-19]。不同种类的络合剂对有机酸萃取效果差别较大[15],以往研究者主要采用伯胺、仲胺、叔胺作为络合剂进行丙酸萃取[5,15,20],较少见到利用季铵进行丙酸络合萃取的研究。目前国内对于丙酸萃取的研究主要集中于丙酸纯溶液萃取[17,20],未见丙酸发酵液萃取分离方面的报道。
本研究对用于丙酸分离的络合剂、稀释剂进行了筛选与优化,开发了一种利用季铵盐萃取分离丙酸纯溶液和发酵液的新方法,考察了其它有机酸(乙酸、琥珀酸)和无机阴离子对丙酸萃取的竞争效应,优化了实际发酵液体系中的丙酸络合萃取条件。
1 实验材料与方法
1.1 试剂与仪器
1.2 萃取平衡实验
将萃取相(含络合剂与稀释剂)和被萃取溶液各2 mL置于10 mL离心管中,置于恒温水浴摇床,温度35 ℃,频率180 r/min,振荡2 h。以4000 r/min的转速离心5 min,针筒取出下层水样,采用HPLC法测定水相中有机酸含量[7],有机相中丙酸及其它有机酸含量通过物料平衡方程计算得到。萃取平衡系数(Kd)为有机相中有机相溶质浓度与水相中溶质浓度的比值,萃取率(%)即为有机相中溶质质量与原液溶质质量的比值。
2 结果与讨论
2.1 络合剂和稀释剂的筛选
2.1.1 络合剂和稀释剂种类对模拟体系中丙酸分配系数的影响
选用TOC和MTAC作为络合剂,正辛醇(octanol)和煤油(kerosene)作为稀释剂对丙酸水溶液(20 g/L,自然pH值为2.5)进行萃取情况考察(图1)。由图1可知,在自然pH值条件下,不同极性的稀释剂对TOC萃取丙酸的效果影响很大。极性稀释剂正辛醇有助于丙酸与TOC形成具有一定极性的离子对萃合物的溶解,从而提高络合萃取剂的萃取能力[19]。由于TOC与煤油配合使用时丙酸溶液的Kd最小,不予采用。MTAC与煤油或正辛醇配合使用时Kd接近,但MTAC-煤油萃取丙酸过程中会出现第三相,不利于丙酸萃取,故选用正辛醇作为稀释剂。
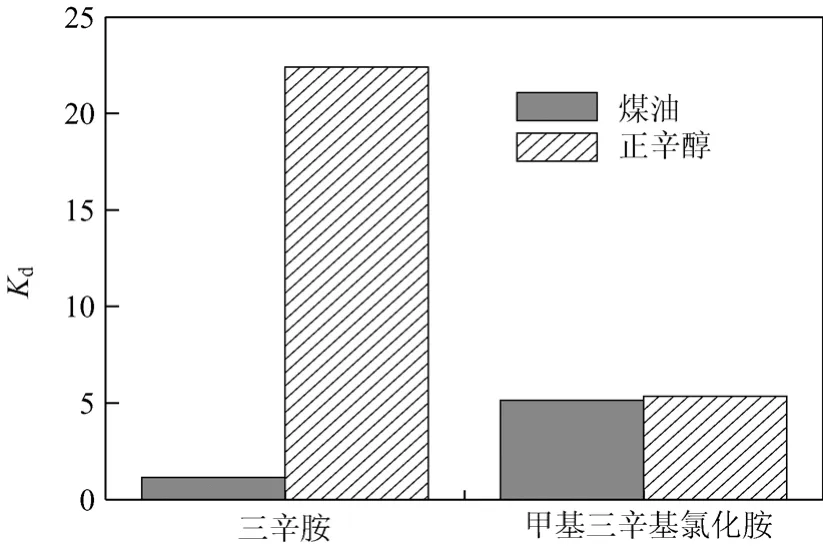
图1 络合剂与稀释剂筛选
2.1.2 不同pH值丙酸水溶液萃取情况考察
配制pH值分别为2.5、4.0、5.0、6.0、7.0的丙酸水溶液(20 g/L, pH值由6 mol/L的NaOH调节获得),考察pH值对于络合萃取的影响。如图2所示,随着pH值的升高,TOC对丙酸的萃取分配系数显著降低,当pH值为5.0~7.0时,萃取分配系数Kd接近为零;而MTAC对于丙酸的萃取效果受pH值的影响较小,在pH值为6.0~7.0的情况下,仍能提供1.5左右的分配系数。丙酸发酵pH值一般在接近中性的条件下进行,因此TOC萃取有机酸的过程主要以离子对缔合和氢键缔合为主。在较低pH值条件下分子态丙酸摩尔分数较高,萃取机理以氢键缔合为主[式(1)];随着pH值的升高,离子态丙酸摩尔分数增加,萃取机理转向以离子对缔合为主[式(2)],但是,由于水溶液中的质子不断减少,季铵阳离子的生成量降低,阻碍了离子缔合的第二步反应,在图2中表现为TOC-正辛醇对丙酸的萃取分配系数显著降低。此外,MTAC是一种季铵盐,能够直接与Lewis酸性有机酸的阴离子进行阴离子交换,形成萃合物,完成萃取分离过程。因此,MTAC的pH值摆动效应不明显(图2),随着pH值的增大,分配系数有所下降,原因在于OH-竞争性地参与了R3NH+与丙酸根进行的阴离子交换过程。
国际油价波动具有短周期约2~5年、长周期约8~10年的特点,本轮油价已进入中高位波动区间。2018年1-11月,布伦特和WTI原油月均价分别突破70美元/桶和65美元/桶,最大涨幅分别超过25%和24%。2017年,布伦特和WTI平均价格分别为64.2美元/桶和57.9美元/桶,比上年分别上涨20%和11%。2017年,国际油价经历了一季度相对稳定,二季度震荡回调,三、四季度波浪上升3个阶段,布伦特油价两年来首次突破60美元/桶(见图1)。
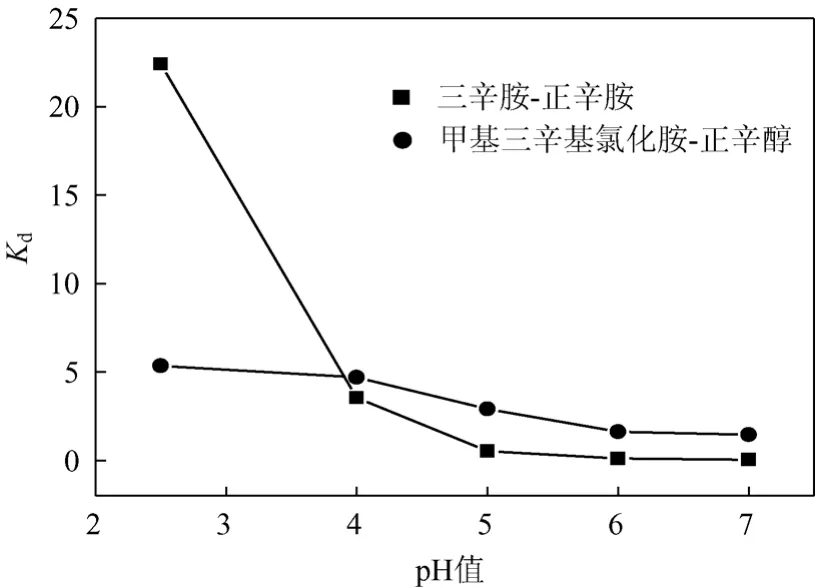
图2 pH值对于分配系数的影响
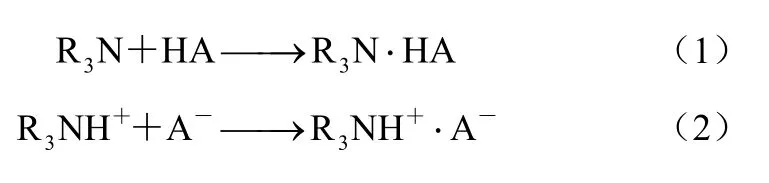
2.2 络合剂浓度对丙酸萃取的影响
在pH值为6.0条件下,考察不同浓度(分别为0,0.2 mol/L,0.6 mol/L,1.0 mol/L,1.4 mol/L,1.8 mol/L)MTAC对20 g/L丙酸水溶液的萃取情况(图3)。在一定MTAC浓度范围内,萃取平衡分配系数Kd值随着萃取剂浓度的升高而增大。但浓度过高导致有机相黏度增加,分配系数值提高幅度不明显,选择1.2 mol/L的MTAC为宜。

图3 络和剂浓度对丙酸萃取的影响
2.3 乙酸、琥珀酸对丙酸萃取的竞争
前期研究表明,P. freudenreichii CCTCC M207015发酵生产丙酸(PA)的同时,还伴有其它副产物乙酸(AA)、琥珀酸(SA)的形成[7-8],因此需要考察这两种有机酸对络合萃取丙酸的竞争性情况。在pH值为6.0情况下,比较萃取剂对10 g/L丙酸水溶液、10 g/L乙酸水溶液、10 g/L琥珀酸水溶液及有机酸混合溶液(丙酸20 g/L、乙酸10 g/L、琥珀酸5 g/L)的萃取情况(图4)。
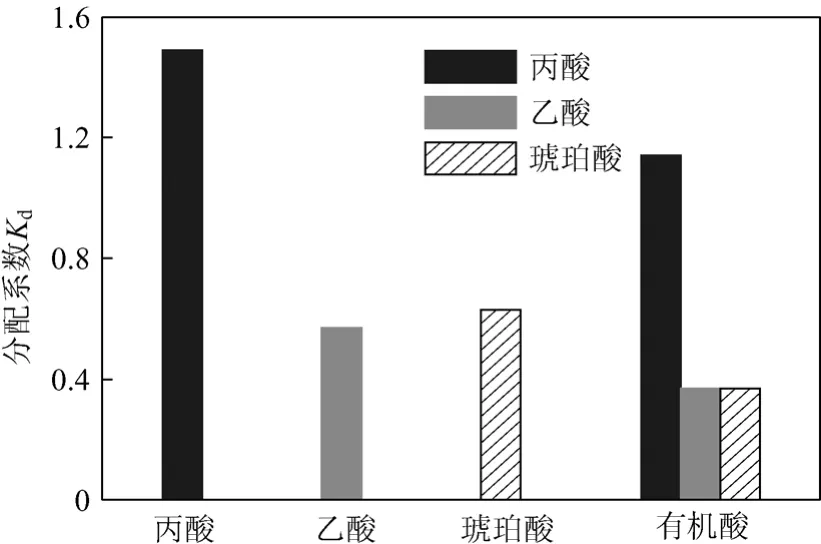
图4 乙酸、琥珀酸对丙酸萃取的影响
结果表明,3种有机酸Kd大小顺序为丙酸>琥珀酸>乙酸,而对有机酸混合溶液的萃取结果发现,萃取剂对丙酸具有较好的选择性。研究表明,胺类络合萃取剂的萃取效果与羧酸的酸性、亲油性和萃取剂的性质有关[23-25]。比较各种有机酸的物性参数发现,丙酸、乙酸的萃取分配系数大小顺序与它们的亲油性参数(lgP)顺序一致,两者的酸性相差很小,影响萃取效率的主要因素是两者亲油性参数的差异;琥珀酸和乙酸的酸性和亲油性差别均较小,两者萃取分配系数相当。
2.4 丙酸萃取的盐效应
实际的丙酸发酵液体系成分复杂,膜透过液中含有培养基组分以及菌体代谢产生的次生代谢产物等,这些杂质的存在,特别是无机阴离子的存在会对实际的萃取过程产生影响[26]。为此,采用丙酸-无机盐-萃取剂模拟体系(丙酸20 g/L,乙酸10 g/L,琥珀酸5 g/L,pH值6.0),考察无机阴离子Cl-和SO42-离子(添加量分别为0、0.2%、0.4%、0.6%、1.0%,质量体积比)对萃取剂MTAC-正辛醇萃取丙酸过程中产生的影响进行了研究[Cl-和SO42-分别由NaCl和(NH4)2SO4提供]。图5表明,分配系数随着无机阴离子浓度的增加有所下降。由于体系中同时存在着两种离子对缔合过程[式(3)和式(4)]。
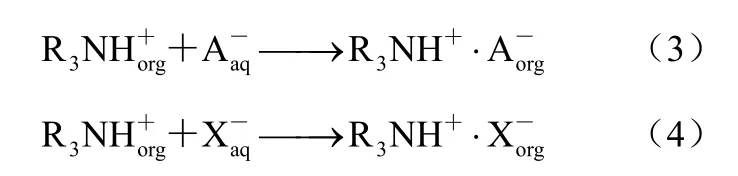
式中,X-表示无机阴离子Cl-和SO42-。无机阴离子的存在对MTAC与丙酸根缔合形成了一定的竞争,实际发酵液中Cl-浓度≤0.3%,SO42-浓度≤0.5%,因此,无机阴离子的存在对丙酸萃取过程有一定的影响,Cl-对于丙酸萃取过程影响大于SO42-。
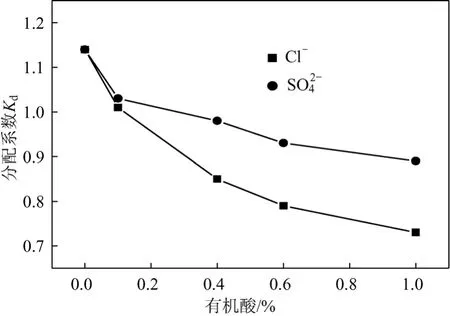
图5 无机阴离子对有机酸萃取的影响
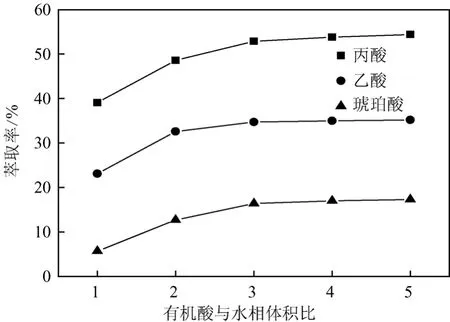
图6 相比对萃取的影响
2.5 实际丙酸发酵液萃取条件的优化
2.5.1 相比对萃取的影响
采用1.2 mol/L MTAC-正辛醇萃取实际丙酸发酵液(丙酸20.2 g/L,乙酸8.5 g/L,琥珀酸4.8 g/L,pH值6.0),考察有机相与水相的体积比对萃取的影响。图6表明,随着相比的增大,萃取率相应提高,有机相/水相(体积比)为3∶1是较佳的相比选择。
2.5.2 萃取平衡动力学曲线
为了确定萃取剂对实际丙酸发酵液(丙酸20.2 g/L,乙酸8.5 g/L,琥珀酸4.8 g/L,pH值6.0)的萃取平衡时间,实验测定了1.2 mol/L MTAC-正辛醇萃取体系对丙酸发酵液萃取的分配系数与时间曲线(有机相体积与水相体积比为3∶1)。从图7可以看出,萃取剂MTAC-正辛醇对丙酸发酵液中丙酸、乙酸和琥珀酸的萃取可在15 min左右达到萃取平衡。
2.5.3 丙酸初始浓度对萃取的影响

图7 萃取时间对分配系数的影响
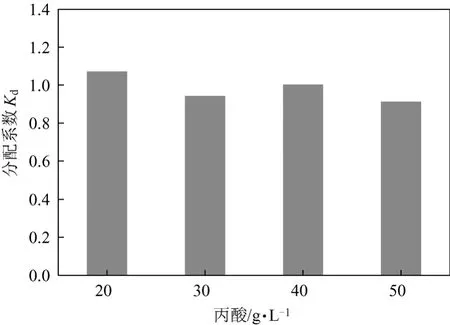
图8 丙酸初始浓度对萃取的影响
对FBB发酵所得的丙酸发酵液进行萃取研究,其中丙酸约52.0 g/L,乙酸9.2 g/L,琥珀酸8.9 g/L。对不同浓度丙酸发酵液对萃取的影响进行考察。如图8所示,在考察的丙酸浓度范围内(20~52.0 g/L),萃取剂对丙酸的萃取分配系数受丙酸浓度影响不大,Kd稳定在1.0左右,这说明该萃取剂同样适用于萃取较高浓度的丙酸发酵液。
2.5.4 丙酸发酵液的多级萃取
在有机相与水相体积比为3∶1的条件下,利用1.2 mol/L MTAC-正辛醇对丙酸发酵液(丙酸52.0 g/L,乙酸9.2 g/L,琥珀酸8.9 g/L,pH值6.0)进行多级萃取,结果见表1。通过四级萃取,丙酸总萃取率达到86.2%。
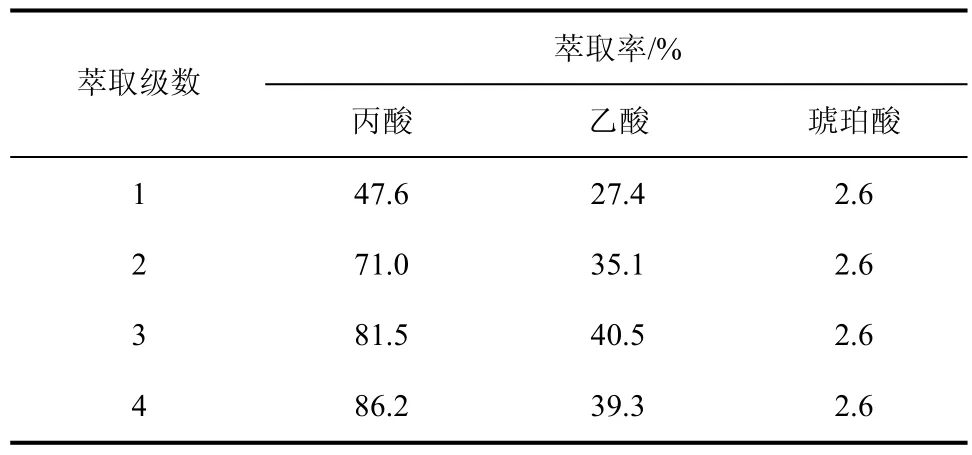
表1 丙酸发酵液多级萃取
3 结 论
经过络合剂和稀释剂筛选,与TOC-正辛醇体系体系相比,MTAC-正辛醇体系受pH值影响较小。无机阴离子对于丙酸萃取有一定影响,Cl-对于丙酸萃取过程影响大于SO42-。当萃取体系中存在乙酸、琥珀酸时,该萃取体系对于丙酸具有较高的选择性,适用于发酵液中丙酸的萃取。以1.2 mol/L的MTAC为萃取相,有机相/水相(体积比)为3∶1的条件下,15 min即能达到萃取平衡;该系统适用于较高浓度丙酸发酵液萃取,经四级萃取丙酸萃取率达86.2%,能较好地满足丙酸分离的要求,本研究对于丙酸提取具有较强的参考价值。
[1] Kerjean J R,Condon S,Lodi R,et al.Improving the quality of European hard-cheeses by controlling of interactions between lactic acid bacteria and propionibacteria[J].Food Res. Int.,2000,33:281-287.
[2] Woskow S A,Glatz B A.Propionic acid production by a propionic acid-tolerant strain of Propionibacterium acidipropionici in batch and semicontinuous fermentation [J].Appl. Environ. Microbiol.,1991,57(10):2821-2828.
[3] Huang Y L,Wu Z,Zhang L,et al.Production of carboxylic acids from hydrolyzed corn meal by immobilized cell fermentation in a fibrous-bed bioreactor [J].Bioresour. Technol.,2002,82:51-59.
[4] Yang S T,Zhu H,Li Y,et al.Continuous propionate production from wheypermeate using a novel fibrous bed bioreactor[J].Biotechnol. Bioeng.,1994,43:1124-1130.
[5] Jin Z,Yang S T.Acetate production from whey lactose using coimmobilized cells of homolactic and homoacetic bacteria in a fibrousbed bioreactor [J].Biotechnol. Progr.,1998,14:457-465.
[6] Rickert D A,Glatz C E.Improved organic acid production by calcium alginate immobilized propionibacteria[J].Enzyme. Microb. Technol.,1998,22:409-414.
[7] 冯小海,吴波,沈晓波,等.利用纤维床反应器固定化发酵生产丙酸的初步研究[J].生物工程学报,2008,24(6):1075-1079.
[8] Feng X H,Xu H,Yao J,et al.Kinetic analysis and pH control strategy for propionic acid production with Propionibacterium freudenreichii CCTCC M207015[J].Appl. Biochem. Biotechnol.,2010,160(2):343-349.
[9] 徐虹,冯小海,李凯,等.一种发酵生产丙酸、丁酸、琥珀酸的固定化纤维床反应器:中国,101182456A[P].2008-05-21.
[10] 徐虹,冯小海,姚忠,等.一种纤维床反应器与膜分离技术联用高密度生产有机酸的装置:中国,101182457A[P].2008-05-21.
[11] 徐虹,冯小海,章燕,等.一种纤维床反应器与萃取分离耦合生产丙酸的装置及工艺:中国,101182455A[P].2008-05-21.
[12] Suwannakham S,Yang S T.Enhanced propionic acid fermentation by Propionibacterium acidipropionici mutant obtained by adaptation in a fibrous-bed bioreactor[J].Biotechnol. Bioeng.,2005,91(3):325-337.
[13] Paik H D,Glatz B A.Propionic acid production by immobilized cells of a propionate-tolerant strain of Propionibacterium acidipropionici [J].Appl. Microbiol. Biotechnol.,1994,42(1):22-27.
[14] 张华峰,仪宏,陈天华.离子交换法提取发酵液中丙酸的初步探讨[J].中国饲料,2005,15(4):12-14.
[15] Gu Z,Glatz B A,Glatz C E.Propionic acid production by extractive fermentation. I. Solvent considerations[J].Biotechnol. Bioeng.,1998,57(4):454-461.
[16] Solichien M S,Brien D O,Hammond E G, et al.Membrane-based extractive fermentation to produce propionic and acetic acids:Toxicity and mass transfer considerations[J].Enzyme. Microb. Technol.,1995,17:23-31.
[17] 罗学辉,秦炜,戴猷元.三烷基胺萃取丙酸的动力学特性[J].化学工程,2003,31(4):8-11.
[18] 王志华,高自立,孙思修,等.伯胺N1923萃取柠檬酸的研究[J].高等学校化学学报,1992(9):5-8.
[19] 李振宇,秦炜,戴猷元.三辛胺萃取一元羧酸的平衡规律(Ⅰ)——萃取平衡特性[J].化工学报,2004,55(1):54-58.
[20] 李斌,常志东,王康,等.N1923络合萃取丙酸的研究[J].环境化学,2007,26(5):642-645.
[21] 徐虹,洪厚胜,李莎,等.利用费氏丙酸杆菌NX-4制备丙酸及联产维生素B12的方法:中国,200710020579.8[P].2009-04-08.
[22] 章燕,冯小海,李凯,等.络合萃取法分离发酵液中丙酸的研究[J].化工进展,2008,27(3):319-323.
[23] Tamada J A,Kertes A S,King C J.Extraction of carboxylic acids with amine extractants(Ⅰ)equilibria and law of mass action modeling[J].Ind. Eng. Chem . Res.,1990,29(7):1319-1326.
[24] Hano T,Matsumoto M,Ohtake T,et al.Extraction equilibria of organic acids with tri-n-octylphosphineoxide [J].J. Chem. Eng. Jpn.,1990,23(6):734-738.
[25] Eyal A M,Canari R.pH dependence of carboxylic and mineral acid extraction by amine-based extractants:Effect of pKa, amine basicity and diluent properties [J].Ind. Eng. Chem. Res.,1994,34(5):1067-1075.
[26] 姚忠,李家璜,韦萍,等.丙酮酸化学萃取的盐效应[J].高校化学工程学报,2001,15(6):587-590.
[27] 张瑾,戴猷元.络合萃取技术及其应用[J].现代化工,2005,25(7):185-188.
Extraction of propionic acid from fermentation broth by chemical complexation
FENG Xiaohai1,CHEN Fei1,YAO Zhong1,ZHANG Yan2,XU Hong1
(1State Key Laboratory of Materials-Oriented Chemical Engineering,College of Food Science and Light Industry,Nanjing University of Technology,Nanjing 210009,Jiangsu,China;2Ningbo Drug Testing Institute,Ningbo 315040,Zhejiang,China)
Extraction of propionic acid by chemical complexation was investigated from simulation solution and fermentation broth. Methyl trioctyl-ammonium chloride(MTAC)diluted with octanol was used for the extraction,which had a higher selectivity for propionic acid over other organic acids and was less affected by pH and inorganic anions. The extraction equilibrium could be reached in 15 min when 1.2 mol/L of MTAC was applied with an extraction phase ratio of 3∶1(organic phase to water phase). This system was believed to be adaptable for the extraction of propionic acid with high concentration. Over four-stage extraction,86.2% of propionic acid could be extracted.
propionic acid;complex extraction;methyl trioctyl-ammonium chloride
O 658.2
A
1000–6613(2010)05–0812–05
2009-10-15;修改稿日期:2009-11-12。
国家973计划(2007CB714304)、江苏省博士后基金(0901011C)、江苏省普通高校研究生科技创新计划(CX08B-113Z)及南京工业大学学科基金项目。
冯小海(1982—),男,博士后。联系人:徐虹,教授,博士生导师。电话 025-83172061;E-mail xuh@njut.edu.cn。

