Kit和KitL在卵泡发育过程中的作用
左 通,成佳兴
(东北农业大学生命科学学院,黑龙江 哈尔滨 150030)
在哺乳动物中,卵巢是重要的雌性生殖器官,主要由各级卵泡和黄体构成。在卵泡发育过程中,卵泡由原始卵泡发育成为初级卵泡、次级卵泡、三级卵泡和成熟卵泡。卵泡发育的调节机制目前仍不明确,因此进一步地阐述卵泡发育的调节机制对基础研究和临床应用都很重要,有助于因异常卵泡募集和发育而引起的不育症的治疗、避孕药物的研发、辅助生殖技术等方面。酪氨酸激酶受体Kit和其配体KitL分别在卵母细胞和颗粒细胞中表达,并在卵泡发育中发挥重要作用[1]。本文就Kit和KitL在卵泡发育中的作用及其作用机制做一综述。
1 Kit和KitL的概况
Kit是976个氨基酸的蛋白,属于跨膜酪氨酸激酶受体家族III型,其成熟蛋白的分子量为125~160kDa。Kit的配体 KitL(KIT LIGAND,stem cell factor,SCF)是248个氨基酸的单体,其中189个氨基酸在胞外域,23个氨基酸在跨膜部分,36个氨基酸在胞质区。KitL存在两种不同的形式,可溶性KitL(KitL1)和膜结合KitL(KitL2)[2]。Kit和KitL在造血干细胞和肥大细胞的维持和生存上起作用。Kit和KitL还在配子形成、黑素形成、血细胞形成过程中起重要作用[3]。Kit和KitL分别由steel和white spotting基因编码,这两个位点突变的小鼠可以证明,Kit和KitL在PGCs的生存、迁移、增殖,以及卵泡的发育中起作用[4]。KitL通过与Kit结合,激活了调节细胞凋亡的信号通路,并激活了PI3K通路,PI3K通路在卵母细胞生长中起重要的调节作用。
2 Kit-KitL在PGCs迁移和增殖过程中的表达和作用
在小鼠胚胎中,在PGCs迁移方向的体细胞上检测到KitL蛋白,且KitL的表达水平随着接近生殖嵴而逐渐增加,PGCs一旦定位在生殖嵴上(胚胎期12.5 d),KitL mRNA的表达也会随着迁移的停止而被限制在性腺中[5]。因此,KitL可能是指导PGCs定向迁移到生殖嵴的分子之一。在Kit基因突变的小鼠胚胎中,发现PGCs推迟迁移,并远离正常的迁移路径,异常地停滞和凝集在后肠中[6]。这些结果表明了KitL/Kit相互作用可能有利于指引PGCs迁移的方向。
Kit和KitL在PGCs增殖中起重要作用。在编码Kit基因和KitL基因双突变的小鼠中,PGCs的数量减少。最近研究表明,KitL在PGCs增殖中的作用可能依赖于KitL1/KitL2复合物的平衡。在体外培养时发现,当KitL2缺乏时,KitL1与成纤维生长因子(FGF)相互作用来促进PGCs的增殖。相反,当KitL2存在时,KitL1抑制FGF诱导的PGCs的增殖。此外,Zama等人用在steel位点等位基因突变的方法证明:KitL对迁移前后的PGCs增殖起不同的作用。该研究结果表明:在迁移前,PGCs在后肠的增殖过程中部分需要KitL,而PGCs一旦从后肠中迁移出后,PGCs的增殖则完全需要KitL[6]。
3 Kit-KitL在卵泡发育中的作用
在小鼠卵巢中,Kit在膜细胞和卵母细胞中表达,而KitL在颗粒细胞中表达。Kit在卵子发生时期的卵原细胞有丝分裂过程中大量表达,并且在卵母细胞发育的所有时期都表达。KitL mRNA在早期有腔卵泡的颗粒细胞中表达很高,在后期有腔卵泡的颗粒细胞中表达下降。卵母细胞与颗粒细胞之间存在着重要的相互作用。卵母细胞在生长、增殖、成熟和受精的全过程中始终与颗粒细胞通过间隙连接保持着联系,这种联系对卵母细胞和颗粒细胞的生长和增生都很重要。因此,Kit和KitL这一对受体-配体的相互作用,在卵母细胞和颗粒细胞的相互作用中也有着重要的意义。
3.1 Kit-KitL在原始卵泡的激活和卵泡生长过程中的作用
有关原始卵泡激活的机制还不清楚,目前认为原始卵泡的激活是自发的。Parrott和Skinner认为KitL对体外培养的大鼠卵巢的原始卵泡的自发激活是重要的,然而小鼠卵巢的体外培养表明原始卵泡的自发激活只能部分地被KitL的抗体抑制。在近年的研究中,采用基因敲入的方法使KitY719F突变,纯合KitY719F突变体雌性小鼠完成了原始卵泡激活并且是可育的,但发现原始卵泡衰竭加快,异常形态的初级/次级卵泡积累。这些结果表明,Kit在维持原始卵泡储量和初级向次级卵泡的过渡中起作用,但在原始卵泡激活中不是必要的[7]。
现已证明KitL可促进卵母细胞生长。Klinger和DeFelici从交配后15.5~16.5d的小鼠胚胎中收集直径约10μm的裸露的卵母细胞,并在不同条件下培养。在KitL的存在下培养4d,卵母细胞生长到19μm,几乎是空白对照组的2倍。添加起中和作用的Kit的抗体ACK-2后,卵母细胞生长受阻,表明KitL能促进卵母细胞的早期生长,诱导早期卵泡的发育。但4 d后卵母细胞不再继续生长,而将这些卵母细胞培养在颗粒细胞中3 d后,卵母细胞的直径增加到42 μm。发现添加KitL的卵母细胞生长比不添加KitL的显著,添加ACK-2后,这种差异减弱,但没有完全阻止卵母细胞生长,即KitL并不能单独促进卵母细胞后期的生长发育。该结果表明KitL在卵母细胞发育的不同时期起不同的作用[8]。
有证据证明Kitl2在卵母细胞生长中起关键作用。Thomas FH等人用KitL1或KitL2构建的载体转染到缺乏KitL的成纤维细胞中。从12天的小鼠中分离出生长的卵母细胞,并将其培养在被转染的成纤维细胞中2天。发现卵母细胞仅在产生KitL2的成纤维细胞的存在下生长,并且抑制KitL2的表达使卵母细胞生长受损。此外,KitL2使Kit表达上调并抑制了自发的GVBD。这些结果表明与KitL1相比,KitL2是调节卵母细胞生长和发育的主要亚型[9]。
3.2 Kit-KitL在卵母细胞成熟中的作用
Ismail等人将Kit反义核苷酸注射到处于减数分裂停滞的大鼠卵母细胞中,结果卵母细胞恢复减数分裂的能力增加。在体外培养的卵母细胞中添加KitL后,卵母细胞减数分裂会瞬时停止[4]。表明了Kit/KitL在卵母细胞生长中可能起维持减数分裂停滞的作用。
YE Y等人用DNA微点阵法分析了小鼠卵巢中的转录子,鉴定出KitL受LH/HCG峰的刺激,并在卵母细胞成熟中起促进作用。将卵泡,卵丘-卵母细胞复合体(COC)进行体外培养:HCG处理4 h后,发现KitL蛋白主要在排卵前卵泡和小有腔卵泡的颗粒细胞中表达,表明了颗粒细胞中的KitL受HCG的刺激;卵泡的体外培养证明了KitL的处理以剂量依赖的方式促进了第一极体的排出,且cyclinB1合成增加,其中cyclinB1对GVBD后的减数分裂进程是重要的。该实验结果表明KitL通过促进第一极体的排出,在排卵前的卵母细胞的成熟中起作用[10]。
4 Kit-KitL在卵泡发育过程中的作用机制
KitL结合到Kit上,Kit胞质区尾部的激酶区激活,并导致一系列胞内蛋白磷酸化,信号进一步传导使RAS,RAF,MAPK等因子激活,从而调节细胞凋亡的信号通路[2]。KitL的刺激也导致了PI3K的激活,PI3K在细胞增殖和生存中起重要作用。另外,一些生长因子,例如Activin和FGF7,也通过Kit/KitL通路介导。其中Activin在卵泡发育的调节中起自分泌和旁分泌的作用,并且是FSH合成和分泌的重要的调节者。在原始卵泡形成时期,Activin对生殖细胞的增殖和生存通过Kit/KitL通路介导[11]。Kit的抑制剂减弱了FGF7刺激卵母细胞生长的作用,表明FGF7可能通过Kit/KitL通路调节卵母细胞的生长[12]。总之,与Kit/KitL有关的这些信号通路,在卵泡发育过程中都起着重要的作用。
4.1 卵母细胞中的Kit-PI3K通路
PI3K是脂酶的一个家族,它可磷酸化磷脂类肌醇的3’-OH。PI3K是由催化亚基p110和调节亚基p85构成的异二聚体。PI3K通路是一个经典的信号通路,包含多种信号分子,建立了调节细胞增殖、生存、迁移和代谢的胞内多级信号通路。
最新实验证明了PI3K通路的组件包括丝氨酸/苏氨酸蛋白激酶(Akt)和Foxo3a(叉头转录因子,forkhead box O3a)、糖元合成酶激酶 3(Glycogen Synthase Kinase 3,GSK3)、P27[13](图1)。PI3K通路可在体细胞和癌细胞中被Kit激活。Kit在细胞质区域内募集PI3K到细胞膜上,并激活PI3K。PI3K被Kit激活后,磷酸化PIP2产生PIP3,然后PIP3从胞质募集包含脂结合结构域的蛋白,例如丙酮酸脱氢酶激酶-同工酶 1(3-Phosphoinositide-Dependent Kinase-1,PDK-1)和 AKT(图 1)。Akt随后被 PDK-1在苏氨酸308位点磷酸化而激活。激活的Akt包含多种底物,其中包括cAMP应答元件结合蛋白(cAMP-response element binding protein ,CREB),BAD和p27,它们可调节细胞生存和细胞周期的进入(图1)。Akt可磷酸化Foxo3a并使其在质膜上定位,而未磷酸化的Foxo3a会重新定位在细胞核上,作为转录因子调节凋亡和细胞周期停滞。Akt可在苏氨酸187位点直接磷酸化p27,并诱发p27从细胞核穿梭到细胞质,从而解除了p27抑制细胞周期和细胞生长的作用。Akt磷酸化GSK-3使其失活而促进糖元合成。Akt还可通过直接磷酸化哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR),mTOR通过激活p70核糖体 S6蛋白激酶(p70 ribosomal S6 kinase,p70S6k)和抑制4E结合蛋白1(4E-EP1)从而在细胞生长中起作用[14];其中p70S6k是核糖体70s亚基S6蛋白激酶,4E-EP1是真核起始因子,它们可直接调控蛋白质翻译(图1)。总之,激活的Kit-PI3K通路不仅促进细胞周期和细胞生长,还促进糖元合成和蛋白质翻译,直接促进卵母细胞生长,增强卵母细胞分泌的能力。
4.2 Kit-KitL-PI3K通路在卵母细胞生长的作用
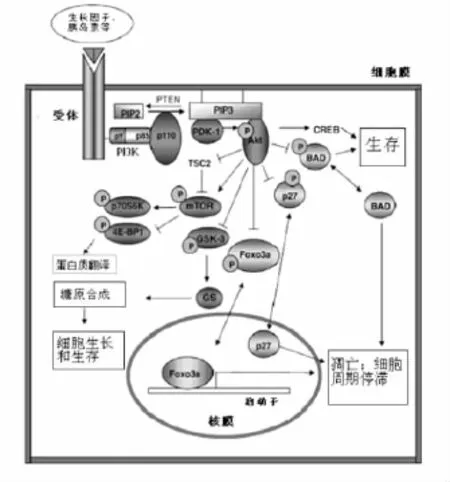
图1 Kit诱发激活的PI3K通路[15]
用KitL处理体外培养的卵母细胞,不仅使Akt激活和磷酸化,并导致Foxo3a以及GSK3α和GSK3β的磷酸化。特异的PI3K抑制剂LY294002使Akt和Foxo3a以及GSK3α和GSK3β的磷酸化受抑制。这表明了Kit诱导的PI3K通路是通过KitL-Kit-PI3K-Akt-Foxo3a和KitL-Kit-PI3K-AKT-GSK3途径传导的[15]。由于在原始卵泡和初级卵泡中的生长的卵母细胞中,PI3K通路中的信号不断地发生激活放大,因此Kit下游的PI3K通路对卵母细胞生长是重要的。
4.3 Kit-KitL-PI3K通路在卵母细胞凋亡中的作用
在近来的研究中,体外培养新生大鼠卵巢中的卵母细胞和初级卵泡,并检测了卵母细胞凋亡中Foxo3a的促凋亡作用以及潜在的信号转导途径。在初级卵泡的卵母细胞中,KitL通过PI3K/AKT启动了从Kit到Bcl-2家族成员的抗凋亡通路。在卵母细胞培养中,KitL不影响Foxo3a蛋白质的总水平,但迅速提高了Foxo3a的磷酸化水平。磷酸化的Foxo3a增加抑制了卵母细胞凋亡。PI3K/Akt的抑制剂LY294002解除了Foxo3a的磷酸化和KitL的抗凋亡作用。这些结果表明Foxo3a与新生的大鼠卵巢中的卵母细胞凋亡有关,且KitL-PI3K-Akt-Foxo3a介导了卵母细胞凋亡的信号通路[16]。
5 结语
Kit和KitL在PGCs的生存、迁移、增殖,以及卵子发生和早期卵泡发育过程中起重要作用。Kit下游的PI3K通路对原始卵泡积累,初级向次级卵泡的过渡,卵母细胞生长和凋亡是重要的。
Kit在卵母细胞中表达停止的原因和KitL在早期卵泡中卵母细胞生存上的作用机制还不清楚。深入研究Kit和KitL在卵泡发育中的调控机制,对探讨卵母细胞与颗粒细胞之间对话的分子基础和阐述卵泡发育障碍性疾病的发病机制有重要意义。
[1] Karla J,Hutt,Eileen A,et al.KIT/KITLigand in Mammalian Oogenesis and Folliculogenesis:Roles in Rabbit and Murine Ovarian Follicle Activation and Oocyte Growth[J].BiologyOf Reproduction,2006,75:421-433.
[2] FionaHThomas,BarbaraCVanderhyden .Oocyte- granulosacell interactions during mouse follicular development:regulation ofkit ligand expression and its role in oocyte growth[J].ReproductiveBiologyand Endocrinology,2006,4:19- 26.
[3] Ray P,Krishnamoorthy N,Ray A. Emerging functions ofc- kit and its ligand stem cell factor in dendritic cells:regulators ofTcell differentiation[J].CellCycle,2008,7(18):2826- 32.
[4] K J Hutt,E A McLaughlin,M K Holland.Kit ligand and c-Kit have diverse roles during mammalian oogenesis and folliculogenesis[J].Molecular Human Reproduction,2006,12(2):61-69.
[5] Marc-Antoine Driancourt et al.Roles of KIT and KIT LIGAND in ovarian function[J].Reviews of Reproduction,2000,5:143-152.
[6] ZamaAM,Hudson FP,BedellMA. Analysis ofHypomorphicKitlSl Mutants Suggests Different Requirements for KITL inProliferation andMigration ofMousePrimordialGermCells[J].Biol Reprod,2005,73:639- 647.
[7] John GB. Kit Signaling via PI3K promotes ovarian folliclematuration but is dispensable for primordial follicle activation[J].DevBiol.,2009,331(2):292- 9.
[8] F G Klinger,MD Felici.In Vitro Development of Growing Oocytes from FetalMouse Oocytes:Stage-Specific Regulation by Stem Cell Factor and Granulosa Cells[J].Dev Biol.,2002,244:85-95.
[9] Thomas F H.Kit ligand 2 promotes murine oocyte growth in vitro[J].BiolReprod.,2008,78(1):167-75.
[10] Ye Y. Kit ligand promotes first polar body extrusion ofmousepreovulatory oocytes [J].Reprod Biol Endocrinol,2009,7:26- 35.
[11] Coutts SM. Activin signals via SMAD2/3 between germ andsomatic cells in the human fetal ovaryand regulates kit ligandexpression[J].DevBiol ,2008,314(1):189- 99.
[12] ChoJ H.Fibroblastgrowth factor 7 stimulates in vitrogrowth ofoocytes originatingfrombovine earlyantral follicles[J].Mol ReprodDev,2008,75(12):1736-43.
[13] Kui Liu. Stem cell factor (SCF)- Kit mediatedphosphatidylinositol 3 (PI3)kinase signaling duringmammalian oocyte growth and earlyfollicular development[J].Frontiers inBioscience,2006,11:126- 135.
[14] Lian J. The mammalian target of rapamycin pathway and itsrole inmolecular nutrition regulation [J].MolNutr Food Res.,2008,52(4):393- 9.
[15] Liu L. Phosphorylation and inactivation ofglycogen synthasekinase- 3 by soluble kit ligand in mouse oocytes during earlyfollicular development [J].J Mol Endocrinol. ,2007,38(1- 2):137- 46.
[16] Liu H. FOXO3a is involved in the apoptosis ofnaked oocytesand oocytes of primordial follicles fromneonatal rat ovaries[J].Biochem Biophys Res Commun,2009,381(4):722- 7.

