昆虫来源的几丁质酶的分离纯化及酶学性质
刘明艳,张洪斌,胡雪芹,魏青丽
合肥工业大学化工学院制药工程系,合肥 230009
昆虫来源的几丁质酶的分离纯化及酶学性质
刘明艳,张洪斌,胡雪芹,魏青丽
合肥工业大学化工学院制药工程系,合肥 230009
几丁质酶在真菌和昆虫的生理和发育过程中起着关键作用,该酶本身及其酶抑制剂是获取生物农药的重要途径。本研究从蚕蛹体内提取几丁质粗酶,经硫酸铵分级沉淀和Sephadex G-150分离得到几丁质酶。用SDS-PAGE测得该酶的分子量为88 kDa。水解胶体几丁质的Km值为22.3 µmol/L。酶反应的最适温度为45℃,最适pH值为6.0,金属离子和有机试剂对几丁质酶活性都有影响,其中高浓度的Mn2+对酶有较强的激活作用,而Cu2+、SDS则有较强的抑制作用。研究结果为基于几丁质酶的生物农药筛选研究奠定了基础。
几丁质酶,分离纯化,酶学性质
Abstract:The importance of chitinases in the physiological and developmental processes of fungi and insects makes themselves and their inhibitors important targets for biological pesticides.A chitinase was isolated fromBombyx moriand purified to electrophoretic homogeneity by ammonium sulfate precipitation and Sephadex G-150 column chromatography.The molecular mass was estimated to be about 88 kDa by SDS-PAGE, while theKmwas calculated to be 22.3 µmol/L.Moveover, the optimal reaction temperature was 45°C, and the optimum pH was 6.0.The effect of metal ions and organic reagents on chitinase activity was investigated.The activity was enhanced by high concentration of Mn2+, while was strongly inhibited by Cu2+and SDS.These results provide a basis for screening the chitinase-based biological pesticide.
Keywords:chitinase, isolation and purification, enzyme properties
几丁质是由N-乙酰-D-氨基葡萄糖以β-1,4糖苷键连接而成的高分子聚合物,是构成大多数真菌细胞壁的主要成分,同时也广泛存在于软体动物以及节肢动物的外壳中。如在真菌、线虫、软体动物的表皮、昆虫的外骨骼和围食膜、甲壳动物的外壳和一些藻类的细胞壁中均含有几丁质[1-2]。几丁质不仅是昆虫的重要结构组分,而且也是昆虫防止机械损伤和生物危害的屏障,而包括人类在内的脊椎动物体内无几丁质成分。几丁质酶是一类能把几丁质降解为 N-乙酰-D-氨基葡萄糖或寡聚 N-乙酰胺基葡萄糖的水解酶,可以降解几丁质为低分子量、可溶或不可溶的寡糖[3]。该酶广泛存在于各种真菌、植物、昆虫和鱼类等生物中,催化水解昆虫几丁质的酶主要是几丁质酶,因此,研究获取昆虫来源的几丁质酶可以作为生物杀虫剂来控制昆虫和真菌病害。另外,几丁质代谢是真菌、昆虫等农作物病虫害生长发育的关键环节,在昆虫体内几丁质酶在其胚后发育中扮演关键角色,尤其是在幼虫蜕皮和化蛾阶段;为了生长和发育,昆虫必须周期性地强行通过蜕皮来形成一个新且松弛的角质层来取代旧的;脱皮前,昆虫通过分泌包含几丁质酶和蛋白酶的蜕皮液,来分别消化旧内表皮的几丁质和蛋白质,使表皮细胞从旧角质层分离,引发蜕皮[4]。因此,以在昆虫几丁质降解中的关键酶——几丁质酶为靶标,是理想的新型生物农药筛选模型。通过阻断几丁质酶,阻止昆虫蜕皮、化蛾和围食膜的再生,以达到杀灭昆虫的目的。综上可知,研究获取几丁质酶及其特性对于生物农药的创制具有重要意义。本论文从鳞翅目昆虫蚕蛹的化蛾后期中提取几丁质酶,对几丁质酶进行分离纯化,并对其酶学性质进行研究,为开发具有新型高效的生物农药奠定基础。
1 材料和方法
1.1 实验材料
蚕蛹购于安庆市潜山;蛋白质分子量标准购自大连TaKaRa公司;Sephadex G-150为Sigma公司产品,其他常用试剂均为分析纯。WFZ800-D38紫外分光光度计(北京瑞利分析仪器公司);KDC-160H高速冷冻离心机(科大创新股份有限公司中佳分公司);HH数显恒温水浴锅(江苏金坛市晶玻实验仪器厂);SPX-150B生化培养箱(上海博讯实业有限公司医疗设备厂)。
1.2 实验方法
1.2.1 胶体几丁质的配置[5]
称取2 g几丁质,加入20 mL 85%浓度的浓磷酸溶解,常温下放置 2 d后,加蒸馏水稀释,反复冲洗(采用离心分离)至pH 5.0以上。离心后的几丁质沉淀用蒸馏水调整终浓度至1%。
1.2.2 几丁质酶的分离纯化
以下若无具体说明,实验操作均在0℃~4℃进行。
1)粗提取:将蛹化后的蚕茧于 25℃培养箱培养8~10 d后至蚕茧中的蛹化蛾前,收集蚕蛹于0.1 mol/L pH 6.0磷酸缓冲液中均质,冰水浴中超声1 s,间歇 2 s,150 W 破碎 16 min,4℃、10 000 r/min离心30 min收集上清。
2)硫酸铵分级沉降:将固体硫酸铵研细加入粗酶液中,调至不同的饱和度(10%~80%),每次加入硫酸铵均需充分溶解,静置过夜,10 000 r/min离心15 min分离沉淀与可溶成分[6],每阶段沉淀用后测定酶活,确定最优沉降比例。
3)Sephadex G-150凝胶过滤层析:将经硫酸铵分级沉降后的沉淀用0.1 mol/L pH 6.0磷酸缓冲液溶解,过夜透析,浓缩后加样到已平衡的 Sephadex G-150凝胶过滤柱(3.0 cm×40 cm),用pH 6.0的磷酸缓冲液洗脱,流速 30 mL/h,收集洗脱液后经15% SDS-PAGE,考马斯亮蓝染色鉴定纯化蛋白。
1.2.3 酶活力测定
以 N-乙酰-D-氨基葡萄糖的生成速度测定酶活性大小。45℃下,以N-乙酰-D-氨基葡萄糖为标准,每小时产生 1 µmol/L N-乙酰-D-氨基葡萄糖所需的酶量为一个活力单位(U)[7-8]。
酶活力测定的原理:胶体几丁质+几丁质酶→N-乙酰-D-氨基葡萄糖。
在装有预热至45℃的0.5 mL 1%胶体几丁质和0.5 mL 0.1 mol/L磷酸缓冲液(pH 6.0)比色管中,加入0.5 mL酶液,于45℃温育1 h,沸水浴保持20 min中止反应,将沸水浴后的酶液置于冰浴冷却,冷却后加入1.5 mL DNS试剂,沸水浴20 min,冷却至室温后用蒸馏水定容到 25 mL,摇匀,离心后取上清,以灭活的等量酶液做空白对照,在波长500 nm下测吸光度,折算成酶活。
1.2.4 蛋白质含量测定
280 nm处的紫外吸收值用于色谱过程检测蛋白质洗脱峰。纯化各步骤的蛋白质浓度测定采用考马斯亮蓝染色法测定[9]。
1.2.5 SDS-PAGE分析
十二烷基磺酸钠-聚丙烯酰胺凝胶电泳用于分析蛋白质的分子量,分离胶浓度为15%,染色使用考马斯亮蓝R-250[10]。
1.2.6 酶学性质
1)酶的最适反应温度及热稳定性:在pH 6.0,0.1 mol/L磷酸缓冲液中,酶分别在30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃不同温度下测定酶活,考察酶的最适反应温度。将酶在不同温度下保温1 h,然后检测残余酶活力,以酶活最高者为100%,考察酶的温度稳定性。并将该酶在45℃、30℃和低温4℃保藏,取样测量保藏过程中酶活力的变化。
2)酶的最适反应 pH及 pH稳定性:在不同pH(5~9)的反应体系中测定酶活力,研究酶促反应的最适pH。将酶液分别置于不同pH的缓冲体系中45℃放置1 h,每个梯度相差一个1个pH,测定其对应的剩余酶活力,并以酶活最高者为 100%,研究酶的pH稳定性。将酶液置于最佳pH,最佳温度体系中保藏,取样测量保藏过程中酶活力的变化。
3)动力学常数 Km的测定:将酶液与不同浓度的胶体几丁质底物作用,测定酶反应的初速度,用Lineweaver-Burk双倒数作图法求出以1%胶体几丁质为底物的酶的Km值。
4)金属离子和其他试剂对酶活力的影响:在不同体系中分别加入各种金属离子和试剂,观察金属离子和试剂对酶活力的影响。
2 结果
2.1 几丁质酶的分离和纯化
几丁质酶在 25%~60%饱和度下沉淀出来(图1),几丁质酶的分离纯化结果见表1,以50 mL发酵液开始,几丁质酶从粗酶液到最后纯化产物共纯化了6.253倍,回收率为8.1%,纯化后酶的比活力为0.1901 U/mg(表 1)。图2为纯化过程中 Sephadex G-150凝胶过滤层析的色谱图。最后纯化结果达到了电泳纯,电泳结果见图3。

图1 几丁质酶在不同饱和度硫酸铵中的溶解曲线Fig.1 Dissolution curve of chitinase in different(NH4)2SO4saturation.

表1 几丁质酶的纯化Table 1 Purification of chitinase

图2 Sephadex G-150凝胶过滤色谱图Fig.2 Gel filtration chromatography of chitinase by Sephadex G-150.
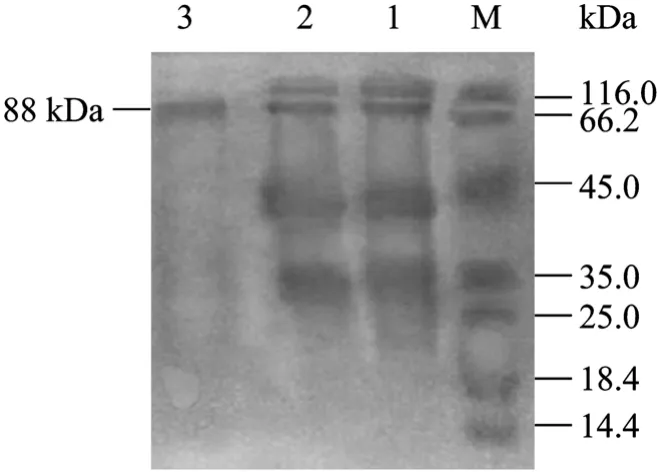
图3 SDS-PAGE检测几丁质酶的纯化Fig.3 SDS-PAGE analysis of the purified chitinase.M:protein marker; 1: crude chitinase; 2: chitinase of(NH4)2SO4; 3:purified chitinase.
2.2 酶学性质研究
2.2.1 酶的最适温度及热稳定性
酶在不同温度下测定的酶活结果见图4,该酶的最适反应温度为45℃左右,在50℃以上酶活急剧下降。酶在 30℃保温 1 h后剩余活力为原来的95.31%,45℃以上保温1 h后酶活大幅下降,达到60℃保温1 h后酶几乎全部失活,表明该酶对热较敏感(图4)。将酶置于4℃、30℃、45℃保藏并取样测量酶的剩余酶活力,结果见表2。酶在4℃下保藏17 h剩余活力为93.70%,8 d后剩余活力仍有原来的68.37%,说明酶在4℃低温下热稳定性好;45℃保温3 h活力仅剩34.28%,说明该酶在45℃以上热稳定性差。
2.2.2 酶的最适反应pH值及pH稳定性
实验结果表明(图5),该酶催化合成反应的最适pH值为6.0,在pH 5~7之间活力较好,当反应pH升到7.0以上,酶活下降比较快。酶的pH稳定性实验结果表明该酶在pH值为5.0~7.0的条件下,稳定性相对较好,一旦高于这个范围,酶活降低较快。

图4 温度对几丁质酶酶活的影响Fig.4 Effect of temperature on the activity and stability of chitinase.1: enzyme activity; 2: relative stability.

表2 温度、时间对几丁质酶酶活稳定性的影响Table 2 Effect of temperature and time on the stability of chitinase
2.2.3 动力学常数Km的测定
分别以0.2%、0.6%、1.0%、1.4%、1.8%的胶体几丁质为底物,测定底物反应速率,用Lineweaver-Burk双倒数作图法,求得 Km值为22.3 µmol/L(图6)。
2.2.4 金属离子和其他试剂对酶活力的影响
金属离子和其他试剂对酶活力的影响实验结果见表3,较高浓度的Mn2+有对酶活有促进作用,0.1 mol/L Mn2+能提高酶活达132.53%,但0.01 mol/L的Mn2+对酶活有抑制作用。实验中所选用其他离子对酶催化活力均有不同程度的抑制作用,其中 Cu2+对酶活有较强的抑制作用,Mg2+、Ca2+、Al3+、Zn2+有微弱的抑制作用。SDS对酶活力抑制最强,0.01 mol/L的SDS抑制了74%左右的活力,Urea只有较弱的抑制作用。
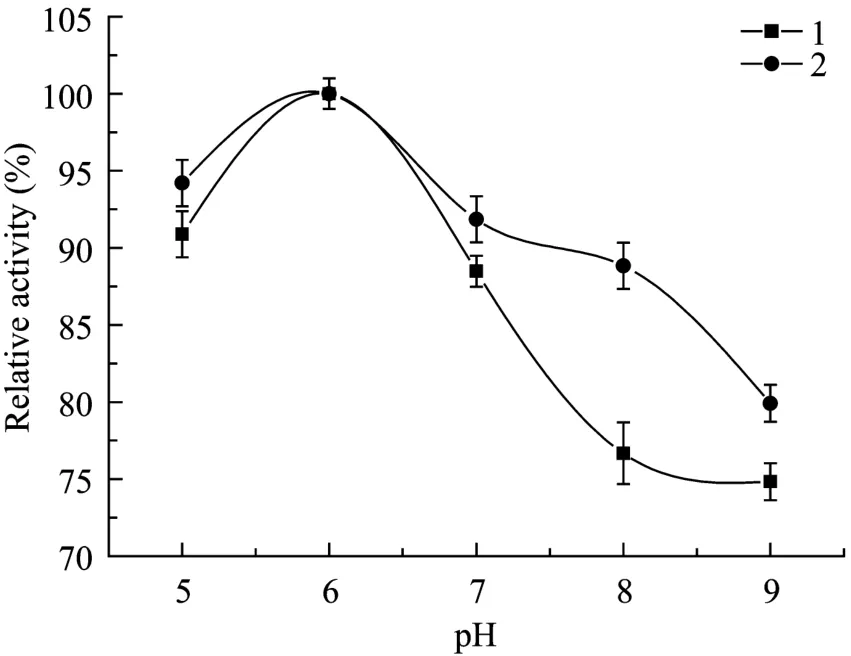
图5 pH对几丁质酶酶活力及稳定性的影响Fig.5 Effect of pH on the activity and stability of chitinase.1:enzyme activity; 2: relative stablity.

图6 几丁质酶的Lineweaver-Burk图Fig.6 Lineweaver-Burk polts of chitinase.
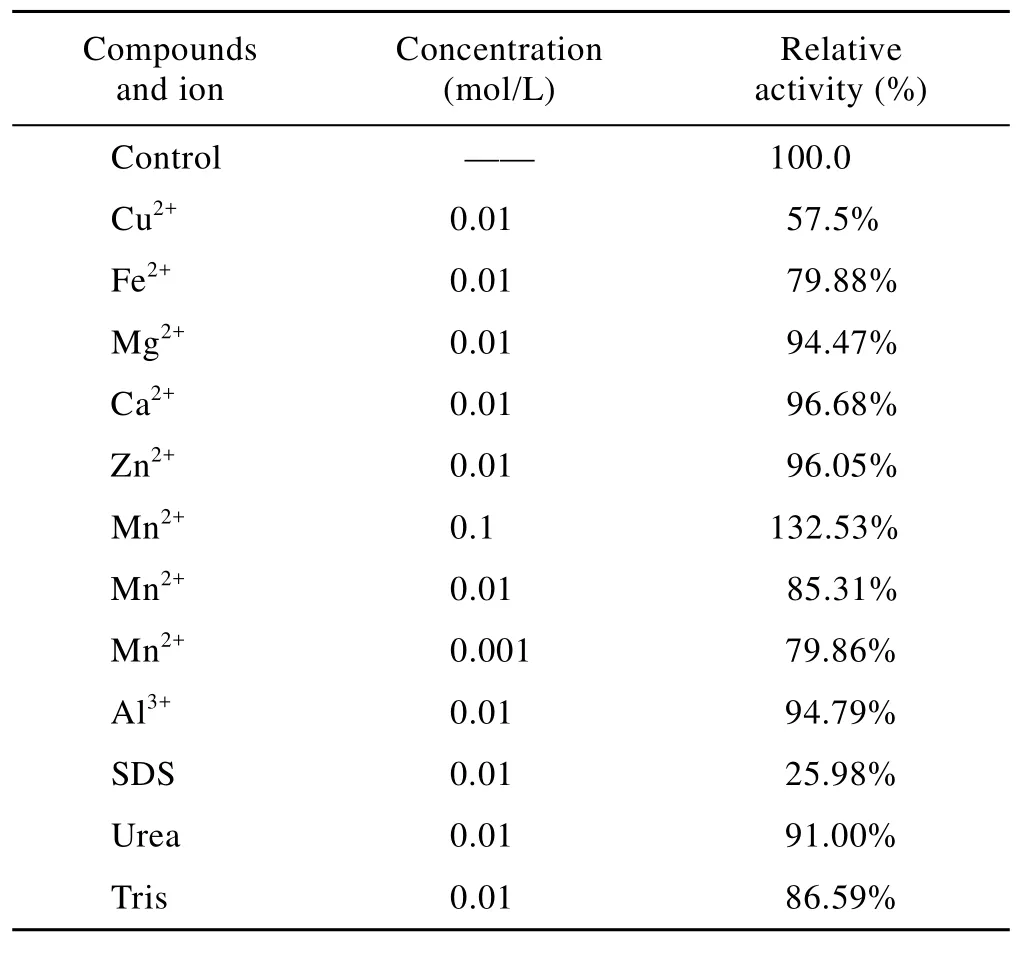
表3 金属离子和其他试剂对酶活力的影响Table 3 Effect of some compounds and metal ions on activity
3 讨论
几丁质酶是一类差异较大的水解酶类,按照水解几丁质链的方式不同可分为 3种,包括外切酶、内切酶和N-乙酰氨基葡萄糖水解酶。内切酶随机地切开几丁质的β-1,4糖苷键,而外切酶从链的非还原端开始切割几丁质,形成(GlcNAc)2,N-乙酰氨基葡萄糖水解酶水解(GlcNAc)2成GlcNAc或是从N-乙酰壳寡糖的非还原端产生GlcNAc[11]。根据催化区域氨基酸序列的相似度,几丁质酶又分为18家族或19家族的氨基水解酶[12]。18家族几丁质酶广泛存在于细菌、真菌、病毒、动物和一些植物的体内,19家族几丁质酶只存在于高等植物体内,但是近来在灰色链霉菌Streptomyces griseus中也有发现[13]。
许多文献已报道了不同来源的几丁质酶的分离纯化及性质研究,但有关从鳞翅目昆虫蚕蛹体内分离到的几丁质酶的分离纯化及性质研究少有报道。本研究从家蚕体内提取到分子量为88 kDa的几丁质酶,并对其性质进行一系列的研究。该酶以胶体几丁质为底物,水解胶体几丁质为N-乙酰氨基葡萄糖(GlcNAc),属于18家族几丁质酶中的一种酶,为外切酶。该酶的最适温度为45℃;该酶的最适pH值为 6.0;较高浓度的 Mn2+对酶活有促进作用,除此之外实验中所选用的其他离子对酶催化活力均有不同程度的抑制作用,其中 Cu2+对酶活的抑制作用较强,Mg2+、Ca2+、Al3+、Zn2+有微弱的抑制作用,SDS对酶活抑制最强,0.01 mol/L的SDS抑制了74%左右的活力。与已有的报道相比较,在酶的分子量、最适温度、最适pH值以及金属离子对酶活力的影响等方面均有差异。Lee 等从青霉菌 Penicillium sp.LYG 0704中提取的几丁质酶的分子量为47 kDa,其最适pH为5.0左右[14];Van-Nam Nguyen等从拟青霉属变曲霉Paecilomyces variotii DG-3中纯化后的几丁质酶有2种,其分子量分别为32 kDa和46 kDa[15];Crispinus等从绿色木霉 Trichoderma viride中纯化几丁质酶最适 pH为 3.5,pH值在3.5~6.0范围内,酶的活性较为稳定[16]。这些差异的产生,可能与因不同来源所产酶的性质有所不同,也可能与分离纯化条件不尽相同等相关。据文献报道[17],几丁质酶的最适 pH与所用底物的分子量有关,如以羟乙基几丁质为底物的酶的最适pH为4.0左右,以GlcNAc5为底物的酶的最适pH为10.0左右。实验中酶的最适温度为 45℃,Babiker等[18]报道54 kDa和65 kDa的几丁质酶的最适温度分别为20℃和30℃。因此,同工酶中分子量越大的几丁质酶在高温下越稳定。金属离子对酶的活力起到了促进或抑制的作用,如 Cu2+对酶的抑制作用明显,这主要是因为 Cu2+能直接作用于酶活性位点中的组氨酸,与巯基形成复合物并能与咪唑环结合[19]。
本实验确定了蚕蛹提取液硫酸铵分级沉淀的范围,达到了浓缩与初步纯化几丁质酶的目的,为进一步使用凝胶层析纯化该酶打下了基础。几丁质酶从粗酶液到最后纯化产物共纯化了 6.253倍,回收率为8.1%。活力较低可能是由于粗酶中不同亚型的协同作用,也可能是在纯化过程中Sephadex G-150凝胶过滤层析一步中损失较多。
以上关于昆虫几丁质酶的分离纯化及其特性的研究结果,为利用该酶进行生物防治以及以此酶为靶标进行酶抑制剂的筛选提供了基础数据,进而为新型高效的生物农药创制打下基础。
REFERENCES
[1]Fukamizo T, Kramer KJ.Mechanism of chitin hydrolysisby the binary chitinase system in insect moulting fluid.Insect Biochem, 1985, 15: 141−145.
[2]Fukamizo T, Kramer KJ.Effect of 20-hydroxyecdysone on chitinase and β-N-acetylglucosaminidase during the larval-pupal transformation ofManduca sexta(L.).Insect Biochem, 1987, 17: 547−550.
[3]Xiao YC, Luo XB, Feng PF,et al.Progress of insect chitinase research.Biotechnol, 2003, 13(1): 38−39.肖业臣, 罗晓斌, 冯佩富, 等.昆虫几丁质酶的研究进展.生物技术, 2003, 13(1): 38−39.
[4]Yang HE, Liu SZ, Li YZ,et al.Chitin synthase from insects and its inhibitors.Chinese Bull Entomol, 2007,44(5): 769−773.杨化恩, 刘守柱, 李友忠, 等.昆虫几丁质合成酶及其抑制剂.昆虫知识, 2007, 44(5): 769−773.
[5]Jeuniaux C.Chitinases.Method Enzymol, 1966, 8: 644−650.
[6]Lai QA, Liu ST, Lu WH,et al.Expression inEscherichia coli, purification and enzymatic properties of chicken aminopeptidase H.Chin J Biotech, 2008, 24(3): 381−386.赖庆安, 刘树淘, 卢菀华, 等.鸡氨肽酶 H 在大肠杆菌中的表达、纯化与部分酶学性质分析.生物工程学报,2008, 24(3): 381−386.
[7]Imoto T, Yagishita K.A simple activity measurement of lysozyme.Agric Biol Chem, 1971, 35: 1154−1156.
[8]Xin FX, Wang P, Zhong SH,et al.Expression,purification and characterization of N-glycanase fromSchizosaccharomyces pombeinEscherichia coli.Chin J Biotech, 2008, 24(4): 592−597.信丰学, 王鹏, 钟盛华, 等.粟酒裂殖酵母 N-糖酰胺酶在大肠杆菌中的表达、纯化及活性分析.生物工程学报,2008, 24(4): 592−597.
[9]Li HY, Jin Y, Zhang W,et al.Purification and characterization of a bromoperoxidase fromGracilaria lemaneiformis.Chin J Biotech, 2008, 24(4): 662−666.李海燕, 靳艳, 张卫, 等.龙须菜中溴过氧化物酶的分离纯化及酶学性质分析.生物工程学报, 2008, 24(4):662−666.
[10]Wang JZ, Fan M.Protein Technical Manual.Beijing:Science Press, 2000: 77−124.汪家政, 范明.蛋白质技术手册.科学出版社, 2000:77−124.
[11]Tanaka T, Fukui T, Imanaka T.Different cleavage specificities of the dual catalytic domains in chitinase from the hyperthermophilic archaeonThermococcus kodakaraensisKOD1.J Biol Chem, 2001, 276: 35629−35635.
[12]Henrissat B.A classification of glycosyl hydrolases based on amino acid sequence similarities.Biochem J, 1991,280: 309−316.
[13]Ohno T, Armand S, Hata T,et al.A modular family 19 chitinase found in the prokaryotic organismStreptomyces griseusHUT 6037.J Bacteriol, 1996, 178: 5065−5070.
[14]Lee YG, Chung KC, Wi SG.Purification and properties of a chitinase fromPenicilliumsp.LYG 0704.Protein Express Purif, 2009, 65: 244−250.
[15]Nguyen VN, Oh IJ, Kim YJ,et al.Purification and characterization of chitinases fromPaecilomyces variotiiDG-3 parasitizing onMeloidogyne incognitaeggs.J Ind Microbiol Biotechnol, 2009, 36(2): 195−203.
[16]Omumasaba CA, Yoshida N, Ogawa K.Purification and characterization of a chitinase fromTrichoderma viride.Gen Appl Microbiol, 2001, 47: 53−61.
[17]Yamamoto Y, Fukunaga Y, Aoyagi H.Purification and characteristion of chitinase secreted by culturedWasabia japonicacells.J Ferment Bioeng, 1995, 2: 148−152.
[18]Babiker MA, Banat YK, Kameyama Y,et al.Purification and characterization of a 54 kDa chitinase fromBombyx mori.Insect Biochem Mol Biol, 1999, 29: 537−547.
[19]Lencki RW, Delaire M, Tecante A,et al.Effect of ferric and cupric ions on the inactivation rate of dextransucrase.Appl Microbiol Biotechnol, 1994, 42(263): 263−269.
Purification and characterization of a chitinase from Bombyx mori
Mingyan Liu, Hongbin Zhang, Xueqin Hu, and Qingli Wei
Department of Pharmaceutical Engineering, Hefei University of Technology, Hefei 230009, China
Received:October 26, 2009;Accepted:January 22, 2010
Supported by:International Science & Technology Cooperation Plan of Anhui Province(No.08080703017), National Innovative Experimental Design of Hefei University of Technology(Nos.2009CXSY131, 091035945).
Corresponding author:Hongbin Zhang.Tel/Fax: +86-551-2901968; E-mail: zhb5678@163.com安徽省国际科技合作计划项目(No.08080703017),国家及合肥工业大学大学生创新性实验计划项目(Nos.2009CXSY131, 091035945)资助。

