植物同源结构域指蛋白在拟南芥等十字花科植物春化作用途径中的功能
胡功铃,陈国平,胡宗利,顾峰,李勇
重庆大学生物工程学院,重庆 400030
植物同源结构域指蛋白在拟南芥等十字花科植物春化作用途径中的功能
胡功铃,陈国平,胡宗利,顾峰,李勇
重庆大学生物工程学院,重庆 400030
春化低温处理可以使拟南芥等十字花科植物提前开花,该过程中涉及到一个重要的植物同源结构域指(PHD-finger)蛋白VERNALIZATION INSENSITIVE 3(VIN3)。PHD-finger结构域是真核生物中一种进化保守的锌指结构域,通常参与蛋白质之间的相互作用,特别是对核小体组蛋白进行甲基化、乙酰化、磷酸化等修饰。在春化处理过程中,VIN3及其同源基因编码的蛋白都具有PHD-finger结构域,该结构域通过对开花抑制基因FLOWERING LOCUS C染色质组蛋白进行H3K9、H3K27甲基化、H3K9和H3K14去乙酰化等修饰,调节FLC染色质结构状态,使其从松弛状态转变为高度凝缩状态而关闭其功能,从而影响FLC转录活性进而促进开花。以下综述了拟南芥等十字花科植物春化作用途径中PHD-finger蛋白的功能,并且概述了春化作用机制。
植物同源结构域指蛋白,VIN3,FLOWERING LOCUS C,春化作用,组蛋白修饰
Abstract:Vernalization makes Arabidopsis and other cruciferous plants flowering earlier.During this process, an important plant homeodomain-finger(PHD-finger)protein named VIN3 is involved.The PHD domain was a conserved zinc-finger domain in eukaryotic organism.It used to take part in the interaction between proteins, especially the modification on histone of nucleosome,such as methylation, acetylation and phosphorylation.In vernaliazation pathway, the proteins translated by VERNALIZATION INSENSITIVE 3(VIN3)and homologous genes could result in methylation on H3K9 and H3K27 and deacetylation on H3K9 and H3K14 on chromatin histone of FLOWERING LOCUS C, a gene that inhibited flowering.The structure state of FLC would be changed from relaxation into compression.Then the transcription activity of FLC could be restrained and it couldn’t inhibit flowering any more, so it would induce flowering earlier.This paper reviewed the function of PHD-finger proteins in vernalization pathway in Arabidopsis and other cruciferous plants, and overviewed the vernalization mechanism.
Keywords:plant homeodomain-finger proteins, VIN3, FLOWERING LOCUS C, vernalization, histone modification
目前,本实验室在研究菜薹Brassica campestris L.ssp.chinensis var.utilissen.et Lee 早花原因的过程中发现春化处理(Vernalization)可以使菜薹提前开花10~20 d。根据拟南芥Arabidopsis及其芸薹属相关领域的研究报道,本研究将重点放在开花网络核心基因FLOWERING LOCUS C(FLC)及其春化作用途径上游的关键基因 VERNALIZATION INSENSITIVE 3(VIN3)上。研究发现,长时间(大于20 d)的低温处理会诱导VIN3的表达,并使FLC表达量降低,此时菜薹的表型为早花。在模式植物拟南芥中很早前就有过这种现象的相关报道,并且对VIN3有较深入的研究。VIN3编码一个 PHD-finger蛋白,在春化作用中起着重要的作用。近年来,对PHD-finger蛋白在拟南芥春化作用途径中的功能已有了一些报道。以下简要介绍PHD-finger结构域的结构与功能,并主要介绍 VIN3及其同源基因编码的PHD-finger蛋白在拟南芥等十字花科植物春化作用途径中的功能。
1 植物开花的多种途径
成花是高等植物个体发育的中心环节,是植物由营养生长转向生殖生长的一个重要生理过程。环境因素对这个过程具有很大的影响,春化作用便是其中一个重要因素[1]。所谓春化作用,是指对植物进行低温处理促进其开花的过程。对拟南芥的研究发现,影响开花的因素主要有4种途径:光周期途径、赤霉素途径、自主途径和春化作用途径[2]。其中,光周期途径和赤霉素途径通过激活开花整合基因FLOWERING LOCUS T(FT)和SUPPRESSOR OF OVEREXPRESSION OF CO 1(SOC1)促进植物开花[3-4]。自主途径和春化作用途径通过抑制FLOWERING LOCUS C(FLC)的表达促进开花(图1)。FLC编码 MADS-box转录因子,通过抑制 FT和SOC1的表达抑制植物开花[2]。
依赖春化作用的开花途径是指植株营养生长阶段必须经过一定时期的低温才能获得向生殖生长转变的潜能,在适宜条件下开花。在拟南芥的研究中发现,春化低温处理诱导了春化作用关键基因VIN3的表达[5]。VIN3编码一个PHD-finger蛋白,对开花抑制基因FLC起负调控作用[5]。VIN3只在长时间低温处理条件下才能被诱导表达,在植株返回常温条件后则无法再检测出VIN3,但FLC仍呈现被抑制状态[5],此时对FLC的抑制需要VERNALIZATION 1(VRN1)和VERNALIZATION 2(VRN2)等基因的维持。VIN3对FLC的抑制效应主要是通过其编码的PHD-finger蛋白对FLC染色质组蛋白H3K9和H3K27的甲基化以及H3K9和H3K14的去乙酰化修饰[5],使FLC的染色质从松弛状态转变为高度凝缩状态而关闭FLC功能,最终抑制其表达。
2 PHD结构域的序列、结构及其功能
春化处理诱导了关键基因VIN3的表达,其编码一种PHD锌指蛋白。真核生物中的许多蛋白质包含锌指结构区,这类蛋白称为锌指蛋白。锌指蛋白包含特殊的指状结构,在对DNA、蛋白质和RNA的识别和结合中起重要作用[6]。PHD锌指结构域是14种已知的锌指结构域(Zinc-binding motif)中的一种,存在于 400多种真核生物蛋白质中,在进化过程中高度保守[7]。1993年,Schinder等在研究拟南芥蛋白HAT3.1和HOXIA时发现了一段富含半胱氨酸的保守序列,而这段序列与金属离子的结合结构域非常相似[8],这段区域就是PHD结构域。
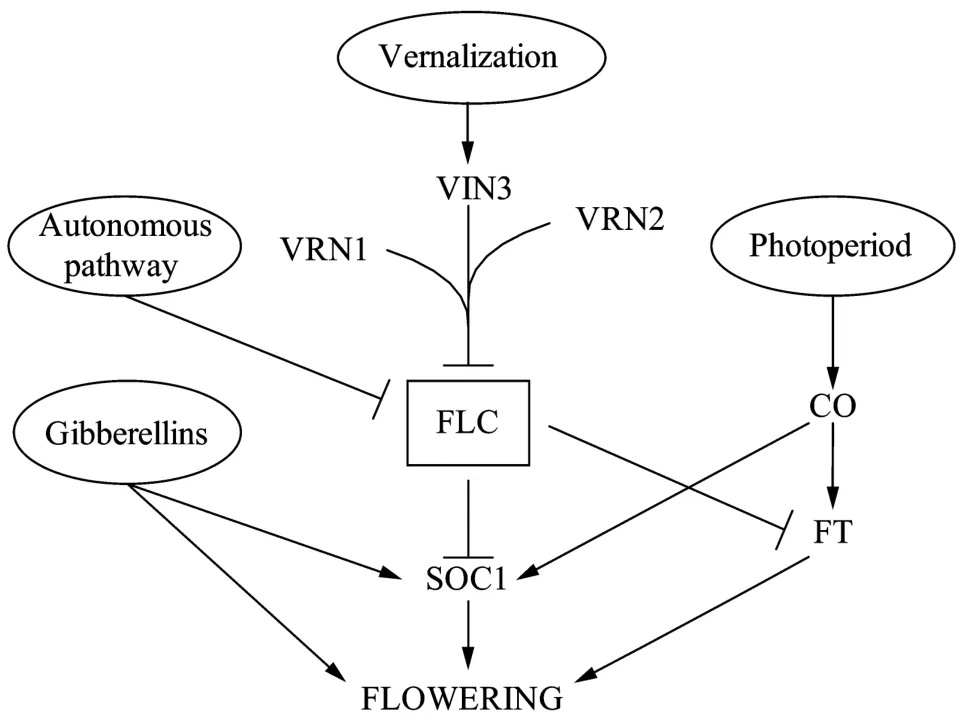
图1 拟南芥的多种开花调控途径Fig.1 Pathways regulating flowering time in Arabidopsis.Lines with arrows indicate activation of gene expression and lines with bars for gene repression.
PHD结构域是一类由约60个氨基酸残基组成的具有 C4HC3(cys4-His-cys3)保守序列的结构(图2),属于“cross-brace”锌指蛋白家族(Cross-brace zinc finger protein)[9]。从拟南芥以及芸薹属中克隆获得的VIN3及其同源VEL家族基因编码的氨基酸序列中都含有PHD结构域,并且具有保守的C4HC3序列结构(图2)。其中,BrVIN3(Ten Bank Accession No.FJ936115)基因片段为本实验室首次从芸薹属中获得,与AtVIN3(Ten Bank Accession No.NM_125121.3)有很高的同源性,且表达模式类似,并且其编码的氨基酸序列中含有保守的PHD结构域。PHD结构可以结合2个锌离子,以pygoupus蛋白为例,分别在C1、C2、H1和 C5上结合第一个锌离子以及 C3、C4、C6和C7上结合第2个锌离子,使得在PHD结构域内形成2个环的稳定结构[10]。本研究推测菜薹中的PHD-finger蛋白VIN3也具有与pygoupus蛋白类似的锌蛋白交叉支架结构(图3)。该结构使得VIN3具有很多生理功能,例如参与蛋白与蛋白之间的相互作用、核小体组蛋白的修饰等。
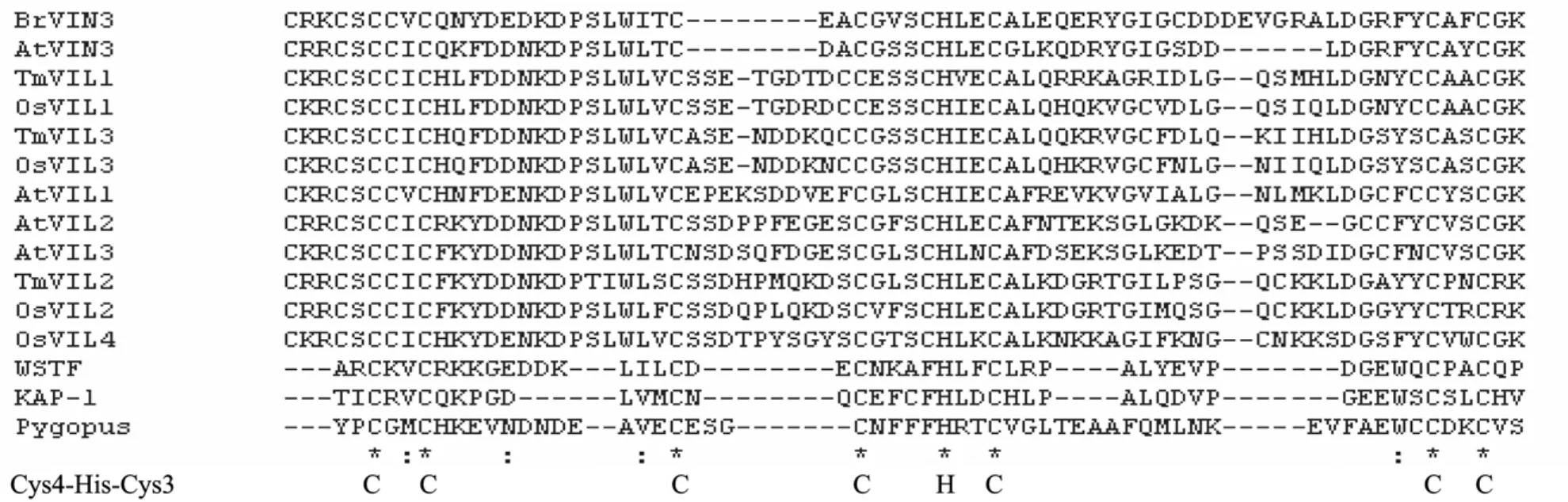
图2 不同蛋白质PHD结构域氨基酸序列比对Fig.2 Alignment of PHD finger sequences among different proteins.Asterisk means the C4HC3 conservative structure.
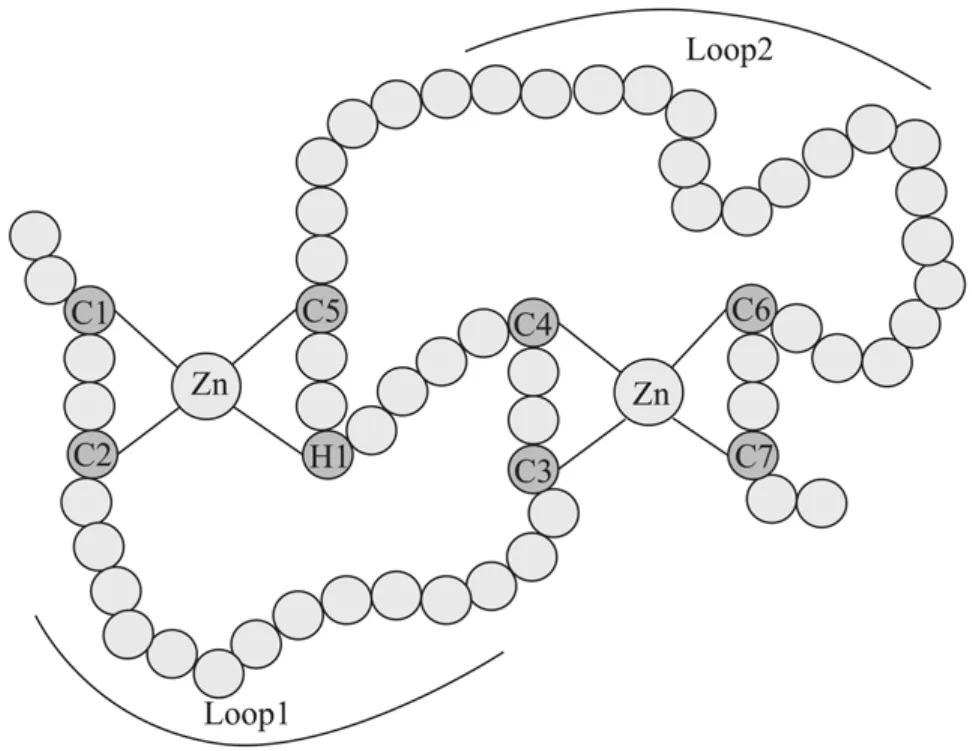
图3 BrVIN3蛋白PHD结构域的cross-brace模型预测Fig.3 Anticipation of cross-brace model of the PHD-finger of BrVIN3, based on the cross-brace model of the PHD-finger of Pygous[11].
各种PHD结构域蛋白的PHD三维结构大致相同,为球状结构域。但随不同PHD结构域氨基酸残基序列的差异,其三维结构也会有细微差异,正是这种差异性,赋予了PHD结构域家族成员不同的生物学功能。例如,原癌蛋白c-Cbl 和MEKK1(MAP kinase/ERK kinase kinase)的PHD结构域具有E3泛素连接酶活性,介导 ERK1/2的泛素化和降解[12];WSTF、KAP-1、Mi-2β以及AIRE等PHD锌指蛋白在细胞核中发现,推测这类锌指可能通过其 loop2表面与特异的核蛋白相互作用,从而参与染色质重塑的调控[6]。此外,PHD结构域能够特异性识别并结合组蛋白H3K4的甲基化密码(修饰),从而发挥基因转录调控功能。在拟南芥的春化作用途径中,涉及到VIN3等PHD-finger蛋白对FLC染色质组蛋白的修饰,而这种修饰参与了开花关键基因转录活性的调控,与开花时间有密切的联系。同样,在芸薹属中,本实验室首次克隆了BrVIN3,由于BrVIN3与AtVIN3具有较高的同源性,进而推测VIN3也参与了FLC组蛋白的修饰,并且具有与AtVIN3类似的功能。
3 春化作用途径中的PHD-finger蛋白及其功能
目前,对于拟南芥中春化作用的分子机理已经有较深入的研究,但对其表观遗传机制尚不十分明确。近年来,对于FLC染色质组蛋白的修饰有较多的报道,组蛋白的修饰与春化作用促进开花是密切相关的。FLC在拟南芥的开花调控网络中处于枢纽位置(图1),在其上游基因FRIGIDA(FRI)等的正调控作用下抑制成花[13]。研究表明,FLC的表达水平与植株低温处理的时间呈量的关系,低温处理时间越长,则FLC的表达越弱[14]。FLC染色质的组蛋白上发生了许多共价修饰[9],这些修饰与FLC的转录水平密切相关,这就涉及到了“组蛋白密码”理论。
3.1 组蛋白密码
染色质基本结构单位——核小体由DNA和4种组蛋白(Histone)H2A、H2B、H3和H4构成。每一种组蛋白各2个分子,形成一个组蛋白八聚体,约200 bp的DNA分子盘绕在组蛋白八聚体构成的核心结构外面,这就形成了一个核小体。核心组蛋白八聚体中央是由组蛋白H3和H4形成的异四聚体,侧翼是组蛋白H2A和H2B形成的异二聚体。每个组蛋白的氨基端约20~35个富含基本氨基酸的片段延伸到核小体的表面称为“组蛋白尾”(Histone tail)[15]。组蛋白尾在空间结构上相对可变,由于与核内各种蛋白质或酶直接接触而被修饰,包括乙酰化、磷酸化、甲基化、泛素化等(图4)[16]。经过修饰的组蛋白,可以改变染色质的状态而促使染色质结构重塑,参与基因的转录表达调控。
当染色质处于高度凝缩状态时,该染色质上的基因就可能不表达,但当染色质处于松弛状态时,该基因就可以作为模板而被转录表达[17]。在组蛋白上发生特定的共价修饰后,可以引起基因位点染色质状态的改变,从而影响基因的表达水平。一旦组蛋白被修饰之后,特定的共价修饰可以被特异性的绑定蛋白识别,而这些绑定蛋白可以招募一些激活或者抑制基因表达的复合物使得染色质形成更高层次的结构,再通过细胞传代使该结构得以维持[9],从而保持激活或抑制靶基因的稳定状态,这就是组蛋白密码理论。在春化作用途径中,涉及到FLC染色质组蛋白的甲基化、乙酰化等修饰,而这些修饰与VIN3等PHD-finger蛋白密切相关。
3.2 春化作用途径中的关键 PHD-finger蛋白对FLC染色质组蛋白的修饰
3.2.1 春化处理前FLC染色质组蛋白H3K4的甲基化和H3K9、H3K14的乙酰化

图4 各种组蛋白尾的修饰[16]Fig.4 Post-translation modifications of the histone tails[16].P: phosphorylation; Ac: acetylation; Me: methylation; Ub: ubiquitin.
未经春化处理时,开花抑制基因 FLC的表达处于较高水平,这与其染色质上H3K4的三甲基化有很直接的关系。H3K4的甲基化一般以3种状态存在:单甲基化、二甲基化和三甲基化[18]。研究发现,H3K4的三甲基化可以激活基因的表达[19]。在酵母中,RNA聚合酶Ⅱ结合因子PAF1复合物与RNA聚合酶Ⅱ在转录过程中结合,招募 H3K4甲基化转移酶 SET1与目的基因结合,使其在转录激活区域的 5′端三甲基化,从而使三甲基化水平上升[18]。在拟南芥中,与酵母中 PAF1复合物功能类似的同源基因分别为EARLY FLOWERING 7(ELF7)、EARLY FLOWERING 8(ELF8)、VERNALIZATION INDEPENDENCE 4(VIP4),与酵母中 SET1甲基化酶作用类似的为EARLY FLOWERING IN SHORT DAYS(EFS)基因,推测酵母与拟南芥中H3K4的甲基化机制是相似的。在elf7和elf8突变体中,FLC染色质组蛋白的甲基化水平降低,表现为早花,这说明PAF1类复合物是FLC染色质组蛋白 H3K4三甲基化所必需的[20]。H3K4的二甲基化也可以激活基因的表达[19]。在酵母中的研究发现,某些转录基因(如 MET16)染色质组蛋白H3K4的甲基化要求Isw1p(酵母ATP水解产物,染色质重塑蛋白)的参与[21]。在拟南芥中,功能与其类似的基因为PIE1,该基因是FLC表达所必需的[18]。PIE1可能通过绑定H3K4等修饰位点引起FLC染色质的重塑,提高其表达水平进而抑制植物成花。
此外,在未春化处理植株中,组蛋白 H3K9和H3K14的乙酰化保持较高的水平,可以促进FLC的表达[1]。核心组蛋白 N端的末端富含赖氨酸,生理条件下带正电,它可与带负电的DNA或相邻的核小体发生作用,导致核小体构象紧凑及染色质高度折叠,该状态下FLC不表达或者表达很弱。乙酰化使组蛋白与 DNA间的作用减弱从而导致染色质构象松散,这种构象有利于转录调节因子的接近并结合,促进基因的转录。综上所述,在未春化处理时,FLC在特定甲基化和乙酰化的协同作用下保持高水平表达。
3.2.2 春化处理后FLC染色质组蛋白H3K9、H3K27的甲基化和H3K9、H3K14的去乙酰化
对拟南芥的研究表明,经过春化处理后,FLC染色质组蛋白 H3K9、H3K27的二甲基化和三甲基化水平升高,植株表现为早花。该过程依赖于关键基因VIN3,VIN3具有感受低温时程的特性。冬性一年生拟南芥只有经过足以产生春化效应的一段时期的低温处理后,VIN3才会被诱导表达,一般时间为20 d[5]。如处理时间不够,VIN3不会被诱导表达,也就不会产生下游的春化效应。当VIN3被诱导表达后,FLC的表达随即被抑制,因而VIN3的作用是在春化过程中识别低温处理的时间进而建立对春化关键基因 FLC表达的抑制[22]。VIN3编码一个PHD-finger蛋白,可以参与核小体组蛋白的甲基化、去乙酰化等修饰,引起染色质结构的重塑。VIN3被诱导后,FLC染色质组蛋白上的H3K9和H3K27发生二甲基化和三甲基化,同时,H3K4的三甲基化和H3K36的甲基化消失[23],该机制目前尚不清楚。此外,FLC所在染色质的组蛋白H3发生了去乙酰化,包括 H3K9、H3K14 的去乙酰化修饰[5]。去乙酰化后,FLC染色质重新回到高度凝缩状态使其表达受到抑制。
Sung等在拟南芥中克隆了 VERNALIZATION 1(VRN1)、VERNALIZATION 2(VRN2)和 VIN3 基因,探索它们与FLC染色质组蛋白修饰的关系[5]。研究发现,VIN3在受长时间低温处理后被诱导,表达量随处理时间的增加而增加,同时FLC随着VIN3的增加而递减。恢复常温后VIN3随即消失,FLC仍然呈现被抑制的效应,这与VRN1和VRN2密切相关[5]。研究表明,VRN1和VRN2不受低温的诱导,为组成型表达。VRN1编码一种植物特有的DNA结合蛋白[24],VRN2编码与果蝇S(U)12同源的polycomb蛋白[25],VRN1和VRN2参与FLC的后生抑制。在该2个基因的突变体中,春化作用对冬性一年生植物没有明显的促进开花作用,并且在低温处理产生春化效应时,FLC的表达量明显降低,但是在植株恢复常温后,FLC的表达迅速升高,表现为未春化的状态,这充分说明了VRN1和VRN2参与VIN3对FLC抑制作用的维持。春化处理使FLC的第一个内含子和启动子区 H3K9和 H3K27二甲基化水平增加。其中VRN1参与H3K9的二甲基化修饰,VRN2参与H3K9和 H3K27的二甲基化修饰[5],VRN2与Polycomb-group(Pc-G)蛋白组成一个类 PRC2蛋白复合体(PRC2-like complex),从而参与春化过程中对FLC的后生性抑制。此外,H3K9的甲基化对植物产生春化效应非常重要。在vrn1的突变体中,没有发现H3K9的甲基化,虽然春化过程中FLC染色质上H3K27的甲基化水平仍然在不断升高,但却不能维持对FLC的稳定抑制。由此表明,植物主要是通过H3K9的甲基化来建立对春化效应的调控[9]。
拟南芥中还存在一些与VIN3同源的基因:VIL1(VIN3-like1,又名 VRN5)、VIL2(VEL1)、VIL3(VEL2)和VIL4(VEL3),属于VEL家族基因[26],它们编码的蛋白都具有类似的PHD关键调控区域(图2),参与对FLC表达的调控。其中VIL1在春化作用过程中与 VIN3形成一个异源二聚体,进而参与春化介导的对FLC染色质的去乙酰化和H3K9、H3K27的三甲基化修饰[27-28]。从经春化处理的拟南芥中分离到了一个包括PRC2复合体、VIN3、VIL1以及VIL2的大复合体(PHD-PRC2复合体),这说明PRC2复合体还与VIN3及其相关蛋白VIL1一起组成一个大蛋白复合体,参与抑制FLC的表达[26]。此外,VIL1与 FLC染色质组蛋白 H3K27的三甲基化的延伸有密切联系。春化处理后,在FLC的转录起始位点和翻译起始位点之间,H3K27三甲基化水平增加,但第一个内含子和启动子区的H3K27三甲基化都没有明显的增加。然而,在植株处于22℃条件下时,发现 H3K27三甲基化的区域向 FLC的启动子区和第一个内含子、编码区延伸,并且第一内含子上的三甲基化水平最高[29]。同时发现,FLC染色质上结合的VIL1与H3K27三甲基化水平有一致的变化,这说明三甲基化范围的延伸与VIL1有着密切的联系。VIL3的表达也受长时间低温的诱导,它可能与VIL1形成异二聚体在叶片中参与春化介导的对FLC的后生性抑制[26]。目前,VIL2和VIL4的功能尚不清楚。
3.3 春化作用机制-FLC染色质结构的重塑
根据组蛋白密码理论,可以较全面地概述春化作用的机制。在低温春化处理之前,植株内本身存在H3K4的三甲基化,该三甲基化信号可以被PAF1复合物与EFS的结合物所识别,从而引导 RNA聚合酶Ⅱ结合于FLC的5′端序列上,起始FLC的转录,激活FLC的表达[20]。此外,开花抑制因子PIE1可以识别 H3K4甲基化并与之结合,稳定染色质的构象[18],并且在SWR1复合体(可以参与FLC染色质组蛋白H3的乙酰化、H3K4的三甲基化修饰)以及FRI(结合在 FLC启动子区域)的共同作用下维持FLC高水平表达(图5)。经过冬天长时间的低温处理,VIN3被诱导表达。VIN3编码蛋白的PHD结构域可以识别染色质上的组蛋白修饰,除了以上阐述的甲基化修饰外,VIN3还参与对 FLC染色质的去乙酰化修饰。在vin3突变体与野生型植株的研究中,野生型植株在 VIN3表达后,FLC染色质组蛋白H3K9、H3K14发生了去乙酰化,而突变体中没有这一现象,所以认为 VIN3也是 FLC染色质组蛋白H3K9、H3K14的去乙酰化所必需的[22]。此外,VIN3/VIL1及VIL2/PRC2复合体形成PHD-PRC2大复合体,对FLC染色质上进行H3K9和H3K14去乙酰化、H3K9和H3K27二甲基化以及转录起始和翻译起始位点之间 H3K27三甲基化等组蛋白修饰,引起FLC染色质结构在空间上的改变,使得EFS无法靠近FLC染色质,因而不能发生H3K4三甲基化。PAF1复合物因无法找到 H3K4三甲基化信号而不能激活FLC的表达,从而实现了对FLC转录的抑制[29]。在VRN1、VRN2和其他蛋白(如LHP1[30],其是维持FLC沉默所必需的)的共同作用下使得这种抑制得以维持(图5),FLC表达的关闭导致下游受FLC抑制的开花促进基因(FT和SOC1等)的表达水平升高,最终促进开花。
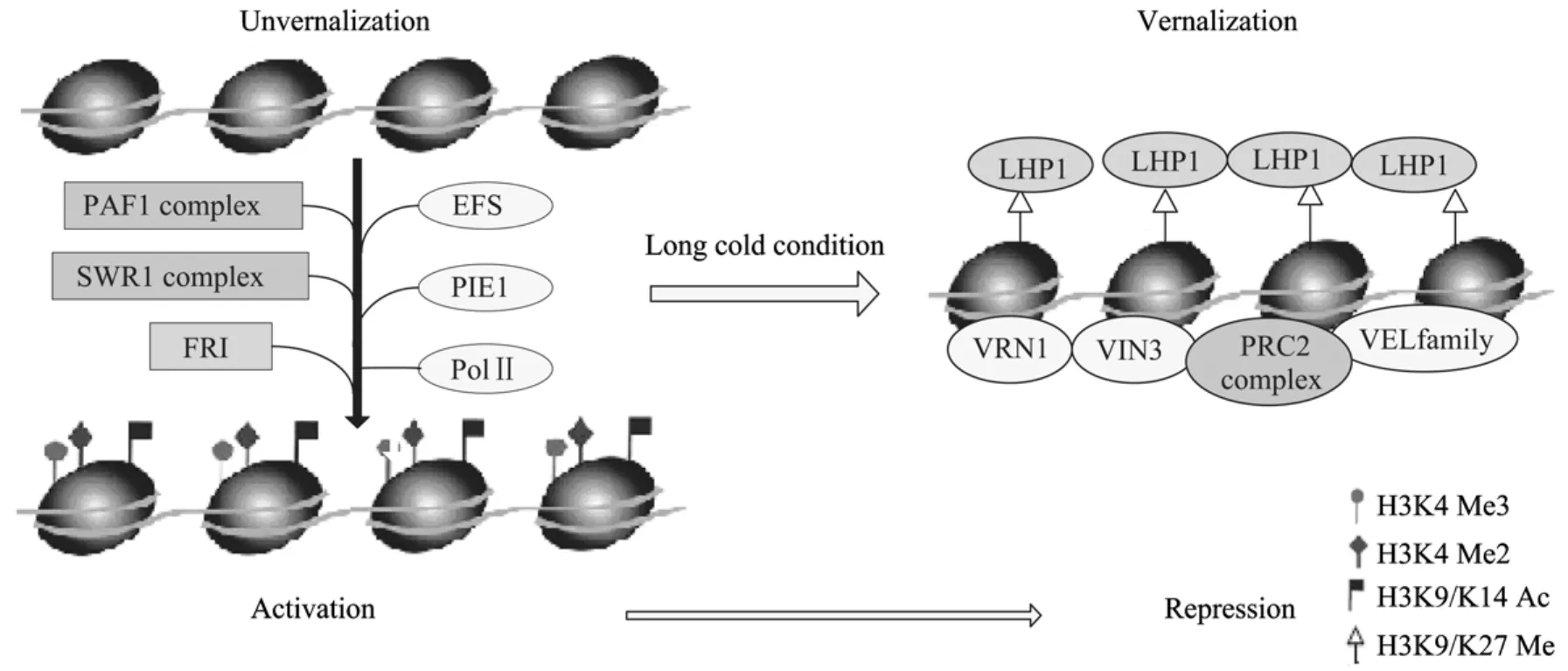
图5 春化作用机制示意图Fig.5 Schematic diagram of the vernalization mechanism.The left picture means FLC was in activation state before vernalization, and the right means FLC has been repressed after a long time of cold treatment.
4 其他物种春化作用途径中的PHD-finger蛋白
除了拟南芥中报道的 VIN3、VIL1(VRN5)等PHD-finger结构域蛋白外,Fu等从小麦 Triticum monococcum L.中克隆得到了 VIN3的 3个同源基因:TmVIL1、TmVIL2和TmVIL3,它们编码的蛋白也具有PHD结构域保守的C4HC3的基序特性(图2)。这3个基因与拟南芥中报道的VIN3极其相似,有较高的同源性,并也受春化的正调控。在恢复常温条件后,小麦 VIL基因的表达水平回到未春化处理的水平[31]。研究发现,小麦的VIL基因保留了与拟南芥VIN3/VIL同系物相似的特征及其转录水平上的调控模式,说明它们可能具有类似的功能。
此外,水稻Oryza sativa中也获得了4个VEL家族的基因:OsVIL1、OsVIL2、OsVIL3和OsVIL4,与拟南芥已报道的AtVIN3、AtVIL1、AtVIL2和AtVIL3以及小麦中的VEL家族相比,它们编码的蛋白都含有保守的 PHD结构域[31],所以推测水稻中的 VIL家族蛋白也具有组蛋白的修饰以及染色质的重塑等功能。
5 结语
植物开花是一个高度复杂的过程,它涉及多种基因、多条途径以及多种信号的参与。春化低温处理作为诱导开花的一个重要因子,与开花网络的其他途径共同作用,促进植物开花。目前,对春化作用的研究已经不仅仅局限于拟南芥,在芸薹属、小麦等物种中都有比较深入的研究。本实验室首次获得了芸薹属中的VIN3片段,并且发现该基因片段与拟南芥AtVIN3具有很高的同源性,具有类似的表达模式,这更加丰富了VIN3/VEL家族基因在不同物种中的功能研究。在拟南芥和禾本科植物中的VIN3/VEL家族蛋白都具有保守的PHD结构域,这对认识PHD-finger蛋白的功能及其在春化途径中的作用是至关重要的。近些年来,人们对于春化作用的分子机制研究有了很大进展,但对于春化作用的上游调控,特别是VIN3感受低温时程而表达和失去低温信号关闭的机制以及低温信号的接受和传递等过程还不清楚。在植物中,E3泛素蛋白连接酶SINAT5与FLC共定位在核小体中,其锌指模序直接作用于FLC的MADS-box区,把FLC作为其泛素连接酶活性的底物,参与FLC的泛素降解途径[32]。同时也有报道FLC染色质上发生了磷酸化修饰,可以影响FLC活性[33]。PHD-finger蛋白有没有涉及到FLC染色质上的泛素化和乙酰化修饰,目前还没有相关的报道。相信随着该领域的进一步深入研究,人们将对春化作用中PHD-finger蛋白的功能以及植物的开花分子机理有更深更清晰的认识。
REFERENCES
[1]Schmitz RJ, Amasino RM.Vernalization: a model for investigating epigenetics and eukaryotic gene regulation in plants.Biochim Biophys Acta, 2007, 1769(5/6): 269−275.
[2]Boss PK, Bastow RM, Mylne JS, et al.Multiple pathways in the decision to flower: enabling, promoting, and resetting.Plant Cell, 2004, 16(Suppl): S18−31.
[3]Suárez-López P, Wheatley K, Robson F, et al.CONSTANS mediates between the circadian clock and the control of flowering in Arabidopsis.Nature, 2001, 410(6832):1116−1120.
[4]Samach A, Onouchi H, Gold SE, et al.Distinct roles of CONSTANS target genes in reproductive development of Arabidopsis.Science, 2000, 288(5471): 1613−1616.
[5]Sung S, Amasino RM.Vernalization in Arabidopsis thaliana is mediated by the PHD fi nger protein VIN3.Nature, 2004, 427(6970): 159−164.
[6]Li XB, Zhang JW.Structure and function of zinc finger proteins in Eucaryon.Chin J Biochem Mol Biol, 2009,25(3): 206−211.李晓波, 张俊武.真核生物中锌指蛋白的结构与功能.中国生物化学与分子生物学报, 2009, 25(3): 206−211.
[7]Kaadige MR, Ayer DE.The polybasic region that follows the plant homeodomain zinc finger 1 of Pf1 is necessary and sufficient for specific phosphoinositide binding.J Biol Chem, 2006, 281(39): 28831−28836.
[8]Schindler U, Beckmann H, Cashmore AR.HAT3.1, a novel Arabidopsis homeodomain protein containing a conserved cysteine-rich region.Plant J, 1993, 4(1): 137−150.
[9]Sung S, Amasino RM.Molecular genetic studies of the memory of winter.J Exp Bot, 2006, 57(13): 3369−3377.
[10]Townsley FM, Thompson B, Bienz M.Pygopus residues required for its binding to Legless are critical for transcription and development.J Biol Chem, 2004, 279(7):5177−5183.
[11]Bienz M.The PHD finger, a nuclear protein-interaction domain.Trends Biochem Sci, 2006, 31(1): 35−40.
[12]Ma HH, Fang CL, Zeng PY.Plant homeodomain(PHD domain)—the code reading of histone code.Prog Biochem Biophys, 2008, 35(6): 625−630.马红辉, 方存磊, 曾平耀.植物同源结构域(PHD结构域)—组蛋白密码的解读器.生物化学与生物物理进展,2008, 35(6): 625−630.
[13]Michaels SD, Amasino RM.FLOWERlNG LOCUS C encodes a novel MADS domain protein that acts as a repressor of flowering.Plant Cell, 1999, 11(5): 949−956.
[14]Scortecci K, Michaels SD, Amasino RM.Genetic interactions between FLM and other flowering-time genes in Arabidopsis thaliana.Plant Mol Biol, 2003, 52(5):915−922.
[15]Luger K, Richmond TJ.The histone tails of the nucleosome.Curr Opin Genet Dev, 1998, 8(2): 140−146.
[16]Peterson CL, Laniel MA.Histones and histone modifications.Curr Biol, 2004, 14(14): R546−551.
[17]Richards EJ, Elgin SC.Epigenetic codes for heterochromatin formation and silencing: rounding up the usual suspects.Cell, 2002, 108(4): 489−500.
[18]He Y, Amasino RM.Role of chromatin modification in flowering-time control.Trends Plant Sci, 2005, 10(1):30−35.
[19]Schubeler D, MacAlpine DM, Scalzo D, et al.The histone modification pattern of active genes revealed through genome-wide chromatin analysis of a higher eukaryote.Genes Dev, 2004, 18(11): 1263−1271.
[20]He Y, Dovle MR, Amasino RM.PAF1-complex-mediated histone methylation of FLOWERING LOCUS C chromatin is required for the vernalization responsive, winter-annual habit in Arabidopsis.Genes Dev, 2004, 18(22): 2774−2784.
[21]Santos-Rosa H, Schneider R, Bernstein BE, et al.Methylation of histone H3K4 mediates association of the lsw1p ATPase with chromatin.Mol Cell, 2003, 12(5):1325−1332.
[22]Zhao ZH, Zeng Q, Zhao SQ.The molecular mechanism of vernalization in plants.Chin Bull Bot, 2006, 23(1): 60−67.赵仲华, 曾群, 赵淑清.植物春化作用的分子机理.植物学通报, 2006, 23(1): 60−67.
[23]Dennis ES, Peacock WJ.Epigenetic regulation of flowering.Curr Opin Plant Biol, 2007, 10(5): 520−527.
[24]Levy YY, Mesnage S, Mylne JS, et al.Multiple roles of Arabidopsis VRN1 in vernalization and flowering time control.Science, 2002, 297(5579): 243−246.
[25]Gendall AR, Levy YY, Wilson A, et al.The VERNALIZATION 2 gene mediates the epigenetic regulation of vernalization in Arabidopsis.Cell, 2001,107(4): 525−535.
[26]De Lucia F, Crevillen P, Jones AM, et al.A PHD-polycomb repressive complex 2 triggers the epigenetic silencing of FLC during vernalization.Proc Natl Acad Sci USA, 2008,105(44): 16831−16836.
[27]Sung S, Schmitz RJ, Amasino RM.A PHD finger protein involved in both the vernalization and photoperiod pathways in Arabidopsis.Genes Dev, 2006, 20(23):3244−3248.
[28]Greb T, Mylne JS, Crevillen P, et al.The PHD finger protein VRN5 functions in the epigenetic silencing of Arabidopsis FLC.Curr Biol, 2007, 17(1): 73−78.
[29]Finnegan EJ, Dennis ES.Vernalization-induced trimethylation of histone H3 lysine 27 at FLC is not maintained in mitotically quiescent cells.Curr Biol, 2007,17(22): 1978−1983.
[30]Sung S, He Y, Eshoo TW, et al.Epigenetic maintenance of the vernalized state in Arabidopsis thaliana requires LIKE HETEROCHROMATIN PROTEIN 1.Nat Genet,2006, 38(6): 706−710.
[31]Fu D, Dunbar M, Dubcovsky J.Wheat VIN3-like PHD finger genes are up-regulated by vernalization.Mol Genet Genomics, 2007, 277(3): 301−313.
[32]Park BS, Sang WG, Yeu SY, et al.Post-translational regulation of FLC is mediated by an E3 ubiquitin ligase activity of SINAT5 in Arabidopsis.Plant Sci, 2007,173(2): 269−275.
[33]Robertson M, Helliwell CA, Dennis ES.Post-translational modifications of the endogenous and transgenic FLC protein in Arabidopsis thaliana.Plant Cell Physiol, 2008,49(12): 1859−1866.
Function of plant homeodomain-finger proteins in vernalization pathway in Arabidopsis and other cruciferous plants
Gongling Hu, Guoping Chen, Zongli Hu, Feng Gu, and Yong Li
Bioengineering College of Chongqing University, Chongqing 400030, China
Received:September 3, 2009;Accepted:November 11, 2009
Supported by:National Natural Science Fundation of China(Nos.30771464, 30871709), Chongqing University Postgraduates' Innovative Team Building Project(No.200909B1007).
Corresponding author:Guoping Chen.Tel: +86-23-65112674; Fax: +86-23-65112674; E-mail: chenguoping@cqu.edu.cn国家自然科学基金(Nos.30771464, 30871709),重庆大学研究生创新团队建设项目(No.200909B1007)资助。