CHO工程细胞无血清悬浮分批培养的生长代谢特征及动力学模型
刘兴茂,刘红,叶玲玲,李世崇,吴本传,王海涛,谢靖,陈昭烈
军事医学科学院生物工程研究所,北京 100071
CHO工程细胞无血清悬浮分批培养的生长代谢特征及动力学模型
刘兴茂,刘红,叶玲玲,李世崇,吴本传,王海涛,谢靖,陈昭烈
军事医学科学院生物工程研究所,北京 100071
以悬浮适应的表达尿激酶原CHO工程细胞为研究对象,在100 mL的摇瓶中进行无血清悬浮培养,以细胞密度、细胞活力、Pro-UK活性、葡萄糖比消耗速率(qglc)、乳酸比生产速率(qlac)、乳酸对葡萄糖的得率系数(Ylac/glc)为观察指标,同时以细胞有血清悬浮培养作为参照,考察CHO工程细胞无血清悬浮培养生长和代谢特征。观察结果表明,CHO工程细胞在无血清及有血清悬浮培养条件下表现为大致相似的细胞生长和代谢特征。在此基础上,依据实际检测的数据,应用MATLAB软件对细胞对数生长期的细胞生长、乳酸生成及葡萄糖消耗的模型参数进行非线性规划,获得全局性收敛的最优参数估计值,建立了细胞在无血清培养条件下的生长及代谢动力学模型。
CHO工程细胞,无血清培养基,分批培养,代谢动力学
Abstract:By using the cell density, cell viability, Pro-UK activity, specific consumption rate of glucose(qglc), specific production rate of lactate(qlac), yield of lactate to glucose(Ylac/glc)and as the evaluation indexes, the growth and metabolism characteristics of pro-urokinase(Pro-UK)expressing CHO cells in serum-free suspension batch culture were examined and compared to those in serum-containing suspension batch culture.We observed hardly differences in growth and metabolism characteristics between the CHO cell populations grown in serum-free suspension batch culture and serum-containing suspension batch culture.The optimal mathematical model parameters for the CHO cells grown in suspension batch culture were obtained by non-linear programming of data representing the growth, substrate consumption and product formation of the CHO cells during logarithmic growth phase using MATLAB software, and the kinetic model of the cell growth and metabolism in serum-free culture were established.
Keywords:recombinant CHO cells, serum-free medium, batch culture, metabolic dynamics
基于实验数据的建模分析是实现细胞培养优化 控制的基础。通过细胞生长动力学模型的建立,不仅有助于理解细胞的代谢和生理特征,也可以为过程控制和优化提供理论依据。在建模分析的过程中,常常需要借助于数学工具软件,在众多的数学工具软件中,目前MATLAB软件以其功能强大、使用方便的特点,成为建模分析最常用的数值处理软件,近年来 MATLAB也被广泛地应用到微生物发酵及动物细胞大规模培养优化控制中[1-2]。本研究以低血清悬浮适应的表达尿激酶原(pro-urokinase,Pro-UK)CHO工程细胞为研究对象,以自行设计的无血清培养基为培养介质,在悬浮分批培养模式下,以细胞有血清悬浮分批培养作为参照,考察了CHO工程细胞无血清悬浮分批培养的生长和代谢特征。在此基础上,为了更准确地描述细胞在无血清悬浮培养条件下的生长及代谢过程,应用 MATLAB 软件,根据CHO细胞无血清悬浮分批培养的实验结果,并分别依据 Logistic方程[3]、Luedeking & Piret方程[4]及质量平衡方程对细胞在对数生长阶段的细胞生长、乳酸生成及葡萄糖消耗进行了模拟,建立了细胞在无血清培养条件下的生长及代谢动力学模型。
1 材料
1.1 细胞株
适应悬浮培养的表达尿激酶原CHO工程细胞。
1.2 培养基
自行设计的无血清培养基:DMEM/F12(1:1)为基础培养基,其他添加成分主要包括胰岛素、转铁蛋白、腐胺、微量元素等。
有血清培养基:在DMEM/F12(1:1)中添加1%的小牛血清。
2 方法
2.1 细胞的悬浮培养
CHO 细胞以 3×105~3.5×105cells/mL接种于100 mL摇瓶内,培养体积35 mL,培养时加入含有5 mmol/L 谷氨酰胺、Pluronic F-68(0.1%)及硫酸葡聚糖(25 µg/mL)的无血清或有血清培养基,摇床转速90 r/min,置于37℃温箱中培养。
2.2 细胞密度及活率测定
采用 Cedex AS20细胞密度和活力自动分析系统(Innovatis, Germany)进行细胞计数和活力分析。
2.3 培养上清中生化指标的测定
采用 YSI 7100多参数生物分析系统(Yellow Springs Instruments, USA)定量检测细胞培养上清的葡萄糖、乳酸和谷氨酰胺的浓度。
2.4 蛋白表达活性的测定及计算
采用体外纤维蛋白琼脂板溶圈法检测 Pro-UK体外纤维蛋白溶解活性[5]。
2.5 无血清悬浮批培养的细胞生长代谢特征
在100 mL的摇瓶中进行无血清悬浮批培养,以细胞密度、细胞活力、Pro-UK活性、葡萄糖比消耗速率(qglc)、乳酸比生产速率(qlac)、乳酸对葡萄糖的得率系数(Ylac/glc)为考察指标,同时以有血清悬浮批培养作为参照,考察无血清培养条件下CHO细胞的生长和代谢特征。
2.6 无血清悬浮分批培养的细胞生长及代谢动力学模型的建立
依据细胞分批培养的细胞生长、底物消耗及产物形成的相关经验模型,并依据 2.5中无血清分批培养实际检测的实验数据,应用MATLAB软件进行非线性规划,采用全局收敛的 Levenberg-Marquardt法,获得了细胞对数生长期的细胞生长、葡萄糖消耗及乳酸生成的模型参数最优估计值,建立了细胞无血清分批培养对数生长期的生长及代谢动力学模型。
2.6.1 细胞生长动力学
目前常用Monod及Logistic方程来描述细胞生长动力学。Monod方程是一种理论化的简单模型[6],主要用来描述非抑制性单一底物限制情形下的细胞生长,Logistic方程是一个典型的S型曲线,能较好地反映细胞分批培养过程中因细胞密度的增加对自身生长的抑制作用,且能较好地反映细胞分批培养的生长规律。式(1)中,X为细胞密度,µmax为最大比生长速率,Xmax为细胞密度生长上限。
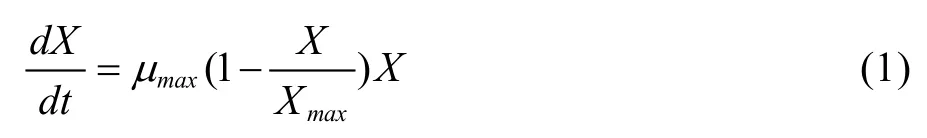
初始条件t=0时,细胞密度X等于细胞初始密度X0。求解式(1)分方程,可得:
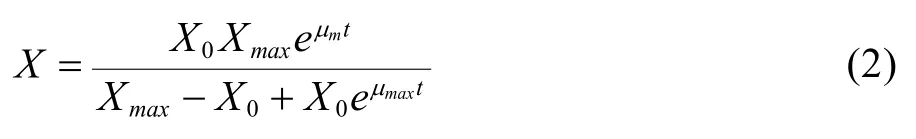
2.6.2 产物生成动力学模型
细胞代谢产物生成非常复杂,定性的描述也很多,产物生成动力学模型中较为通用的模型是由Luedeking & Piret所提出的数学表达式,把产物生成率看作细胞生长率和细胞生长量的函数。

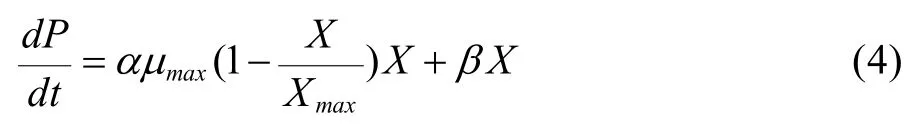
初始条件t=0时,乳酸浓度P等于接种初始的乳酸浓度P=0。对(4)式积分可得:
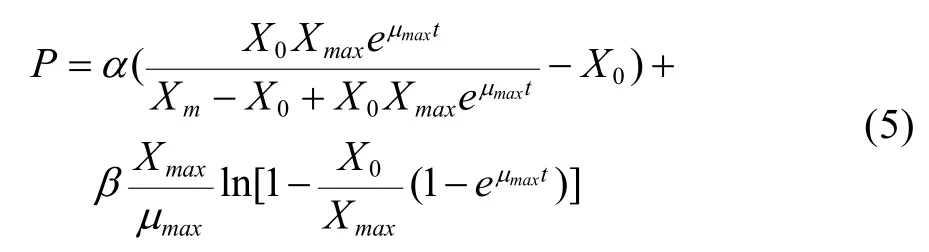
其中,P为乳酸浓度,µmax为最大比生长速率;X0为细胞初始接种密度;Xmax为细胞密度生长上限,α和β为常数。
2.6.3 底物消耗动力学模型
在细胞无血清批次悬浮培养的过程中,其消耗主要有 3个方面:一是细胞生长的消耗,用以合成新的细胞;二是细胞维持基本生命活动的消耗;三是用于合成代谢产物的消耗。因此底物消耗动力学模型可表示为:
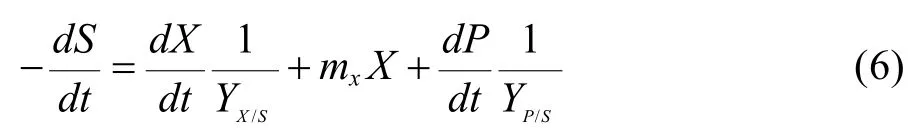
其中 Yx/s为葡萄糖用于细胞生长的得率常数;Yp/s为葡萄糖用于产物积累的得率常数;mx为细胞的维持系数。将(3)式代入(6),整理后可得:
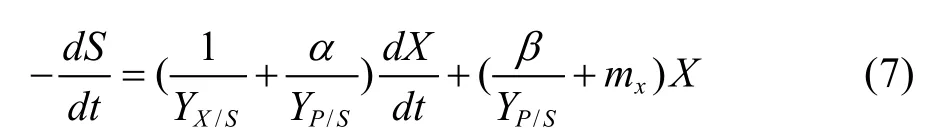
初始条件t=0时,葡萄糖浓度S等于初始葡萄糖浓度S0。求解式(7)积分得:
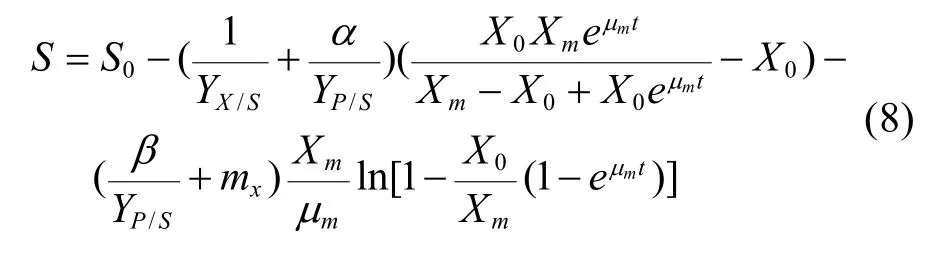
3 结果
3.1 CHO工程细胞无血清分批培养条件下的生长代谢特征
图1所示细胞在无血清和有血清培养条件下的细胞增殖呈现大致相似的变化趋势,随着培养时间的增加,细胞密度逐渐增加,在培养至 96 h细胞密度达到最大,分别为3.9×106cells/mL和2.5×106cells/mL,细胞在对数生长期平均比生长速率分别为0.61 d−1和0.49 d−1,随后细胞密度呈现逐渐下降的趋势,至培养结束时细胞密度分别为2.5×106cells/mL和1.4×106cells/mL;两种培养条件下的细胞存活率没有明显差异,细胞在无血清培养条件下的细胞活率总体略好于有血清培养,且在整个培养过程中细胞维持较高的活率。两种培养条件下的Pro-UK活性变化趋势也大致相近,Pro-UK最大活性分别为5614 IU/mL 和3513 IU/mL,结果表明细胞在无血清培养条件下的细胞密度及Pro-UK活性,与有血清培养相比均有了较大程度地提高。
图2所示为细胞在无血清和有血清培养条件下细胞的代谢特征。在无血清及有血清培养条件下,培养上清葡萄糖浓度随着培养时间的延长而逐渐降低,呈现出培养前期下降较快、中后期下降减缓的趋势,至培养结束时上清中葡萄糖浓度降至最低,分别为5.03 mmol/L和7.19 mmol/L。两种培养条件下葡萄糖比消耗速率(qglu)变化趋势大体相近,总体呈现先升后降的变化趋势,在培养初期 qglu随着细胞密度的增加而逐渐增加,培养至72 h qglu达到最大,分别为 1.81 µmol/(106cells·d)和 2.25 µmol/(106cells·d),之后随着细胞密度的增大,qglu逐渐下降,在培养后期由于细胞密度的下降及细胞生理特性的改变,qglu略有升高。两种培养条件下在对数生长期葡萄糖平均比消耗速率分别为 1.33 µmol/(106cells·d)和 1.40 µmol/(106cells·d),结果说明两种培养条件下葡萄糖平均比消耗速率没有明显差异。
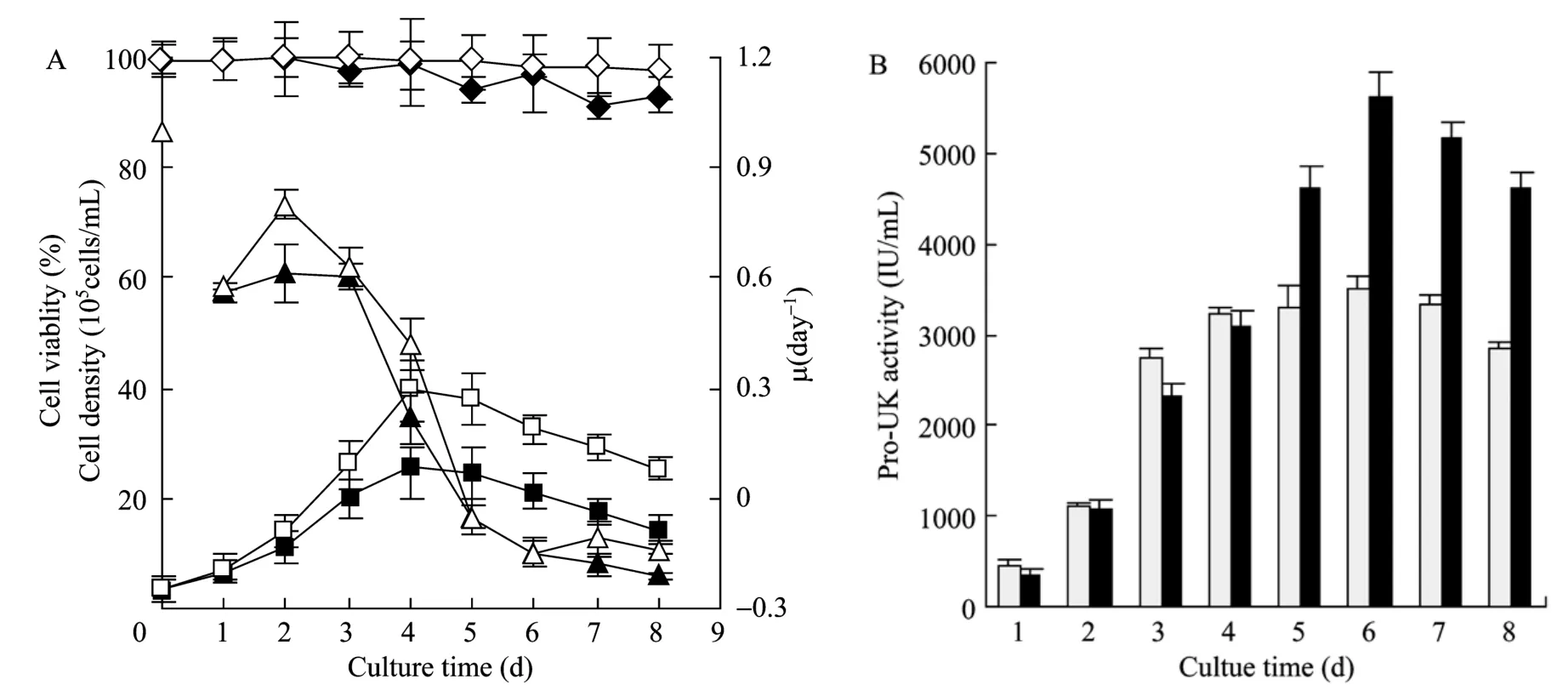
图1 细胞在不同培养条件下的细胞生长(A)及Pro-UK活性(B)Fig.1 Growth(A)and Pro-UK activity(B)of CHO cells in different culture conditions.(A)▲: the specific growth rate of cells cultured in serum-containing medium; △: the specific growth rate of cells cultured in serum-free medium; ■: density of cells cultured in serum-containing medium; □: density of cells cultured in serum-free medium; ◆: viability of cells cultured in serum-containing medium;◇: viability of cells cultured in serum-free medium.(B)■: protein activity of cells cultured in serum-containing medium; ■: protein activity of cells cultured in serum-free medium.Data presented in figure are averages from three experiments, expressed in M±SD.
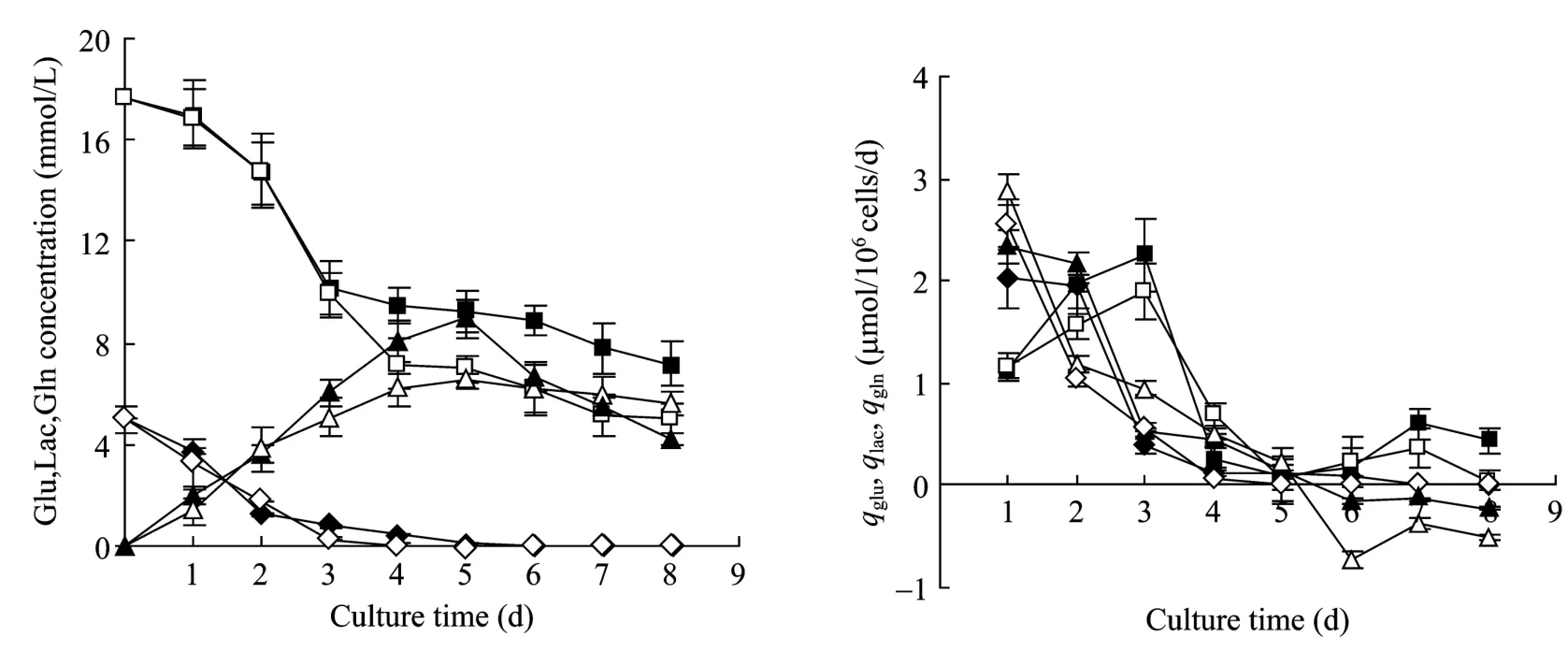
图2 细胞在不同培养条件下的生长代谢Fig.2 Metabolism characteristics of CHO cells cultured in different culture conditions.■: the glu concentration and qglu of cells cultured in serum-containing medium; □: the glu concentration and qglu of cells cultured in serum-free medium; ▲: the lac concentration and qlac of cells cultured in serum-containing medium; △: the lac concentration and qlac of cells cultured in serum-free medium; ◆: the gln concentration and qgln of cells cultured in serum-containing medium; ◇: the gln concentration and qgln of cells cultured in serum-free medium.Data presented in figure are averages from three experiments, expressed in M±SD.
在无血清及有血清培养条件下,在培养初期培养上清中乳酸浓度随着培养时间的延长而不断累积,培养至120 h浓度达到最大,分别为8.97 mmol/L和6.52 mmol/L,随后培养上清中乳酸的浓度又呈现逐渐下降的趋势,至培养结束时上清中乳酸浓度分别降至5.62 mmol/L和4.19 mmol/L;提示在培养后期,由于细胞生理状态的改变,细胞同时消耗葡萄糖及乳酸,用于维持细胞的活力。两种培养条件下乳酸比生产速率(qlac)变化总体呈现下降的趋势,两种培养条件下在对数生长期乳酸平均比生产速率分别为1.38 µmol/(106cells·d)和 1.36 µmol/(106cells·d),且两种培养条件下在对数生长期乳酸对葡萄糖平均得率系数(Ylac/glu)分别为 1.06 µmol/µmol、0.97 µmol/µmol。结果说明两种培养条件下乳酸平均比生产速率及乳酸对葡萄糖平均得率系数没有明显差异。在无血清及有血清培养条件下,培养上清中谷氨酰胺的浓度随着培养时间的延长而逐渐降低,培养至 72 h时,培养上清中谷氨酰胺分别降为0.39 mmol/L和0.56 mmol/L;两种培养条件下谷氨酰胺比消耗速率(qgln)变化总体呈现下降的趋势,两种培养条件下谷氨酰胺平均比消耗速率分别为 1.06 µmol/(106cells·d)和 1.12 µmol/(106cells·d),说明两种培养条件下 qgln没有明显差异。
3.2 细胞无血清分批培养生长及代谢动力学模型的建立
在动物细胞的动力学研究中,所用的动力学模型多为经验模型,并且大多数只能分段描述,对于细胞对数生长期的生长及代谢过程可以较好地模拟,但都不能很好地模拟细胞生长的整个过程。在细胞无血清分批培养生长及代谢动力学研究中,根据CHO细胞无血清悬浮分批培养的实验结果,并分别依据Logistic方程、Luedeking & Piret方程及质量平衡方程对细胞在对数生长阶段的细胞生长、乳酸生成及葡萄糖消耗进行了模拟。将式(2)、(5)、(8)自定义为拟合函数,根据实际测得的细胞无血清及有血清分批培养中所测得的细胞密度、乳酸生成及葡萄糖消耗实验数据,并运用MATLAB软件中的曲线拟合工具箱对数据进行非线性拟合,可分别求得各个参数,结果见表 1。细胞在两种培养条件下在细胞对数生长期细胞生长、乳酸生成及葡萄糖消耗的实验值与模型拟合图见图3~5。
从图3可以看出在细胞对数生长期,模拟计算的细胞密度变化曲线与实验数据吻合较好,置信度选为0.95。模型经F检验后显著性很高,无血清及有血清培养条件下的R2分别为0.979和0.985,即在无血清及有血清培养条件下模型分别在 97.9%及98.5%的概率水平上非常显著。说明这一模型较好地描述了两种培养条件下细胞生长的实际过程。
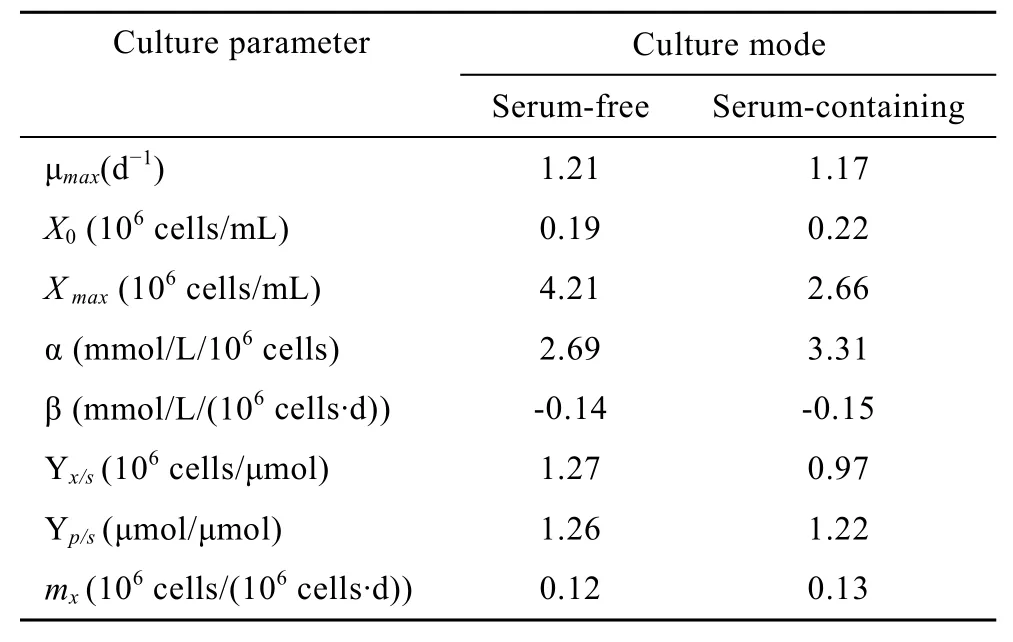
表1 细胞无血清及有血清悬浮分批培养各参数比较Table 1 Kinetics model parameter of the CHO cells in serum-free and serum-containing suspension batch culture
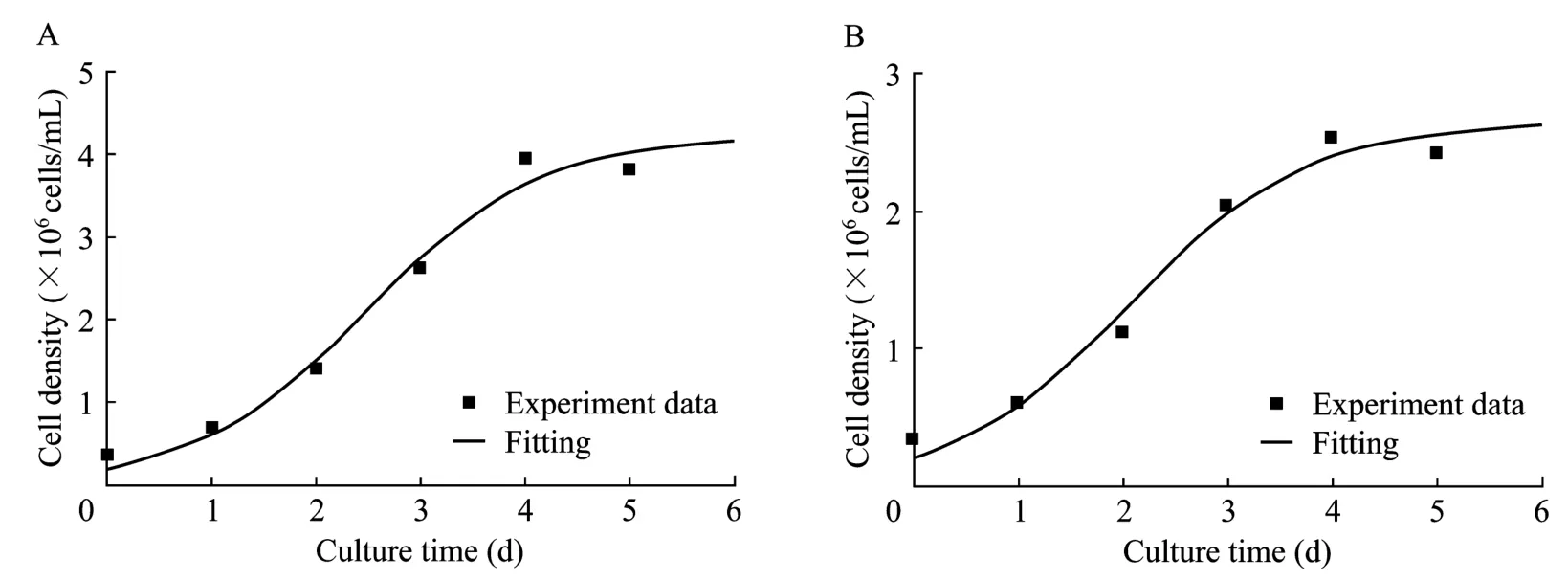
图3 无血清(A)及有血清(B)悬浮分批培养细胞生长实验值与模型拟合值的比较Fig.3 Fitting curve of the cells growth in serum-free and serum-containing suspension batch culture.(A)Serum-free.(B)Serum-containing.
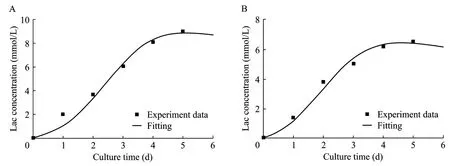
图4 无血清(A)及有血清(B)悬浮分批培养乳酸生成实验值与模型拟合值的比较Fig.4 Fitting curve of the lactate accumulation of cells in serum-free and serum-containing suspension batch culture.(A)Serum-free.(B)Serum-containing.
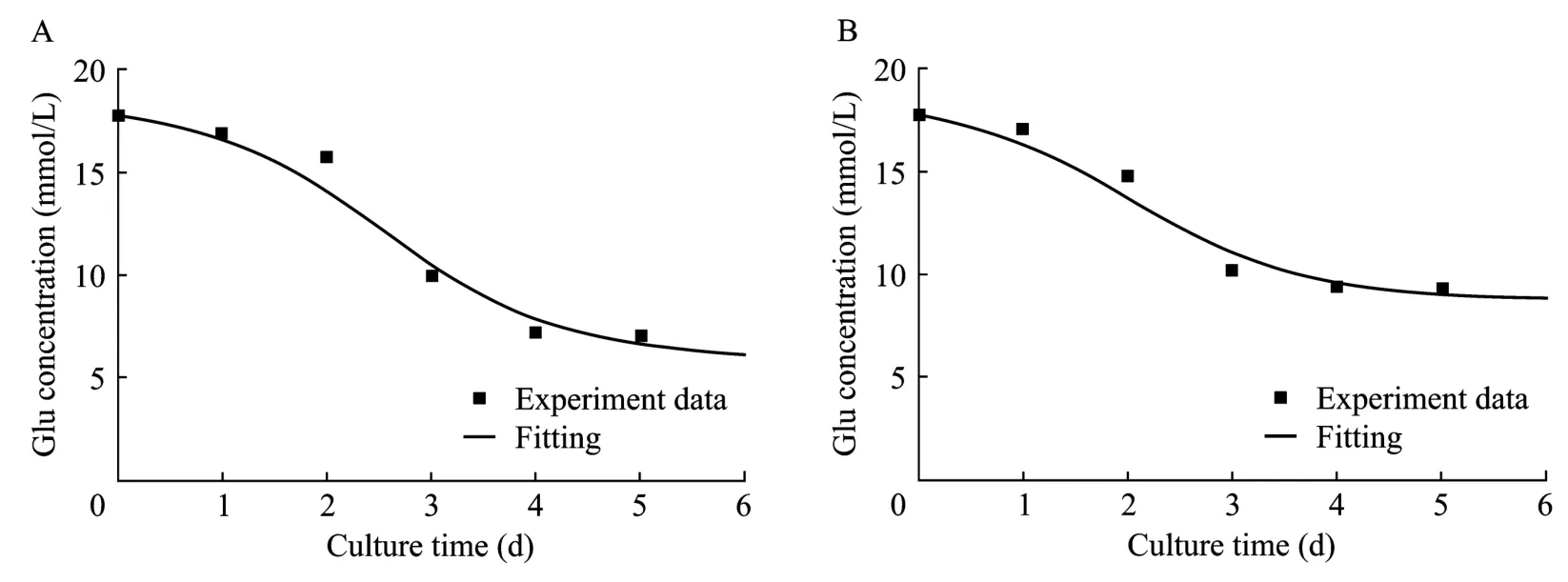
图5 无血清(A)及有血清(B)悬浮分批培养葡萄糖消耗实验值与模型拟合值的比较Fig.5 Fitting curve of the glucose consumption of cells in serum-free and serum-containing suspension batch Culture.(A)Serum-free.(B)Serum-containing.
从图4可以看出,在细胞对数生长阶段,模拟计算的乳酸生成变化曲线与实验数据拟合情况比较理想,置信度选为0.95。模型经F检验后显著性很高,无血清及有血清培养条件下的 R2分别为 0.971和0.983,即在无血清及有血清培养条件下模型分别在 97.1%及 98.3%的概率水平上非常显著。说明建立的产物生成模型可用于描述两种培养条件下细胞悬浮分批培养乳酸的生成。
从图5可以看出在细胞对数生长阶段,模拟计算的葡萄糖消耗变化曲线与实验数据拟合情况比较理想。模型经F检验后显著性很高,无血清及有血清培养条件下的R2分别为0.963和0.961,即在无血清及有血清培养条件下模型分别在 96.3%及96.1%的概率水平上非常显著。说明该方程在细胞对数生长阶段能很好地描述两种培养条件下细胞悬浮分批培养葡萄糖消耗随时间变化的关系。
综上所述,细胞在无血清批次培养条件下的对数生长期的细胞生长、乳酸生成及葡萄糖消耗的动力学模型方程如下:
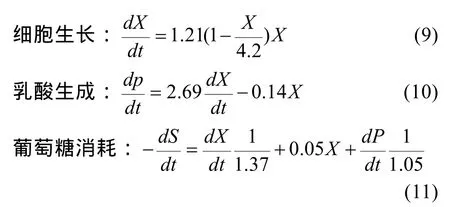
4 讨论
通常情况下,当细胞从有血清的状态下进入无血清环境时,由于存在代谢转换,会出现细胞生长滞迟的现象,因此细胞常常需要在无血清培养环境中进行适应[7-8]。在本研究中,当CHO工程细胞从有血清培养基转入无血清培养基中时,细胞并没有出现常见的细胞生长滞迟的现象,对比有血清及无血清条件下细胞培养初期的比生长速率(图1),在培养至24 h时,两种培养条件下比生长速率分别为0.56 d−1和0.58 d−1,培养至48 h时两种培养条件下比生长速率达到最大,分别为0.61 d−1和0.80 d−1,说明在进行CHO工程细胞无血清悬浮培养时,当细胞经历了低血清的悬浮适应后,细胞无须再进行无血清悬浮适应,就可以较快地生长。但从图2可以看出,在无血清培养条件下,细胞在培养初始的葡萄糖比消耗速率、谷氨酰胺比消耗速率及乳酸比生产速率明显高于有血清培养条件,之后细胞的葡萄糖比消耗速率及乳酸比生产速率总体上低于有血清,结果提示当细胞从有血清培养基转入无血清培养基后,细胞可能需要一个较为短暂的适应过程,因此在培养初始增加了能耗,产生了较多的乳酸。
一些研究表明,杂交瘤细胞系葡萄糖代谢过程中,乳酸的生成存在着切换作用,最近通过对这种代谢切换的分子机制进行研究,发现当葡萄糖浓度从高变低时会引起代谢的变换,切换的结果是乳酸的产率下降,有时会降到零[9-10]。图2所示在细胞培养的平台期及衰退期由于细胞密度及培养上清中葡萄糖浓度的逐步下降,细胞的葡萄糖的消耗基本维持在一个较低的水平,同时乳酸也不再产出,培养上清中乳酸累积量呈现出逐渐下降的趋势。结果提示细胞在悬浮培养的后期,可能是由于细胞生理状态的改变,细胞的代谢途径发生了变化,细胞同时消耗葡萄糖及乳酸,用于维持细胞的活力。总体而言,依据细胞在两种培养条件下对数生长期的葡萄糖平均比消耗速率及乳酸平均比生产速率,表明细胞在无血清培养条件下对葡萄糖具有更高的利用效能,不仅有效地支持了细胞的生长及蛋白的表达,也提高了细胞对萄糖的利用效率。
细胞培养的动力学模型可以分为非结构模型和结构模型两大类结构模型,非结构模型是一种经验性模型,来自对生物过程基本现象的观察,可用于描述细胞培养中很多重要的特性,在生物过程的控制和优化中经常用到[11-12];结构模型是基于细胞内部的结构和生化反应及其调节机制,主要包括化学计量平衡模型、代谢流模型及控制论模型等,在动物细胞培养中,用化学计量平衡和代谢流分析的方法研究代谢路径已经开展了多年,并取得了不少成果[13-14]。然而由于动物细胞系统非常复杂,对于细胞内生物过程的数学描述只能是近似的,因此在对动物细胞培养的研究中,多使用非结构模型。在建立细胞生长及代谢动力学模型时,需根据经验和细胞生长代谢特性,并经反复验证,不断修正参数,从而使模型能更好地反映细胞生长代谢的内在规律。在求解参数时,常需借助各类计算机软件如SAS、Origin及SPSS等软件,对动力学模型参数进行非线性拟合,并以绝对误差平方和最小为目标,多采用Runge-Kutta法、Marquardt法及遗传算法等方法求解参数。近年来随着MATLAB软件功能的日益完善及各类工具箱的开发,MATLAB软件的应用几乎覆盖了各行各业。MATLAB软件也被逐渐应用于动物细胞的生长及代谢动力学模型的建立。
本研究应用MATLAB软件的拟合工具箱,并根据实验数据和经验获得模型参数的初估值,采用经Levenberg-Marquardt修正的高斯-牛顿法,以全局性收敛为目标,不断修正模型参数的初估值,获得最优估计参数。结果表明细胞在无血清培养条件下的对数生长期的细胞生长、乳酸生成及葡萄糖消耗的动力学模型方程基本反映了细胞对数生长期的细胞生长、基质葡萄糖消耗及乳酸产出的内在规律。虽然Logistic方程只涉及到了最大比生长速率,未能对整个培养过程中的比生长速率的变化规律进行详尽的描述,但是也比较本质地反映了细胞生长的快慢。通过产物生成动力学模型确定的乳酸与细胞耦联参数α和非耦联参数β,较清晰地反映了细胞生长与乳酸产出的关系。底物消耗动力学模型所确定的碳源用于细胞生长的得率常数Yx/s和碳源用于乳酸生成的得率常数Yp/s与细胞在无血清及有血清条件下生长的实际状况基本吻合,也进一步印证了细胞在无血清培养条件下对葡萄糖具有更高的利用效能。
REFERENCES
[1]Sauer PW, Burky JE, Wesson MC.A high-yielding generic fed-batch cell culture process for production of recombinant antibodies.Biotechnol Bioeng, 2000, 67(5): 585−597.
[2]Senger RS, Karim MN.Optimization of fed-batch parameters and harvest time of CHO cell cultures for a glycosylated productwith multiple mechanisms of inactivation.Biotechnol Bioeng, 2007, 98(2): 378−390.
[3]Bailey JE, Ollis DF.Biochemical Engineering Fundamentals.2nd Ed.New York: Mc-Grawl-Hill Book Company, 1986.
[4]Luedeking R, Piret EL.A kinetic study of the lactic acid fermentation: batch process at controlled pH.J Biochem Microbiol Technol Eng, 2004, 1(4): 393−412.
[5]Han SW, Yu WY, Li XZ, et al.Study on plasminogen activators secreted by various cultured cells.Bull Acad Mil Med Sci, 1987, 11: 101−108.韩素文, 俞炜源, 李秀珍, 等.培养细胞分泌的血纤维蛋白溶解酶原激活物的研究.军事医学科学院院刊,1987, 11: 101−108.
[6]Monod J.The growth of bacterial cultures.Annu Rev Microbiol, 1949, 3: 364−371.
[7]Kurano N, Leist C, Messi F, et al.Growth behavior of Chinese haster ovary cells in a compact loop bioreactor: 1.Effects of physical and chemical enviroments.J Biotechnol, 1990, 15(1): 101−112.
[8]Ozturk SS, Palsson BO.Physiological changes during the adaption of hybridoma cells to low serum and serum-free media.Biotechnol Bioeng, 1991, 37(1): 35−46.
[9]Europa AF, Gambhir A, Fu PC, et al.Multiple steady states with distinct cellular metabolism in continuous culture of mammalian cells.Biotechnol Bioeng, 2000,67(1): 25−34.
[10]Korke R, Gatti Mde L, Lau AL, et al.Large scale gene expression profiling of metabolic shift of mammalian cells in culture.J Biotechnol, 2004, 107(1): 1−17.
[11]Zeng AP, Bi J.Cell culture kinetics and modeling//Ozturk SS, Hu WS.Cell Culture Technology for Pharmaceutical and Cellular Therapies.Atlanta: Taylor & Francis Group,2003: 299−347.
[12]Goudar CT, Joeris K, Konstantinov KB, et al.Logistic equations effectively model mammalian cell batch and fed-batch kinetics by logically constraining the fit.Biotechnol Prog, 2005, 21(4): 1109−1118.
[13]Provost A, Bastin G.Dynamic metabolic modeling under the balanced growth condition.J Proc Cont, 2004, 14(7):717−728.
[14]Novák B, Tyson JJ.A model for restriction point control of the mammalian cell cycle.J Theor Biol, 2004, 230(4):563−579.
Metabolic characteristics and kinetic model of recombinant CHO cells in serum-free suspension batch culture
Xingmao Liu, Hong Liu, Lingling Ye, Shichong Li, Benchuan Wu, Haitao Wang, Jing Xie, and Zhaolie Chen
Institute of Biotechnology, Academy of Military Medical Sciences, Beijing 100071, China
Received:August 6, 2009;Accepted:November 9, 2009
Supported by:National Major Special Program of New Drug Research and Development(No.2009ZX09503-011).
Corresponding author:Zhaolie Chen.E-mail: chenzl23@hotmail.com重大新药创制科技重大专项(No.2009ZX09503-011)资助。