未修饰碳纳米管的细胞毒性机理及其影响因素
刘元方, 刘佳蕙, 王海芳
(1.上海大学纳米化学与生物学研究所,上海 200444;2.北京大学化学与分子工程学院,北京 100871)
未修饰碳纳米管的细胞毒性机理及其影响因素
刘元方1,2, 刘佳蕙1,2, 王海芳1
(1.上海大学纳米化学与生物学研究所,上海 200444;2.北京大学化学与分子工程学院,北京 100871)
随着碳纳米管(carbon nanotubes,CNTs)制备技术的成熟和潜在应用的开发,CNTs的毒性也逐渐引起人们的重视.就未修饰 CNTs而言,目前已有大量的文献报道了它们的细胞毒性的效果、机理、影响因素等.一种观点认为,CNTs通过影响细胞粘附、细胞周期或引起细胞内氧化应激水平的提高等手段,导致细胞发生凋亡,存活率下降.但也有一些研究发现,CNTs具有较高的生物安全性,没有显著的细胞毒性.存在对立的实验结果的主要原因是影响CNTs细胞毒性的因素很多.CNTs杂质的种类和含量、纯化方法不同,细胞培养环境的不同甚至生物终点检测方法的不同,都会影响对 CNTs细胞毒性的判断.CNTs本身的性质,包括长度 /直径、分散性等也都影响着 CNTs的细胞毒性.为了更准确地评估 CNTs的细胞毒性,建立标准样品,统一检测方法势在必行,即建立 CNTs标准品和暴露剂量标准,发展适合 CNTs的细胞毒性检测方法.归纳总结了以上各方面的研究成果,对今后的相关研究提出看法和建议.
碳纳米管;细胞毒性;氧化应激
Abstract:With the development of production and application of carbon nanotubes(CNTs),the toxicity of CNTs has attracted much research attention.Cytotoxicity of p ristine CNTs and its mechanism and influencing factors have been widely reported.CNTs are reported to induce cell apoptosis/necrosis and reduce cell viability by influencing cell adhesion,cell cycle p rogressor oxidative stress.On the contrary,some researchers report that CNTs have little effectson cells.The conflicting results come from the fact thatmany chemical and physical p roperties affect cytotoxicity of CNTs,including the impuritiesof CNTs,the purification method,the size of CNTs,aggregation/dispersion of CNTs,cell culture condition,and even analysismethods.It is essential to establish standard reference samp les and detection methods for accurate assessment of the CNTs cytotoxicity.This review summarizes the research achievements on the cytotoxicity of pristine CNTs,and gives the perspective of the future research.
Key words:carbon nanotubes(CNTs);cellular toxicity;oxidative stress
1991年,Iijima在高分辨透射电子显微镜下意外观察到碳纳米管 (carbon nanotubes,CNTs)之后,CNTs便成为了最受重视的纳米材料之一.CNTs具有典型的层状中空结构特征,管身由六边形碳环微结构单元组成,是一种径向尺寸为纳米量级、轴向尺寸为微米量级的一维量子材料.根据管壁层数的差别,CNTs一般分为单壁 CNTs(single-walled CNTs,SWNTs)和 多壁 CNTs(multi-walled CNTs,MWNTs)[1-2].MWNTs在开始形成的时候,层与层之间保持固定的距离,约为 0.34 nm,直径一般大于2 nm,层与层之间很容易成为陷阱中心而捕获各种缺陷,因而管壁上通常布满小洞样的缺陷.与MWNTs相比,SWNTs是由单层圆柱型石墨层构成,其直径大小的分布范围小,缺陷少,具有更高的均匀一致性.由于 CNTs独特的结构,其研究具有重大的理论意义和潜在的应用价值,如 CNTs具有高拉伸强度、低密度、独特的电学性质,以及良好的热稳定性和化学稳定性等多种特性,在电子器件、复合材料等众多领域有着广泛的应用前景.在生物学领域,CNTs作为一种高级生物传感器材料已被实际应用,如抗原识别、酶催化反应和 DNA杂交等;CNTs拥有独特的一维纳米结构,是多种药物理想的纳米载体[3-6];CNTs的复合材料可以作为人造骨骼植入体内,为新生肌肉提供骨架和载体[7-8],并能诱导骨骼细胞的定向分化[9-10];CNTs还可以作为神经生长的基质[8]、多功能生物传输器和近红外射线选择性杀伤癌细胞的媒介[11]等.
随着制备技术的成熟和应用潜力的开发,CNTs的产量正逐年增长,人们直接或间接地接触 CNTs的机会也随之增加,随之而来的 CNTs生物安全性也逐渐引起广泛的重视[12-13].相关毒性研究已经在分子、细胞、组织到整体动物多个层次上展开,获得了相当多的数据.特别是细胞水平的工作,由于模型简单,适合机理性的研究,受到了大家的关注.已有大量的文献就 CNTs细胞毒性的效果、机理和影响因素进行了报道.但是,至今对于 CNTs是否具有细胞毒性仍存在争议[13-14].一部分研究者认为 CNTs具有毒性,并给出了各种毒性产生的机理;另一部分研究者发现 CNTs没有细胞毒性.但可以肯定的是,之所以有这样矛盾的结果,是因为有诸多的外在和内在的因素影响了对 CNTs细胞毒性的判断.本文将总结归纳 CNTs的细胞生物效应研究结果,探讨影响其生物效应的各种因素,在此基础上对未来CNTs细胞毒性研究提出看法和建议.
1 未修饰碳纳米管
未修饰碳纳米管 (pristine CNTs)在理论上是指单纯、完整的碳纳米管结构,在本文中特指经过纯化但没有被化学修饰的 CNTs.研究未修饰 CNTs的细胞毒性有着广泛的意义.
首先,随着研发的进步,CNTs的应用范围越来越广,产量也随之逐年增长.CNTs已由实验室走进人们的生活和环境,未修饰 CNTs已经作为商品流通于市,人们不可避免地会接触到 CNTs.因而,研究CNTs细胞毒性,对了解其对人类健康和安全的影响提供了重要数据.
其次,虽然 CNTs的各种生物学应用,包括生物传感器、药物载体等,往往要求 CNTs经过各种修饰,具备良好的水溶性、生物相容性和特定的生物学功能,但是,这些 CNTs衍生物在各种环境和条件下,可能发生去修饰作用,重新成为未修饰 CNTs.因此,研究未修饰 CNTs的生物效应对 CNTs安全应用于生物医学领域至关重要.
最后,人们对未修饰 CNTs的各种物理性质的控制也越来越精细.对不同性质未修饰 CNTs的细胞毒性的比较和研究,有利于阐明 CNTs细胞毒性的影响因素和机理.
2 碳纳米管对细胞活性和功能的影响
CNTs对细胞的活性和功能可能会产生重要的影响.从 2003年 Shvedova等[15]首次报道了 SWNTs能使人表皮角化细胞活性降低以来,已有大量的文献采用多种细胞系、多样的检测手段,研究了 CNTs的毒性.作为一种碳纳米材料,CNTs相对于纳米氧化铁、纳米氧化锌、半导体量子点等纳米材料,具有相对较小的毒性和较高的生物相容性[16-17].但是,仍有众多的实验数据显示,在一定条件下,CNTs对细胞的存活率和功能有影响,甚至导致细胞死亡.如图1所示的研究结果,CNTs能够降低细胞的粘附能力,提高细胞内氧化应激水平,阻碍细胞周期.通过这些过程,细胞可能会进一步通过凋亡/坏死的途径走向死亡.在某些情况下,细胞本身并未死亡,但增殖受到了抑制,并在实验中表现为总细胞活力的降低.
2.1 CNTs对细胞粘附的影响
细胞主要通过细胞粘附分子 (cell adhesion molecule,CAM)介导细胞间或细胞与细胞外基质(extracellular matrix,ECM)间的相互接触和结合.细胞正常粘附具有重要的生物学意义:①细胞的粘附影响细胞的存活与生长.正常真核细胞,除成熟血细胞外,大多需粘附于特定的细胞外基质上才能避免凋亡而存活,称为定着依赖性 (anchorage dependence).例如,上皮细胞及内皮细胞一旦脱离了细胞外基质就会发生凋亡.②细胞粘附决定细胞的形状.体外实验证明,各种细胞脱离了细胞外基质呈单个游离状态时多呈球形.③细胞通过与特定的细胞外基质成分作用而发生分化.例如,成肌细胞在纤粘连蛋白上增殖并保持未分化的表型,而在层粘连蛋白上则停止增殖,进行分化,融合为肌管.④参与细胞的迁移.细胞的迁移依赖于细胞的粘附与细胞骨架的组装,粘着斑是联系细胞外基质与细胞骨架的“铆钉”.
2005年,Cui等[18]发现用 SWNTs处理人胚胎肾细胞 HEK293后,细胞的活性减低.他们认为这与经过孵育后,细胞粘附能力明显降低有关.他们还发现,经过 SWNTs处理后,与细胞粘附相关的细胞因子层粘蛋白、纤连蛋白、粘着斑激酶 (focal adhesion kinase,FAK)、钙粘蛋白和胶原蛋白等的表达都显著降低.
2006年,Tian等[19]也发现人真皮纤维细胞与SWNTs接触后细胞活力显著降低.他们推测 SWNTs产生细胞毒性的机制是:正常细胞通过钙粘分子等细胞粘附分子介导细胞间或细胞与细胞外基质间的相互接触和结合,通过细胞骨架支持细胞完整的结构;而 SWNTs能够干扰细胞膜的结构组成,使细胞粘附相关分子的表达改变;进而细胞骨架断裂,细胞形态和细胞粘附能力发生改变,最终导致细胞的凋亡或坏死 (见图2).

图1 CNTs对细胞的活性和功能的影响Fig.1 Effects of CNTs on the viability and function of cells

图2 CNTs通过影响细胞的粘附能力产生毒性[19]Fig.2 CNTs induce cytotoxicity by changing the adhesion ability of cells[19]
Wörle-Knirsch等[20]通过免疫染色,在荧光显微镜下观察到 FAK和肌动蛋白在 SWNTs周围的聚集.FAK是整合蛋白介导的信号转导中的重要成员,有酪氨酸蛋白激酶活性,并可自身磷酸化;FAK可抑制细胞凋亡,与细胞内其他信号转导通路存在串话 (crosstalk),直接参与细胞多种功能的调节.在他们的实验条件下,A549细胞团绕 SWNTs生长,并将 SWNTs包裹起来,形成聚集体,并从培养皿底脱离开来.2008年,Zhang等[21]也研究了 CNTs对 FAK蛋白表达的影响.他们发现:在 SWNTs培养的细胞中,点状和线状的 FAK都分布在细胞的边缘;而在MWNTs培养的细胞中,只有点状的 FAK存在,并且均匀分布在细胞内.因此,CNTs的引入会影响细胞中 FAK的分布,并且不同种类的 CNTs对 FAK表达的影响也不同.Walker等[22]也观察到,被 SWNTs或MWNTs孵育后,细胞骨架崩解,钙粘蛋白减少.
与干扰细胞粘附能力的报道相反,关于细胞能够在 CNTs复合材料的缝隙中粘附、生长、增殖、分化的报道也有很多[7,9,23-26].2009年,Tutak等[27]细致研究了 SWNTs薄膜对成骨细胞的影响.首先将SWNTs沉积到聚纤维素酯膜上,并在该基底上培养大鼠成骨干细胞.结果发现,细胞与 SWNTs接触24 h后,能够吞噬少量的疏松 SWNTs,并引起急性的细胞毒性,诱发细胞死亡.然而,继续培养该细胞却发现,残余的细胞仍具有旺盛的增殖能力.在后续培养的 23 d时间内,细胞数量持续增加,总蛋白含量远高于在聚苯乙烯基底上生长的对照组细胞.他们认为,SWNTs接触的急性毒性引起少量的细胞死亡,促进了细胞内源性细胞毒性因子的表达,刺激了细胞的生长.
经过 CNTs的孵育,细胞中粘附相关蛋白的表达和细胞的粘附能力往往会发生变化,但这些变化是否导致 CNTs产生细胞毒性以及机制如何,在目前零散的数据中,还不能有确定的结论.CNTs对粘附相关蛋白的表达水平、粘附相关蛋白的信号通路以及细胞粘附的动力学的影响,包括这些因素对细胞迁移、存活的影响都有待细致地研究.
2.2 CNTs对细胞增殖的影响
2007年,De Nicola等[28]研究了用不同方法制备的、杂质含量有差异的多种MWNTs对 U937细胞的活力及增殖的影响.他们用直接计数法来判断细胞的增殖,用台酚兰拒染实验测定细胞死亡率,用Hoechst 33342/PI双染法判断细胞凋亡.结果发现,在与 25μg/mL的 CNTs孵育 48 h后,细胞的个数相对于对照组显著减少,即增殖被抑制,但没有明显的坏死或凋亡.根据他们的实验数据,在 CNTs环境下孵育后,细胞增殖能力的改变是一个相对于细胞死亡的早期事件.
2007年,Herzog等[29]利用克隆形成法(clonogenic assay),在三种细胞系 (A549,HaCaT和BEAS-2B)中都观测到了 CNTs对细胞增殖的影响.Casey等[30]报道的结果与此一致.
CNTs对细胞增殖的影响可以体现在对细胞周期的影响上.细胞周期是指能持续分裂的真核细胞从一次有丝分裂结束后生长,再到下一次分裂结束的循环过程,即细胞增殖一次的过程.细胞周期的长短反映了细胞所处状态.
研究发现,CNTs能够通过延滞细胞周期影响细胞的增殖.2005年,Cui等[18]用 SWNTs处理HEK293细胞,发现细胞被阻滞在 G1期,无法正常分裂,进而引发凋亡.相应地,与细胞周期相关的蛋白激酶(CDK)和周期蛋白 (cyclin)有相应的上调或下调.
2005年,Ding等[31]利用 BrdU标记 DNA,发现细胞被阻滞在 G2/M期.但是,当细胞暴露于低剂量的 CNTs时,细胞内与蛋白合成、转运相关的基因表达降低,促 G1-S期转换的基因表达也降低,细胞将被滞在 G1期.
2009年,Sargent等[32]报道 SWNTs能够参入到有丝分裂纺锤体中,促使纺锤体分解,诱发细胞转化为多倍体.
2.3 CNTs提高细胞内氧化应激水平
氧化应激指机体在遭受刺激时,体内高活性分子如活性氧自由基 (reactive oxygen species,ROS)和活性氮自由基 (reactive nitrogen species,RNS)产生过多,氧化程度超出细胞清除氧化物的能力,于是氧化系统和抗氧化系统失衡,导致细胞损伤.它通常被认为是纳米颗粒导致细胞毒性的重要途径[33].ROS是血管细胞增长的重要细胞内信号,与血管状态 (如高血压、动脉粥样硬化)有关,在肺纤维化、癫痫、高血压、动脉粥样硬化、帕金森等疾病中均扮演重要角色.因而,在很多的 CNTs毒性试验中,人们很自然地对CNTs引起细胞氧化应激水平进行了测定.
早在 2003年,Shvedova等[15]发现,在暴露于CNTs后,细胞内活性氧水平升高,细胞抗氧化能力降低,细胞内低分子量含巯基蛋白减少.CNTs引发的细胞内 ROS的提升,能够进一步引起细胞内转录因子核因子 -κB(nuclear factor-κB,NF-κB)表达的提高,并最终引起细胞死亡[34].不过,在他们的实验中,所使用的 CNTs纯度很低,铁含量高达 30%,而铁是已知的能强烈引起 ROS的物质.因而,他们推测氧化应激主要来源于生产 CNTs时引入的金属催化剂.
2006年,Fenoglio等[35]利用纯化后的 MWNTs,探讨 CNTs与自由基的关系.他们通过NaOH和 SDS等的处理,将 MWNTs中的金属含量控制在 1%以下.结果发现,CNTs不仅没有引发自由基的产生,反而有很强的捕获自由基的能力.这佐证了细胞中自由基来源于金属杂质的说法.
Kagan等[36]探讨了纯化前 (w(Fe)=26%)和纯化后 (w(Fe)=0.23%)的 SWNTs对RAW264.7细胞产生自由基的影响.在他们的实验条件下,二者都没有直接引起 RAW264.7细胞内自由基含量的升高.但是,对于已经被酵母聚糖 (zymosan)或十四烷酸乙酸佛波酯 (phorbol myristate acetate,PMA)刺激激活的 RAW264.7细胞,纯化前和纯化后的 SWNTs都能引起细胞内谷胱甘肽 (GSH)含量的降低,以及脂过氧化的提高.含有杂质较多的 SWNTs较纯化后的 SWNTs能更显著地改变两个氧化应激指标.他们还研究了这两种碳管对鼠上皮细胞 (JB6 P+)的影响[37].结果发现,在未纯化的 SWNTs孵育过的细胞中检测到了自由基信号和转录因子活化蛋白-1(activating protein-1,AP-1)表达量升高,而纯化后的SWNTs孵育的细胞中则没有.不过,在两种碳管孵育过的细胞内,另一种通常在氧化应激中被激活的NF-κB表达量的提高程度却非常相似.
2007年,Pulskamp等[38]探讨了金属杂质对细胞产生 ROS的影响.通过比较含催化剂少、纯度高的酸处理过的 SWNTs与直接商业生产出的金属含量较高的 SWNTs的细胞毒性,他们发现,在 100μg/mL的浓度下,经酸处理过且金属含量较少的 SWNTs没有引起细胞内 ROS的显著提高,其他金属量较多的CNTs都引起了 ROS的提高.
Pulskamp等[39]还发现,修饰前的 CNTs样品中通常混杂的金属杂质和不定形碳,都可能引起细胞内氧化应激水平的增高,但是,两种杂质可能通过刺激不同的途径引起氧化应激.他们发现,不定形碳杂质能够在短短的 10 min内迅速引起细胞内自由基含量的升高,而金属杂质只有经过较长时间的接触(如 24 h),才能引起细胞内自由基含量的提高.
研究还发现,虽然除掉杂质能够减弱 CNTs引起的氧化应激,但是并不能完全消除.也就是说,碳管本身可能也具有导致细胞产生氧化应激的能力.2009年,Choi等[40]在测定 SWNTs引起细胞内 ROS提高的实验中,使用了更高的浓度 (500μg/mL)和更久的孵育时间(72 h),结果得到的 ROS响应非常明显.更有意思的是,尽管以往的实验中都推测,CNTs中含有的 Fe杂质对 CNTs产生氧化应激起着关键的作用,但是在该实验中,SWNTs孵育过的细胞内ROS水平高于同等浓度氧化铁纳米粒子孵育过的细胞 (见图3).图中:LMH(layered metal hydroxide)是一种复合纳米材料 (Mg0.68Al0.32(OH)2(CO3)0.16·0.1H2O,尺寸为 200 nm);氧化铁和硅的尺寸分别为20~30 nm和约 14 nm;SWNTs直径为1.2~1.5 nm,最大长度为 2.5μm.
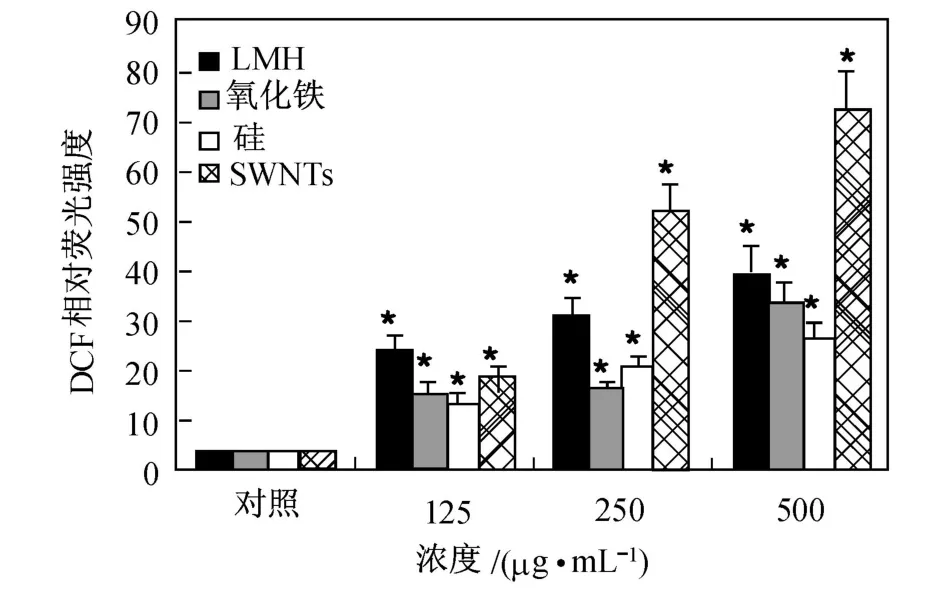
图3 CNTs孵育 A549细胞 72 h后 ROS的升高[40]Fig.3 CNTs induce the ROS generation in A549 cells after 72 h incubation[40]
Herzog等[41]的研究也认为,减少 CNTs外的金属含量,能够显著降低碳管在细胞内产生活性氧的能力.但是,纯化的 CNTs仍然具有一定的引起细胞内活性氧增高的能力,并且该能力与 CNTs在体系中的分散密切相关.也就是说,不仅是金属催化剂,碳管的表面性质也是引发细胞内 ROS提升的原因.
2.4 CNTs促使细胞凋亡
凋亡,又称程序化细胞死亡,是细胞主动实施的一种死亡形式和机制.细胞粘附能力的降低,细胞增殖受阻,细胞内氧化应激水平的提高,都可能引起细胞通过凋亡走向死亡.
2005年 ,Cui等[18]用 SWNTs处理 HEK293细胞,并利用形态学观察、DNA Ladder和 PI单染等多种方法检测细胞凋亡.结果发现,25μg/mL的SWNTs,经过 4 d的孵育能够引发 43.5%的细胞发生凋亡.凋亡发生的程度与孵育时间和暴露剂量成正比.他们认为,凋亡的发生是由 CNTs改变细胞周期相关因子,以及细胞粘附相关因子引起的.
2005年 ,Ding等[31]利用 YO-PRO1/PI双染的方法观测 MWNTs导致的细胞坏死与凋亡.他们发现,MWNTs处理造成细胞出现凋亡和坏死,并且具有剂量依赖性.基因芯片分析结果显示:经过 48 h的暴露,低剂量下 (0.06 mg/mL)MWNTs主要使得细胞活力降低;高剂量下 (0.6 mg/mL)MWNTs能引起大量的促进细胞凋亡和坏死的基因,如 TNF家族蛋白、BCL2L2、MCL1等表达量升高.
2006年,Bottini等[42]研究了 CNTs诱导 T细胞凋亡的效果,结果也显示高剂量 (400μg/mL)的CNTs能引起严重的细胞凋亡 (见图4).2009年,Choi等[40]、Ravichandran等[43]也分别在两种肺上皮细胞A549和 LE中,观察到了 CNTs引起的细胞凋亡.

图4 CNTs引起 Jurkat细胞凋亡[42]Fig.4 CNTs induce apoptosis of human Jurkat cells[42]
Muller等[44]也报道了 MWNTs引起上皮细胞MCF-7的凋亡,他们还同时发现MWNTs能够引起细胞染色体断裂和形成细胞内的微核体.他们的结果在Lindberg等[45]和 Cveticanin等[46]的 DNA双链的断裂检测和微核体的形成实验中得到了进一步证实.
利用相似的实验手段,一些文献也报道了 CNTs不能引发细胞发生凋亡.De Nicola等[28]就认为CNTs仅影响细胞的增殖,不会让细胞坏死和凋亡.Hirano等[47]报道 CNTs不能引起凋亡路径上的Caspase 3和 PARP表达量提高.Tabet等[48]在研究CNTs对 A 549的细胞毒性时,用 DNA Ladder方法观测细胞内 DNA的变化,结果发现细胞没有发生凋亡的趋势.但要注意的是,在这些工作中使用的 CNTs的浓度都低于 100μg/mL,相对于那些观测到细胞凋亡的实验来说剂量偏低,并且作用时间偏短.要判断 CNTs是否能引起细胞发生凋亡,还要考虑体外实验的暴露剂量是否远高于最大的机体真实暴露剂量,而使结果失去真实性.总体来说,CNTs是否引起细胞发生凋亡或坏死有一定的剂量效应,低剂量的CNTs常显示出较高的安全性,而高剂量的 CNTs则有可能引起细胞凋亡或坏死.
2.5 CNTs对细胞的其他影响
除了上述影响外,经过 CNTs暴露,细胞本身所具有的某些特性也有可能发生改变.2005年,Cui等[18]用 SWNTs处理 HEK293细胞 ,发现 SWNTs会逐渐被细胞分泌出的蛋白包裹,以起到与细胞分隔的效果,这是细胞自我保护的一种手段.经过电泳分析,发现这些蛋白是一组分子量在 20~30 kD的蛋白.Hirano等[47]否认MWNTs刺激巨噬细胞产生氧化应激的能力,他们认为 MWNTs表面能够吸附和结合细胞表面的MARCO(macrophage recep tor w ith collagenous structure),促进了巨噬细胞对MWNTs的吞噬和消化,并相应地在巨噬细胞中体现出一定的细胞毒性.2005年,Jia等[49]研究了 CNTs对肺气泡巨噬细胞 (alveolar macrophage,AM)的影响.他们发现,当 SWNTs浓度高于 0.38μg/cm2,MWNTs浓度高于 3.06μg/cm2时,AM的吞噬能力降低.另外,对于免疫细胞,CNTs通常能引起细胞的炎症反应,如IL-8[50],TNF-α[51]分泌的增加等.但是 ,Herzog等[52]报道 SWNTs能够抑制 A549细胞和 NHBE细胞 IL-8和 TNF-α的表达,尤其在二棕榈酰磷脂酰胆碱 (肺液中的成分,能够提高 CNTs的分散性)和 TNF-α的刺激下,SWNTs抑制细胞因子产生的能力更加显著.
3 影响 CNTs细胞毒性的因素
3.1 外在因素
3.1.1 实验条件的影响
CNTs的剂量、接触时间以及细胞系的选择都会影响 CNTs毒性的大小.上文已经提到,CNTs的细胞毒性存在剂量效应.通常来讲,CNTs在低浓度下有较高的安全性,在较高浓度下毒性较强.同时,CNTs的细胞毒性也存在时间效应.在 Cui等[18]的实验中,相同剂量下,CNTs孵育细胞的时间越长,细胞的存活率越低.然而,在 Tutak等[27]的实验中,相同剂量下,短时间的 CNTs孵育后 (24 h内),细胞有较多的死亡,随着时间的延长,细胞增殖能力回复,细胞数目不断增长.在 CNTs的细胞毒性研究中,剂量和时间两个变量的影响也非线性,可能存在复杂的机制.在同一研究中,使用相同的 CNTs、相同的暴露剂量和时间,选择的细胞系不同,得到的毒性数据也存在差别[16-17,29,53].因此,剂量、时间点、细胞系等实验条件的选择,对于检测和评估 CNTs的细胞毒性至关重要.
3.1.2 杂质的影响
CNTs制备过程中引入的,经纯化过程后残留的金属杂质、碳杂质,能够引起细胞内 ROS升高,消耗细胞内还原性多肽和蛋白,引起细胞内 NF-κB表达的提高[33,38],增大 CNTs的细胞毒性[15,54-56].经过基本的纯化步骤,少量被封装在碳结构中的金属,在细胞培养体系中仍有可能被释放出来,并对其毒性产生重要影响[57].目前,CNTs的完全纯化仍然是一个有待突破的课题[58].制备方法、纯化步骤的不同,CNTs中杂质的组成、比例也存在差异,这使得杂质对 CNTs毒性的影响更为复杂.
3.1.3 纯化方法和混酸处理的影响
未修饰 CNTs在制备与直接接触细胞之间,还涉及纯化步骤.纯化过程是一个化学过程,往往涉及强酸回流、高温加热、超声等操作.这些操作在除去金属杂质的同时,不可避免地在 CNTs的表面,尤其是缺陷位置引入官能团.Bottini等[42]比较了纯MWNTs和酸处理后的MWNTs对 T淋巴细胞系 Jurkat细胞的影响.结果发现,酸处理后的 MWNTs的细胞毒性显著提高.Albini等[59]用硝硫混酸处理 SWNTs,得到的氧化 SWNTs有更强的细胞毒性.与之相对的是 Porter等[55]的实验,他们也利用酸化后的分散性很好的SWNTs来检验 CNTs的毒性,并且利用 Raman技术确定了所用的 CNTs表面存在大量由于酸化而产生的官能团.但是,该实验中使用的 CNTs并没有显示出细胞毒性.这些结果提示我们,虽然在纯化过程中产生的官能团是少量和简单的,但是,这一部分官能团的存在对 CNTs的分散性可能有较大的影响,在生物体系中可能影响其生物效应.3.1.4 细胞培养环境体系的影响
评价 CNTs的细胞毒性,需要考虑到 CNTs与培养基等复杂液体环境相混合的过程和影响.CNTs具有大的比表面积,可以吸附环境体系中的蛋白质、芳香类分子.在自身表面性质变化的同时,其毒性也受到影响.CNTs还受到生物体系中金属离子 (缓冲体系)的影响,其分散性能发生显著地变化.常用的培养基通常加入血清为细胞正常生长提供营养,加入酚红指示培养基的 pH值变化.研究表明,CNTs可以吸附酚红[60],改变其细胞毒性.CNTs在无血清体系中的细胞毒性较有血清体系显著偏高[61-62],血清能够包裹 CNTs,降低 CNTs在细胞内产生 ROS的能力[41].Casey等[30]研究发现 CNTs之所以会显现出细胞毒性,是因为血清中蛋白被 CNTs所吸附,相当于消耗了培养基中的营养,使所孵育的细胞缺乏营养而活力低于空白组,产生假阳性.他们将 CNTs在培养基中孵育一定时间,过滤培养基获得不含有CNTs的培养基,用此培养基培养的细胞的细胞活力显著降低.但 Geys等[63]也做了相似的实验,却发现血清的存在与否对 CNTs的毒性没有产生影响.综合上述工作,CNTs的吸附性能可能影响其细胞毒性,但目前对于培养基中究竟何种组分被 CNTs吸附带来的影响更为关键,并产生了怎样的影响还有待于进一步细致、深入地研究.
3.1.5 实验方法的影响
要检验 CNTs细胞毒性各个方面的影响,需要使用多种实验方法.细胞毒性一个方面的变化,可以选择的检测方法也不唯一,而利用不同的方法检验同一指标的变化也有可能存在差异.例如,细胞存活率检测方法包括台盼兰染色直接计数法、MTT染色测紫外吸收法、MTT的改进方法WST和 MTS法、间接指示细胞死亡率的乳酸脱氢酶 (LDH)露出率法、用流式细胞仪计数细胞存活率的碘化丙啶 (PI)法以及Bradford测蛋白浓度法等.这些方法主要是利用各种染料,与细胞内恒定含量的组分结合,或被与活细胞数目相关的酶催化转化,生成有特定吸光或荧光的物质,通过检测光信号的变化来检测细胞活力的变化.每种检测方法都是从各自的角度来确定细胞毒性,因此,对于同样的 CNTs,不同方法检测得到的毒性结果可能有所不同[64].
CNTs对染料的吸附也有可能干扰通过使用这些染料得到结果.研究发现,在MTT方法测定细胞活力的实验中,虽然 CNTs并不干扰甲臜 (MTT被线粒体内酶催化氧化生成的产物)在细胞内的形成,但是,吞噬到细胞中的 CNTs能够吸附生成的甲臜.而通常所使用的用于溶解甲臜的 DMSO或 SDS的酸溶液无法将吸附在 CNTs上的那部分溶解下来 (见图5),因而,实验上观测到的吸光度比实际产生的甲臜完全溶解后的溶液的吸光度低,造成假阳性[20,65-66].
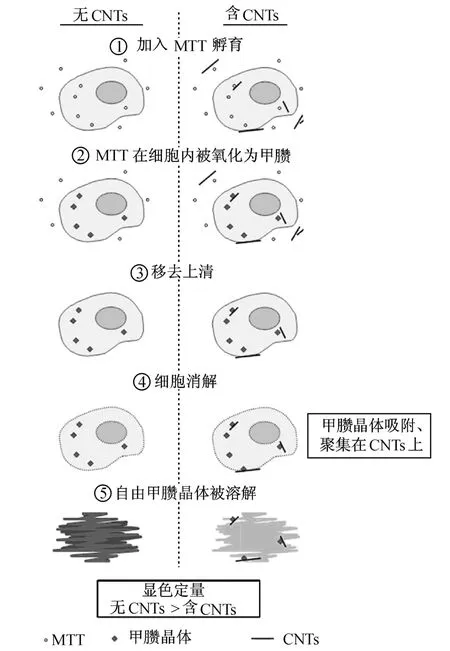
图5 利用M TT方法检测 CNTs细胞毒性时假阳性产生的机制[65]Fig.5 Proposed m echan ism for the false positive cytotox icity of CNTs using M TT assay[65]
不使用染料评价 CNTs细胞毒性的方法能够避免染料与 CNTs相互作用带来的影响.克隆形成法是一种不涉及染料的细胞毒性检测方法,该方法最初主要用于放射线毒性的检查 (普通染料可能被辐射破坏),目前也被用于 CNTs的毒性研究中[29-30,67].该方法通过稀释并得到单分散的细胞,在培养皿中经过 10 d的培养,使每个能正常繁殖的细胞在原位扩增为肉眼可以观察的集落 (见图6).图中,P90为 Printex炭黑,ArcD为电弧法生产的CNTs,Hipco为 Hipco 生产的 CNTs[29].集落数量的减少表示细胞存活率的降低,集落的大小则可反映增殖能力的变化.Herzog等[28]的结果和 Wörle-Knirsch等[20]、Casey等[30]得到的结果一致,即 CNTs没有明显地使细胞存活率降低.该方法的最大好处就是不受任何染料的影响,缺点是工作量较大,比较费时.该方法可以作为标准方法用来参比使用染料方法的准确性.
综上,CNTs细胞毒性的结论应该是建立在综合多种方法实验结果的基础上,这样的结论也才是可靠的.

图6 CNTs对 A549细胞集落形成的影响[29]Fig.6 Effect of CNTs exposure on colony formation of A549 cells[29]
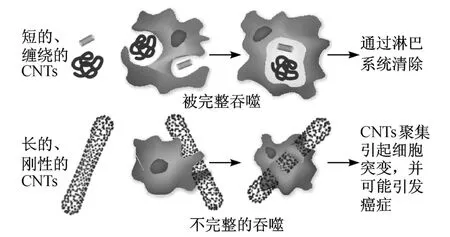
图7 长度对 CNTs细胞毒性的影响[68]Fig.7 Influence of the length on the cytotoxic ity of CNTs[68]
3.2 内在因素
3.2.1 长度的影响
Sato等[51]研究了平均长度为 220和 825 nm的两种MWNTs对人急性白血病细胞系 HTP-1的细胞毒性.他们发现,长MWNTs引起细胞内 TNF-α表达量升高的幅度比短 MWNTs大.他们推测:短MWNTs更容易被细胞吞噬和包裹,因而引起的免疫反应更小;长 CNTs更容易穿破细胞,造成细胞损伤(见图7)[68].
在 Shi等[69]的研究中,长 SWNTs和短 SWNTs都没有显示出明显的细胞毒性.在 Simon-Deckers等[65]的实验中,长的和短的MWNTs都显示了较强的细胞毒性,但是二者之间没有显著性差别.
可以看到,长度究竟怎样影响CNTs的细胞毒性,目前还存在着争议,值得进行更深入研究.
3.2.2 聚集程度的影响
碳纳米管的聚集程度会影响到 CNTs的形态、表面积等,对其细胞毒性影响显著.Belyanskaya等[53]在研究 SWNTs对神经元细胞和胶质细胞的毒性时发现,分散性好的 SWNTs对两种细胞均显现了更强的毒性.他们推测,这是由于分散性好的 CNTs表面积更大,和细胞的作用更强.Raja等[70]通过过滤的方法,将 CNTs中大的聚集体滤掉,发现 CNTs表现出的毒性有所降低,但降低程度不明显.然而,支持 CNTs的毒性来源于其纤维状结构的研究者却发现,分散性差的 CNTs由于具有较高的刚性而显示出更大的细胞毒性[71].3.2.3 管壁层数的影响
尽管没有能够得出确切结论的报道,SWNTs的细胞毒性通常大于 MWNTs[21].在 Jia等[49]的研究中,SWNTs在 0.38μg/cm2浓度下就显现出细胞毒性,而MWNTs在 3.06μg/cm2才开始引起细胞活力的损失.SWNTs有较大的比表面积和较强的管间作用力,容易形成纳米管束,而MWNTs管壁通常存在更多的缺陷和官能团.虽然同为 CNTs材料,但二者无论在毒性,还是在毒性产生的机制上都存在差异.
综上所述,CNTs的细胞毒性是一个多维的课题.要判断 CNTs的细胞毒性,搞清楚 CNTs的毒性的机制,还需要很多实验数据的积累和系统分析.
4 总结与展望
作为纳米材料中的明星成员,碳纳米管的细胞毒性受到人们的关注.随着大量相关工作报道,我们也从中获得关于 CNTs细胞效应的诸多信息.然而,纵览 CNTs细胞毒性的研究文献,会发现即使用相同的细胞生物学研究手段,就某一项指标在结论上却常常出现大相径庭的结果.产生这些矛盾的影响因素很多,这些矛盾也为今后 CNTs细胞毒性的研究指明方向.
首先,CNTs的多样性给 CNTs的毒性评价带来困难.CNTs的制备方法、纯化手段多种多样,使得同实验室不同批次得到的 CNTs在长度、管径、纯度方面都存在着不同[28].早期用于 CNTs毒性评价的CNTs样品往往金属杂质含量偏高,CNTs的毒性也较高[15].随着纯化和分离手段的进步,人们逐渐发觉 CNTs的纯度[28]、长度[51]、聚集程度[70,72]都会影响 CNTs的细胞毒性[73-74].同时,关于这些因素是否真的会影响 CNTs的细胞毒性还存在争议[66].CNTs的物化参量众多,在比较 CNTs的细胞毒性时,这个多维的体系需要保持单一的变量,所得到的结果才有意义,但目前还很难做到.而且,即使是使用同一种 CNTs,在同样实验条件下,不同的细胞对 CNTs的反应也可能存在差异[29,70,75].这些变量对 CNTs细胞毒性的影响需要系统研究.要使不同的实验室所得数据具有可比性,最有效的方法就是能够建立一个公认的标准品.在此基础上进行的研究结果,才会有更广泛的应用意义.
其次,传统的细胞生物学方法不一定适用于CNTs细胞毒性研究.CNTs作为一种高比表面积、高吸附能力的外源物质被引入细胞培养体系,并可能被细胞吞噬.而表征细胞活性或机能的参数很多是通过特定分子发出的吸光或荧光信号给出的.CNTs是否会对这些表征产生影响正逐渐引起人们的关注,已经有一些先期的工作发表.目前比较保守的做法是针对每一个指标尽量用多种方法,从多个角度相互佐证,以提高结果的可靠性.当然,在这些方法比较的过程中,必须建立标准和可靠的用于 CNTs甚至所有纳米材料细胞毒性研究的方法.发展 CNTs细胞毒性标准检测方法是最终获得 CNTs真实毒性的基础.
最后,纳米材料的浓度界定模糊.许多纳米材料,包括未修饰 CNTs,在水溶液中溶解性低,多以固体形式沉积于细胞表面,而不是悬浮于培养基中.利用单位体积内的 CNTs数量、单位细胞的 CNTs数量、培养皿单位面积的 CNTs数量,作为 CNTs单位的文献都已报道,因此,确立合适的 CNTs剂量描述单位,对纳米材料的毒性研究意义深远.
总体来说,对于 CNTs细胞毒性的研究,要获得真实可信的结果,需要标准可信的检测方法,需要标准的 CNTs样品,需要系统研究各个影响因素造成的细胞应答.
[1] BETHUNE D S,KLANG C H,DEVRIES M S,et al.Cobalt-catalyzed growth of carbon nanotubeswith singleatomic-layerwalls[J].Nature,1993,363(6430):605-607.
[2] IIJIMA S,ICHIHASHI T.Single-shell carbon nanotubes of 1-nm diameter[J].Nature,1993,363(6430):603-605.
[3] AJIMA K,YUDASAKA M,MURAKAM I T,et al.Carbon nanohorns as anticancer drug carriers[J].MolecularPharmaceutics,2005,2(6):475-480.
[4] KLUMPP C,KOSTARELOS K,PRATO M,et al.Functionalized carbon nanotubes as emerging nanovectors for the delivery of therapeutics[J].Biochimica et Biophysica Acta:Biomembranes,2006,1758(3):404-412.
[5] L IU Z,CHEN K,DAV IS C,et al.Drug delivery with carbon nanotubes for in vivo cancer treatment[J].Cancer Research,2008,68(16):6652-6660.
[6] L IU Z,SUN X M,NAKAYAMA-RATCHFORD N,et al.Supramolecular chemistry on water-soluble carbon nanotubesfor drug loading and delivery[J].ACSNano,2007,1(1):50-56.
[7] KALBACOVA M,KALBAC M,DUNSCH L,et al.Influence of single-walled carbon nanotube films on metabolic activity and adherence of human osteoblasts[J].Carbon,2007,45(11):2266-2272.
[8] TRAN P A,ZHANG L,WEBSTER T J. Carbon nanofibers and carbon nanotubes in regenerative medicine[J].Advanced Drug Delivery Reviews,2009,61(12):1097-1114.
[9] ZANELLO L P,ZHAO B,HU H,et al.Bone cell p roliferation on carbon nanotubes[J].Nano Letters,2006,6(3):562-567.
[10] ZHANG D,YIC,ZHANG J,et al.The effectsof carbon nanotubes on the p roliferation and differentiation of p rimary osteoblasts[J].Nanotechnology,2007,18(47):475102.
[11] KAM N W S,O′CONNELL M,W ISDOM J A,et al.Carbon nanotubes as multifunctional biological transporters and near-infrared agents for selective cancer cell destruction [J]. Proceedings of the National Academy of Sciences of the United States of America,2005,102(33):11600-11605.
[12] SMART S K,CASSADY A I,LU G Q,et al.The biocompatibility of carbon nanotubes[J]. Carbon,2006,44(6):1034-1047.
[13] LEWINSKIN,COLV IN V,DREZEK R.Cytotoxicity of nanoparticles[J].Small,2008,4(1):26-49.
[14] KOLOSNJAJ J,SZWARC H,MOUSSA F.Toxicity studies of carbon nanotubes[M]∥ Bio-Applications of Nanoparticles.New York:Springer,2007:181-204.
[15] SHVEDOVA A A,CASTRANOVA V,KISIN E R,et al.Exposure to carbon nanotube material:assessment of nanotube cytotoxicity using human keratinocyte cells[J].Journal of Toxicology and Environmental Health:Part A,2003,66(20):1909-1926.
[16] SOTO K,GARZA KM,MURR L E.Cytotoxic effects of aggregated nanomaterials [J]. Acta Biomaterialia,2007,3(3):351-358.
[17] SOTO K F,GARZA KM,SHI Y,et al.Direct contact cytotoxicity assays for filter-collected, carbonaceous(soot)nanoparticulate material and observations of lung cell response[J].Atmospheric Environment,2008,42(9):1970-1982.
[18] CUID X,TIAN FR,OZKAN C S,et al.Effectof single wall carbon nanotubes on human HEK293 cells[J].Toxicology Letters,2005,155(1):73-85.
[19] TIAN FR,CUID X,SCHWARZ H,et al.Cytotoxicity of single-wall carbon nanotubes on human fibroblasts[J].Toxicology in Vitro,2006,20(7):1202-1212.
[20] WÖRLE-KNIRSCH J M,PULSKAMP K,KRUG H F.Oops they did it again!Carbon nanotubes hoax scientists in viability assays[J].Nano Letters,2006,6(6):1261-1268.
[21] ZHANG X K,WANG X F,LU Q H,et al.Influence of carbon nanotube scaffolds on human cervical carcinoma HeLa cell viability and focal adhesion kinase expression[J].Carbon,2008,46(3):453-460.
[22] WALKER V G,L I Z,HULDERMAN T,et al.Potential in vitro effects of carbon nanotubes on human aortic endothelial cells [J]. Toxicology and Applied Pharmacology,2009,236(3):319-328.
[23] MENG J,SONG L,KONG H,et al.Using single-walled carbon nanotubes nonwoven films as scaffolds to enhance long-term cell p roliferation in vitro [J]. Journal of Biomedical Materials Research:Part A,2006,79(2):298-306.
[24] ABARRATEGIA,GUTIERREZ M C,MORENO-V ICENTE C,et al.Multiwall carbon nanotube scaffolds for tissue engineering purposes[J].Biomaterials,2008,29(1):94-102.
[25] LOBO A O,ANTUNES E F,PALMA M B S,et al.Monolayer formation of human osteoblastic cells on vertically-aligned multi-walled carbon nanotube scaffolds[J].Cell Biology International,2010,34(4):393-398.
[26] LOBO A O,CORAT M A F,ANTUNES E F,et al.An evaluation of cell proliferation and adhesion on verticallyaligned multi-walled carbon nanotube films [J].Carbon,2010,48(1):245-254.
[27] TUTAK W,PARK K H,VASILOV A,et al.Toxicity induced enhanced extracellular matrix production in osteoblastic cells cultured on single-walled carbon nanotube networks[J].Nanotechnology,2009,20(25):255101.
[28] DE NICOLA M,GATTIA D M,BELLUCCI S,et al.Effect of different carbon nanotubes on cell viability and p roliferation [J]. Journal of Physics: Condensed Matter,2007,19(39):395013.
[29] HERZOG E,CASEY A,LYNG F M,et al.A new approach to the toxicity testing of carbon-based nanomaterials—the clonogenic assay[J]. Toxicology Letters,2007,174(1/2/3):49-60.
[30] CASEY A,HERZOG E,LYNG FM,et al.Singlewalled carbon nanotubes induce indirect cytotoxicity by medium depletion in A549 lung cells[J].Toxicology Letters,2008,179(2):78-84.
[31] DING L H,STILWELL J,ZHANG T T,et al.Molecular characterization of the cytotoxic mechanism of multiwall carbon nanotubes and nano-onions on human skin fibroblast[J].Nano Letters,2005,5(12):2448-2464.
[32] SARGENT L M,SHVEDOVA A A,HUBBS A F,et al.Induction of aneup loidy by single-walled carbon nanotubes [J]. Environmental and Molecular Mutagenesis,2009,50(8):708-717.
[33] OBERDÖRSTER G,OBERDÖRSTER E,OBERDÖRSTER J.Nanotoxicology:an emerging discipline evolving from studiesof ultrafine particles[J].Environmental Health Perspectives,2005,113(7):823-839.
[34] MANNA SK,SARKAR S,BARR J,et al.Single-walled carbon nanotube induces oxidative stress and activates nuclear transcription factor-κB in human keratinocytes[J].Nano Letters,2005,5(9):1676-1684.
[35] FENOGLIO I,TOMATIC M,L ISON D,et al.Reactivity of carbon nanotubes: free radical generation or scavenging activity?[J]. Free Radical Biology and Medicine,2006,40(7):1227-1233.
[36] KAGAN V E,TYURINA Y Y,TYURIN V A,et al.Direct and indirect effects of single walled carbon nanotubes on RAW264.7 macrophages:role of iron[J].Toxicology Letters,2006,165(1):88-100.
[37] MURRAY A R,KISIN E,LEONARD S S,et al.Oxidative stress and inflammatory response in dermal toxicity of single-walled carbon nanotubes [J].Toxicology,2009,257(3):161-171.
[38] PULSKAMP K,DIABAT S,KRUG H F.Carbon nanotubes show no sign of acute toxicity but induce intracellular reactive oxygen species in dependence on contaminants[J].Toxicology Letters,2007,168(1):58-74.
[39] PULSKAMP K,WÖRLE-KNIRSCH JM,HENNRICH F,et al.Human lung epithelial cells show biphasic oxidative burst after single-walled carbon nanotube contact[J].Carbon,2007,45(11):2241-2249.
[40] CHOI SJ,OH JM,CHOY J H.Toxicological effects of inorganic nanoparticleson human lung cancer A549 cells[J].Journal of Inorganic Biochemistry,2009,103(3):463-471.
[41] HERZOG E,BYRNE H J,DAVOREN M,et al.Dispersion medium modulatesoxidative stress response of human lung epithelial cells upon exposure to carbon nanomaterial samples[J]. Toxicology and Applied Pharmacology,2009,236(3):276-281.
[42] BOTTINIM,BRUCKNER S,N IKA K,et al.Multi-walled carbon nanotubes induce T lymphocyte apoptosis[J].Toxicology Letters,2006,160(2):121-126.
[43] RAV ICHANDRAN P, PERIYAKARUPPAN A,SADANANDAN B,et al.Induction of apoptosis in rat lung epithelial cells by multiwalled carbon nanotubes[J].Journal of Biochemical and Molecular Toxicology,2009,23(5):333-344.
[44] MULLER J,DECORDIER I,HOET P H,et al.Clastogenic and aneugenic effects of multi-wall carbon nanotubes in epithelial cells[J].Carcinogenesis,2008,29(2):427-433.
[45] L INDBERG H K,FALCK G C M,SUHONEN S,et al.Genotoxicity of nanomaterials: DNA damage and micronuclei induced by carbon nanotubes and graphite nanofibres in human bronchial epithelial cells in vitro[J].Toxicology Letters,2009,186(3):166-173.
[46] CVETICANIN J,JOKSIC G,LESKOVAC A,et al.Using carbon nanotubes to induce micronuclei and double strand breaks of the DNA in human cells[J].Nanotechnology,2010,21(1):015102.
[47] H IRANO S,KANNO S,FURUYAMA A.Multi-walled carbon nanotubes injure the plasma membrane of macrophages [J]. Toxicology and App lied Pharmacology,2008,232(2):244-251.
[48] TABET L,BUSSY C,AMARA N,et al.Adverse effects of industrial multiwalled carbon nanotubes on human pulmonary cells [J]. Journal of Toxicology and Environmental Health:A,2009,72(2):60-73.
[49] JIA G,WANG H F,YAN L,et al.Cytotoxicity of carbon nanomaterials:single-wall nanotube,multi-wall nanotube,and fullerene[J].Environmental Science&Technology,2005,39(5):1378-1383.
[50] MONTEIRO-RIV IERE N A,NEMANICH R J,INMAN A O,et al.Multi-walled carbon nanotube interactionswith human epidermal keratinocytes[J].Toxicology Letters,2005,155(3):377-384.
[51] SATO Y,YOKOYAMA A,SHIBATA K I,et al.Influence of length on cytotoxicity of multi-walled carbon nanotubes against human acutemonocytic leukemia cell line THP-1 in vitro and subcutaneous tissue of rats in vivo[J].Molecular Biosystems,2005,1(2):176-182.
[52] HERZOG E,BYRNE H J,CASEY A,et al.SWCNT suppress inflammatory mediator responses in human lung epithelium in vitro [J]. Toxicology and Applied Pharmacology,2009,234(3):378-390.
[53] BELYANSKAYA L,WEIGEL S,HIRSCH C,et al.Effects of carbon nanotubes on primary neurons and glial cells[J].NeuroToxicology,2009,30(4):702-711.
[54] PORTER A E,GASS M,MULLER K,et al.Direct imaging of single-walled carbon nanotubes in cells[J].Nature Nanotechnology,2007,2(11):713-717.
[55] PORTER A E,GASSM,BENDALL J S,et al.Uptake of noncytotoxic acid-treated single-walled carbon nanotubes into the cytoplasm of human macrophage cells[J].ACS Nano,2009,3(6):1485-1492.
[56] AMBROSI A,PUMERA M. Regulatory peptides are suscep tible to oxidation by metallic impurities within carbon nanotubes[J].Chemistry A European Journal,2010,16(6):1786-1792.
[57] L IU X Y,GUREL V,MORRIS D,et al.Bioavailability of nickel in single-wall carbon nanotubes[J].Advanced Materials,2007,19(19):2790-2796.
[58] LU F,WANG X,MEZIANI M J,et al. Effective purification of single-walled carbon nanotubes w ith reversible noncovalent functionalization[J].Langmuir,2010,26(10):7561-7564.
[59] ALBINIA,MUSSIV,PARODIA,et al.Interactions of single-wall carbon nanotubesw ith endothelial cells[J].Nanomedicine:Nanotechnology,Biology and Medicine,2009,6(2):277-288.
[60] YANG K,WU W H,JING Q F,et al.Aqueous adsorption of aniline,phenol,and their substitutes by multi-walled carbon nanotubes[J]. Environmental Science&Technology,2008,42(21):7931-7936.
[61] DAVOREN M,HERZOG E,CASEY A,et al.In vitro toxicity evaluation of single walled carbon nanotubes on human A549 lung cells[J].Toxicology in Vitro,2007,21(3):438-448.
[62] CASEY A,DAVOREN M,HERZOG E,et al.Probing the interaction of single walled carbon nanotubeswithin cell culture medium as a precursor to toxicity testing[J].Carbon,2007,45(1):34-40.
[63] GEYS J,NEMERY B,HOET P H M.Assay conditions can influence the outcome of cytotoxicity tests of nanomaterials:better assay characterization is needed to compare studies[J]. Toxicology in Vitro,2009,24(2):620-629.
[64] MONTEIRO-RIV IERE N A,INMAN A O,ZHANG L W.Limitations and relative utility of screening assays to assess engineered nanoparticle toxicity in a human cell line[J].Toxicology and Applied Pharmacology,2009,234(2):222-235.
[65] SIMON-DECKERS A,GOUGET B,MAYNE-L′HERM ITE M,et al.In vitro investigation of oxide nanoparticle and carbon nanotube toxicity and intracellular accumulation in A549 human pneumocytes[J].Toxicology,2008,253(1/2/3):137-146.
[66] BELYANSKAYA L,MANSER P,SPOHN P,et al.The reliability and limits of the MTT reduction assay for carbon nanotubes-cell interaction[J].Carbon,2007,45(13):2643-2648.
[67] KNIEF P,CLARKE C,HERZOG E,et al.Raman spectroscopy: a potential platform for the rapid measurement of carbon nanotube-induced cytotoxicity[J].Analyst,2009,134(6):1182-1191.
[68] KOSTARELOS K.The long and short of carbon nanotube toxicity[J].Nature Biotechnology,2008,26(7):774-776.
[69] SHIX F,SITHARAMAN B,PHAM Q P,et al.In vitro cytotoxicity of single-walled carbon nanotube/biodegradable polymer nanocomposites[J].Journal of Biomedical Materials Research:Part A,2008,86A(3):813-823.
[70] RAJA PM V,CONNOLLEY J,GANESAN G P,et al.Impact of carbon nanotube exposure, dosage and aggregation on smooth muscle cells[J]. Toxicology Letters,2007,169(1):51-63.
[71] W ICK P,MANSER P,L IMBACH L K,et al.The degree and kind of agglomeration affect carbon nanotube cytotoxicity[J].Toxicology Letters,2007,168(2):121-131.
[72] WANG J,SUN R H,ZHANG N,et al.Multi-walled carbon nanotubes do not impair immune functions of dendritic cells[J].Carbon,2009,47(7):1752-1760.
[73] YU Y M,ZHANG Q,MU Q X,et al.Exploring the immunotoxicity of carbon nanotubes[J].Nanoscale Research Letters,2008,3(8):271-277.
[74] 诸颖,李文新.碳纳米管的细胞毒性 [J].中国科学:B辑,2008,38(8):677-684.
[75] BELLUCCI S,CHIARETTI M,CUCINA A,et al.Multiwalled carbon nanotube buckypaper:toxicology and biological effects in vitro and in vivo [J].Nanomedicine,2009,4(5):531-540.
(编辑:刘志强)
Cytotoxicity of Pr istine Carbon Nanotubes:M echan ism and Influencing Factor s
L IU Yuan-fang1,2, L IU Jia-hui1,2, WANGHai-fang1
(1.Institute of Nanochemistry and Nanobiology,ShanghaiUniversity,Shanghai200444,China;2.College of Chemistry and Molecule Engineering,Peking University,Beijing 100871,China)
O 613.71
A
1007-2861(2010)05-0447-13
10.3969/j.issn.1007-2861.2010.05.002
2010-06-08
国家重点基础研究发展计划(973计划)资助项目(2006CB705604)
刘元方 (1931~),男,教授,中国科学院院士,博士生导师,研究方向为纳米生物学.E-mail:yliu@pku.edu.cn

