磁性多壁碳纳米管吸附水中双氯芬酸的热力学与动力学
熊振湖 王 璐 周建国 刘建明
(1天津市水质科学与技术重点实验室,天津 300384; 2天津城市建设学院环境与市政工程系,天津 300384;3天津城市建设学院材料科学与工程系,天津 300384)
磁性多壁碳纳米管吸附水中双氯芬酸的热力学与动力学
熊振湖1,2,*王 璐1,2周建国3刘建明1,2
(1天津市水质科学与技术重点实验室,天津 300384;2天津城市建设学院环境与市政工程系,天津 300384;3天津城市建设学院材料科学与工程系,天津 300384)
研究了磁化多壁碳纳米管(MWCNTs)对于水中非甾体抗炎药双氯芬酸的吸附过程.结果表明,双氯芬酸的吸附量随磁性MWCNTs投加量的增加而增大,而且吸附剂量增加到一定阶段后,双氯芬酸的吸附量达到平衡.在磁性MWCNTs的量为0.7 g·L-1时,水溶液中双氯芬酸被磁性MWCNTs吸附的量达到最大,为33.37 mg·g-1,对应的双氯芬酸去除率为98.1%.双氯芬酸的去除率随溶液pH的增加先增大后下降,随温度的升高而下降.用准一级、准二级模型进行了动力学分析.回归结果表明,准二级模型更准确地反映了吸附动力学.通过实验确定了Langmuir和Freundlich等温线的线性相关系数与标准偏差,结果揭示出Langmuir等温线与实验数据有很好的拟合度.对热力学参数的计算表明,ΔG0<0,意味着磁性MWCNTs对双氯芬酸的吸附是自发的;ΔH0<0,指明吸附是一个放热的物理吸附过程,温度低对吸附有利;ΔS0>0,代表该吸附是熵增过程.
吸附; 双氯芬酸; 磁性多壁碳纳米管; 动力学; 热力学
Abstract:We investigated the adsorption of diclofenac(an anti-inflammatory drug)in aqueous solutions by magnetic multiwalledcarbon nanotubes(MWCNTs).The results showed that the amount of adsorbed diclofenac initially increased with magnetic MWCNT dosage and stabilized at a magnetic MWCNT dosage of 0.7 g·L-1.The amount of diclofenac adsorbed by the magnetic MWCNTs was 33.37 mg·g-1and the removal rate of diclofenac was 98.1%.The removal rate for the diclofenac increased and then decreased with the pH value of solution,but it decreased with the temperature of solution.Kinetic analysis was conducted using pseudo first and second order models.Regression results showed that the adsorption kinetics was more accurately represented by a pseudo second order model.The linear correlation coefficients and standard deviations of the Langmuir and Freundlich isotherms were determined and the results revealed that the Langmuir isotherm fit the experimental results well.The calculated thermodynamic parameters were:ΔG0<0 indicating that the adsorption of diclofenac on magnetic MWCNTs was spontaneous,ΔH0<0 indicating that the absorption reaction was exothermic and that low temperatures are favorable for adsorption,and ΔS0>0 indicating that the adsorption process was a entropy enhancing process.
Key Words: Adsorption;Diclofenac;Magnetic multiwalled carbon nanotubes;Kinetics;Thermodynamics
双氯芬酸(diclofenac)是一种非甾体抗炎药,作为一种广泛存在于环境水体中典型的药物与个人护理用品(PPCPs)而引起了人们的注意[1].双氯芬酸难以被生物降解,常规水处理过程(活性污泥或厌氧发酵工艺)仅能将其部分去除,导致污水处理厂出水与接受出水的水体中双氯芬酸的蓄积量已高达ng·L-1至μg·L-1水平[2].这个浓度范围的双氯芬酸已经对陆地动物以及水生物的生长具有负面作用,并且给人类的健康带来潜在的危险[3].双氯芬酸的结构见示意图1.
目前水中双氯芬酸的处理方法主要包括高级氧化法[4]和吸附法[5],其中吸附法中常用的吸附剂有活性炭、粉煤灰、粘土等.这些吸附剂或由于吸附效果不甚理想或由于再生困难等原因而阻碍了其实际应用,因此,寻找一种更有效的吸附剂很有必要.多壁碳纳米管(MWCNTs)由于具有较大的比表面积,作为吸附材料引起了国内外研究者的广泛兴趣[6-7].研究表明,MWCNTs对水中重金属离子、卤代有机物,多环芳烃等污染物均具有较强的吸附作用[8-9].然而,MWCNTs一般是以纳米级颗粒悬浮在水中,将它们从水介质中收集起来非常困难.为此,近年来出现了将磁性分离技术与固相吸附剂结合的方法,并且在解决环境污染问题中发挥了很好的作用[10].已经有人用磁化MWCNTs吸附水中的偶氮染料,在吸附之后用简单的外磁场将磁性MWCNTs从水介质中分离出来[11-12].然而,目前还没有采用磁性MWCNTs吸附水中PPCPs类污染物的报道.另一方面,MWCNTs对有机污染物的吸附研究多集中在吸附效果方面,对吸附动力学、热力学及机理研究还较少.鉴于此,本研究中采用湿式化学方法,将原位生成的Fe3O4纳米颗粒填入MWCNTs的管径中并包覆在MWCNTs的表面.在对磁性MWCNTs进行表征的基础上,采用准一级、准二级模型对吸附过程进行拟合;探讨了各种参数对吸附过程的影响;计算了不同温度下吸附自由能(ΔG0)、标准焓变(ΔH0)、标准熵变(ΔS0)等热力学参数.
1 实验部分
1.1 试剂与仪器
MWCNTs购自中国科学院成都有机化学有限公司,其内径为3-5 nm,外径为8-15 nm,长度约为50 μm,比表面积约为 200 m2·g-1.(NH4)2Fe(SO4)2·6H2O与NH4Fe(SO4)2·12H2O是分析纯,购自天津江天化学品公司.双氯芬酸钠盐的纯度≥98%(安阳九州药业有限责任公司),用于制备浓度为500 mg·L-1的本体溶液,在使用前将其稀释到所需浓度.实验用水为蒸馏水,其它试剂为分析纯.
MWCNTs的透射电子显微(TEM)图像是通过200 kV加速电压的JEM-2011电子显微镜(JEOL,Japan)获取的.采用D/max 2550 X射线衍射仪(RigaKu,Japan)进行磁性MWCNTs的X射线衍射图谱分析.红外光谱的数据由傅里叶变换红外光谱仪(FTIR,NEXUS-5670,Nicolet,America)测得.MWCNTs的表面积、孔体积和孔径分布是在77 K下用氮气吸附法,由ASAP-2010比表面积和孔隙度吸附仪(美国麦克仪器公司)进行.
根据文献介绍的方法[13]并稍加改进制备磁性MWCNTs.全部玻璃器皿用新配制的10%稀硝酸溶液清洗.为了去除MWCNTs中的杂质,称取1.0 g MWCNTs加入到250 mL四口瓶中,加入100 mL浓硝酸,机械搅拌下水浴升温60℃,在此温度下恒速搅拌12 h,反应结束后自然冷却至室温,用大量去离子水洗涤至中性.在100℃干燥4 h,冷却后放置在干燥器中备用.
将纯化后的MWCNTs(1.0 g)悬浮在含有(NH4)2Fe(SO4)2·6H2O(1.7g,4.33mmo1)与NH4Fe(SO4)2·12H2O(2.51 g,8.66 mmo1)的200 mL去离子水中并且超声10 min,在反应瓶中通入氮气,水浴升温至50℃,300 r·min-1恒速搅拌下逐滴加入氨水溶液(约10 mL,8 mol·L-1)使混合液pH值控制在11-12.30 min后悬浮液的颜色由黑色变为褐色,表明Fe2+、Fe3+反应生成磁性Fe3O4纳米颗粒并沉积在MWCNTs表面或进入管中.反应完成后用磁铁将生成的磁性MWCNTs从悬浮液中分离出来,分别用蒸馏水和无水乙醇洗涤3次,真空干燥后放入干燥器备用.
1.2 实验过程
以间歇方式进行吸附实验.将0.175 g磁性MWCNTs加入到250 mL一定初始浓度的双氯芬酸溶液中,用0.1 mol·L-1H2SO4或NaOH调节悬浮液的pH值后,将混合物置于一台可调节温度与速率的振荡器中,以150 r·min-1速率振摇,在规定时间内从溶液中取样,用磁铁分离磁性MWCNTs后,用紫外-可见光分光光度计测定上清液中双氯芬酸的浓度,并计算出单位吸附剂对双氯芬酸的吸附量(公式(1)).

式中,q为药物的吸附量(mg·g-1),V为溶液体积(mL),C0和Ce分别是吸附前和吸附平衡时溶液中药物的质量浓度(mg·L-1),m为MWCNTs用量(g).
2 结果与讨论
2.1 磁性MWCNTs的表征
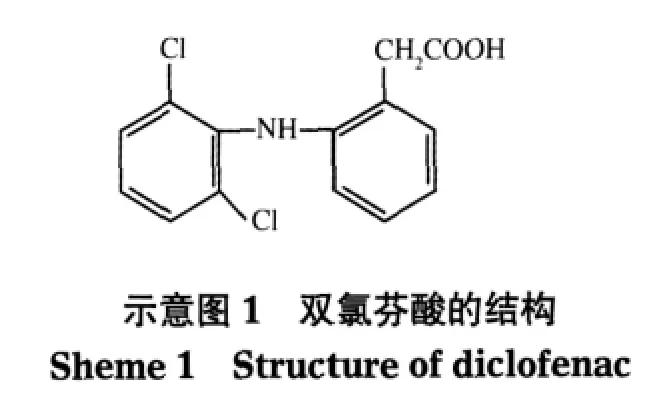
图1(a)是未经处理的MWCNTs的TEM图像,可以发现相对较长的MWCNTs相互纠缠在一起.在图(1b)中可发现有Fe3O4纳米颗粒局部覆盖在MWCNTs表面,而且MWCNTs内部也填充了Fe3O4纳米颗粒.据文献报道[14],MWCNTs的孔由两部分构成,一是MWCNTs自身的孔;另一部分主要由碳管之间的空隙构成,称为“堆积孔”,相应的孔径等于管之间的距离.这些堆积孔相当于孔隙为纳米级的毛细管,而涉及的作用力称之为毛细管力.
MWCNTs的氧化过程是将其浸渍在硝酸水溶液中,水中的Fe2+和Fe3+有可能进入MWCNTs孔内或堆积孔中,但进入过程受到水的表面张力与毛细管力的作用.Fe2+和Fe3+离子表面上水分子的张力阻碍Fe2+和Fe3+进入MWCNTs的孔内或堆积孔中,而毛细管力是驱动Fe2+和Fe3+进入MWCNTs的内孔或孔隙中的力.由于毛细管力大于水的表面张力,导致Fe2+和Fe3+进入MWCNTs的内孔或堆积孔中而原位生成Fe3O4.另外,硝酸的氧化处理使MWCNTs被切断,形成开口端和表面功能基团,这也有助于铁离子进入MWCNTs的内部并在表面的吸附.
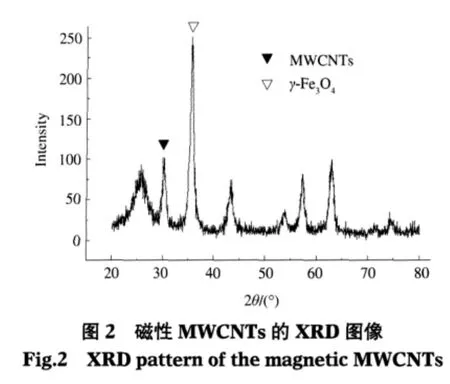
MWCNT/Fe3O4纳米复合物的XRD模式显示在图2中.对图2的分析可知,产物由两相组成:MWCNTs和立方晶系的Fe3O4.在 2θ=26°的衍射峰属于MWCNTs的(002)反射.XRD图谱表明存在面心立方晶系的Fe3O4,其它较宽的峰型属于晶体尺寸较小的不同晶相的Fe3O4.
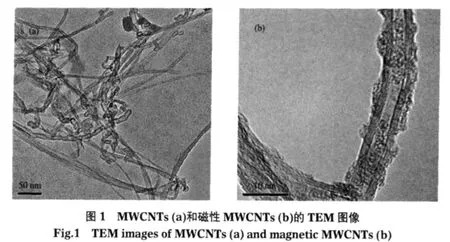
图3给出了MWCNTs的FTIR光谱.图3(a,b)在1400-1600 cm-1的吸收峰相应于MWCNTs石墨烯结构碳六元环的C=C键伸缩振动,而3430 cm-1处的峰归于被吸附分子水的弯折振动.与图3(a)原始MWCNTs的FTIR光谱比较,图3(b)出现在591 cm-1处较强的吸收峰属于Fe—O键的伸缩振动.在图3(b)中还可明显看出氧化MWCNTs在1730 cm-1的吸收峰,相当于羧基(—COOH)的C=O伸缩振动.结果表明,MWCNTs能被硝酸氧化,在其表面得到羧基、羟基等活性基团.
MWCNTs的表面积、平均孔径和孔体积列于表1中.可见,MWCNTs的氧化过程改变了它的物理特性,例如比表面积和孔径分布.MWCNTs孔的BET表面积和BJH累积表面积分别从307.8 m2·g-1增加到 402.8 m2·g-1和从 328.8 m2·g-1增加到 405.3 m2·g-1,而且氧化过程还使得MWCNTs孔的BJH累积孔体积从 0.6477 cm3·g-1增加到 0.9682 cm3·g-1.但是,MWCNTs的平均孔径有所减小.
为证实磁性MWCNTs对有机污染物的吸附能力,将少量磁性MWCNTs加入到一定量的偶氮染料中性红溶液中,二者混合为黑色悬浮液(图4(a)).将吸附混合物超声5 min后,溶液的颜色由红色迅速变浅至无色,在外置磁铁吸引下,吸附了中性红的磁性MWCNTs很快沉积到玻璃瓶的底部或侧壁(图4(b,c)),这就证实了磁性MWCNTs具有磁性和吸附能力.
2.2 两种MWCNTs吸附双氯芬酸的比较

表1MWCNTs和磁性MWCNTs的N2吸附数据Table 1 N2adsorption data of MWCNTs and magnetic MWCNTs
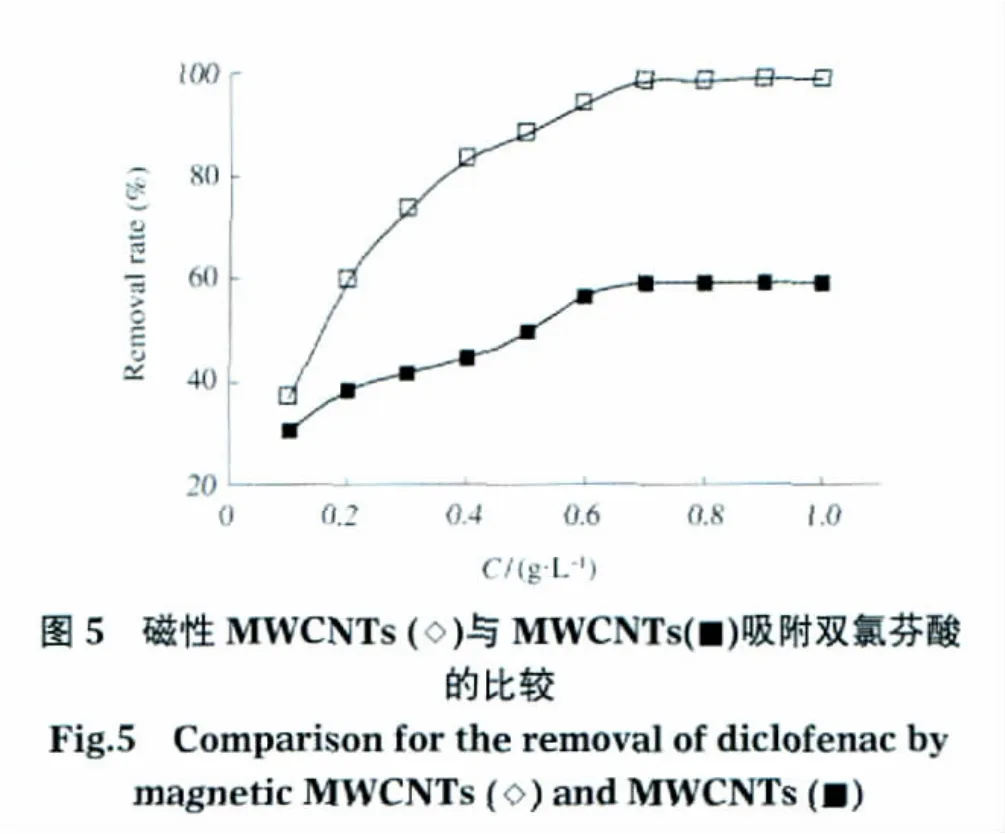
图5给出了在双氯芬酸浓度为20 mg·L-1、pH值6.0、吸附时间为6 h的条件下,两种MWCNTs吸附双氯芬酸的结果.

由图5发现,同样条件磁性MWCNTs对双氯芬酸的吸附量要比原始MWCNTs的大,而且随MWCNTs量的增加,二者的差距更显著.这个现象的原因有两个可能:第一,根据双氯芬酸的性质[15],pH>5时它在水中以羧酸盐的负离子形式(—COO—)存在.由于羧基负离子是一种典型的吸电子基团,容易通过π-π作用接受电子而与提供电子的电子供体形成电子授受体.这类电子供体主要包括含有孤电子对的含氧官能团和电子云高度极化的石墨化电子结构或离域化的π电子结构.碳纳米管管壁表面的碳原子以sp2杂化,具有电子云高度极化的石墨化电子结构,可以作为电子供体与受体的羧基化合物形成电子授受体结构.由于MWCNTs与磁性MWCNTs都可以作为电子供体,从而导致它们都与双氯芬酸发生较强的吸附作用;第二,磁性MWCNTs在制备过程中经过硝酸的氧化,其表面分布着大量的羧基(—COOH)与羟基(—OH),而且在双氯芬酸的分子中有羧基与亚胺基的存在.因此,磁性MWCNTs与双氯芬酸之间除了上述的电子授受体结构之外,二者还存在着另外的一种分子间作用力,即氢键作用.这种较强的作用力使磁性MWCNTs对双氯芬酸的吸附作用大于MWCNTs.另外,如表1所示,经过氧化处理的磁性MWCNTs的比表面积和中孔体积增大,也增加了磁性MWCNTs对双氯芬酸的吸附作用.上述因素共同作用,使磁性MWCNTs比原始MWCNTs对双氯芬酸的吸附能力有较大程度的提高.
随着两种MWCNTs的量从 0.1 g·L-1增加到0.7 g·L-1,双氯芬酸的去除率都有提高,尤其是磁性MWCNTs的去除率由37.1%增加到98.1%,这说明增加MWCNTs的量不仅增大了吸附的有效表面积,还增加了参与吸附的官能团数量.但MWCNTs的量增加到0.7 g·L-1以上时,去除率的增加趋于平缓,达到平衡后略有下降.这种现象可能与MWCNTs以悬浮状态分散到被吸附物溶液中有关[16],此时增加MWCNTs的量将加大悬浮液的粘度,就有可能抑制双氯芬酸分子扩散到MWCNTs表面.
2.3 双氯芬酸的吸附动力学
为了探讨磁性MWCNTs对双氯芬酸的吸附速率,在 25℃、双氯芬酸初始浓度 C0=20 mg·L-1、pH=6、磁性MWCNTs投加量为0.7 g·L-1条件下,研究了吸附剂与双氯芬酸接触时间对吸附量的影响,结果如图6所示.
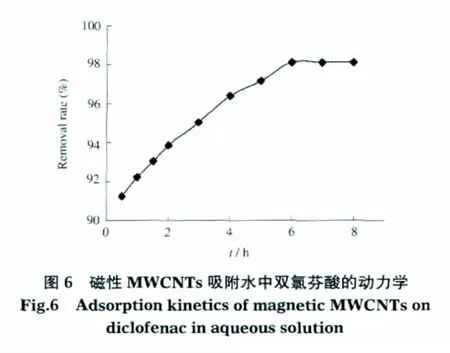
由图6见,磁性MWCNTs对双氯芬酸具有非常快的吸附速度,在吸附初始阶段的前0.5 h,去除率就达到了90%左右.之后速率趋缓,吸附6 h后大约有98%的双氯芬酸被去除并且达到吸附平衡.这个现象与文献中相关的研究报道一致[17-18].之所以出现这种先快后慢的现象或许是在初始阶段MWCNTs上有大量未被占据的表面位点可用于吸附,表现为吸附速度相当快,但随吸附量的增大,磁性MWCNTs上吸附的双氯芬酸分子与溶液中的双氯芬酸分子产生排斥力,使得剩余的空表面位点很难被占据,导致吸附量的饱和.根据上述结果,在后续试验中采用振荡6 h作为磁性MWCNTs吸附双氯芬酸的平衡时间.
2.4 双氯芬酸吸附过程的评价
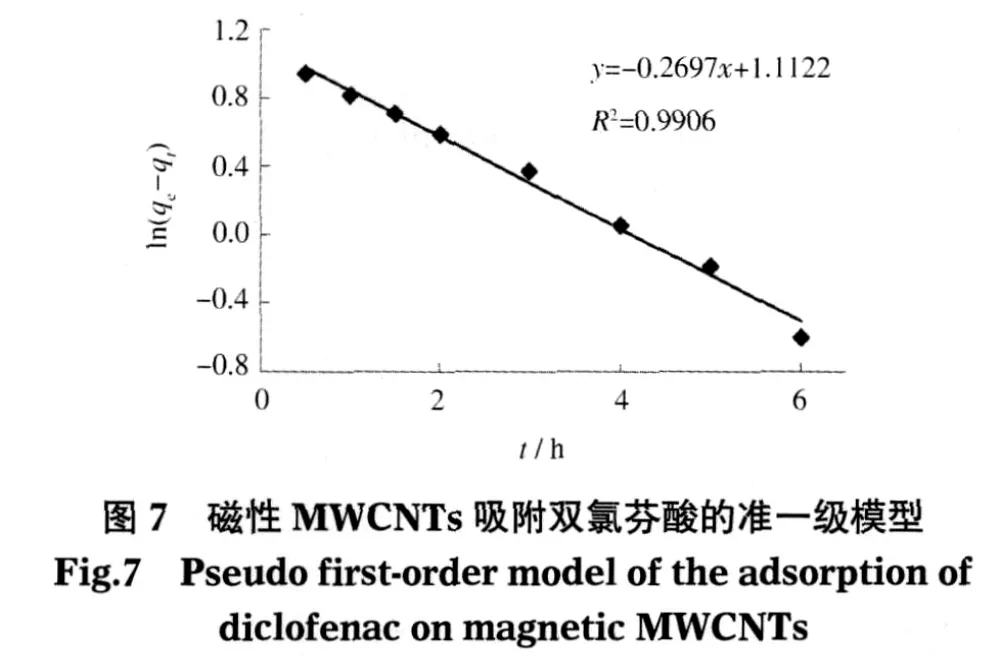
为确定双氯芬酸在磁性MWCNTs上的吸附速度,用准一级方程式(2)和准二级方程式(3)的模型来模拟吸附过程的动力学:

式中,qe和 qt是平衡时与时间t条件下被磁性MWCNTs吸附的双氯芬酸量,k1(h-1)是方程式(2)的吸附速率常数,k2(g·mg-1·h)是方程式(3)的吸附速率常数.qe和k1的值可根据与方程式(2)有关的ln(qeqt)对时间t线性图的截距和斜率进行计算(图7).方程式(3)的1/k2和1/qe可根据 t/qt对t直线的截距和斜率得出(图8).
与吸附动力学相关的线性回归数据列于图7、图8与表2中.方程式(3)的R2值接近1,比方程式(2)的值大,而且方程式(3)的标准偏差明显小于方程式(2).此外,方程式(3)中的qe测定值与计算值很接近,但方程式(2)的qe测定值与计算值相差较大(表2).总之,实验数据表明了方程式(3)所代表的准二级模型可以较好地描述磁性MWCNTs对双氯芬酸的吸附动力学.
2.5 pH对磁性MWCNTs吸附双氯芬酸的影响
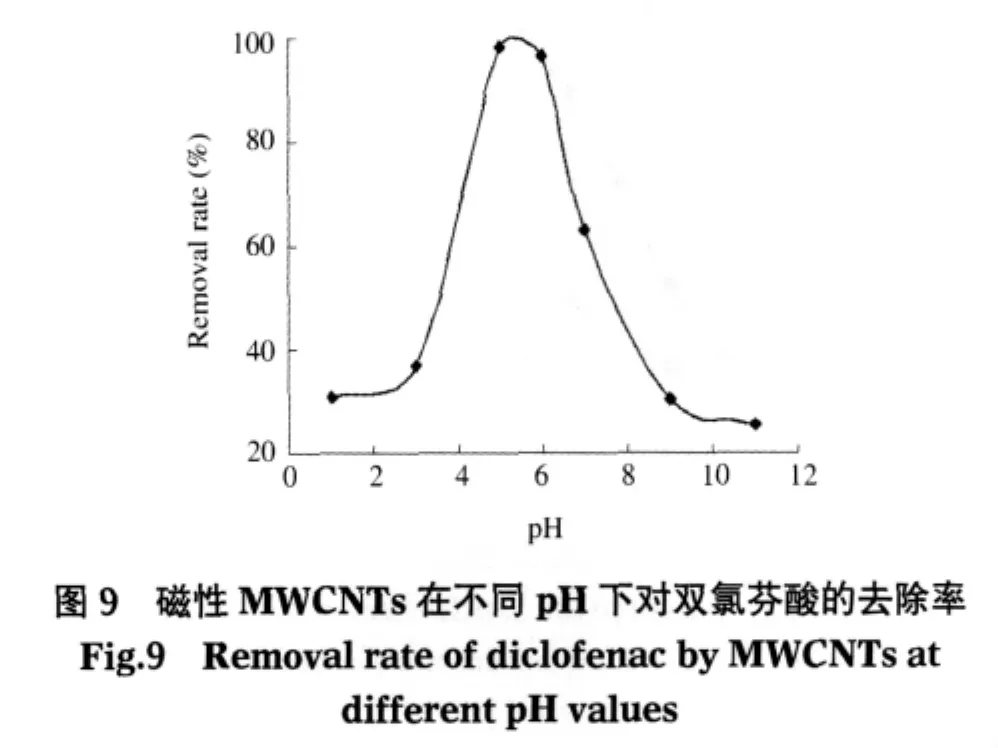
在双氯芬酸初始浓度为 20 mg·L-1、磁性MWCNTs投加量为0.7 g·L-1、反应时间为6 h条件下,考察了磁性MWCNTs吸附双氯芬酸的结果.由图9知,当溶液的pH为1到2时,双氯芬酸的去除率低下为36.7%,但随pH增大到6,双氯芬酸去除率迅速增加到98.1%;若pH值继续增大,双氯芬酸的去除率却开始下降,到pH=11时去除率降低到25.5%.溶液pH值由低到高,双氯芬酸去除率呈现出的变化规律并不孤立,某些有机物在不同pH值下被水中MWCNTs吸附就表现出了与此相似的现象[19-21].
低pH溶液中的双氯芬酸去除率低的原因可能有两个:首先,低pH水溶液中存在着丰富的水合质子(H3O+),MWCNTs表面富含电子的π键吸附缺电子的H3O+而发生质子化,形成了表面正电荷.另一方面,根据文献[15],双氯芬酸在低pH下(pH=3)是以分子状态存在的,分子中的羧基在H3O+作用下也会带有部分正电荷.所以,同种电荷之间的斥力导致MWCNTs难以吸附双氯芬酸.但随着pH值的增加(3<pH<6),溶液中既有离子型双氯芬酸、又有分子型的双氯芬酸存在.由于离子型双氯芬酸的羧基负离子是一种典型的吸电子基团,容易通过π-π作用接受电子而吸附在电子云高度极化的石墨化电子结构MWCNTs类的电子供体上形成电子授受体,致使双氯芬酸在MWCNTs上的吸附量增加.当pH>6时,双氯芬酸完全以羧酸盐的负离子形式存在,而且溶液中不断增多的羟基负离子(OH-)使MWCNTs上的羧基(—COOH)离子化,增加了表面负电荷密度,表面带负电荷的磁性MWCNTs排斥负离子形态的双氯芬酸分子,不利于磁性MWCNTs对双氯芬酸的吸附.此外,当pH>6时,负离子形态的双氯芬酸在水中溶解性迅速增大,导致磁性MWCNTs吸附双氯芬酸的驱动力减小.


表2 动力学模型回归系数Table 2 Coeffcients of kinetic model regression
2.6 吸附等温线
吸附等温线可反映被吸附的分子在平衡时液相和固相间的分布状况.虽然Langmuir等温线方程与实验数据也有很好的相关性(表3),但Freundlich方程能更好地解释本实验中发生的现象,方程式(4)的Freundlich等温线方程描述了吸附平衡过程(图10).可见,在288 K下,初始浓度为20 mg·L-1的双氯芬酸水溶液在MWCNTs上的饱和吸附量达到了33.37 mg·g-1,并且吸附量随平衡浓度的增大而增大.另一方面,平衡吸附量随温度的升高而下降,这表明了吸附为放热过程,温度低对吸附有利.
用方程式(4)表示的Freundlich等温方程对图10的数据进行线性拟合(表4).式中:qe为平衡吸附量(mg·g-1);Ce为平衡质量浓度(mg·L-1);KF和 n是Freundlich常数,分别代表吸附容量和吸附强度.

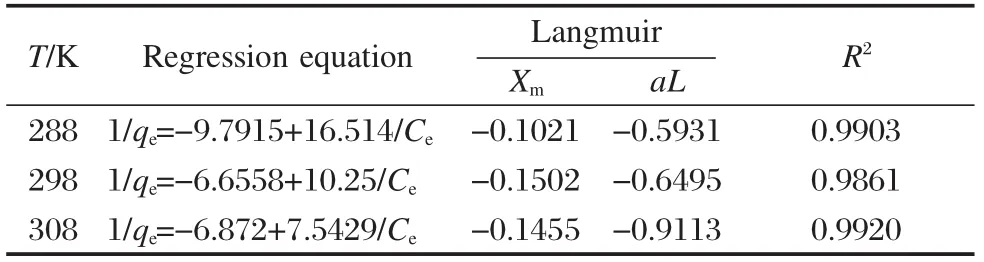
表3 磁性MWCNTs吸附双氯芬酸的Langmuir吸附等温式参数Table 3 Parameters of Langmuir isothermal adsorption equations of magnetic MWNTs to diclofenac
表4中的拟合相关系数均大于0.97,说明Freundlich方程较好地描述了磁性MWCNTs对双氯芬酸的吸附.Freundlich公式中的KF和1/n可以从lnqe对lnCe直线的截距与斜率获得.KF表示吸附能力的相对大小,而表4中的KF值随温度的升高而下降,说明降低温度对吸附有利,意味着吸附是放热过程.另外,常数n与吸附推动力的强弱有关,在表4中温度由高到低而n值由大变小也说明了降低温度对吸附有利.
2.7 吸附热力学
吸附热力学参数可提供吸附过程在能量转化方面更深层次的信息.由于Langmuir等温线更适用于计算热力学参数,本文采用该等温线计算与吸附有关的标准自由能(ΔG0)、标准焓变量(ΔH0)、标准熵变量(ΔS0).有关方程式见方程式(5)、(6).


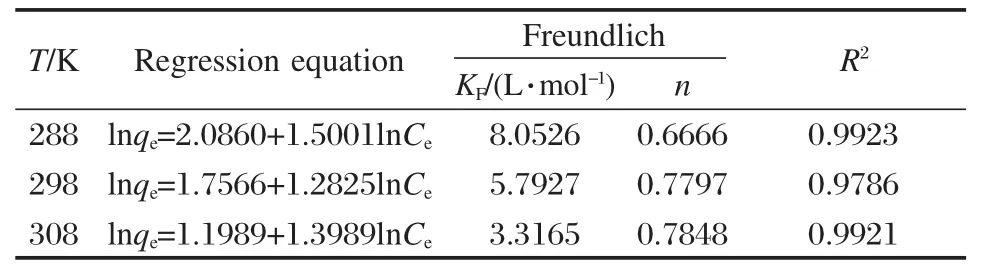
表4 磁性MWCNTs吸附双氯芬酸的Freundlich吸附等温式参数Table 4 Freundlich isothermal adsorption equations of magnetic MWCNTs to diclofenac
式中,KL是Langmuir平衡常数(L·mol-1);R是气体常数(8.314×10-3kJ·mol-1·K);T 是温度(K).由方程式(5)计算出 ΔG0,再根据方程式(6)代表的 van′t Hoff方程,由lnKL对1/T作图得直线(图11)斜率和截距计算出ΔH0和ΔS0.有关的热力学数据列于表5中.
由实验数据获得的 ΔG0在 288、298、308 K下的值为负值,意味着磁性MWCNTs吸附双氯芬酸具有较大的驱动力,即双氯芬酸在磁性MWCNTs上的吸附是自发的.但是,当温度从288 K增加到308 K时,ΔG0的绝对值变小,说明提高温度对磁性MWCNTs吸附双氯芬酸不利,将导致吸附能力的降低.这个事实也可从表5中的ΔH0加以说明,三种温度下ΔH0都是负值,表明磁性MWCNTs吸附双氯芬酸是放热过程,提高温度不利于对双氯芬酸的吸附.这个结论也与前述的温度升高吸附量降低的实验结果相符.
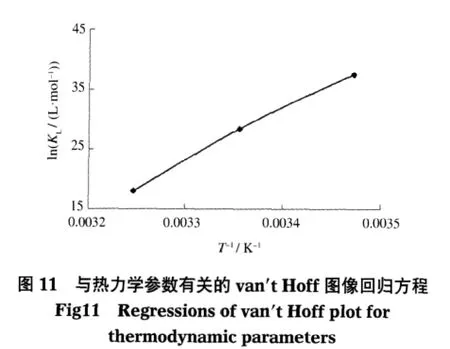

表5 磁性MWCNTs吸附双氯芬酸的热力学函数值Table 5 Adsorption thermodynamics functions of magnetic MWCNTs to diclofenac
根据吸附交换理论,对于固-液交换吸附,溶质分子由溶液相交换到固-液界面会失去一部分自由度(包括平动和转动)[22],这是熵减少的过程;而在磁性MWCNTs吸附双氯芬酸的同时必然有大量水分子被解吸,即水分子在磁性MWCNTs上整齐、紧密的排列变为解吸后的自由运动,这是熵增过程.但由于水分子体积较小,解吸过程的熵变量必然很大.由这两部分组成总熵变量,即熵变量的总和最终为正值,表现为磁性MWCNTs吸附双氯芬酸的过程是一个熵增过程.
在一定程度上,吸附的类型可以从焓变量的数量级加以区分[23].如果结合能小于84 kJ·mol-1,一般可考虑为物理吸附,而化学吸附的强度可达到84-420 kJ·mol-1,由于表3中的焓变量为负值,远远小于84 kJ·mol-1.据此,磁性MWCNTs对双氯芬酸的吸附应是物理吸附过程.但也有文献认为[24],物理吸附的ΔG0比化学吸附的小,前者是在-20 kJ·mol-1到 0 kJ·mol-1之间,而后者在-80 kJ·mol-1到-400 kJ·mol-1之间.我们实验中的 ΔG0位于-20 kJ·mol-1到-80 kJ·mol-1左右.因此,根据实验的 ΔH0、ΔG0值可认为磁性MWCNTs吸附双氯芬酸基本上是受物理吸附驱动的.这个观点可以从吸附剂与吸附质之间存在的作用力得到解释[25].在MWCNTs的表面具有大量富含π电子的多烯结构,与含有苯环(π电子)的吸附质接触过程中必然存在着π-π共轭效应,其吸附能力强,这使溶质吸附放出的热量大于溶剂水脱附吸收的热量,从而使得整个吸附表现为放热过程.
3 结 论
研究了磁性MWCNTs从水溶液中去除双氯芬酸的过程.单位质量磁性MWCNTs吸附双氯芬酸的量随磁性MWCNT的量增加而增加,在最佳吸附条件下(双氯芬酸浓度为20 mg·L-1、磁性MWCNTs投加量为 0.7 g·L-1、pH=6、吸附时间为 6 h),双氯芬酸的去除率可达到98.1%.溶液的pH值对吸附过程有很大的影响,当溶液的pH=1时,双氯芬酸的去除率仅为36.7%,随pH增大到6,双氯芬酸去除率迅速增加到98.1%;从pH>6起,双氯芬酸的去除率下降,pH=11对应的去除率降低到25.5%.用准一级、二级模型进行了动力学分析.回归结果表明,准二级模型更准确地反映了吸附动力学.通过实验确定了Langmuir和Freundlich等温线的线性相关系数与标准偏差,结果揭示出Langmuir等温线与实验数据有很好的拟合度.吸附过程的吉布斯自由能为负值,表明MWCNTs对双氯芬酸的吸附是自发的且具有较强的驱动力;吸附焓变量为负值,表明双氯芬酸在磁性MWCNTs上的吸附是物理吸附过程,而且双氯芬酸在磁性MWCNTs上的吸附为放热过程,温度低对吸附有利;吸附熵的总和大于0,表明该吸附反应是熵增过程.
1 Zhang,Y.J.;Sven,U.G.;Carmen,G.Chemosphere,2008,73:1151
2 Sun,Z.;Schüssler,W.;Seng,M.;Niessner,R.;Knopp,D.Analytica Chimica Acta,2008,620:73
3 Alessandra,D.C.;Carmen,S.;Ana,A.;Maria,J.G.;Santiago,E.;Márcia,D.Science of the Total Environment,2009,407:3572
4 Yu,W.L.;Xiong,Z.H.;Ma,H.J.Acta Scientiae Circumstantiate,2009,29:2070 [于万禄,熊振湖,马华继.环境科学学报,2009,29:2070]
5 Alfred,R.;Shane,A.S.;Detlef,R.U.K.Water Research,2009,43:3787
6 Patrick,O.;Bo,P.;Xing,B.S.Environmental Science&Technology,2009,43:9167
7 Lu,Y.M.;Gong,Q.M.;Liang,J.Acta Physico-Chimica Sinica,2009,25:1697 [卢月美,巩前明,梁 吉.物理化学学报,2009,25:1697]
8 Pan,B.;Xing,B.S.Environmental Science&Technology,2008,42:9005
9 Sheng,G.D.;Li,J.X.;Shao,D.D.;Hu,J.;Chen,C.G.;Chen,Y.X.;Wang,X.G.Journal of Hazardous Materials,2010,178:333
10 Chen,J.;Duan,C.F.;Guan,Y.F.Journal of Chromatography B,2010,878:1216
11 Noushin,R.;Reza,A.;Nasrin,S.;Abbas,S.;Masud,Y.Analytica Chimica Acta,2010,662:90
12 Zhang,Q.;Zhu,M.;Zhang,Q.H.;Li,Y.G.;Wang,H.G.Composites Science and Technology,2009,69:633
13 Wang,B.;Gong,J.L.;Yang,C.P.;Zeng,G.M.;Zhou,W.Q.China Environmental Science,2008,28:1009 [王 彬,龚继来,杨春平,曾光明,周雯婧.中国环境科学,2008,28:1009]
14 Ye,C.;Gong,Q.M.;Lu,F.P.;Liang,J.Separation and Purification Technology,2007,58:2
15 Liu,C.Research of diclofenac sodium silk fibroin-chitosansustained-release microsphere[D].Suzhou:Suzhou University,2009 [刘 纯.双氯芬酸钠丝素蛋白-壳聚糖缓释微球的研究[D].苏州:苏州大学,2009]
16 Chen,M.L.;Zhang,F.J.;Oh,W.C.New Carbon Materials,2009,24:159 [陈明亮,张峰君,吴沅春.新型炭材料,2009,24:159]
17 Kuo,C.Y.;Wu,C.H.;Wu,J.Y.Journal of Colloid and Interface Science,2008,327:308
18 Chen,G.C.;Shan,X.Q.;Zhou,Y.Q.;Shen,X.;Huang,H.L.;Khan,S.U.Journal of Hazardous Materials,2009,169:912
19 Hideyuki,K.;Tomohiro,M.;Satoshi,K.;Tohru,S.;Kiyohisa,O.Microchemical Journal,2008,88:82
20 Zhang,J.B.;Zhou,Q.F.;Liu,W.;Jiang,G.B.Acta Scientiae Circumstantiae,2009,29:1056 [张建斌,周群芳,刘 伟,江桂斌.环境科学学报,2009,29:1056]
21 Shahnaz,Q.;Ashley,G.;Yousef,H.Journal of Hazardous Materials,2009,169:318
22 Wojciech,P.;Wladyslaw,R.;Anita,P.Advances in Colloid and Interface Science,2009,152:2
23 Salama,M.A.;Burk,R.C.Applied Surface Science,2008,255:1975
24 Kuo,C.Y.;Wu,C.H.;Wu,J.Y.Journal of Colloid and Interface Science,2008,327:308
25 Gong,J.L.;Wang,B.;Zeng,G.M.;Yang,C.P.;Niu,C.C.;Niu,Q.Y.;Zhou,W.J.;Liang,Y.Journal of Hazardous Materials,2009,164:1517
Thermodynamics and Kinetics of Adsorption of Diclofenac on Magnetic Multiwalled Carbon Nanotubes in an Aqueous Solution
XIONG Zhen-Hu1,2,*WANG Lu1,2ZHOU Jian-Guo3LIU Jian-Ming1,2
(1Tianjin Key Laboratory of Water Quality Science and Technology,Tianjin 300384,P.R.China;2Department of Environmental and Municipal Engineering,Tianjin Institute of Urban Construction,Tianjin 300384,P.R.China;3Department of Material Science and Engineering;Tianjin Institute of Urban Construction,Tianjin 300384,P.R.China)
O642;O643
Received:May 26,2010;Revised:August 24,2010;Published on Web:October 13,2010.
*Corresponding author.Email:zhenhu.xiong@126.com;Tel/Fax:+86-22-23085308.
The project was supported by the National Natural Science Foundation of China(50878138)and Major Project of Natural Science Foundation of Tianjin,China(07JCZDJC01700).
国家自然科学基金(50878138)及天津市自然科学基金(07JCZDJC01700)资助项目

