一种具有人VEGF结合活性的人源单一重链可变区的克隆与表达
刘珩,刘思国,武艺,马梓力,刘煜,张爱民,陈建泉,成国祥
1 同济大学生命科学与技术学院,上海 200092
2 上海转基因研究中心,上海 201210
3 中国药科大学 生化教研室,南京 210009
医学与免疫生物技术
一种具有人VEGF结合活性的人源单一重链可变区的克隆与表达
刘珩1,2,刘思国2,武艺2,马梓力1,2,刘煜3,张爱民2,陈建泉2,成国祥2
1 同济大学生命科学与技术学院,上海 200092
2 上海转基因研究中心,上海 201210
3 中国药科大学 生化教研室,南京 210009
为避免一种来自五特征转基因小鼠的全人VEGF单克隆IgM抗体分子量大的不足,本研究探讨了该抗体单一重链可变区的功能特性。首先,PCR获得该抗体的重链可变区,将该序列克隆至pET28a表达载体内,在大肠杆菌中进行了诱导表达。通过变性纯化和复性等方法获得了具有生物学活性的16 kDa重组抗体片段——rhVVH。体外结合实验表明,rhVVH保留有完整免疫球蛋白的人VEGF结合活性。人脐静脉内皮细胞 (HUVEC) 增殖抑制实验表明:rhVVH可以剂量依赖性的抑制 HUVEC的增殖。上述结果揭示了该抗体单一重链可变区保留有完整抗体的部分功能,为进一步开展全人源VEGF单克隆IgM抗体小型化研究奠定了基础。
全人抗体,VEGF,单域抗体,重链抗体
Abstract:In the application of therapeutic antibodies, large molecular weight of antibodies is always a problem that prevents them from penetrating into tissues or binding to antigenic determinants. To overcome this problem, we investigated the function of the heavy chain variable domain of a monoclonal anti-VEGF human IgM antibody derived from the Five-Feature Translocus Mice. We cloned the cDNA of the heavy chain variable domain, which was then inserted into pET28a vector and expressed inEscherichia coli. After purification and renaturation of the denatured recombinant protein, we obtained a 16 kDa antibody fragment,which is named as rhVVH. By immunoassaying its VEGF-binding capabilityin vitro, we proved that rhVVH retains this activity as the complete IgM. Importantly, rhVVH is shown to inhibit the HUVEC cell proliferation in a concentration-dependent manner. Ourresults indicate that the single heavy chain variable domain might inherit part of the biological function of the complete IgM antibody, which provided a valuable potential in further research on antibody miniaturisation.
Keywords:human antibody, vascular endothelial growth factor, sdAbs, heavy-chain antibody
血管内皮细胞生长因子 (Vascular endothelial growth factor,VEGF) 在肿瘤的血管发生过程中发挥极其重要的作用。抑制VEGF及其受体可有效地抑制肿瘤从无血管期向血管期转变,从而抑制肿瘤生长,并降低癌细胞转移的几率[1]。FDA目前已批准两种靶向 VEGF的治疗性抗体上市,即 Avastin和 LUCENTIS[2],另有数种靶向 VEGF的治疗性抗体正在不同阶段的临床实验。Avastin自 2004年上市以来被证明对于转移性直肠癌、非小细胞肺癌、乳腺癌等肿瘤均有显著的抑制效果。
目前几乎所有被 FDA批准上市或正在进行临床实验的治疗性抗体都是人源化或嵌合IgG1抗体,具有分子量大和鼠源性两方面的不足。大分子很难穿透组织或结合隐藏在抗原内部的抗原决定簇[2]。抗体内的鼠源成分会引起 HAMA反应 (Human anti-mouse antibody),在临床应用时导致抗体被迅速降解和清除[3]。目前克服这些不足的主要方法是制作全人抗体和对抗体进行小型化改造 (如 Fab片段、单链抗体、单域抗体和CDR模拟抗体等)。其中,由单一重链或重链可变区构成的单域抗体被证明具有出众的进入抗原分子表面空隙 (Cavity)的能力,同时还具有体积小、可溶性高、热稳定性好、重折叠能力强和体内组织穿透性好等优点,能够较高水平保留完整抗体的抗原识别能力和亲和力[4]。
我们使用人 VEGF165免疫五特征小鼠 (Fivefeature translocus mice),得到了一种具有治疗效果的全人源VEGF单克隆IgM抗体 (HVmAb)[5]。为进一步探索 HVmAb的抗原结合特性,降低抗体分子量,本研究克隆并表达了该抗体的重链可变区(VH),获得了全人源VEGF抗体的小型片段,并探索了其功能特性。
1 材料与方法
1.1 培养物与试剂
V75 杂交瘤细胞系为本实验室保存;pMD19-T载体购自 TaKaRa公司;pET28a表达载体购自Novagen公司;DH5α大肠杆菌和BL21 (DE3) 大肠杆菌为实验室自存;人脐静脉内皮细胞 (Human umbilical vein endothelial cells,HUVEC) CRL-1730细胞株购自ATCC。
限制性内切酶、LATaq聚合酶以及 RNA LA PCRTMKit (AMV) Ver.1.1反转录试剂盒购自TaKaRa公司;DMEM (High glucose) 培养基、0.25%胰蛋白酶购自Invitrogen公司;RPMI 1640培养基、胎牛血清购自 PAA公司;凝胶回收试剂盒、质粒大提试剂盒购自 Qiagen公司;T4 DNA连接酶购自NEB公司;His亲和层析纯化试剂盒购自 Novagen公司;鼠抗His抗体和HRP标记抗鼠第二抗体购自上海欣百诺生物科技有限公司;人VEGF标准品购自Sigma公司;VEGF多抗兔血清 (NB100-698) 购自 Novus公司;HVmAb单抗为本单位自制,提取自V75杂交瘤;鼠抗人λ链抗体购自Santa Cruz公司;Costar 96孔酶标板购自Corning公司;聚组氨酸标签蛋白 (6×His) (BS-0287P) 购自北京博奥森生物技术有限公司;CCK-8活细胞计数试剂盒购自日本同仁化学研究所;PCR引物合成和 DNA测序由上海Invitrogen公司完成。
1.2 重链可变区的克隆
杂交瘤细胞 V75的培养参照文献[5]进行。总RNA提取和反转录按照试剂盒说明书进行。参照文献[6]进行人免疫球蛋白重链可变区 (Heavy chain variable region,VH) 扩增,所用PCR引物见表1。PCR反应条件为:94℃预变性 3 min;94℃变性30s,69℃退火30s,72℃延伸30s,30个循环;最后72℃延伸7 min。预期大小的PCR产物经1.5%琼脂糖凝胶电泳后回收,克隆入pMD19-T载体中。
1.3 序列分析
获得的VH序列经NCBI IgBLAST和IMGT分析VH区的功能片段。
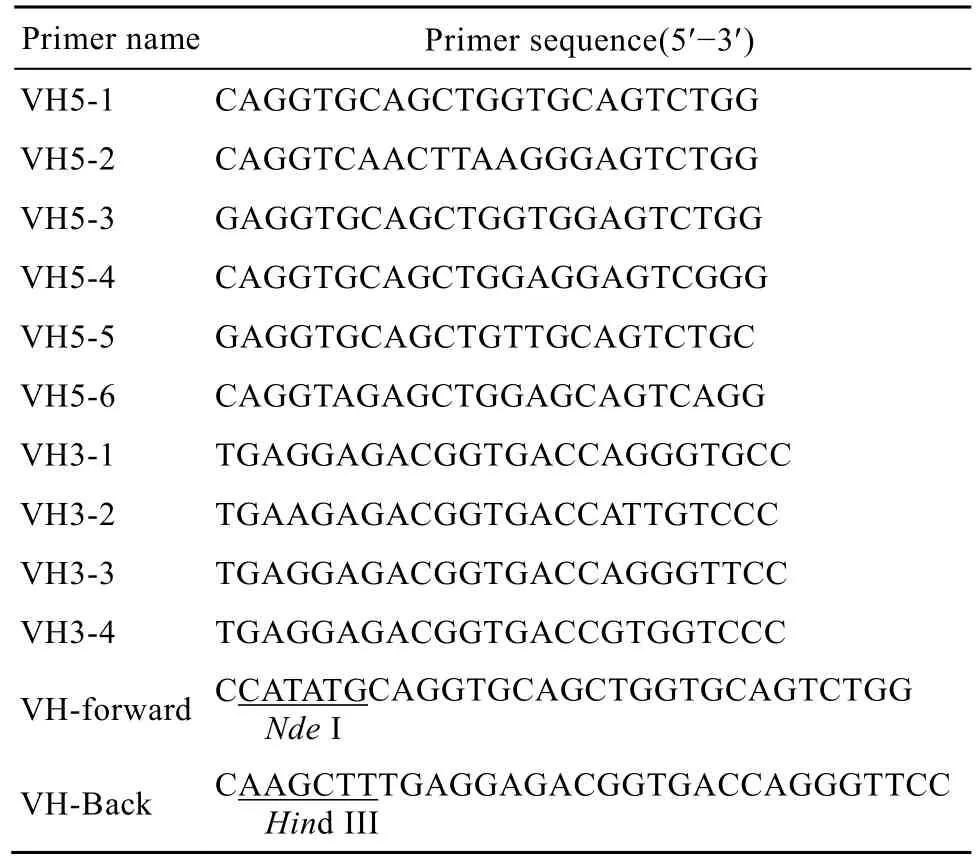
表1 扩增VH所使用的通用引物Table 1 Primers used to amplify VH region
1.4 VH重组蛋白的诱导表达
利用Hind III和NdeI酶切位点将VH片段定向插入pET28a表达载体中,形成重组质粒pET-VH。将pET-VH转入BL21受体菌,摸索最佳诱导表达温度 (28℃、32℃和37℃) 和诱导表达时间 (1 h、2 h和 3 h)。
利用SDS/PAGE和Western blotting分析目的蛋白的表达情况和纯化结果。Western blotting一抗为鼠抗6×His单抗,二抗为HRP标记的抗鼠IgG抗体。
1.5 VH的纯化
参照 Novagen HisBind纯化试剂盒说明进行rhVVH重组蛋白的纯化。主要试剂配方为:结合缓冲液为:5 mmol/L咪唑,0.5 mol/L NaCl,20 mmol/L Tris-HCl (pH 7.9);洗涤缓冲液为:60 mmol/L咪唑,0.5 mol/L NaCl,20 mmol/L Tris-HCl (pH 7.9);洗脱液为:1 mol/L咪唑,0.5 mol/L NaCl,20 mmol/L Tris-HCl (pH 7.9)。
rhVVH的变性纯化方法为:菌体经超声裂解(强度 80,间隔 2 s,超声 30s后间隔 30s,重复5次),5 000 ×g离心收集包涵体沉淀。用含有6 mol/L尿素的结合缓冲液溶解包涵体,0.45 μm滤膜过滤后,进行Ni-NTA色谱柱纯化。主要试剂配方为:结合缓冲液为:5 mmol/L咪唑,0.5 mol/L NaCl,20 mmol/L Tris-HCl,6 mol/L 尿素 (pH 7.9);洗涤缓冲液为:60 mmol/L 咪唑,0.5 mol/L NaCl,20 mmol/L Tris-HCl,6 mol/L 尿素 (pH 7.9);洗脱液为:1 mol/L咪唑,0.5 mol/L NaCl,20 mmol/L Tris-HCl,6 mol/L尿素 (pH 7.9)。
在4℃条件下,将变性纯化获得的rhVVH依次经含4、2、1、0 mol/L尿素的50倍体积PBS透析复性。最后将复性好的rhVVH经0.22 μm滤膜过滤除菌,4℃保存。
1.6 VEGF结合能力检测
rhVVH的VEGF结合能力参考文献[7]进行,具体为:用0.5 μg/mL的人VEGF标准品包被酶标板,每孔100 μL。将rhVVH做倍比稀释,以HVmAb和VEGF多抗作为阳性对照组,pET28a空载体提取物作为阴性对照组。各组稀释浓度、所用抗体情况如表2,每组3个重复。最后以OPD显色,测定各样品在490 nm处的光吸收值,计算平均值和方差。
1.7 HUVEC细胞的增殖抑制检测
复苏HUVEC细胞至100 mm培养皿,以含10%FBS的高糖DMEM培养基培养至90%密度,0.25%胰酶消化后计数,按照每孔6×103个细胞铺至24孔板。待 8 h细胞贴壁后,分别加入不同浓度rhVVH。阳性对照为兔抗人 VEGF多抗,6×His聚组氨酸标签蛋白和PBS作为阴性对照,每组3个重复。2~4 d后使用CCK-8试剂盒测定活细胞数量,测定450 nm处吸光度。

表2 样品稀释和抗体使用情况Table 2 Sample Concentration and antibodies used in ELISA
2 结果与分析
2.1 重链可变区的克隆和序列分析
经引物配对尝试确定,引物 VH5-1和引物VH3-3配对可高效扩增出约350 bp的VH片段 (图1A)。将该片段插入到pMD19-T载体中,酶切鉴定正确 (图 1B)。
经测序表明,所克隆的片段属于人抗体重链基因家族。经IgBLAST和IMGT/V-QUEST分析,得到了 VH区中的功能区域划分 (图 2)。该片段属于人VH1家族,其中FR1到FR3区的296个碱基与IGHV1-2*02基因100%同源。
2.2 重组抗体片段的诱导表达和纯化

图1 VH片段琼脂糖凝胶电泳分析Fig.1 Agarose electrophoresis of cloned VH segment. (A) specific band of VH observed in PCR product at the predicted position(about 350 bp). (B) ampicillin selected T-Vector clones indentified withBamH I-Hind III. 1: clone I digested withBamH I-Hind III;2: clone II digested withBamH I-Hind III. (C) ampicillin selected T-Vector clones indentified withXbaI-XhoI. 1: clone I digested withXbaI-XhoI; 2: clone II digested withXbaI-XhoI.

图2 VH片段序列分析和功能区划分Fig.2 Sequence and domains analysis of VH.

图3 rhVVH在BL21大肠杆菌中诱导表达条件的摸索Fig.3 SDS-PAGE analysis of the induction conditions of the expression of rhVVH in BL21E. coli. Proteins were separated by 15%SDS-PAGE and stained with Coomassie Brilliant Blue. 1−2: lysis supernatant and debri of BL21 cell with no transferred plasmid induced at 37°C for 3 hours, as negative control; 3−8: lysis of BL21 cell harbouring the recombinant plasmid induced at 37°C; 9−14:lysis of BL21 cell harbouring the recombinant plasmid induced at 28°C; 15−20: lysis of BL21 cell harbouring the recombinant plasmid induced at 32°C. 3,4,9,10,15,16 indicate BL21 induced for one hour; 5,6,11,12,17,18 indicate BL21 induced for two hours;7,8,13,14,19,20 indicate BL21 induced for three hours; 3,5,7,9,11,13,15,17,19 indicate lysis supernatant of BL21 cells;4,6,8,10,12,14,16,18,20 indicate lysis debri of BL21 cells.

图4 rhVVH表达和纯化结果的鉴定Fig.4 SDS-PAGE (A/B) and Western blotting (C) analysis of expressed and purified rhVVH. (A) 1: lysis supernatant of rhVVH expression BL21 cell; 2: lysis debri of rhVVH expression BL21 cell. (B) Samples collected in denatured purification. 1: flow through; 2: wash; 3: eluted rhVVH. (C)Samples identified by an Anti-6×His tag Western blotting. 1:lysis supernatant of rhVVH expression BL21 cell; 2: lysis debri of rhVVH expression BL21 cell, as positive control; 3: flow through; 4: wash; 5: eluted rhVVH.
pET-VH转入大肠杆菌BL21菌株,经过尝试后发现rhVVH在BL21表达系统中主要以包涵体形式表达(图4A)。OD600≈0.6时,加入1 mmol/L IPTG,32℃诱导3 h (图3 样品19)。Western blotting实验(图4C样品1、2) 验证了约16 kDa大小的特异条带确为pET-28a中所带片段表达的重组蛋白,大小亦符合预期。在非变性条件下,在多次尝试诱导条件 (图3) 后,仍难以得到较大量的可溶目的蛋白,而且非变性rhVVH的纯化效果比较差 (数据未显示),因此决定采用变性纯化 (图4B)。经蛋白定量计算,每升菌液可获得4.8 mg的rhVVH纯品。
2.3 重组抗体结合实验
将复性好的rhVVH纯品与包被在ELISA板上的人VEGF进行反应,然后通过6×His标签单抗进行ELISA检测。尽管实验各组所用一抗和酶标抗体不一致,抗原抗体反应效果不尽相同,但从图5可见:与来源于V75杂交瘤的完整IgM单抗 (HVmAb组) 相比,rhVVH仍有较好的 VEGF结合能力,OD490呈现有较好的浓度梯度。
2.4 HUVEC细胞体外抑制实验
加入rhVVH后48 h观察细胞,细胞数量可见明显差异 (图6),75 ng/mL rhVVH实验组显示了与阳性对照接近的抑制HUVEC细胞增殖的效果,并在与加VEGF组的对比中显示了与VEGF的拮抗作用。
放大给药浓度重复实验,在培养120 h后使用CCK-8试剂盒对活细胞数进行测定 (图 7),结果显示rhVVH对HUVEC细胞有一定抑制作用,且抑制作用与浓度正相关。

图5 rhVVH结合VEGF活性实验浓度曲线Fig.5 VEGF-binding activity assay of rhVVH. (A)ELISA results of rhVVH, HVmAb, VEGF-pAb and NC. Lane 1 to lane 5 of each sample were added following the concentrations shown in Table 2. (B) Statistics ofOD490for ELISA. 50 ng per well VEGF was coated; rhVVH with concentration ranged from 5.926 μg/mL to 480 μg/mL (1:3 dilution for 4 times); polyclonal rabbit VEGF antibody (VEGF-pAb) with concentration ranged from 0.309 μg/mL to 25 μg/mL (1:3 dilution for 4 times) as positive control;HVmAb with concentration ranged from 6.173 μg/mL to 500 μg/mL (1:3 dilution for 4 times) as another control; Empty pET28a vector 6His-tagged expression extract with concentration ranged from 6.173 μg/mL to 500 μg/mL (1:3 dilution for 4 times) as negative control; OPD working solution added to VEGF coated well as blank.
3 讨论
通过IgBlast和IMGT比对所得的VH序列,发现VH属于人免疫球蛋白 VH1家族,FR1到 FR3的 296个碱基与 IGHV1-2*02有 100%同源性。1987年,Schroeder等[8]在研究人死亡B细胞的过程中发现了IGHV1-2*02,具体功能不详。本研究揭示该基因编码的重链可变区多肽具有人VEGF的结合活性。ELISA结合实验表明,与完整抗体相比,rhVVH保留了体外VEGF结合活性,符合通常认为的:重链在结合抗原过程中起主要作用,轻链的缺失会降低抗体与抗原的亲和力[10]。

图6 HUVEC细胞典型密度Fig.6 Typical HUVEC cell density. (A) 100 ng/mL polyclonal rabbit anti-VEGF antibody with 3 ng/mL VEGF.(B) 100 ng/mL polyclonal rabbit anti-VEGF antibody. (C)75 ng/mL 6×His with 3 ng/mL VEGF. (D) 75 ng/mL 6×His. (E)0.1% (V/V) PBS with 3 ng/mL VEGF. (F) 0.1% (V/V) PBS. (G)75 ng/mL rhVVH with 3 ng/mL VEGF. (H) 75 ng/mL rhVVH.(I) 15 ng/mL rhVVH with 3 ng/mL VEGF. (J) 15 ng/mL rhVVH. (K) 3 ng/mL rhVVH with 3 ng/mL VEGF. (L) 3 ng/mL rhVVH.

图7 HUVEC细胞抑制实验Fig.7 HUVEC inhibition result. HUVEC cell cultured with different concentration (ranged from 62.5 ng/mL to 2 000 ng/mL)of rhVVH added in medium. Equal volume of PBS were added as negative control.
在细胞增殖抑制实验中,rhVVH显示出了抑制HUVEC CRL-1730细胞的增殖活性。前期研究已表明,HVmAb所识别的 VEGF表位可以有效阻断VEGF的血管促生活性,并抑制肿瘤生长[5]。可见,rhVVH抗体片段可被应用于筛选和生产高亲和力的工程抗体,这种筛选过程可通过近年来发展起来的丙氨酸替换、胚系基因热点突变等技术实现[11-12]。

图8 获得的无义轻链可变区序列Fig.8 Sequence and domains analysis of VL.
将抗体的CDR区独立拼装组成的CDR多肽也能够保留原抗体的抗原结合活性[13]。笔者在尝试相关研究过程中 (结果未发表),克隆出了一条无义HVmAb轻链 (图8) 和一条有义HVmAb轻链可变区的基因,该无义轻链基因来源于 λ链基因所在的22号染色体,与V2-4P序列99.2%同源。造成两种轻链基因共存的原因,笔者认为可能与五特征小鼠中人源和小鼠的内源抗体基因共存有关。五特征小鼠携带有人重链、κ链和λ链基因,小鼠的内源重链和κ链基因被抑制,而λ链基因仍处于激活状态[14]。Ren等[15]也曾报道过这种异源抗体基因共存引发抗体基因异常表达的现象,他们发现两种源于 SP2/0的杂交瘤细胞中都存在 κ链基因的异常重排和表达。不过,目前关于Vλ家族中的假基因在B细胞成熟过程中如何影响抗体序列的重排还无定论,也不排除假基因在抗体形成过程中发挥有重要功能 (如鸡的抗体形成[16])。由此看来,五特征小鼠可作为研究人免疫球蛋白λ链重排机制的模型动物。
IgM 是免疫球蛋白各个亚型中较早被发现的一类,并很快应用于短期感染的检测。但是由于 IgM分子量巨大,很难被用于体内免疫治疗。本研究,证实了来源于全人源VEGF单克隆IgM抗体的重链可变区仍保留有完整抗体的部分功能,这为进一步开展抗体小型化和功能特性分析奠定了基础。
REFERENCES
[1] Folkman J. Angiogenesis in cancer, vascular, rheumatoid and other disease.Nat Med, 1995, 1(1): 27−31.
[2] Dimitrov DS, Marks JD. Therapeutic antibodies:current state and future trends——is a paradigm change coming soon?Methods Mol Biol, 2009, 525: 1−27.
[3] Carter P, Merchant AM. Engineering antibodies for imaging and therapy.Curr Opin Biotechnol, 1997, 8:449−454.
[4] Wesolowski J, Alzogaray V, Reyelt J,et al. Single domain antibodies: promising experimental and therapeutic tools in infection and immunity.Med Microbiol Immunol, 2009,198(3): 157−74.
[5] Liu Y, Yun DJ, Chen JQ,et al. Isolation and characterization of human anti-VEGF165 monoclonal antibody with anti-tumor efficacy from transgenic mice expressing human immunoglobulin loci.Cancer Lett,2009, 273: 28−34.
[6] Goding JW. Monoclonal Antibodies: Principles and Practice. 3rd ed. London: Academic Press, 1988: 43−434.
[7] Clark MF, Adams AN. Characteristics of the microplate method of enzyme-linked immunosorbent assay for the detection of plant viruses.J Gen Virol, 1977, 34: 475−483.
[8] Schroeder HW Jr, Hillson JL, Perlmutter RM. Early restriction of the human antibody repertoire.Science,1987, 238: 791−793.
[9] Ward ES, Gussow D, Grifiths AD,et al.Binding activities of a repertoire of single immunoglobulin variable domains secreted fromE. coli.Nature, 1989, 341: 544−546.
[10] Riechmann L, Muyldermans S. Single domain antibodies:comparison of camel VH and camelised human VH domains.J Immunol Methods, 1999, 231: 25−38.
[11] Heap CJ, Wang Y, Pinheiro TJT,et al. Analysis of a 17-amino acid residue, virus-neutralizing microantibody.J Gen Virol, 2005, 86: 1791−1800.
[12] Ho M, Kreitman RJ, Onda M,et al.In vitroantibody evolution targeting germline hot spots to increase activity of an anti-CD22 immunotoxin.J Biol Chem, 2005, 280(1):607−617.
[13] Qiu XQ, Wang H, Cai B,et al. Small antibody mimetics comprising two complementarity-determining regions and a framework region for tumor targeting.Nat Biotechnol,2007, 25(8): 921−929.
[14] Nicholson IC, Zou X, Popov AV,et al. Antibody repertoires of four and five feature translocus mice carrying human immunoglobulin heavy chain and kappa and lambda light chain yeast artificial chromosomes.J Immunol, 1999, 163: 6898−6906.
[15] Ren J, Bai J, Si XM,et al. Effect of disproportional expression of the aberrant and correct kappa chain transcripts on antibody secretion of SP2/0 derived-CEA and AFP hybridomas.Int J Mod Cancer Ther, 1999, 2(2):65−70.
[16] Carlson LM, McCormack WT, Postema CE,et al.Templated insertions in the rearranged chicken IgL V gene segment arise by intrachromosomal gene conversion.Genes Dev, 1990, 4: 536−547.
Cloning and expression of a single human immunoglobulin heavy-chain variable domain with vascular endothelial growth factor binding activity
Heng Liu1,2, Siguo Liu2, Yi Wu2, Zili Ma1,2, Yu Liu3, Aimin Zhang2, Jianquan Chen2,and Guoxiang Cheng2
1School of Life Science and Technology,Tongji University,Shanghai200092,China
2Shanghai Transgenic Research Center,Shanghai201210,China
3Department of Biochemistry,China Pharmaceutical University,Nanjing210009,China
Received:February 10, 2010;Accepted:May 10, 2010
Supported by:National Natural Science Foundation of China (No. 30672478), Science and Technology Major Projects of Major New Drug Development of China (No. 2009ZX09103-654).
Corresponding author:Siguo Liu. Tel: +86-21-51380637; E-mail: lsg@cngenon.com
国家自然科学基金 (No. 30672478),国家新药创制重大专项 (No. 2009ZX09103-654) 资助。

