microRNA调控的靶向性病毒载体在基因治疗中的应用
张国海,王启钊,张景红,许瑞安,2
1 华侨大学分子药物学研究所,泉州 362021
2 分子药物教育部工程研究中心,泉州 362021
综 述
microRNA调控的靶向性病毒载体在基因治疗中的应用
张国海1,王启钊1,张景红1,许瑞安1,2
1 华侨大学分子药物学研究所,泉州 362021
2 分子药物教育部工程研究中心,泉州 362021
安全、有效、具有靶向性的病毒载体是基因治疗药物在临床上得以应用的关键。microRNA是一类单链、内源性的转录后调控小分子,它的发现为开发具有靶向性调控能力的病毒载体提供了新的研究方法。以下在介绍microRNA调节病毒载体靶向性原理的基础上,着重介绍 microRNA在清除复制能力病毒的污染、消除转基因特异性免疫、增强肿瘤靶向性基因治疗、开发活体疫苗等领域的应用。
基因治疗,microRNA,病毒载体,靶向性调控
Abstract:A safe and effective targeting viral vector is the key factor for successful clinical gene therapy. microRNA, a class of small, single-stranded endogenous RNAs, act as post-transcriptional regulators of gene expression. The discovery of these kind regulatory elements provides a new approach to regulate gene expression more accurately. In this review, we elucidated the principle of microRNA in regulation of targeting viral vector. The applications of microRNA in the fields of elimination contamination from replication competent virus, reduction of transgene-specific immunity, promotion of cancer-targeted gene therapy and development of live attenuated vaccines were also discussed.
Keywords:gene therapy, microRNA, viral vector, targeting regulation
病毒载体因具有转染效率高、表达时间长、感染细胞广泛等优势,在基因治疗的载体选择中一直备受关注[1]。但是在将外源基因导入细胞的过程中,病毒载体本身以及编码基因产物的非特异性表达常常引起免疫反应,以致封闭目的基因的表达而使其失去治疗效果[2]。因此开发安全、有效、靶向性的病毒载体是基因治疗取得进一步成功的关键。作为转录后调控分子,microRNA在调节病毒载体靶向性的成功应用[3-6],使基因治疗在造福人类的道路上又向前迈进了坚实的一步。它不但能从根源上解决具有复制能力病毒的污染问题,还能够消除转基因特异性免疫,开发肿瘤特异性基因治疗,拓展基因治疗的新领域。本文就 microRNA调节病毒载体靶向性在基因治疗中的应用进展作一综述。
1 基于microRNA的靶向性病毒载体的构建
microRNA调节病毒载体的靶向性源于它作为转录后小分子调节物的作用机理。它主要通过 5′端的前 2~8个核苷酸的种子序列 (Seed sequence) 识别 mRNA 3′端非翻译区 (3′UTR) 来实现在转录后水平上调节基因的表达[7]。因此将含有特定microRNA靶向元件 (miRNA target element,miRTE) 的靶盒置于目的基因或病毒载体关键元件的3′UTR区,就能通过内源性的microRNA来调控目的基因的表达,达到在转录后水平上调节病毒载体的靶向性[6]。

图1 miRTE-病毒载体的构建Fig.1 Construction of viral vector containing miRTE. (A) MicroRNA Eliminated contamination of replication competent virus. If there were replication competent virus during vector production, the replication competent virus can’t replicate by interfering capsid genes expression in targeted tissue. (B) Tissue-specific expression of transgenes. When the viral vectors transfect the unwanted tissue or cell, transgene can’t express under the interference of miRTE associated microRNA. First Incorporation four tandem copies of a single miRTE (red) into the viral vector helper plasmid (A) or 3′UTR of a function gene (B), then the viral plasmid and the packaging plasmids co-infect the packaging cell, after the encapsidation of viral DNA, viral vectors containing miRTE are harvested.
目前miRTE-病毒载体的构建主要分为两类:一类是将特定的miRTE克隆到病毒包装所需辅助质粒中 (图 1A),以达到在以特定组织为靶器官的基因治疗中解决具有潜在复制能力病毒的污染问题;另一类是将特定的miRTE克隆到目的基因的3′UTR (图1B),以实现转基因产物的细胞或组织特异性表达。在这两类病毒载体的构建中,miRTE数量和种类的选取至关重要。已有文献报道将4个相同的miRTE串联置于载体上能达到最佳的调控效果[5],低于或超过 4个都会减弱其调控效果[8]。miRTE种类的选取则主要取决于其对应的内源性 microRNA的数量和分布情况。理想的microRNA应在数量上占优势以达到调控的有效性,同时在分布上具有特异性 (表1),以达到调控的靶向性。如肝组织特异性 microRNA、miR-122a因在体内的含量非常高,且仅在肝脏、大脑等少数组织中表达,故常常被用于调控病毒载体的靶向性[10-12];或者在病理情况下变化较明显的microRNA,如在肿瘤中起抑癌作用的 microRNA,在正常组织中大量表达在癌组织中却明显下调,据此可以构建靶向于癌组织的病毒载体[13-14]。
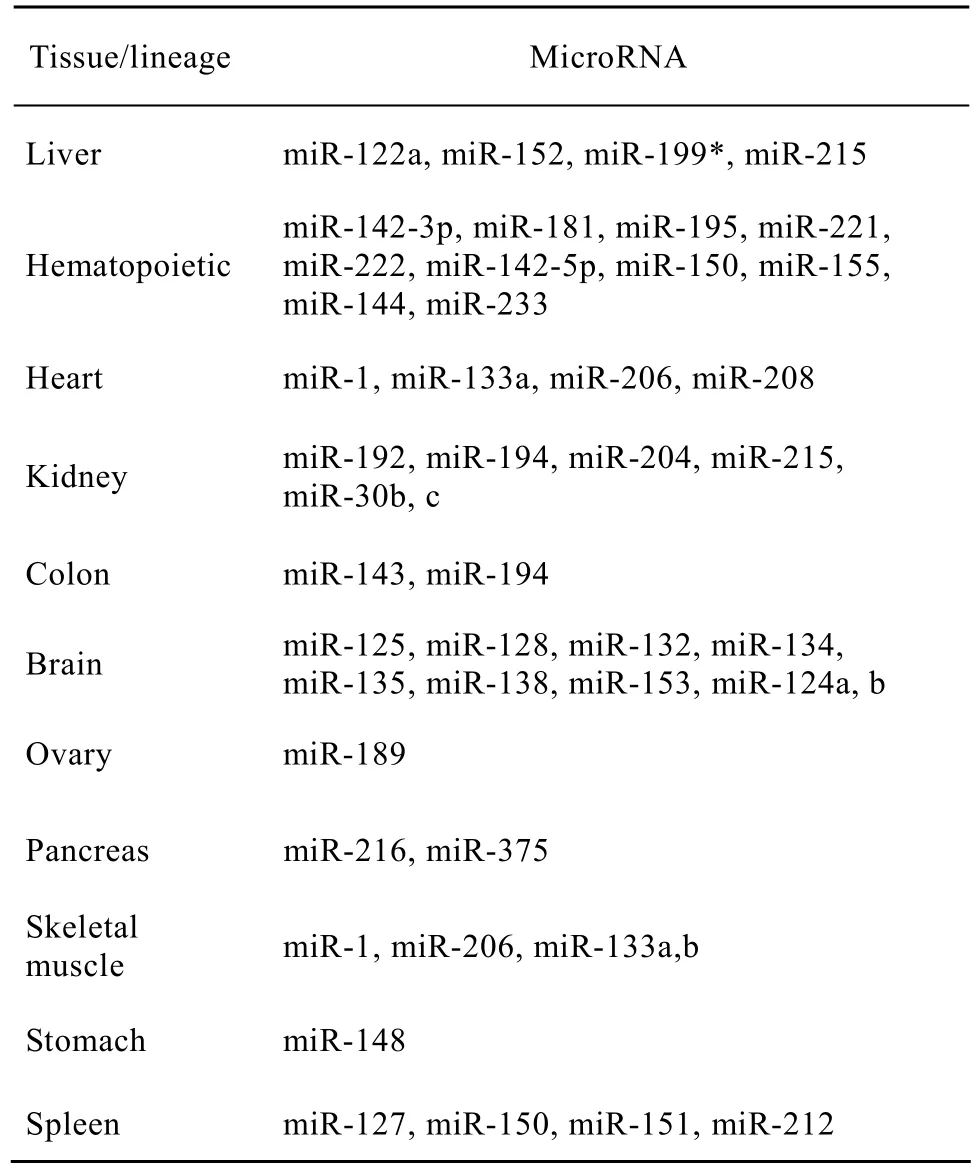
表1 组织特异性microRNA表达[6,9-12]Table 1 Tissue-specifc microRNA expression[6,9-12]
miRTE-病毒颗粒包装的基因组中含有外源性的miRTE序列,这种序列对于病毒的包装效率和基因的表达是否有影响呢?本实验室的体内外实验研究显示,这种外源性的miRTE序列对病毒载体的包装和基因的表达几乎没有影响[15]。在生产AAV所需的衣壳蛋白辅助质粒中加入肝组织特异性的 miR-122和造血特异性的 miR-142-3p的 miRTE序列后,与原辅助质粒相比,生产的 rAAV病毒颗粒无论在产量还是感染效率上都没有明显的区别,这说明加入miRTE序列后对病毒包装和基因表达不会产生显著影响。肌肉内注射rAAV-LacZ经X-gal染色发现,两种辅助质粒产生的病毒载体产生的转基因数量在肌肉组织内类似;在肝脏中,由新型辅助质粒包装成的rAAV-FIX (凝血因子IX) 在开始的4~6周内表达逐渐增加,并达到1 000 ng/mL的峰值,与传统的rAAV载体所表达出来的效能基本一致[15]。
2 microRNA靶向性调控能力在基因治疗中的应用
2.1 从根源上解决具有复制能力病毒的污染问题
用于基因治疗的病毒载体都是经过遗传改造后只保留了病毒复制所需顺式元件的改造载体,对人体无害[1]。但是在病毒包装过程中,由于同源重组或非同源重组的原因会产生具有复制能力的病毒,致使在治疗过程中引发免疫反应而关闭功能基因的表达[16]。为了降低具有复制能力病毒的污染,本实验室[15]对含有miR-122和miR-142-3p miRTE的新辅助质粒产生的 rAAV载体进行了细胞学研究。实验表明,新型辅助质粒携带的Cap基因能在293细胞中稳定表达,且新体系生产的病毒无论在数量上还是品质上都和原来相似。在肝细胞系中Cap基因的表达急剧减少,在肝脏中,99.9%的Cap基因表达受到抑制,蛋白印记的方法未检测到Cap基因的表达产物。目前本课题组正在着手进行由新辅助质粒包装的 rAAV载体的免疫反应研究,如果成功,将可能解决肝脏内具有复制能力 AAV病毒污染而引发的免疫反应。这种新方法同样可以应用于其他类型病毒载体的构建,进一步解决基因治疗中由复制能力病毒污染而引起的免疫问题。
2.2 消除转基因特异性免疫反应
免疫问题仍是基因治疗无法在临床上取得突破性进展的关键所在[17]。到2009年12月,世界范围内各国批准的基因治疗临床实验项目已经达到1 579项 (http://www.abedia.com/wiley/),却由于存在免疫反应、转染效率等问题,迄今只有一项基因治疗产品面世。在基因治疗的过程中,很多因素都能诱发免疫反应[2]。但以病毒载体本身以及转基因产物在抗原递呈细胞中表达所引起的特异性免疫最为重要[18],它是当前基因药物无法持久表达的主要障碍[19]。
为了解决这一难题,Brown等[20]率先将microRNA引入到克服转基因特异性免疫反应领域,并取得了突破性的进展,作者认为,慢病毒介导的FIX不能持续维持高水平表达乃是慢病毒转染脾脏来源的造血世系细胞并表达目的基因而诱发针对FIX的免疫反应所致。为此,研究人员将造血细胞特异性表达的miR-142-3p的4个miRTE克隆到目的基因的 3′UTR,以绿色荧光蛋白为报告基因的研究发现,在人类U937单核细胞和树突状细胞中,慢病毒介导的绿色荧光蛋白的表达量下降了近 100倍,而在 293细胞中表达量没有显著变化。随后,他们又将这一成果用于 B型血友病治疗。正如预期,含有4个miR-142-3p miRTE的慢病毒载体可使FIX持久稳定的表达,且未发现抗-FIX的抗体,更没有发生由FIX引起的免疫反应[21]。这充分说明由microRNA调节的靶向性病毒载体可以消除转基因表达所引起的特异性免疫反应。此外,microRNA介导的质粒 DNA同样具有消除免疫反应的效果。为了验证这种消除特异性免疫反应的方法能否以及在多大程度上发挥作用,Wolff等[22]首次以质粒 DNA为载体,将4个miR-142-3p miRTE克隆到目的基因的3′UTR来验证该方法的有效性。他们的可行之处在于既采用了 microRNA调控,又使用了组织特异性启动子调控,并配合使用胞内蛋白和分泌蛋白进行了双验证。结果显示由microRNA调节的靶向性载体可以消除转基因表达所引起的特异性免疫反应,特别是配合使用组织特异性启动子,可达到最佳效果。
2.3 增强溶瘤病毒的肿瘤靶向性基因治疗
越来越多的研究表明宿主来源的 microRNA在病毒的复制和翻译过程中发挥着重要的调节作用,通过作用于病毒转录后元件,既可以抑制病毒感染[23-24],也可以促进病毒的感染[25-26],这为开发 microRNA用于肿瘤靶向性基因治疗提供了强有力的佐证。
2.3.1增强肿瘤靶向性
溶瘤病毒治疗和自杀性基因治疗已被证明是肿瘤靶向性基因治疗的两种行之有效的方法[27]。目前国内外正在开发的溶瘤病毒有腺病毒、单纯疱疹病毒(HSV)、新城疫病毒、水疱性口炎病毒(VSV) 和脊髓灰质炎病毒等10多种。由于病毒具有复制能力以及在向瘤内注射过程中存在扩散等问题,毫无疑问提高溶瘤病毒的肿瘤靶向性是其在临床上取得成功的关键。
研究表明 microRNA介导的调节可以提高溶瘤病毒的肿瘤靶向性。Edge等[13]通过将 let-7 miRTE置于野生型VSV基质蛋白的3′UTR,发现VSV在正常组织中不能复制,只能专一性地在肿瘤组织中生长。这是由于let-7在正常组织中表达量很高,但在肿瘤组织中表达明显下降,载有let-7 miRTE的野生型VSV因受到let-7的调节而在正常组织中失去了复制能力。与 let-7相似,miR-143 和 miR-145在正常组织中表达量很高,但在乳腺癌组织中表达明显下调。同样基于microRNA表达量的变化,Lee等[14]将miR-143 和 miR-145用于调控HSV的肿瘤靶向性,并成功构建了专一性靶向乳腺癌组织的溶瘤病毒。
2.3.2降低毒副作用
作为一种新型溶瘤病毒,腺病毒的开发一直是国内外研究的热点。研究表明腺病毒在向瘤内注射过程中极易扩散进入循环系统,感染肝组织,从而诱发肝毒性。因而肝毒性问题是腺病毒可否用于溶瘤病毒基因治疗的瓶颈。为了攻克这一技术难关,几乎两个实验室同时报道了利用 microRNA介导的调节作用来消除腺病毒所引发的肝毒性问题[11,28]。他们都采用了肝组织特异性 miR-122a作为调节分子,通过将其miRTE克隆到腺病毒关键基因E1A的3′UTR上,从而构建出了只能在其他组织复制而无法在肝组织复制的腺病毒。Cawood等[11]进一步证实这种经修饰的腺病毒丝毫没有减弱其对肿瘤的杀伤能力,进而为腺病毒的成功开发提供了有利证据。与此同时,腺病毒介导的自杀性基因治疗也因肝毒性的降低而变得更加安全、有效[12]。
此外,柯萨奇病毒 A21(CVA21) 所引发的肌肉毒副作用是困扰其成功用于溶瘤病毒治疗的原因所在。体内试验表明CVA21在大鼠体内能使肿瘤迅速退化,但同时会引起肌肉麻痹。活组织检测发现CVA21仅存在于肿瘤组织和骨骼肌中,而不存在于其他组织,因此消除CVA21向骨骼肌组织的扩散是解决这一问题的关键。Kelly等[29]首次采用双靶向的microRNA调控成功地解决了这一难题。他不但证明了将肌肉组织特异性miR-133和miR-206的miRTE置于CVA21的3′UTR能成功抑制其向肌肉组织的扩散,还验证了两个miR-133和两个miR-206 miRTE的联合应用要比4个miR-133或miR-206 miRTE的调控效果要好[29]。
VSV由于对免疫系统的敏感性特别是对Ⅰ型干扰素的敏感性而在正常组织中很容易被清除,但是这种易损性在大部分肿瘤组织中却不起作用,正是基于这种原因以VSV为溶瘤病毒的基因治疗已进入了Ⅰ期临床实验[30]。但是,VSV仍具有潜在的神经毒性,可引起致命性的大脑炎,因此消除VSV向中枢神经系统的渗透是其在临床上取得广泛应用的关键。
先前有很多研究致力于消除VSV的神经毒性,诸如修饰VSV的基因组使其对干扰素更敏感,虽然可以减弱病毒的毒性但同时也降低了病毒的抗肿瘤能力。为了避免削弱病毒的抗肿瘤能力,Stojdl等[31]采用microRNA介导的调控作用调节VSV在大鼠体内的分布以达到减弱病毒神经毒性的同时又不影响病毒抗肿瘤能力的目的。通过将大脑特异性 miRTE置于 VSV 基因组关键基因 (N gene,L gene) 的3′UTR从而构建重组型VSV(rVSV),细胞学实验显示大脑特异性 microRNA对于 rVSV的生长动力学影响不大,体外实验进一步证明外源性的大脑特异性microRNA mimics并不能显著降低rVSV的细胞毒性,只有内源性表达的大脑特异性 microRNA才能显著减弱rVSV的细胞毒性。为了验证rVSV在大脑组织中毒性的减弱情况,作者将1×104rVSV注射到免疫缺陷鼠体内,对其观察了35 d未发现任何并发症发生。特别是将大脑特异性miR-125的miRTE置于L gene 3′UTR的rVSV (VSV 125r L),在颅内注射1周后,10只大鼠中有9只大鼠正常,未发现神经毒性,且能健康生活到病毒注射后35 d;而在颅内分别注射VSV-Luc,VSV 125r M和VSV 206r L的大鼠则在 1周后发生了严重的神经毒性症状。作者又进一步验证了 rVSV的溶瘤能力,通过将1×109rVSV注入到预先造好的肿瘤模型中,在第3天通过静脉注射的方式将 1×109rVSV导入大鼠体内,通过对肿瘤大小的检测和荧光图像的采集,发现rVSV与VSV相比,无论是抗肿瘤能力还是病毒在瘤内的复制能力均没有明显区别[31]。
2.4 开发肿瘤免疫基因治疗
肿瘤免疫治疗是利用机体自身的免疫系统清除肿瘤的过程。开发肿瘤免疫治疗的最大难题是需要激活大量的具有相同肿瘤专一性的T淋巴细胞以进行持久的治疗。研究表明在造血干细胞中表达肿瘤特异性的T细胞抗原受体(TCR) 能够持续激活肿瘤专一性的T淋巴细胞而达到免疫治疗的目的[32]。载体介导的TCR既在胸腺细胞中表达又在成熟的T细胞中表达,因此就存在一个潜在问题:T细胞会对遗传环境产生耐受,进而把自身的肿瘤抗原当作胸腺细胞克隆删除的结果而无法激活[33]。因此只在 T细胞表达TCR,不在胸腺细胞中表达TCR将可以避免这一负选择而进行持续的免疫治疗。Papapetrou等[34]首次证明了miR-181a可以调控TCR在胸腺细胞和成熟T细胞中分开表达。miR-181a在胸腺细胞中表达量很高,但在T细胞中表达量急剧下降。通过将 miR-181a miRTE克隆到编码抗原受体的慢病毒载体上,然后将其导入鼠BM细胞中,TCR的表达在胸腺细胞中被选择性抑制,但在T细胞中恢复了表达,并且对肿瘤的攻击有免疫保护作用[34]。这说明 microRNA调节病毒载体的靶向性可以实现目标基因在不同细胞中的选择性表达,从而为肿瘤免疫基因治疗的开发提供了有利的工具。
2.5 开发减毒活体疫苗
疫苗是抵抗病毒感染最有效的方法,在美国,每年因病毒感染而导致的死亡率下降了 99.9%[35]。在所有种类的疫苗中,活体疫苗因能激活免疫系统的全部元件,而成为世界各国竞相开发的热点。目前活体疫苗开发的主要障碍是缺乏一套有效的减毒方法,减毒后的疫苗仍具有恢复致病性的潜能。与此同时,病毒只有在特定组织复制才会引发疾病,如骨髓灰质炎病毒在肠胃中复制不会威胁生命,只有在脑干和运动神经元感染才会诱发骨髓灰质炎[36]。因此开发具有组织特异性的活体疫苗是活体疫苗消除其毒副作用的一条新途径。
作为一个新领域,Barnes等[37]首次证明了microRNA同样可以用于开发减毒活体疫苗。通过将内源性的let-7a和miR-124a的miRTE分别置于骨髓灰质炎病毒的5′UTR和两个编码元件之间,发现修饰后的病毒不能在中枢神经系统复制,并且大大降低了致病性。体内试验显示野生型髓灰质炎病毒的半致死剂量只有 2.2×106病毒颗粒 (Plaque-forming unit,PFU),而经修饰的病毒其半致死剂量高达1×108PFU,当将1×108PFU的野生型病毒通过肌肉注射的方式注入小鼠体内,可迅速感染中枢神经系统,并在 6 d内引起麻痹和死亡;而将1×108PFU的修饰型病毒注入小鼠体内不会引起麻痹或死亡。实验进一步验证了将其开发成疫苗的可行性,通过向小鼠腹腔内注射修饰后的病毒,发现其免疫原性要优于现在使用的疫苗,且对野生型病毒的再次攻击具有免疫反应[37]。虽然这是 microRNA用于减毒活体疫苗开发仅有的一个例子,它却为活体疫苗的开发提供了新的思路。
3 展望
基因治疗在人类疾病治疗中的地位越来越来重要,特别是在治疗诸如癌症[38]、糖尿病[39]、白血病、血友病[40]等现在用其他治疗方法尚无法完全治愈的疾病方面所具有的前景被人们所普遍看好。但是由于载体本身[41]、转基因产物的非特异性表达等[2]常常引起免疫反应,致使基因药物无法进行持久治疗。因此载体的靶向性、治疗基因的可控性、免疫问题的祛除与克服仍是当前基因治疗迫切需要解决的问题。
microRNA调节的靶向性病毒载体在基因治疗领域的成功开发,为解决当前面临的难题提供了新的思路和方法,但同时也应看到许多问题尚待回答。如microRNA的具体调节机制以及其在生命周期中的确切作用,能起到靶向性调节的microRNA的最低含量,能发挥最佳调控作用的 miRTE的数目以及相互之间的空间距离,miRTE在病毒载体上的插入位点等问题。现在普遍认为将 miRTE插入功能基因或重要元件的 3′UTR上能发挥较好的调控效果[10,13,29],但也有研究显示将其插入 5′UTR上亦能发挥调控效果[37]。总之,这些问题的回答将对其在基因治疗领域的成功开发具有重要的指导意义。此外,microRNA调控的靶向性病毒载体还存在一个潜在的问题,尤其是对溶瘤病毒来说,病毒极易在外源性的miRTE序列处产生突变,进而恢复病毒原有的组织渗透性和免疫原性。因此,如何避免 miRTE的突变将是当前研究的一个重点。其次,microRNA广泛存在于人体内并发挥着重要的调节作用,但只有那些具有组织特异性或在病理条件下表达发生明显变化的 microRNA才能在靶向性病毒载体的构建中所采用,所以,如何筛选这些具有独特性质的microRNA也是迫切需要解决的问题。
本实验室长期从事癌症[38]、糖尿病[39]、血友病[40]等恶性疾病的基因治疗研究,特别是近期利用microRNA调节病毒载体的靶向性的原理成功开发了一种新型的、细胞特异性的、内含多个组织特异如肝特异和造血特异序列拷贝的 microRNA结合序列的基因片段,通过控制包装蛋白基因片段表达,进而达到在以肝脏为靶器官的血友病基因治疗中彻底解决具有复制能力的AAV病毒污染问题[15]。如将这一基因片段同时应用于病毒包装的辅助质粒和目的基因质粒,也许能同时解决因载体本身和转基因产物分别诱发的免疫反应。
REFERENCES
[1] Xu RA, Chen L, Xiao WD. Molecular Gene Medicine.Beijing: Peking University Press and Peking University Medical Press, 2008: 2–41.
许瑞安, 陈凌, 肖卫东. 分子基因药物学. 北京: 北京大学出版社&北京大学医学出版社, 2008: 2–41.
[2] Brown BD, Lillicrap D. Dangerous liaisons: the role of“danger” signals in the immune response to gene therapy.Blood, 2002, 100(4): 1133–1140.
[3] Sayed D, Rane S, Abdellatif M. MicroRNAs challenge the status Quo of therapeutic targeting.J Cardiovasc Transl Res, 2009, 2(1): 100–107.
[4] Grimm D. Small silencing RNAs: state-of-the-art.Adv Drug Deliv Rev, 2009, 61(9): 672–703.
[5] Brown BD, Gentner B, Cantore A,et al. Endogenous microRNA can be broadly exploited to regulate transgene expression according to tissue, lineage and differentiation state. Nat Biotechnol, 2007, 25(12): 1457–1467.
[6] Kelly EJ, Russell SJ. MicroRNAs and the regulation of vector tropism.Mol Ther, 2009, 17(3): 409–416.
[7] Nilsen TW. Mechanisms of microRNA-mediated gene regulation in animal cells.Trends Genet, 2007, 23(5):243–249.
[8] Callis TE, Chen JF, Wang DZ. MicroRNAs in skeletal and cardiac muscle development.DNA Cell Biol, 2007, 26(4):219–225.
[9] Landgraf P, Rusu M, Sheridan R,et al. A mammalian microRNA expression atlas based on small RNA library sequencing.Cell, 2007, 129(7): 1401–1414.
[10] Ylosmaki E, Hakkarainen T, Hemminki A,et al.Generation of a conditionally replicating adenovirus based on targeted destruction of E1A mRNA by a cell type-specific microRNA.JVirol, 2008, 82(22):11009–11015.
[11] Cawood R, Chen HH, Carroll F,et al. Use of tissue-specific microRNA to control pathology of wild-type adenovirus without attenuation of its ability to kill cancer cells.Plos Pathogens, 2009, 5(5): e1000440.
[12] Suzuki T, Sakurai F, Nakamura S,et al. miR-122aregulated expression of a suicide gene prevents hepatotoxicity without altering antitumor effects in suicide gene therapy.Mol Ther, 2008, 16(10): 1719–1726.
[13] Edge RE, Falls TJ, Brown CW,et al. A let-7 microRNA-sensitive vesicular stomatitis virus demonstrates tumorspecific replication.Mol Ther, 2008, 16(8): 1437–1443.
[14] Lee CYF, Rennie PS, Jia WWG. MicroRNA regulation of oncolytic herpes simplex virus-1 for selective killing of prostate cancer cells.Clin Cancer Res, 2009, 15(16):5126–5135.
[15] Xu RA, Xiao WD, Lu H. A novel cell specific microRNA binding sequence gene: HAAVmir for gene therapy: CN,101532024. 2009-09-16.
许瑞安, 肖卫东, 陆辉. 一种用于基因治疗的新型细胞特异性内含 microRNA结合序列的基因 HAAVmir: 中国, 101532024. 2009-09-16.
[16] High KA. AAV-mediated gene transfer for hemophilia.Ann NY Acad Sci, 2001, 953(1): 64–74.
[17] High KA. Gene transfer for hemophilia: can therapeutic efficacy in large animals be safely translated to patients?J Thromb Haemost, 2005, 3(8): 1682–1691.
[18] De Geest BR, Van Linthout SA, Collen D. Humoral immune response in mice against a circulating antigen induced by adenoviral transfer is strictly dependent on expression in antigen-presenting cells.Blood, 2003,101(7): 2551–2556.
[19] Thomas CE, Ehrhardt A, Kay MA. Progress and problems with the use of viral vectors for gene therapy.Nat Rev Genet, 2003, 4(5): 346–358.
[20] Brown BD, Venneri MA, Zingale A,et al. Endogenous microRNA regulation suppresses transgene expression in hematopoietic lineages and enables stable gene transfer.Nat Med, 2006, 12(5): 585–591.
[21] Brown BD, Cantore A, Annoni A,et al. A microRNA-regulated lentiviral vector mediates stable correction of hemophilia B mice.Blood, 2007, 110(13):4144–4152.
[22] Wolff LJ, Wolff JA, Sebestyén MG. Effect of tissue-specific promoters and microRNA recognition elements on stability of transgene expression after hydrodynamic naked plasmid DNA delivery.Hum Gene Ther, 2009, 20(4): 374–388.
[23] Otsuka M, Jing Q, Georgel P,et al. Hypersusceptibility to vesicular stomatitis virus infection in Dicer1-deficient mice is due to impaired miR24 and miR93 expression.Immunity, 2007, 27(1): 123–134.
[24] Huang J, Wang F, Argyris E,et al. Cellular microRNAs contribute to HIV-1 latency in resting primary CD4+T lymphocytes.Nat Med, 2007, 13(10): 1241–1247.
[25] Jopling CL, Yi M, Lancaster AM,et al. Modulation of hepatitis C virus RNA abundance by a liver-specific microRNA.Science, 2005, 309(5740): 1577–1581.
[26] Henke JI, Goergen D, Zheng JF,et al. MicroRNA-122 stimulates translation of hepatitis C virus RNA.Embo J,2008, 27(24): 3300–3310.
[27] Parato KA, Senger D, Forsyth PA,et al. Recent progress in the battle between oncolytic viruses and tumours.Nat Rev Cancer, 2005, 5(12): 965–976.
[28] Ylösmäki E, Hakkarainen T, Hemminki A,et al.Generation of a conditionally replicating adenovirus basedon targeted destruction of E1A mRNA by a cell type-specific MicroRNA.J Virol, 2008, 82(22):11009–11015.
[29] Kelly EJ, Hadac EM, Greiner S,et al. Engineering microRNA responsiveness to decrease virus pathogenicity.Nat Med, 2008, 14(11): 1278–1283.
[30] Stolzer AL, Sadelain M, Sant'Angelo DB. Fulminant experimental autoimmune encephalo-myelitis induced by retrovirally mediated TCR gene transfer.Eur J Immunol,2005, 35(6): 1822–1830.
[31] Stojdl DF, Lichty BD, tenOever BR,et al. VSV strains with defects in their ability to shutdown innate immunity are potent systemic anti-cancer agents.Cancer Cell, 2003,4(4): 263–275.
[32] Kelly EJ, Nace R, Barber GN,et al. Attenuation of vesicular stomatitis virus encephalitis through microRNA targeting.J Virol, 2010, 84(3): 1550–1562.
[33] Houghton AN, Gold JS, Blachere NE. Immunity against cancer: lessons learned from melanoma.Curr Opin Immunol, 2001, 13(2): 134–140.
[34] Papapetrou EP, Kovalovsky D, Beloeil L,et al. Harnessing endogenous miR-181a to segregate transgenic antigen receptor expression in developing versus post-thymic T cells in murine hematopoietic chimeras.J Clin Invest,2009, 119(1): 157–168.
[35] Centers for Disease Control and Prevention (CDC).Impact of vaccines universally recommended for children-United States,1990-1998.MMWR Morb Mortal Wkly Rep, 1999, 48(12): 243–248.
[36] Andino R, Böddeker N, Silvera D,et al. Intracellular determinants of picornavirus replication.Trends Microbiol,1999, 7(2): 76–82.
[37] Barnes D, Kunitomi M, Vignuzzi M,et al. Harnessing endogenous miRNAs to control virus tissue tropism as a strategy for developing attenuated virus vaccines.Cell Host Microbe, 2008, 4(3): 239–248.
[38] Cai KX, Tse LY, Xu RA,et al. Suppression of lung tumor growth and metastasis in mice by adeno-associated virus-mediated expression of vasostatin.Clin Cancer Res,2008, 14(3): 939–949.
[39] Li H, Li X, Xu R,et al. Adeno-associated virus-mediated pancreatic and duodenal homeobox gene-1 expression enhanced differentiation of hepatic oval stem cells to insulin-producing cells in diabetic rats.J Biomed Sci,2008, 15(4): 487–497.
[40] Hauck B, Xu R, Xie J,et al. Efficient AAV1-AAV2 hybrid vector for gene therapy of hemophilia.Hum Gene Ther,2006, 17(1): 46–54.
[41] Manno CS, Pierce GF, Arruda VR,et al. Successful transduction of liver in hemophilia by AAV-Factor IX and limitations imposed by the host immune response.Nat Med, 2006, 12(3): 342–347.
Progress in application of targeting viral vector regulated by microRNA in gene therapy: a review
Guohai Zhang1, Qizhao Wang1, Jinghong Zhang1, and Ruian Xu1,2
1Institute of Molecular Medicine,Huaqiao University,Quanzhou362021,China
2Engineering Research Center of Molecular Medicine,Ministry of Education,Quanzhou362021,China
Received:January 5, 2010;Accepted:March 15, 2010
Supported by:National High Technology Research and Development Program of China (863 Program) (No. 2008AA02Z135), National Natural Science Foundation of China (No. 30900822).
Corresponding author:Ruian Xu. Tel/Fax: +86-595-22690952; E-mail: ruianxu@hqu.edu.cn
国家高技术研究发展计划 (863计划) (No. 2008AA02Z135),国家自然科学基金 (No. 30900822) 资助。

