SYBR Green I荧光RT-PCR法检测贝类中的诺如病毒
莫雪梅,高东微
1 暨南大学药学院基因组药物研究所,广州 510632
2 广东出入境检验检疫局检验检疫技术中心,广州 510623
生物技术与方法
SYBR Green I荧光RT-PCR法检测贝类中的诺如病毒
莫雪梅1*,高东微2*
1 暨南大学药学院基因组药物研究所,广州 510632
2 广东出入境检验检疫局检验检疫技术中心,广州 510623
针对诺如病毒II型的保守区域设计引物,建立了SYBR Green I实时荧光RT-PCR检测诺如病毒II型的反应体系。此方法的病毒检测下限达到102拷贝,标准曲线的线形范围为102~106拷贝,相关系数为0.9952,斜率为−2.982,截距为35.84。对诺如病毒II型检测特异,与轮状病毒、腺病毒、甲肝病毒、星状病毒无交叉反应。针对质粒标准品检测的批内试验变异系数 (CV) 为0.95%~1.69% (n=5),批间试验CV为0.87%~1.24% (n=3)。运用此方法随机检测30份贝类水产品,检测出2份阳性样品。结果表明,SYBR Green I荧光RT-PCR检测诺如病毒II型的方法灵敏、特异、重复性好,可应用于贝类水产品的快速检测。
诺如病毒 II型,SYBR Green I荧光 RT-PCR,检测
Abstract:We set up an SYBR Green I real-time RT-PCR method for the detection of genogroup II Norovirus, and this method’s primers were encompassed the conservative region of Norovirus II. The limit of the detection was 102copies. The standard curve’s linear range was 102–106copies, correlation coefficient was 0.9952, the slope was −2.982, and the intercept was 35.84. This method possessed specificity for genogroup II Norovirus, without any cross-reaction with rotavirus, adenovirus, hepatitis A virus or astrovirus. The coefficients of variation (CV) of theCtvalues of the standard plasmid were 0.95%–1.69% (n=5) in intra-assay and 0.87%–1.24% (n=3) in inter-assay. We used this method to detect 30shellfish samples, and found 3 samples were positive. This method is sensitive, specific and reliable for Norovirus II. It can be used to detect the Norovirus II in the shellfish rapidly.
Keywords:Norovirus II, SYBR Green I real-time RT-PCR, detection
诺如病毒(Norovirus,NVs) 是人类急性非菌性胃肠炎的最主要病原。近年来,诺如病毒引发的大规模肠胃炎事件在世界范围内频繁爆发[1-3],已成为威胁公共卫生安全的重要因素之一。由于水环境的污染,作为滤食性水生动物的贝类,很容易从污染的水中富集大量食源性病毒。当人们生食含有诺如病毒的贝类时,极有可能因感染病毒而诱发急性肠胃炎。因此,建立贝类水产品中诺如病毒的快速检测方法,对于保障食品安全非常重要。
诺如病毒根据其 RNA多聚酶区 (RDRP) 和衣壳蛋白编码区核苷酸和氨基酸序列特征,可被分为5个遗传组 (GG I~V),其中GG I、GG II和GG IV型可以感染人类[4-5]。流行病学调查结果表明,GG II是世界范围内最常见的基因型。我国病人感染的诺如病毒也以GG II为主,GG I及GG IV型较为罕见。
由于诺如病毒迄今尚未能在细胞内培养,在早期研究中,电镜是其唯一的检测手段,导致食品中相对微量的病毒检测十分困难。近年来,随着分子生物学技术的发展,RT-PCR技术已广泛应用于食品中诺如病毒的检测[6-8]。但是,RT-PCR技术仍存在灵敏度不高以及易发生交叉污染等不足。
实时荧光定量PCR是近年新兴的分子生物学技术,具有直观、敏感性高、重复性好、可定量、速度快、操作简便和污染少等优点,已经在病毒、微生物、肿瘤基因检测等方面取得许多成果[9-11]。Real-time PCR技术主要有TagMan 探针法和SYBR green I 染料法[12-13]。SYBR Green I染料法主要是利用SYBR Green I荧光染料与双链DNA分子结合发光的特性来指示扩增产物增加,其荧光信号的增强与PCR产物的增加完全同步。SYBR Green I染料法的优势是无需另外设计荧光探针,设计的程序通用性好,且价格相对较低。因此,为了提高我国对水产品中诺如病毒的检测水平,加强对诺如病毒疫情的预防和控制,本实验建立了可用于贝类水产品快速检测GGII型诺如病毒的SYBR green I Real-time PCR方法。
1 材料和方法
1.1 酶和试剂
Viral RNA MiNi Kit购自美国QIAamp公司。逆转录酶AMV、ddH2O、RNA酶抑制剂、DNA聚合酶、10×PCR缓冲液购自大连宝生物工程有限公司。小量质粒抽提试剂盒和 DNA提取试剂盒均购自北京天根生化科技有限公司。20×SYBR Green I购自美国Invitrogen公司。引物由上海英骏生物技术有限公司合成。Agarose Gel DNA Purification Kit和pMD18-T载体购自TaKaRa公司。其余试剂均为国产或进口分析纯。
1.2 材料
诺如病毒 II型的质粒标准品由广州市儿童医院检验科馈赠。甲型肝炎减毒活疫苗由暨南大学社区医疗服务中心提供。轮状病毒、腺病毒、星状病毒阳性粪便标本由广东省妇幼保健院提供。抽查的 30份贝类水产品样品于广州市多个农贸市场随机采集。
1.3 标准品的制备
将诺如病毒II型质粒转化大肠杆菌Escherichia coliTop 10菌株,扩增后用小量质粒抽提试剂盒提取,用紫外分光光度计测A260值定量,用ddH2O调整至 1×1010拷贝/µL,−20℃保存备用。
1.4 SYBR Green I荧光RT-PCR法的建立
1.4.1引物的设计
根据目前GenBank中所有的诺如病毒cDNA序列,用DNAStar软件进行同源性比对,选择高度保守区域。用Primer Premier 5.0软件,选择比较保守的诺如病毒II型的RNA依赖的RNA多聚酶区与衣壳蛋白区的连接区域作为靶向扩增区域,设计出荧光定量PCR引物。上游引物:5′-TCTATGTATGGA TCGCACTCG-3′;下游引物:5′-GTAGGCAAGTCC ATCAAAGTC-3′。
1.4.2SYBR Green I荧光RT-PCR的反应体系
PCR 反应体系 (20 µL):10× PCR 缓冲液 2 µL,25 mmol/L MgCl22.4 µL,5 mmol/L dNTPs 1.2 µL,20× SYBR Green I 1 µL,上、下游引物 (20 µmol/L)各 0.5 µL,DNA聚合酶 0.5 µL,逆转录酶 AMV 0.25 µL,RNAse 抑制剂 0.4 µL,待测模板 8 µL,超纯水 3.75 µL。
RT-PCR反应条件:42 ℃ 30 min 逆转录。95℃预变性2 min;95℃变性15 s,52℃退火20s,72℃延伸20s,40个循环。于52℃20s退火阶段采集荧光信号。
熔解曲线的分析条件:在荧光实时PCR检测仪Chromo 4 (美国MJ公司) 的系统上,将SYBR Green I荧光实时PCR的产物,设定为从50℃以0.2℃/s的速度缓慢上升至95℃,连续收集荧光信号,系统自动绘制熔解曲线。
1.4.3标准曲线的建立
用10倍系列稀释法处理诺如病毒II型质粒标准品。取 6个浓度梯度 (106、105、104、103、102、101拷贝) 诺如病毒 II型质粒标准品作为模板,以ddH2O作为阴性对照,分别进行SYBR Green I荧光PCR反应。根据诺如病毒荧光实时PCR的动力学曲线,检测仪系统自动生成标准曲线以及回归方程。
1.4.4SYBR Green I荧光RT-PCR的特异性研究
为了检验所建立方法的特异性,我们分别用病毒RNA提取试剂盒提取了轮状病毒、星状病毒阳性粪便标本以及甲型肝炎减毒活疫苗的RNA,用DNA提取试剂盒提取了腺病毒的 DNA,并运用 SYBR Green I荧光RT-PCR体系进行检测。
1.4.5SYBR Green I荧光RT-PCR重复性和准确性的验证
为了确定该反应体系的重复性,分别用 4个不同浓度 (103、104、105、106拷贝) 的质粒标准品进行了批内 (5孔重复试验) 以及批间 (3批重复试验)实验。为了验证此反应体系的准确性,随机抽取 3个荧光 PCR阳性样品的产物,将纯化后的 PCR产物连接到pMD18-T载体上,委托上海英骏生物技术有限公司进行测序。
1.5 SYBR Green I荧光RT-PCR法检测贝类的诺如病毒
1.5.1贝类样品的处理
随机采集 30份贝类水产品样品,种类包括花蛤 (菲律宾帘蛤Ruditapes philippinarum)、生蚝 (牡蛎Oyster)、扇贝Placopecta magellanicus、贻贝Mytilus edulis、河蚬Corbicula fluminea。其中,花蛤、贻贝的规格约为20 g/个;生蚝、扇贝、河蚬的规格约为100~200 g/个。解剖取下贝类中的肠道组织,取1.5 g样品加入15 mL Tris-HCl缓冲液(0.05 mol/L,pH 7.4),冰上匀浆。将匀浆液置于50 mL离心管中,37℃温育30 min。4℃、5 000× g离心20 min,收上清液至一新管。按上清液量的10%浓度添加PEG-8000,添加NaCl至终浓度为0.4 mol/L,4℃过夜。次日,离心取沉淀 (10 000× g,5 min,4℃),向沉淀中加入10 mL Tris-HCl缓冲液,充分溶解后加等量氯仿,室温振荡30 min,离心 (2 000×g,30 min,4℃),取上层水相,−20℃保存待检。
1.5.2贝类样品病毒RNA的提取
将以上处理后的样品液,用病毒RNA提取试剂盒进行常规RNA提取,提取的RNA立即进行SYBR Green I荧光RT-PCR反应。
1.5.3运用SYBR Green I荧光定量RT-PCR方法检测样品
以提取的病毒RNA作为待测模板,按照以上建立的方法进行检测。通过样品在荧光实时PCR检测仪上生成扩增曲线的Ct值,判断样品阴性或阳性。
2 结果
2.1 SYBR Green I荧光RT-PCR反应体系的建立
不同浓度的诺如病毒II型质粒标准品的动力学曲线见图1。结果显示,浓度在102拷贝以上的标准品有明显的荧光增长,而 101拷贝和阴性对照均无荧光增长,因此该荧光 RT-PCR检测体系的病毒检测下限为102拷贝。
在Chromo 4荧光实时PCR检测仪上结束扩增后,用系统上Opticon Monitor (version 3.1) 软件进行分析,以起始模板的对数为x轴,以Ct值为y轴作回归曲线,即得诺如病毒检测的标准曲线 (图2)。该标准曲线的相关系数为 0.9952,斜率为−2.982,截距为35.84。标准曲线在102~106拷贝范围内呈现良好的线形关系。
2.2 SYBR Green I荧光RT-PCR的特异性
从图3中质粒标准品的荧光RT-PCR熔解曲线分析,浓度在 102~106拷贝的质粒的 PCR产物熔解峰特异,Tm值为85℃±0.1℃,没有其他明显的杂峰出现;浓度为 101拷贝的质粒以及阴性对照均没有出现溶解峰。说明没有产生由引物二聚体引起的假阳性扩增信号,反应体系的特异性高。
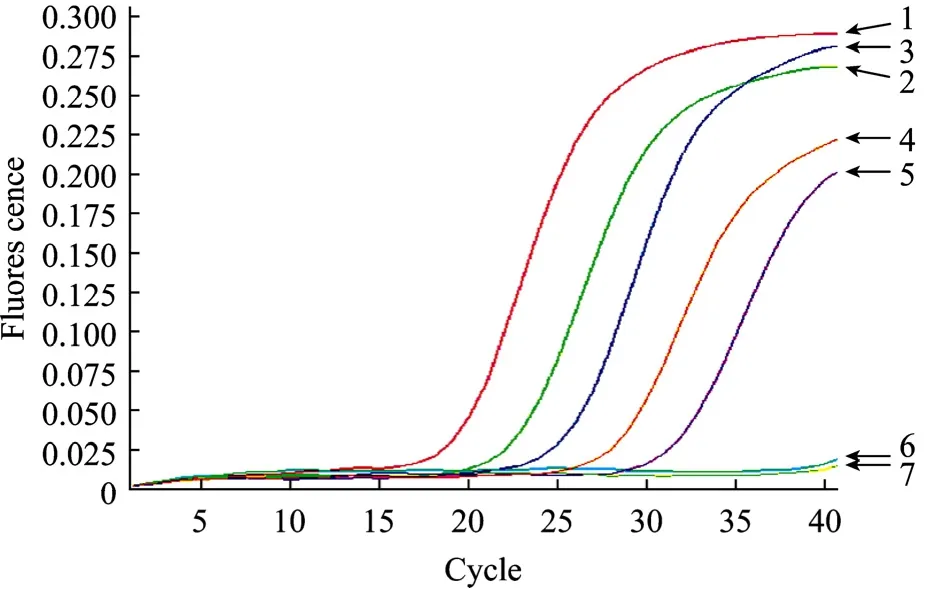
图1 SYBR Green I荧光定量PCR法的动力学曲线Fig.1 Dynamic curve of the real-time RT-PCR for Norovirus.1–6: GII Norovirus plasmid standards containing from 106to 101copies per reaction; 7: negative control.
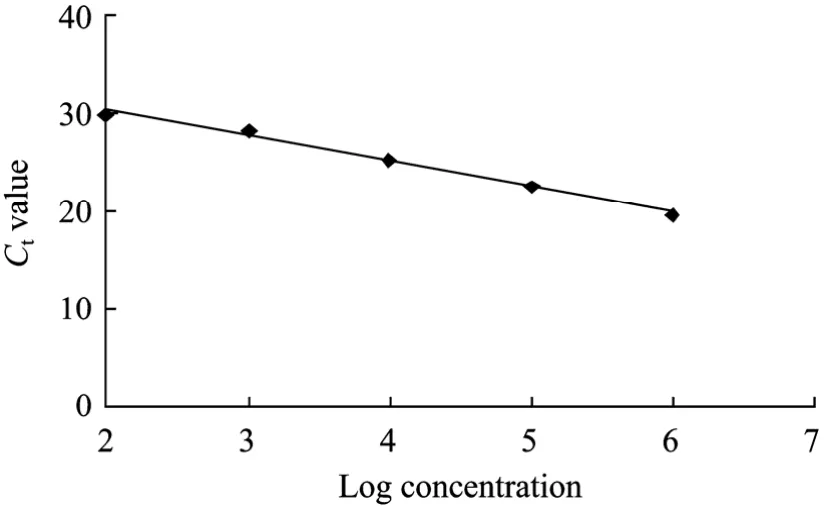
图2 SYBR Green I荧光定量PCR法的标准曲线Fig.2 Standard curve of the real-time RT-PCR for Norovirus.
从图4中不同病毒的扩增曲线可以看到,只有诺如病毒II型质粒标准品有明显的荧光增长,其他病毒 (包括轮状病毒、腺病毒、星状病毒、甲型肝炎病毒) 均无荧光增长,说明该方法能特异扩增GG II诺如病毒。
2.3 SYBR Green I荧光PCR检测的重复性和准确性
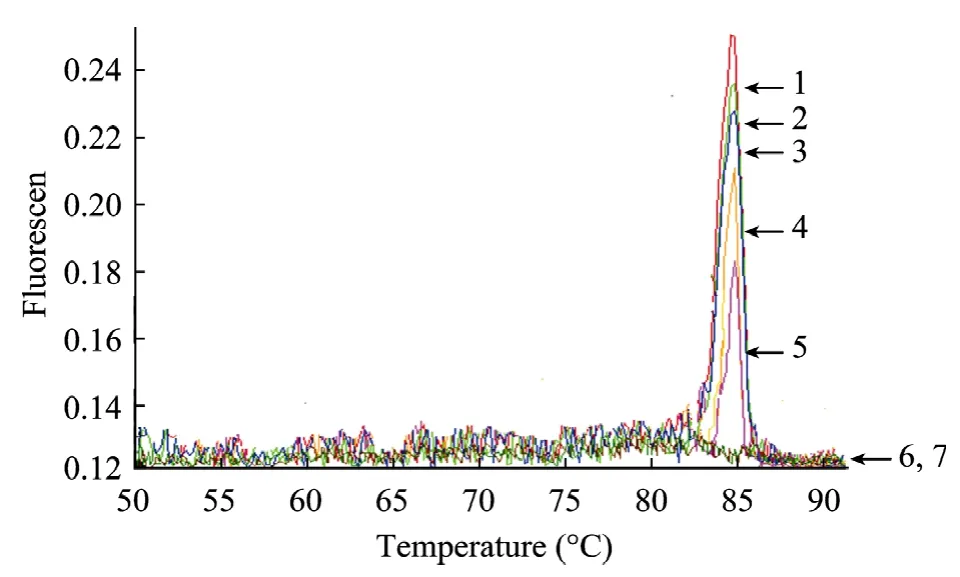
图3 SYBR Green I荧光定量PCR法的熔解曲线Fig.3 Melting curve of the real-time RT-PCR for Norovirus.1–6: GII Norovirus plasmid standards containing from 106to 101copies per reaction; 7: negative control.

图4 SYBR Green I荧光定量RT-PCR体系对不同病毒的扩增曲线Fig.4 Amplification curves of the real-time RT-PCR system for different viruses. 1: GII Norovirus plasmid standard; 2:rotavirus; 3: hepatitis A virus; 4: adenovirus; 5: astrovirus.
表1中的数据显示,4个不同浓度的质粒标准品(106、105、104、103拷贝) 所进行的批内试验 (n=5) 的Ct值变异系数 (CV) 分别为1.02%、1.69%、0.95%、1.13%,批间试验 (n=3) 的Ct值变异系数 (CV) 分别为0.90%、1.18%、1.24%、0.87%。上述结果表明,在相同实验条件下,SYBR Green I荧光PCR检测体系的重复性好。随机抽取3个阳性PCR产物进行委托测序,测序结果显示全部为GG II型诺如病毒,说明所建立的荧光PCR检测体系准确可靠。
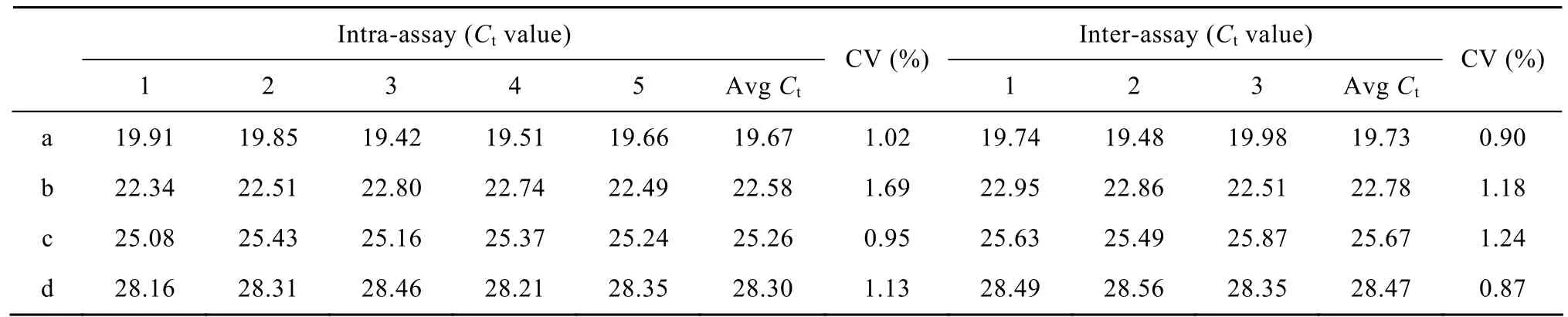
表1 Real-time PCR检测的批内和批间试验的Ct值及其变异系数Table 1Ctvalues and coefficients of variation (CV) of intra-assay and inter-assay of the real-time PCR
2.4 SYBR Green I荧光定量RT-PCR法检测贝类抽样样品
为了评价所建立的荧光 RT-PCR法的实用性,我们运用此方法检测了 30份于广州市多个农贸市场随机采集的贝类水产品。检测结果显示,30份样品中有 2份呈阳性 (7%),均为牡蛎,其Ct值分别为26.95、27.32;其余28份抽样样品呈阴性 (图5)。
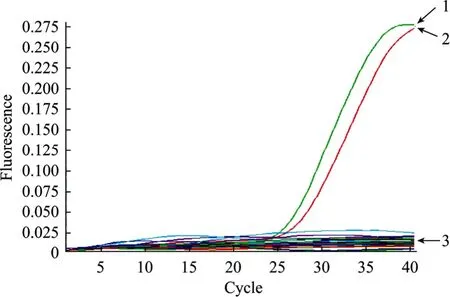
图5 SYBR Green I荧光定量RT-PCR法检测30份抽样水产品的扩增曲线Fig.5 Amplification curves of the real-time RT-PCR system for 30shellfish samples. 1: positive sample (Oyster); 2: positive sample (Oyster); 3: negative samples.
3 讨论
近年来,诺如病毒感染日益成为一个全球范围内重要的公共卫生问题。受污染的贝类是诺如病毒一个重要传染源。因此,建立贝类中诺如病毒灵敏的检测方法,对于保障人们的健康和预防疫情的爆发具有重要意义。本实验采用SYBR green I染料法建立了诺如病毒的荧光RT-PCR检测体系。
SYBR Green I浓度是影响实验的关键因素之一,如果浓度过低会导致荧光信号强度不够;而过高浓度则会抑制PCR反应[14]。本实验所用的SYBR Green I染料为美国Invitrogen公司产品,生产商建议SYBR Green I终浓度为1×。此外,本文所建立的反应体系中,Mg2+浓度达到 3 mmol/L,高于常规RT-PCR体系中Mg2+浓度 (0.5~2.0 mmol/L),适当提高Mg2+浓度可以有效降低SYBR Green I对PCR反应的抑制作用。
引物二聚体引起的荧光信号会对结果产生较大影响,必须尽量消除引物二聚体的干扰。提高退火温度可消减二聚体产生,但同时也会导致扩增效率下降[15]。本实验在查阅文献[16]以及预实验的基础上,最终将退火温度设定为52℃。SYBR green I 荧光定量PCR理想扩增产物应在100 bp以下[17],本实验所设计的引物选择了诺如病毒II型保守区域,扩增片段长度为95 bp,符合此要求。
本实验所建立的 SYBR green I荧光定量RT-PCR法,GG II NVs病毒检测下限达到102拷贝,比常规RT-PCR的灵敏度 (检测下限约103拷贝)[18-19]提高10倍左右。为了实现病毒的富集,水产品需要经过预处理的过程,预处理过程需在4℃过夜的条件下进行。在完成水产品的预处理后,如果采用常规RT-PCR法,从病毒核酸提取到RT-PCR及电泳检测约需要6 h,而采用该方法从病毒核酸提取到完成检测仅需要约3 h。该方法实行闭管式操作,PCR产物不会污染环境。熔解曲线分析表明,反应体系的PCR产物熔解峰特异,没有明显的杂峰出现,基本消除引物二聚体的干扰。特异性实验表明,该方法对诺如病毒II型检测特异,与轮状病毒、腺病毒、甲肝病毒、星状病毒无交叉反应。针对质粒标准品检测的批内试验和批间试验表明,所建立的检测体系重复性好。运用此SYBR green I荧光定量RT-PCR检测每份样品的成本约为25元 (人民币),比TagMan探针法价格更适宜。因此,本实验所建立的SYBR green I荧光定量RT-PCR法具有灵敏、快速、特异、稳定、经济的优点,可适用于大规模水产品中诺如病毒II型的检测。
REFERENCES
[1] Tan M, Jiang X. Norwalk viruse gastroenteritis, increased understanding and future antiviraloptions.Curr Opin Investig Drugs, 2008, 9(2): 146–151.
[2] Esteve GA, Navarro RG, Sala MR,et al. Outbreak of gastroenteritis by Norwalk virus in nursing home.Med Clin, 2008, 130(3): 117–125.
[3] Esteve GA, Navarro RG, Sala MR,et al.Recombinant norwalk viruse implicated in gastroenteritis outbreaks in Hiroshima Prefecture.J Med Virol, 2008, 80(5):921–928.
[4] Ando T, Noel JS, Fankhauser RL. Genetic classification of“Norwalk-like viruses”.J Infect Dis, 2000, 181(l2):336–348.
[5] Goodgame R. Norwalk viruse gastroenteritis.Curr Gastroenterol Rep, 2006, 8(5): 401–408.
[6] Marshall JA, Bruggink LD. Laboratory diagnosis of Norwalk viruse.Clin Lab, 2006, 52(11): 571–581.
[7] Igor VK, Irina AA, Alan M,et al. 3′-Minor groove binder-DNA probe increase sequence specificity at PCR extension temperatures.Nucleic Acids Res, 2000, 28(2):655–661.
[8] Jiang X, Huang PW, Zhong WM,et al. Design and evaluation of a primer pair that detects both Norwalk- and Sapporo-like caliciviruses by RT-PCR.J Virol Methods,1999, 83(1/2): 145–154.
[9] Hua R, Tanaka Y, Fukai K,et al. Rapid detection of the hepatitis B virus YMDD mutant using TagMan-minor groove binder probes.Clin Chim Acta, 2008, 395(1/2):151–154.
[10] Schmidtke G, Groettrup M. Identification of homozygous transgenic mice by genomic real-time PCR.Methods Mol Biol, 2008, 429: 45–58.
[11] Vinje J, Vennema H, Maunula L,et al. International collaborative study to compare reverse transcriptase PCR assays for detection and genotyping of noroviruses.J Clin Microbiol, 2003, 41(4): 1423–1433.
[12] Jothikumar N, Kang G, Hill VR. Broadly reactive TagMan assay for real-time RT-PCR detection of rotavirus in clinical and environmental samples.J Virol Methods,2009, 155(2): 126–131.
[13] Catriona L, John J, Niamh S,et al. Real-time reverse transcription PCR detection of norovirus, sapovirus and astrovirus as causative agents of acute viral gastroenteritis.J Virol Methods, 2007, 146(2): 36–44.
[14] Shou L, Guangyu H, Qingye Z,et al. A SYBR Green I real-time RT-PCR assay for detection and differentiation of influenza A (H1N1) virus in swine populations.J Virol Methods, 2009, 162(2): 184–187.
[15] Santhosh SR, Parida MM, Dash PK,et al. Development and evaluation of SYBR Green I-based one-step real-time RT-PCR assay for detection and quantization of Japanese encephalitis virus.J Virol Methods, 2007, 143(1): 73–80.[16] Kong LL, Omar AR, Bejo MH,et al. Development of SYBR Green I-based one-step real-time RT-PCR assay for the detection and differentiation of very virulent and classical strains of infectious bursal disease virus.J Virol Methods, 2009, 161(2): 271–279.
[17] Marino JH, Cook P, Miller KS. Accurate and statistically verified quantification of relative mRNA abundances using SYBR Green I and real-time RT-PCR.J Immunol Methods, 2003, 283(2): 291–306.
[18] Hewitt J, Bell D, Simmons GC,et al. Investigation of a waterborne norovirus outbreak in a New Zealand ski resort.Appl Environ Microbiol, 2007, 154(3): 718–723.
[19] Scott TM, Rose JB, Jenkins TM,et al. Microbial source tracking: current methodology and future directions.Appl Environ Microbiol, 2002, 68(12): 5796–5803.
SYBR Green I real-time polymerase chain reaction for detection of Norovirus II in the shellfish
Xuemei Mo1*, and Dongwei Gao2*
1Institute of Genome Medicine,Jinan University,Guangzhou510632,China
2Guangdong Inspection and Quarantine Technology Center,Guangzhou510623,China
Received:January 5, 2010;Accepted:March 23, 2010
Supported by:Scientific and Technological Project of Guangdong Province (No. 2005B20401017), Scientific and Technological Project of Guangdong Inspection and Quarantine Office (No. 2005AGDK28).
Corresponding author:Dongwei Gao. Tel/Fax: +86-20-33320663; E-mail: mxm200101@163.com
*These authors contributed equally to this study.
广东省科技攻关项目 (No. 2005B20401017),广东检验检疫局科技项目 (No. 2005AGDK28) 资助。

