日本脑炎病毒C蛋白对其复制子载体自主复制活性的影响
黄莺,刘珊,杨鹏,王超,杜韫,孙志伟,俞炜源
1 军事医学科学院生物工程研究所 蛋白质工程研究室,北京 100071
2 中国人民解放军第二炮兵总医院病理科,北京 100088
医学与免疫生物技术
日本脑炎病毒C蛋白对其复制子载体自主复制活性的影响
黄莺1*,刘珊2*,杨鹏1,王超1,杜韫1,孙志伟1,俞炜源1
1 军事医学科学院生物工程研究所 蛋白质工程研究室,北京 100071
2 中国人民解放军第二炮兵总医院病理科,北京 100088
为了研制具有高效自主复制能力的日本脑炎病毒 (JEV) 复制子载体,验证其作为新型复制子疫苗载体的可能性。以保留全长核心蛋白C基因的JEV复制子载体pCTCJEV为基础,通过PCR的方法减短C蛋白的部分基因序列,分别保留 C23和 C68位氨基酸,以Lac Z基因作为报告基因,构建了 C基因长短不同的 JEV复制子载体pCMW-2M-1LACZ、pCMW-2M-3LACZ。将复制子载体转染表达JEV结构蛋白的细胞系CME-4,通过Lac Z的表达检测JEV复制子载体表达外源蛋白的能力,反映了JEV的系列复制子载体的自主复制能力。结果保留C基因全长,C68、C23的复制子载体表达外源蛋白的能力相当,以上结果说明仅仅保留C蛋白的69个核苷酸即可保留JEV复制子载体的自主复制能力,为进一步优化JEV复制子载体,将该载体开发研制成为高效表达外源蛋白的疫苗载体提供了依据。
JEV,C蛋白,复制子载体
Abstract:To optimize a self-replicate Japanese enciphalitis virus (JEV) replicon, and to make it as an efficient vector to express the heterologous protein, we constructed three JEV replicons by PCR-based shortening the length of capsid genes. The vectors remained full or part of C gene, based on the JEV replicon pCTCJEV.Lac Zwas selected as the reporter gene to verify the self-replicate ability of these DNA-based replicons. While transfected into the cell lines CME-4, which continuously expressing the JEV structure proteins C-prM-E, the JEV replicons pCMW-2M-1LACZ, pCMW-2M-3LACZ, which remained the first 23aa and 68aa of C protein, can express the reporter protein as the same level as pCMW-2M-LACZ with the full-length C protein.These results illustrated that the JEV replicon vector with 69-nt of the C gene can retain the self-replicate ability, and provide valuable tools to construct a possible vector for a long-lasting JEV RNA virus expression system.
Keywords:Japanese enciphalitis virus (JEV), C protein, replicon vector
黄病毒属病毒成员属于 (+) RNA病毒,其基因 组的显著特性是具有自主复制能力和感染性,裸RNA进入敏感细胞后,能够大量自主复制,并且进一步翻译成相应的病毒蛋白,在胞内包装成为完整的病毒颗粒[1]。黄热病毒复制子通常指将基因组上的结构基因部分切割下来,而保留完整的非结构蛋白基因,这样的亚基因组RNA也保留了自主复制能力,其不但能够表达自身非结构蛋白,而且能够表达保留的部分结构蛋白和/或添加的外源蛋白。理论上讲,这种亚基因组的复制能力等同于完整的基因组,在复制过程中,正链RNA呈指数级增加。如果在这种复制子中插入外源基因,随着复制子RNA在细胞胞浆内大量扩增,就使得外源基因得到有效表达,因此,复制子可作为表达外源基因的良好载体[2-4]。
本研究即在以往构建的 JEV复制子载体pCTCJEV基础上[5],对其进行进一步优化。pCTCJEV是删除JEV基因组的结构基因prM和E基因,而保留JEV结构蛋白区域C基因全长的复制子载体,经证实该载体有自主复制能力,并且能够有效表达非结构蛋白以及外源蛋白。在此基础上,我们通过PCR的方法减短C基因的长度,分别保留C23和C68位氨基酸,构建了pCMW-2M-1LAC、pCMW-2M-3LAC。将复制子载体转染稳定表达JEV结构蛋白的细胞系CME-4[6],通过Lac Z报告基因,检测复制子载体的表达外源蛋白的能力,反映了JEV复制子载体的自主复制能力。结果显示保留C68、C23的复制子载体和保留全长C基因的复制子载体表达外源蛋白的能力相当,说明仅仅保留C基因的69个核苷酸即可保留JEV复制子载体的自主复制能力,为我们进一步优化JEV复制子载体,将该载体开发研制成为高效表达外源蛋白的疫苗载体提供了依据。
1 材料与方法
1.1 材料
质粒提取试剂盒、胶回收试剂盒、限制性内切酶EcoRⅠ、Hind Ⅲ和Prime star聚合酶等均购自大连宝生物工程有限公司。引物由上海生物工程技术服务有限公司合成。LipofectamineTM2000脂质体试剂盒、β-Gal staining kit购自Invitrogen公司。pMW118质粒购自 Nippon Gene。pcDNA3.1、pBR-JTF、pCTCJEV、pCMV-Lac为本室保存或构建。
1.2 复制子载体pCTCJEV的优化
以低拷贝pMW118质粒载体为基础进行改造,首先设计两条含有SalI-SacI-BamH I-MluI-KpnIXbaI-EcoR I多克隆位点 (MCS) 的寡核苷酸序列D118和P118,用于构建一个衔接头,通过SalI/EcoR I酶切位点克隆到质粒载体pMW118中,构建重组质粒 pMW-118L。以质粒 pcDNA3.1为模板,用引物pPCMV和引物pSCMV通过PCR扩增出长为607 bp的CMV序列。通过SphI/SalI酶切位点克隆到质粒载体pMW-118L中,构建质粒pCMW-118L。以 pCTCJEV为模板,用引物 pT1L/dXFMDV通过PCR扩增出长557 bp的片段。以pCTCJEV为模板,用引物pX2MUN/dxMUN通过PCR扩增出长约1 515 bp的片段。BsaI酶切两PCR产物,连接后将连接产物片段纯化,以该连接物为模板,引物pT1L/dxMUN扩增约2 054 bp片段。通过SalI/MfeI酶切后亚克隆到 pBR-JTF中,构建重组质粒pBR-2M,进一步通过SalⅠ/XbaⅠ双酶切将pBR-2M的复制子片段连接到质粒载体 pCMW-118L中,构建以原载体为基础的优化载体 pCMW-2M (上述所用引物序列见表1)。

表 1 构建优化复制子载体 pCMW-2M 以及其衍生载体所需引物Table 1 Primers for optimization of the JEV replicon vectors
1.3 含报告基因Lac Z的复制子载体的构建
以质粒 pCMV-Lac为模板,用引物 plac/dlac,通过PCR扩增Lac Z报告基因序列,利用XhoⅠ和BsrGⅠ酶切位点将报告基因Lac Z插入JEV复制子pCMW-2M中,得到重组质粒pCMW-2M-LAC。
1.4 以C基因长度不等为区别,进行复制子载体的构建
以pCMW-2M-LAC为基础,利用PCR方法减短 JEV C基因,通过 pTR1/dTR1、pTR1/dTR3引物组合,以pCMW-2M-Lac为模板,分别扩增出190 bp、328 bp片段,通过SalI/XhoI酶切位点亚克隆到质粒pCMW-2M-LAC中,构建以C基因长短不同为区别的系列表达LacZ的复制子载体pCMW-2M-1LAC、CMW-2M-3LAC。
1.5 复制子载体转染细胞系BHK-21、CME-4以及放大培养
将3种pCMW-2M-LAC载体用XbaI线性化,纯化后用脂质体法分别转染六孔板中的 BHK-21细胞,以及表达JEV结构蛋白的细胞系CME-4,转染CME-4后第4天后收集培养上清,取1/10体积的上清液体分别进一步感染细胞系 CME-4及正常BHK-21细胞,吸附1~4 h后,更换加5% FCS的MEM培养基继续培养,感染的同时将原细胞固定原位染色,检测LacZ的表达情况,以同样的方法感染CME-4细胞系培养假病毒颗粒,进一步放大培养2~4代,每一代细胞均进行Lac Z的表达检测。
1.6 原位染色检测Lac Z的表达
质粒转染细胞或者假病毒颗粒PIPs感染细胞后第4天,收集上清,PBS冲洗细胞2~3次,常温下,细胞用19∶1的甲醇:醋酸固定液进行固定10 min,PBS 冲洗细胞 2次。按照β-Gal staining kit(Invitrogen) 说明书配制染色溶剂,六孔板每孔加染色液2.5 mL,37℃孵育0.5~2 h,光镜下观察细胞蓝染情况,计算细胞蓝染率,70%甘油封闭染色后的细胞各孔,4℃下可以长期保存。
2 结果
2.1 复制子载体的优化
pMW-118是一个低拷贝载体,低于10个拷贝/细菌,研究发现[7]该载体插入长片段的外源基因,在细菌中依旧比较稳定。为了JEV复制子载体更方便地插入外源基因,首先我们对原载体pMW-118进行改造,将一个衔接头插入到载体中,引入的这段序列包含一个多克隆位点 (MCS),改造的质粒命名为pMW-118L。同时为了构建DNA/RNA based 双启动子的复制子载体,以质粒pcDNA3.1为模板,PCR扩增出真核启动子CMV序列。通过SphI/SalI酶切位点克隆到质粒载体 pMW-118L中,构建质粒pCMW-118L,重组质粒测序结果和实验预期设计一致。进一步利用PCR的方法对原复制子载体进行优化改造 (图 1),在原复制子载体 pCTCJEV的 C-E基因的衔接处,添加XhoI/BsrG I酶切位点,以方便外源基因的插入,同时在外源基因的插入点 3′端位置加入FMDV 2A序列,以保证外源蛋白的正确切割,最终构建优化后的复制子载体 pCMW-2M,以下含报告基因的复制子载体以及不同长度C基因的复制子载体均以此为基础进行构建。
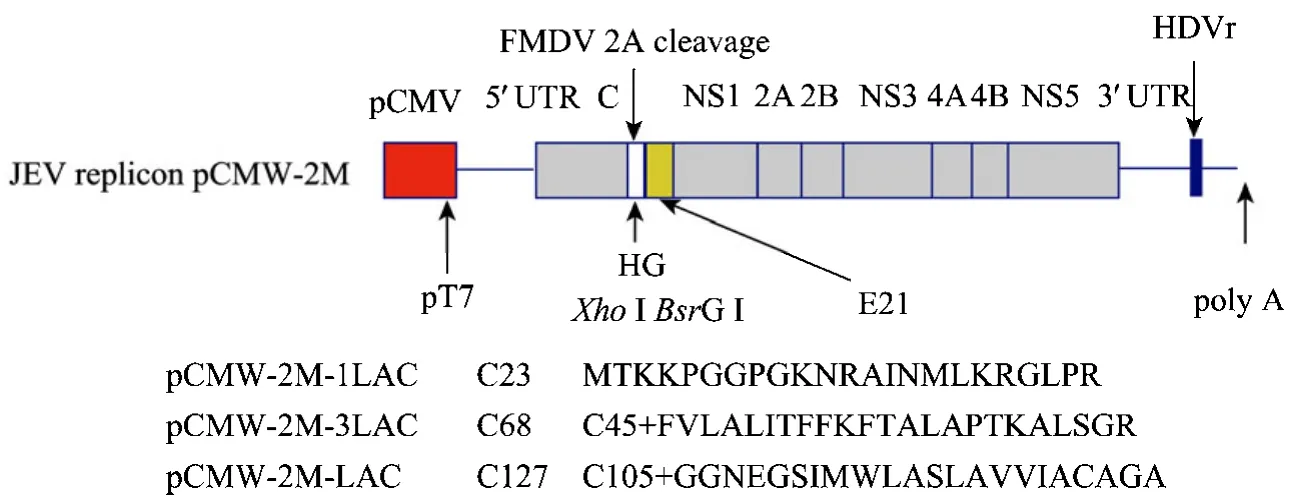
图1 含报告基因Lac Z的系列复制子载体的构建示意图Fig.1 Schematic diagram of the three JEV replicons including the reporter geneLac Z.
2.2 含报告基因Lac Z的系列复制子载体的构建
Lac Z报告基因长3 057 bp,通过PCR的方式从pCMV-Lac质粒中获得,利用XhoⅠ/BsrGⅠ酶切位点插入 JEV复制子 pCMW-2M 中,得到重组质粒pCMW-2M-LAC。进一步利用PCR方法减短JEV C基因,构建以 C基因长短不同为区别的系列表达Lac Z的复制子载体pCMW-2M-1LAC,pCMW-2M-3LAC (图1),C蛋白分别保留23、68位氨基酸,经过酶切鉴定酶切图谱正确,测序结果和实验设计一致。
2.3 复制子载体 pCMW-2M-LAC转染 BHK-21细胞
将复制子载体 pCMW-2M-LAC线性化后转染BHK-21细胞,同时设立一孔未作转染的正常BHK-21细胞作为阴性对照。转染4 d后X-Gal原位染色检测β-半乳糖苷酶活性。从图2中可以看出,复制子载体转染细胞后有Lac Z的表达,但是阳性细胞较少,表达量不均一。重复实验显示同样的结果,增加转染的DNA量或者采用电转的方式转染复制子载体,阳性细胞率会有所提高,但是最高不会超过10%。
2.4 复制子载体 pCMW-2M-LAC转染细胞系CME-4、CME-17
细胞系CME-4、CME-17是能稳定表达JEV结构蛋白C-prM-E的细胞系[6],将复制子载体pCMW-2M-LAC转染包装细胞系CME-4以及CME-17后,Lac Z的阳性率和表达量都有了明显提高,如图3所示,在12孔板中1.6 µg的pCMW-2M-LAC线形化质粒DNA转染结构蛋白细胞系CME-4后,有20%左右的细胞表达LacZ,部分细胞蓝染明显,提示表达量非常高。一方面证实了JEV复制子载体具有良好的复制能力,同时证实了表达JEV结构蛋白的细胞系具有包装JEV复制子载体形成假病毒颗粒的能力。由于Lac Z基因约3.1 kb,构建的包装细胞系可以将其包装成为重组的假病毒颗粒,这也提示将来利用复制子载体系统生产假病毒颗粒疫苗PIPs时,复制子载体可以承载的外源基因的长度至少可以达到3 kb。
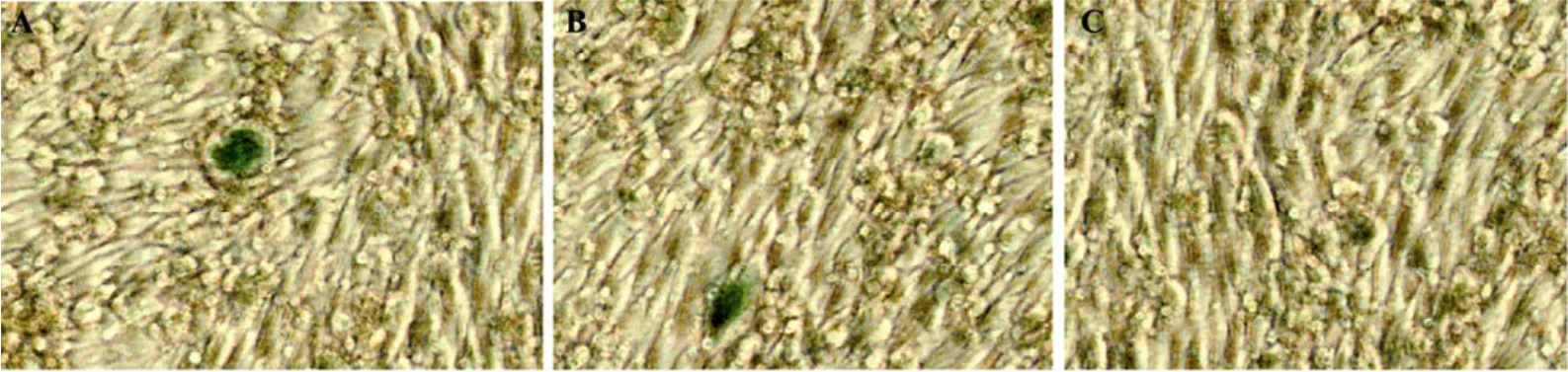
图2 X-Gal原位染色法检测复制子载体中Lac Z基因在BHK-21细胞中的表达Fig.2 Expression of theLac Zgene in JEV replicon vector pCMW-2M-LAC by X-GAL in-situ staining. (A) Expression of theLac Zgene of pCMW-2M-LAC in BHK-21 cells. (B) Repeated assay of A. (C) negative BHK-21 cells.
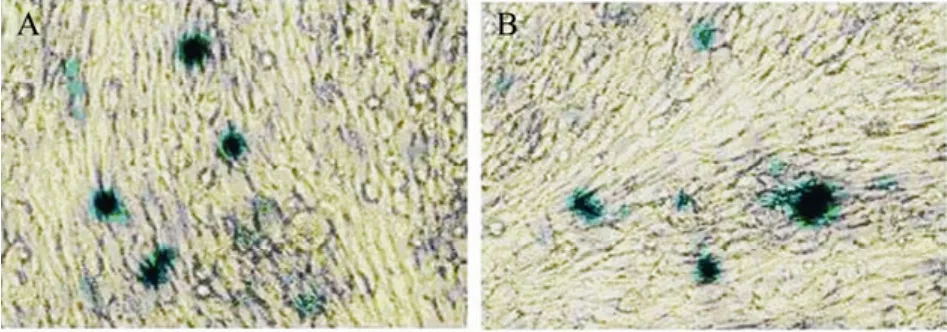
图3 X-Gal原位染色法检测LacZ在细胞系中的表达Fig.3 Expression of theLac Zgene by JEV replicon vector pCMW-2M-LAC in cell lines CME-4 and CME-17. Expression of theLac Zgene at Day 4 after transfecting replicon pCMW-2M-LAC into the cell lines CME-4(A) and CME-17(B).
2.5 复制子载体 pCMW-2M-1LAC、CMW-2M-3LAC转染CME-4以及假病毒颗粒的放大培养
将3种pCMW-2M-LAC复制子载体转染包装细胞系CME-4后,4 d后检测Lac Z的表达情况。并且为检测JEV假病毒颗粒的存在,将原代培养上清继续感染细胞系,培养 4 d后,检测被感染的下一代细胞系中Lac Z的表达,再进一步将含假病毒颗粒的上清感染下一代,由图4可以看出第二代细胞系中约有 50%左右的细胞表达 Lac Z,阳性率较 1代有大幅度地增加,从染色情况看表达量与第一代相当。而用第一代的培养上清感染正常的 BHK-21细胞,阳性率没有进一步增加,表达量也相对较弱。收获第二代的细胞培养上清继续感染细胞系CME-4,阳性细胞率与第二代相似,大部分细胞均蓝染。继续第3次感染后,阳性细胞率下降较明显,表达量和第一代细胞、第二代细胞的检测结果相比较有所下降,在进一步的实验中,我们发现假病毒颗粒能够传代2~3次。根据第一代感染结果,计算假病毒颗粒的滴度为1.2×103U/mL,第二代感染结果计算得到的假病毒颗粒滴度约为1×104U/mL,并且3种复制子载体表达Lac Z的能力相当。
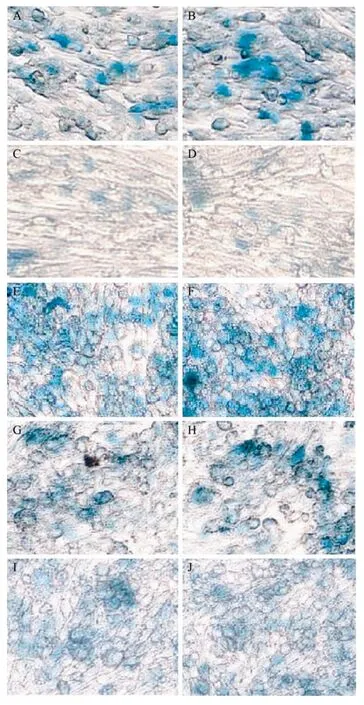
图4 X-Gal原位染色法检测假病毒颗粒的放大培养Fig.4 Expression of theLac Zgene after infecting the JEV PIPs into the cell lines CME-4 for 4 passages. (A, C, E, G, I)The left panel detected the JEV PIPs produced by transfecting pCMW-2M-1LAC into the cell lines CME-4. (B, D, F, H, J) The right panel detected the JEV PIPs produced by transfecting pCMW-2M-3LAC into the cell lines CME-4. Expression of theLac Zgene at Day 4 after infecting CME-4 with the JEV PIPs at passage 1 (A, B); infecting the BHK-21 cells with the JEV PIPs at passage 1 (C, D); infecting CME-4 with the JEV PIPs at passage 2 (E, F); infecting CME-4 with the JEV PIPs at passage 3 (G, H); infecting CME-4 with the JEV PIPs at passage 4 (I, J).
3 讨论
以黄病毒基因组为基础,开发研制病毒载体是目前黄热病度属病毒相关研究中的一个热点,因为黄病毒属的病毒宿主细胞广泛,在多种宿主细胞中感染、复制,相对简单的基因组结构及复制过程使得病毒可在较短时间内多次复制传代,产生高滴度的病毒。研制能够表达外源基因的黄热病毒载体有3种形式:一是嵌合型活病毒载体,原病毒的结构基因部分被同类病毒结构蛋白基因代替,构建嵌合活病毒。目前主要用于构建嵌合型的重组减毒活疫苗,最为成功的是以黄热病毒减毒活疫苗 YF-17D为基础而建立的ChimeriVax技术,以YF-17D为基础与日本脑炎病毒减毒活疫苗SA14-14-2、WNV、DEN等病毒的结构基因进行嵌合,构建了新型疫苗 ChimeriVax-JE、ChimeriVax-WN、ChimeriVax-DEN[8-10],其中 ChimeriVax-JE、ChimeriVax-WN 已经进入了Ⅲ期临床试验。
二是保留原病毒完整的基因组,选择合适的插入位点,将外源基因插入到病毒基因组中,构建重组病毒,通过常规细胞培养,可以将改构的重组活病毒进行放大培养。因为这种重组病毒的构建破坏了原病毒基因组的完整性,能否得到正确包装的活病毒受到外源基因的大小,插入位点的选择等多重因素的影响,目前仅见到少数关于该类重组病毒的报道[11-12]。
三是复制子病毒载体,去除病毒的结构基因部分,插入外源抗原基因,通过反式互补作用,由表达结构蛋白的包装细胞提供复制子载体缺失的结构蛋白,从而包装成假病毒颗粒,在包装细胞中该假病毒颗粒可以获得放大培养。这种复制子载体系统的研究在近10年来也得到广泛的发展,如DENV、YFV、WNV、KUNV、TBEV等的某些病毒株都开发有复制子载体。1997年,Khromykh等以 Kunjin病毒为研究对象,率先进入黄病毒复制子载体研究领域,建立了以KUN为基础的复制子载体系统[2,13]。在研究KUN亚基因组复制子性质时发现,复制子的持续表达并未引起培养细胞的细胞病变,说明KUN的复制对宿主细胞无细胞毒性,使得黄病毒复制子非常适合作为表达外源基因的载体。在此基础上,更多细致而深入的工作随之开展[14-16]。
近几年来,我们一直以JEV SA14-14-2株为基础,开发研制JEV复制子载体系统,首先,我们构建了 JEV复制子载体 pCTCJEV、pCTMJEV,证实了该载体在 BHK-21细胞中能够自主复制并且表达非结构蛋白,插入的外源蛋白 EGFP能够有效地得以表达[5]。在该复制子载体中,我们是将EGFP通过IRES偶联的形式置于JEV基因组3′-UTR的末端构建的双顺反子载体,由于IRES的存在,EGFP的表达量和复制子载体自主复制能力的相关性不能得到很精确的体现。为了提高试验的严谨性,我们进一步改造了JEV复制子,在复制子的结构基因缺失处C基因与NS1基因之间添加了MCS,以方便外源基因的插入,同时添加了FMDV 2A顺式水解元件序列以保证外源蛋白的正确切割,将外源基因和病毒的基因置于同一读码框内。这样避免了以往试验中报告基因通过 IRES序列的偶联插入到于 JEV 3′-UTR后,而不是位于JEV的读码框里,以非帽子依赖的翻译形式进行蛋白的表达。
在黄热病毒复制子的系列研究中,得到的共识是用复制子载体来表达外源基因,报告基因的表达水平和复制子的复制能力成正相关关系,利用报告基因的表达水平来评价载体的复制水平可以取代烦琐的检测基因复制能力的工作,通过报告基因的表达可以更加客观的评价 JEV复制子的自主复制能力,也使得复制子载体能成为一个评价整个黄热病毒基因组复制的重要工具。如Lo等[17]利用WNV复制子插入的报告基因LUC来评价3′-UTR的突变和缺失对 WNV基因组复制能力的影响。本研究中,我们选用的Lac Z作为报告基因来判断系列复制子载体的自主复制能力。
载体的大小和对外源基因的最大包容量是评价复制子载体实用性的一个重要指标,我们在优化JEV复制子载体时,一方面是尽可能地削减JEV基因组序列,在保留亚基因组的自主复制能力的前提下,尽可能减短结构基因的序列,pCMW-2M 复制子载体是保留了C基因的全部序列,以此为基础分别保留C23和C68位氨基酸,进一步构建了pCMW-2M-1LAC、pCMW-2M-3LAC;另一方面,由于EGFP基因相对较短,我们改构了JEV复制子载体后,选择了Lac Z基因,该基因长3 057 bp,观察复制子载体能否容纳较长的报告基因。将pCMW-2M-LAC转染 BHK-21细胞后,经过原位染色能够观察到 β-半乳糖苷酶的表达,证实了JEV复制子载体能够表达较大的外源蛋白的能力,但是Lac Z阳性细胞率较低,不足 5%,这个结果和我们预期的结果相差较大,可能的原因有:1) JEV亚基因组本身的自主复制能力;2) 实验操作等诸多因素的影响,比如转染效率、细胞的敏感程度、细胞的生长状态等。同样的结果也出现在Pang报道的DEN-2复制子载体中,用IFA检测复制子表达非结构蛋白的阳性细胞率不足1%[18]。
复制子载体能够在敏感细胞中自主复制自身基因组,但是由于缺乏结构蛋白,所以不能包装成完整的病毒颗粒。为了检测构建的JEV复制子载体能否在表达JEV结构蛋白的细胞系中包装成假病毒颗粒PIPs,我们将pCMW-2M-LAC转染到CME-4细胞系中,结果在CME-4细胞系中,约20%左右的细胞表达 β-半乳糖苷酶,并且细胞蓝染明显,阳性细胞率提高了4~10倍。将收获的上清再次感染CME-4细胞系后,至第二代时,感染细胞系约有50%的细胞表达 β-半乳糖苷酶,阳性细胞数目增加,表达量与第一代相当;而用第一代的培养上清感染正常的BHK-21细胞,阳性率没有进一步增加,表达量也相对较弱。第 3代感染细胞系后阳性细胞占到一半以上,但从染色结果看表达量要少于第二代。进一步将第3代细胞上清再次感染CME-4细胞系后,染色结果却显示阳性细胞数减少至20%左右,且表达量有所下降。在进一步的实验中,我们发现假病毒颗粒能够传代2~3次。根据第一代感染结果,计算假病毒颗粒的滴度为1.2×103U/mL,第二代感染结果计算得到的假病毒颗粒滴度约为1×104U/mL。
在实验中我们发现,pCMW-2M-1Lac、pCMW-2M-3Lac始终和 pCMW-2M-LAC保持很高的一致性,即JEV复制子载体保留23位的C蛋白氨基酸残基,其复制子载体依旧保留有自主复制能力,并且能够表达至少长约3 kb的外源基因。另外我们发现在PIPs传至第3代时,报告基因表达量有所降低,提示我们携带报告基因Lac Z的假病毒颗粒在传代过程中有可能出现报告基因的丢失,有相关报道提示,在PIPs存在下,复制子在传代过程中选择压力导致外源基因丢失,使报告基因表达量急剧下降。Fayzuli等[19]在建立WNV复制子表达系统时发现,将包含报告基因的复制子载体在包装细胞系上传代时,一代后就有90%以上的报告基因丢失,但是PIPs仍可持续存在。考虑原因可能为在缺乏外源基因的情况下,复制子可维持相对高的复制水平,经过几轮传代后,包含报告基因的复制子全部失去,而单纯的复制子更加适合扩增。插入小片段的报告基因是否更加稳定,得到的PIPs能否稳定传代,这类问题在今后的实验中仍需深入研究。本研究初步探索了JEV复制子载体系统,优化了原来的JEV复制子载体,并且证实了包装大片段Lac Z外源基因的复制子假病毒颗粒的获得,为进一步开发以乙脑病毒复制子为基础的疫苗载体系统打下基础。
致谢:特别感谢中国药品生物制品检定所疫苗一室俞永新院士、董关木研究员、贾丽丽研究员提供实验技术方面的指导。
REFERENCES
[1] Mackenzie JS. Emerging flaviviruses: the spread and resurgence of Japanese encephalitis, West Nile and dengue viruses.Nat Med, 2004, 10: 98−109.
[2] Khromykh AA, Westaway EG. Subgenomic replicons of the flavivirus Kunjin: construction and applications.J Virol, 1997, 71(2): 1497−1505.
[3] Jones CT, Patkar CG, Kuhn RJ. Construction and applications of yellow fever virus replicons.Virology,2005, 331(2): 247−259.
[4] Hayasaka DK, Yoshii K, Ueki T,et al. Sub-genomic replicons of tick-borne encephalitis virus.Arch Virol,2004, 149(6): 1246−1256.
[5] Ying H, Wei S, Lili J,et al. Construction of subgenomic replicon vectors of Japanese encephalitis virus.Chin J Virol, 2007, 23(1): 33−38.
黄莺, 邵炜, 贾丽丽, 等. 日本脑炎病毒 (JEV) 复制子表达载体的构建及其鉴定. 病毒学报, 2007, 23(1):33−38.
[6] Liu S, Huang Y, Yang P,et al. Construction of Mammalian cell lines continuously expressing JEV structural proteins.Chin J Virol, 2009, 25(4): 279−285.
刘珊, 黄莺, 杨鹏, 等. 稳定表达乙脑结构蛋白细胞系的建立. 病毒学报, 2009, 25(4): 279−285.
[7] Mori Y, Okabayashi T, Yamashita T,et al. Nuclear localization of Japanese encephalitis virus core protein enhances viral replication.J Virol, 2005, 79(6): 3448−3458.
[8] Pugachev KV, Guirakhoo F, Trent DW,et al. Traditional and novel approaches to flavivirus vaccines.Int J Parasitol, 2003, 33(5/6): 567−582.
[9] Guirakhoo F, Zhang ZX, Chambers TJ,et al.Immunogenicity, genetic stability and protective efficacy of a recombinant chimeric yellow fever/Japanese encephalitis virus (ChimeriVax-JE) as a live, attenuated vaccine candidate against Japanese encephalitis.Virology,1999, 257: 3634−3672.
[10] Monath TP, McCarthy K, Bedford P,et al. Clinical proof of principle for ChimeriVax: recombinant live, attenuated vaccines against flavivirus infections.Vaccine, 2002, 20:1004−1018.
[11] Mcallister A, Arbetman AE, Mandl S, et al.Recombinant yellow fever viruses are effective therapeutic vaccines for treatment of murine experimental solid tumors and pulmonary metastases.J Virol, 2000, 74(19): 9197–9205.
[12] Bonaldo MC, Garratt RC, Marchevsky RS,et al.Attenuation of recombinant yellow fever 17D viruses expressing foreign protein epitopes at the surface.J Virol,2005, 79(13): 8602−8613.
[13] Harvey TJ, Anraku I, Linedale R,et al. Kunjin virus replicon vectors for human immunodeficiency virus vaccine development.J Virol, 2003, 77(14): 7796–7803.
[14] Molenkamp R, Kooi EA, Lucassen MA,et al. Yellow fever virus replicons as an expression system for hepatitis C virus structural proteins.J Virol, 2003, 77: 1644–1648.
[15] Shi, PY, Tilgner M, Lo MK. Construction and characterization of subgenomic replicons of New York strain of West Nile virus.Virology, 2002, 296: 219–233.
[16] Kofler, RM, Heinz FX, Mandl CW. Capsid protein C of tick-borne encephalitis virus tolerates large internal deletions and is a favorable target for attenuation of virulence.J Virol, 2002, 76: 3534–3543.
[17] Lo MK, Lenches E, Smith K,et al. Functional analysis of mosquito-borne flavivirus conserved sequence elements within 3’untranslated region of west nile virus by use of a reporting replicon that differentiates between viral translation and RNA replication, 2003,J Virol, 70(5):2757−2763.
[18] Pang X, Zhang M, Dayton AI. Development of dengue virus replicons expressing HIV-1 gp120 and other heterologous genes: a potential future tool for dual vaccination against dengue virus and HIV.BMC Microbiol, 2001, 1: 28.
[19] Fayzuli R, Scholle F, Petrakova O,et al. Evaluation of replicative capacity and genetic stability of West Nile virus replicons using highly efficient packaging cell lines.Virology, 2006, 351: 196–209.
Influence of Japanese enciphalitis virus capsid protein on the self-replicate ability of JEV replicon vectors
Ying Huang1*, Shan Liu2*, Peng Yang1, Chao Wang1, Yun Du1, Zhiwei Sun1, and Weiyuan Yu1
1Laboratory for Protein Engineering,Institute of Biotechnology,Academy of Military Medical Sciences,Beijing100071,China
2The Pathology Department,General Hospital of the Second Artillery of Chinese PLA,Beijing100088,China
Received:February 3, 2010;Accepted:May 20, 2010
Corresponding author:Weiyuan Yu. Tel: +86-10-66948877; E-mail: yeyelaitao@sina.com*These authors contributed equally to this study.

