白藜芦醇对猪前体脂肪细胞凋亡的作用及机理
张朝,杨扬,庞卫军,孙超,杨公社
西北农林科技大学动物脂肪沉积与肌肉发育实验室,杨凌 712100
动物及兽医生物技术
白藜芦醇对猪前体脂肪细胞凋亡的作用及机理
张朝,杨扬,庞卫军,孙超,杨公社
西北农林科技大学动物脂肪沉积与肌肉发育实验室,杨凌 712100
旨在研究白藜芦醇对猪前体脂肪细胞凋亡的作用,探讨其分子机制。以50 μmol/L、100 μmol/L、200 μmol/L、400 μmol/L白藜芦醇处理猪前体脂肪细胞,采用Hoechst 33258染色剂染色,光学和荧光显微镜分别观察细胞的形态学变化。semi-qRT-PCR和 Western blotting方法检测凋亡相关基因sirt1、caspase-3、bcl-2、bax、p53、NF-κB的 mRNA和蛋白的表达变化。结果表明,白藜芦醇处理后,前体脂肪细胞出现明显的细胞凋亡,伴随细胞体积缩小,染色质凝集,核质固缩等特征显现,与对照组相比200 μmol/L处理组细胞的凋亡率显著升高 (P<0.05)。凋亡相关基因sirt1、caspase-3和bax的mRNA和蛋白表达水平显著上调 (P<0.05),而bcl-2、p53、NF-κB等基因的表达水平明显下调 (P<0.05)。进一步证实白藜芦醇特异性地增加sirt1的表达活性,而sirt1的上调影响caspase-3和bcl-2家族因子的活性,同时参与调控p53和NF-κB的转录表达。因此,推测sirt1调控凋亡相关因子表达是白藜芦醇诱导前体脂肪细胞凋亡的关键原因。
白藜芦醇,猪前体脂肪细胞,sirt1,caspase-3
Abstract:We demonstrated the effect of resveratrol on porcine primary preadipocytes apoptosis, to study the intracellular molecular mechanism. Porcine primary preadipocyte was treated with different concentration of resveratrol (0 μmol/L, 50 μmol/L,100 μmol/L, 200 μmol/L, 400 μmol/L). We used optical microscope and fluorescence microscope to observe morphological changes during apoptosis after Hoechst 33258 Fluorescent dyes staining; and RT-PCR and Western blotting to measure the expression of apoptosis-associated genesirt1,caspase-3,bcl-2,bax,p53,NF-κB. Primary preadipocyte apoptosis was apparent, accompanied by reduced cell volume, chromatin condensation, and nuclear shrinkage. Compared to the control and low concentration group, high dose group (200 μmol/L) significantly increased the ratio of primary preadipocyte apoptosis. The expression ofsirt1,caspase-3,and baxwas up-regulated markedly in response to resveratrol; in contrast, apoptotic inhibitorbcl-2,p53,NF-κBdown-regulated. We further proved fact that resveratrol can specifically promote the activity of sirt1; moreover, activatedsirt1modulates the activity ofcaspase-3andbcl-2family, involving in transcriptional regulation ofp53andNF-κBthrough antagonizing factor-inducedacetylation. Taken together, our data established resveratrol as new regulator in porcine primary preadipocyte apoptosis via activating the expression of sirt1, modulating activity of apoptotic-associated factor.
Keywords:resveratrol, porcine primary preadipocyte,sirt1,caspase-3
脂肪细胞是体内功能组织的基本组成单位,参与机体多方面的代谢调控。研究证实脂肪发育的调节控制主要有以下几个方面,包括:祖细胞向脂肪细胞分化的抑制;前体脂肪细胞和脂肪细胞的凋亡;以及脂肪细胞的去分化[1]。因此,前体脂肪细胞的凋亡调控是控制脂肪的关键途径之一。白藜芦醇(RES) 是一种天然的植物抗毒素,首次发现于红葡萄酒和葡萄汁中,具有抗氧化、抗炎症、抗肿瘤的活性[2];不仅可减少小鼠肝脏和3T3-L1脂肪细胞系中的脂质合成,还可抑制某些蛋白激酶的活性,诱导脂肪细胞凋亡的发生[3-4]。sirt1(Sirtuin-1) 是NAD+依赖性蛋白脱乙酰基酶家族的成员之一,参与细胞增殖分化、细胞周期、能量代谢及寿命等多方面调控[5]。研究表明,sirt1通过调节关键的脂肪控制基因来减少脂肪合成,促进脂肪水解[6]。此外,RES是sirt1重要的激活剂,能有效减少脂肪的过多积累,促进脂肪的动员,诱导脂肪细胞凋亡,但其内部的分子机制不甚清楚[7-8]。目前,尚未见 RES对于猪的原代前体脂肪细胞凋亡影响的报道。与试验鼠相比,猪的生理特点更接近人类,是研究人类肥胖病的理想模式动物。因此,本研究以猪前体脂肪细胞为研究对象,探讨RES对于猪前体脂肪细胞凋亡的影响,以及凋亡中sirt1和相关凋亡基因的表达变化,为控制体脂沉积提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1实验动物
1~3日龄仔猪由西北农林科技大学种猪场和杨凌光明猪畜牧公司共同提供。
1.1.2主要试剂
白藜芦醇 (Sigma);DMEM/F12、Ⅰ型胶原酶(Gibco);胎牛血清 (Hyclone公司);牛血清白蛋白(BSA) (华美生物工程公司);TRIzol总RNA提取试剂盒 (百泰克生物技术有限公司);DEPC原液(Sigma);反转录试剂盒 (TaKaRa);DL2000 (天为时代);TaqDNA 聚合酶 (Fermentas,MBI);Hoechst33258凋亡染色试剂盒 (南京凯基公司);dNTPs (TaKaRa);Sirt1、bcl-2、bax、NF-κB和p53基因引物由上海生工合成;Caspase-3、p53多克隆抗体购自bioworld公司;sirt1鼠源的单克隆抗体、NF-κB、bcl-2多克隆抗体购自SAB公司;实验的二抗均来源于Santa Cruz公司;其他试剂为国产或进口分析纯。
1.2 方法
1.2.1细胞培养
猪前体脂肪细胞原代培养参照本实验室建立的方法。无菌状态下取1~3日龄健康仔猪颈、背部的皮下脂肪组织,剪成1 mm3小块,加消化液 (DMEM/F12(Invitrogen,USA) +20 g/L 牛血清白蛋白(华美生物工程公司),临用时加 1 g/L的胶原酶 Ⅰ (Gibco))37℃消化30~50 min (恒温水浴锅振荡),然后过孔径为200目的不锈钢细胞筛,收集滤液至离心管,1 500 r/min 离心10 min,弃上清,加入 DMEM/F12培养液洗1次,1 000 r/min 离心5 min,然后加10% FBS (Hyclone) 的 DMEM/F12 混匀,即获得猪前体脂肪细胞。以 5×104个/cm2密度接种前体脂肪细胞。
1.2.2RT-PCR
以 5×104个/cm2密度接种猪前体脂肪细胞于中皿内,24 h 后更换为含 0、50、100、200、400 μmol/L RES的处理培养液,设3个重复。48 h后取出培养皿,Trizol试剂盒提取细胞总 RNA,利用1%琼脂糖凝胶电泳和核酸定量仪检测总RNA质量和纯度。反转录试剂盒 (TaKaRa) 将各组之间等量的RNA逆转录为cDNA,再取适当的cDNA扩增(PCR引物见表1)。Dolphin2DOC凝胶分析系统摄像分析,分别测得2个扩增产物条带的光密度值,并计算下列基因与β-actin的光密度比值。

表1 细胞凋亡相关基因引物列表Table 1 Primer list apoptosis related gene
1.2.3Hoechst33258染色
分别以 0、200 μmol/L处理原代前体脂肪细胞48 h,弃培养液,缓冲液洗涤细胞2次,4%甲醇溶液固定细胞10 min,离心去固定液,用Buffer A洗2遍,适当的Hoechst 33258染色液避光染色10 min,荧光显微镜观察。凋亡细胞中,细胞膜对 Hoechst 33258的摄取增多,并且由于染色体高度浓缩,Hoechst 33258与之结合增强,染色呈强蓝色荧光,而正常细胞只呈微弱荧光,死细胞则不被染色。
1.2.4Western blotting
以不同浓度的RES处理细胞,提取细胞中的总蛋白,蛋白定量仪定量。经蛋白定量后,按蛋白等量原则将不同处理样品进行SDS-PAGE电泳,分离不同大小的目的蛋白,然后转移至 PVDF膜,利用合适浓度比例一抗孵育,4℃过夜,缓冲液冲洗3次,每次10 min;二抗孵育2 h,缓冲液洗涤3次,发光液发光检测。ChemiDoc XRS曝光系统检测蛋白条带亮度,Quantity One (Bio-Rad,USA) 分析蛋白条带密度值和表达量;将各目的蛋白密度值数据与相应β-actin的密度值比对,所得的数值进一步与对照组的数值比对,作相对表达的柱状分析图。
1.2.5统计学分析
试验所得数据采用统计软件SPSS16.0进行单因素方差分析与显著性检验。
2 结果与分析
2.1 RES对猪前体脂肪细胞凋亡的形态学观察
本课题组前期的研究表明,RES对于细胞的增殖和分化具有较强抑制作用,呈浓度和时间依赖性,推测原因是RES启动了细胞的死亡机制[9]。取仔猪的原代前体脂肪细胞培养,如图1A所示,细胞消化后贴壁呈长梭形或者不规则的三角形状,24 h后,利用200 μmol/L的RES处理细胞,如图1B所示,细胞变圆皱缩,呈不规则的形状,偶见细胞核聚集等现象。进一步利用Hochest33258染色剂染色,图1C为对照组,细胞核呈圆形或椭圆形,细胞呈现正常的生长状态;图1D为处理组,细胞核出现凝集,断裂等不规则的形状,呈现出典型的细胞凋亡特征。结果表明,RES可显著的抑制前体脂肪细胞的增殖,诱导前体脂肪细胞的凋亡。
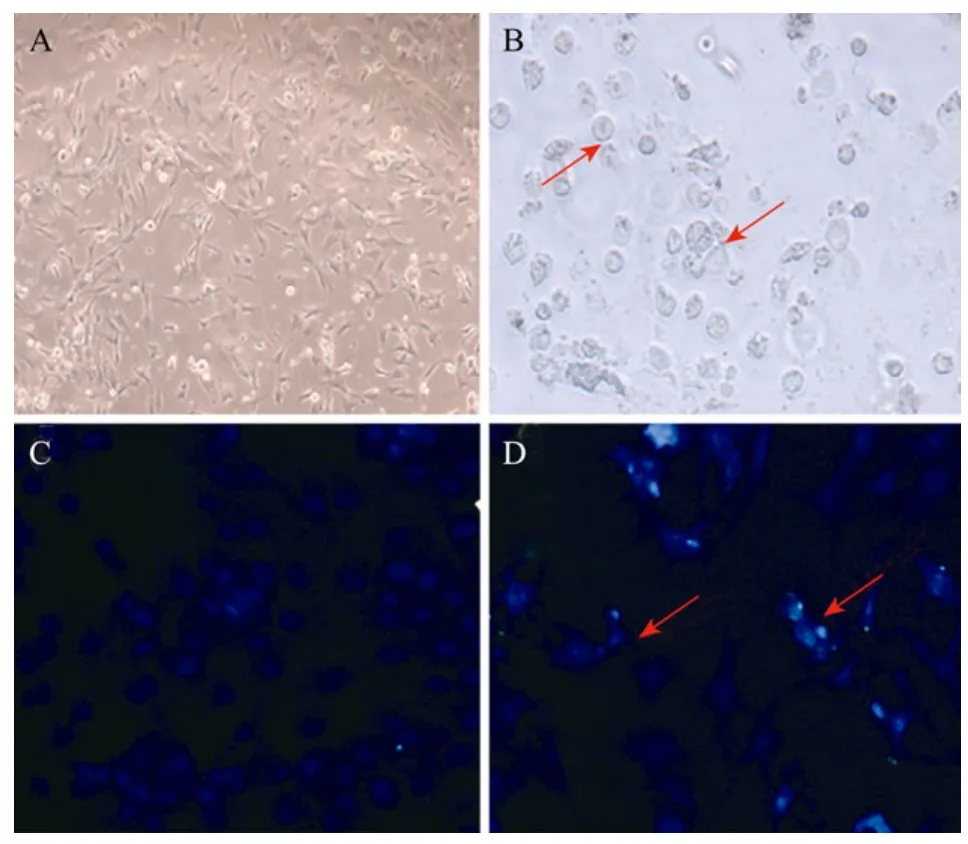
图1 猪原代前体脂肪细胞凋亡的形态学观察Fig.1 Morphological observation during porcine primary preadipocyte apoptosis. (A) Porcine primary preadipocyte were cultured for 24 hin vitro. Showing stretched fibroblast-like or triangle cell phenotypes. (B) Cell morphological changes were observed after treatment with resveratrol. (C) Preadipocyte cells were stained with fluorescent dyes after culturing for 24 h,showing that cell nulei was spherical. (D) Fluorescence microscopy of preadipocyte, after exposure to 200 μmol/L resveratrol 48 h, cell were stained with fluorescent dyes Hochest-33258, showing that cell nuclei was shrinkage.Condensed nuclei are indicated using red arrows.
2.2 RES对于前体脂肪细胞凋亡中 sirt1和caspase-3表达的影响
白色脂肪组织中,sirt1可抑制前体脂肪细胞向成熟脂肪细胞的分化,减少脂滴的积累[10]。研究表明,sirt1负调控PPAR-γ等细胞核受体来调节脂肪细胞的分化增殖,然而,脂肪细胞的脂解机制仍不甚清楚,表明了sirt1还有其他的作用机制来调节脂肪的代谢。以0、50、100、200 μmol/L等浓度的RES处理前体脂肪细胞48 h,采用半定量RT-PCR 检测脂肪细胞中sirt1mRNA表达 (引物见表 1) 和Western blotting检测蛋白的表达情况。结果表明,与 100 μmol/L 和 50 μmol/L 相比,200 μmol/L 条件下sirt1的表达量显著的上升 (P<0.05),随着RES的浓度增加到一定的程度,sirt1的表达量不再增加,维持在较高的水平 (图 2A)。Caspase-3是细胞凋亡的关键的执行因子,如图2B所示,caspase-3蛋白表达量随着处理浓度的增加出现递增的趋势,在200 μmol/L的水平下达到最高值。结果表明,白藜芦醇对于细胞中的sirt1具有明显的促进作用,同时caspase-3也参与了白藜芦醇所调控的生理过程。
2.3 RES对前体脂肪细胞凋亡中bcl-2和bax表达的影响
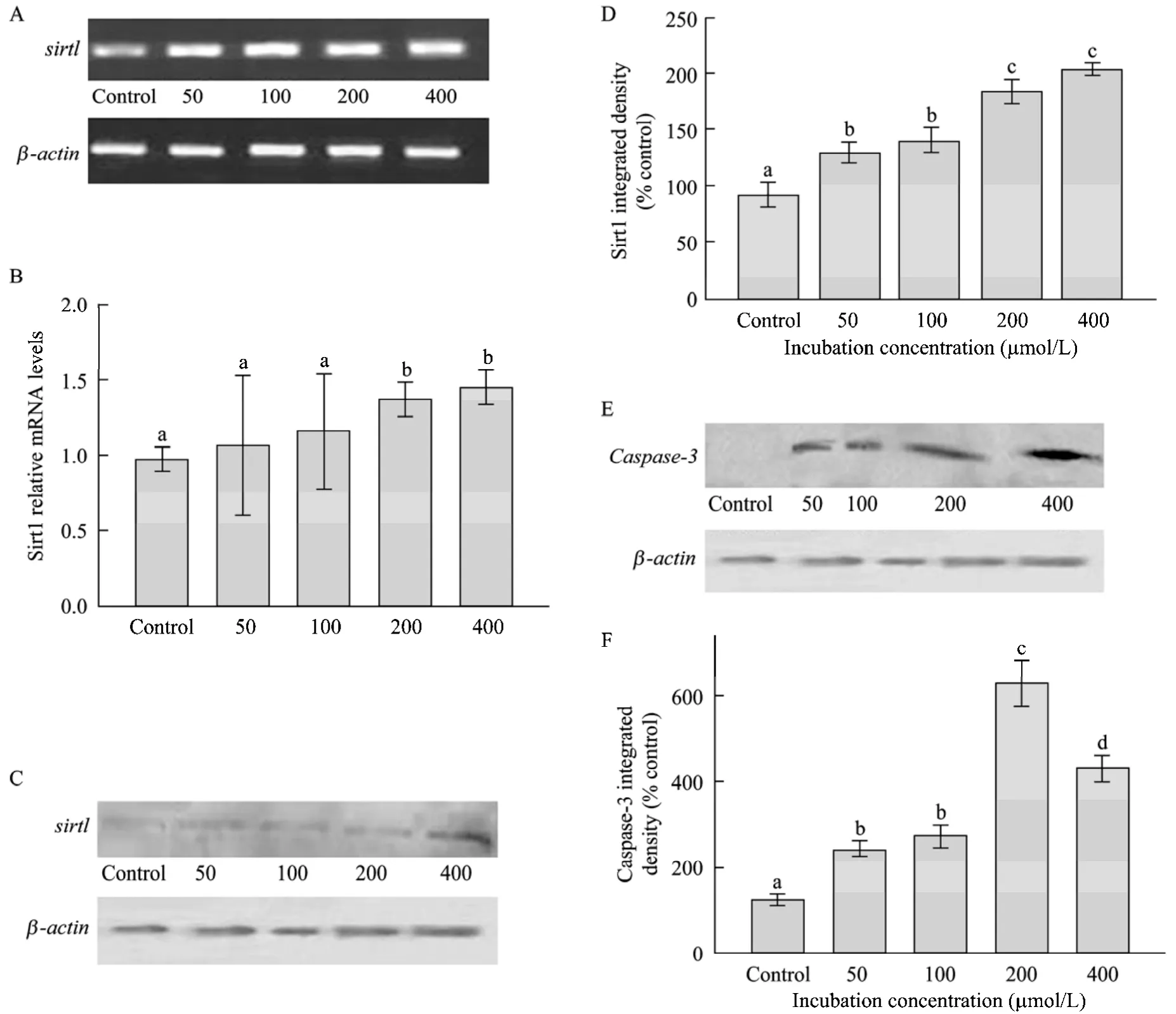
图2 RES对猪前体脂肪细胞凋亡中sirt1和caspase-3表达的影响Fig.2 Effect of RES on the expression sirt1 and caspase-3 during porcine primary preadipocytes. (A) Agarose gel electrophoresis ofsirt1gene after treatment with indicated resveratrol (μmol/L). (B) Quantitative analysis ofsirt1mRNA expression, different letters mark show significant difference (P<0.05). (C) Protein analysis of sirt1 by western blotting treated with indicated concentration of resveratrol. (D) Quantitative analysis of sirt1 protein level, different letters mark show significant difference (P<0.05). (E) Protein analysis of caspase-3 by western blotting after dealing with indicated concentration of resveratrol. (F) Quantitative analysis of caspase-3 protein, different letters mark show significant difference (P<0.05).
Bcl-2家族是细胞凋亡中关键的调节因子,起着凋亡分子开关的作用[11]。研究表明,bcl-2位于线粒体的内膜和内质网中,通过影响线粒体的活性抑制细胞的凋亡。最近的研究证实,bcl-2抑制caspase-3的表达活性从而抑制RES所诱导的细胞凋亡[12]。Bax的作用机制正好与bcl-2相反,是细胞凋亡的正向调控因子[13]。以不同浓度的RES处理前体脂肪细胞 48 h,提取细胞中的 RNA和蛋白,利用半定量RT-PCR (引物见表1) 和Western blotting分析bcl-2和bax的表达变化。如图3A和3B所示,bcl-2的表达量随着浓度的增加而呈现逐渐下降的趋势,与对照组和低浓度的处理组相比,bcl-2在高浓度的作用下表达量显著降低 (P<0.05)。与此相反,bax的活性在100 μmol/L处理水平下显著增加 (P<0.05),但高浓度处理组之间的差异不明显。bcl-2蛋白表达变化与mRNA的变化相一致,在高浓度的处理下显著降低 (P<0.05) (图 3C、3D)。
2.4 RES对于前体脂肪细胞凋亡中p53和NF-κB表达的影响
研究表明,sirt1位于细胞核中,通过去乙酰化NF-κB、Foxo1、p53参与细胞的能量代谢和炎症反应[5]。sirt1可与p53的C端结合,介导p53去乙酰化反应,抑制p53的转录活性[14]。此外,sirt1通过去乙酰化p65亚基的lys310抑制NF-κB的转录激活[15]。以不同浓度的 RES处理细胞,提取细胞的mRNA和蛋白,PCR和 Western blotting分别检测NF-κB、p53的表达变化。如图4A、4B所示,随着处理浓度的增加p53mRNA表达水平逐渐下调,与低浓度处理组相比,200 μmol/L的表达量显著下调(P<0.05)。与此相反的是,NF-kBmRNA表达量逐渐上调,与对照组相比,处理组之间差异显著(P<0.05)。如图4C、4D所示,p53和NF-κB的蛋白表达量逐渐下调,与对照组相比,50 μmol/L及100 μmol/L处理组 NF-κB的表达量显著下调(P<0.05),而 200 μmol/L和 400 μmol/L 的处理组NF-κB的蛋白表达几乎检测不到。
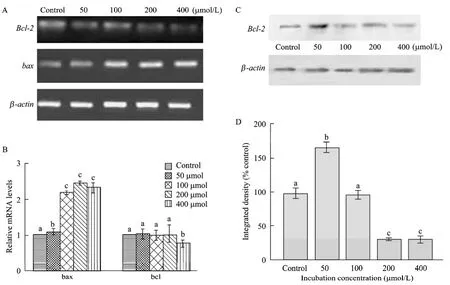
图3 RES诱导前体脂肪细胞凋亡中bcl-2和bax的表达变化Fig.3 Effect RES on the expression change of bcl-2 and bax during primary preadipocyte. (A) Electrophoresis analysis ofbcl-2,baxgene after treatment with indicated concentration of resveratrol. (B) Quantitative analysis ofbcl-2,baxmRNA expression, different mark show significant difference (P<0.05). (C) Protein analysis of bcl-2 by western blotting in response to indicated concentration of resveratrol. (D) Quantitative analysis of bcl-2 protein, different mark show significant difference (P<0.05).
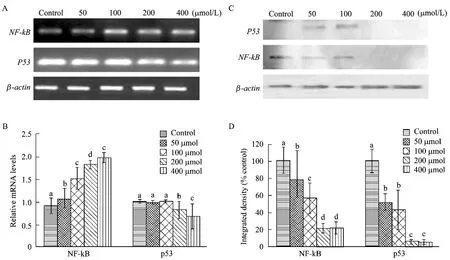
图4 RES诱导前体脂肪细胞凋亡中p53和NF-κB的表达变化Fig.4 Effect RES on the expression change of p53 and NF-κB during primary preadipocytes. (A) Agarose gel electrophoresis ofp53andNF-κBmRNA following treatment with indicated concentration (μmol/L). (B) Quantitative analysis ofp53andNF-κBmRNA expression, different mark show significant difference (P<0.05). (C) Protein analysis of p53 and NF-κB by western blotting in response to indicated concentration of resveratrol. (D) Quantitative analysis of p53 and NF-κB protein, different mark show significant difference (P<0.05).
3 讨论
研究指出脂肪组织由成熟脂肪细胞和少量的前体脂肪细胞组成。前体脂肪细胞位于脂肪组织的间充质和血管腔隙中,在相应的信号诱导下,经过一系列复杂的基因表达变化分化为成熟的脂肪细胞[16-17]。脂肪细胞的数量除受前体脂肪细胞分化和增殖的调控外,还受脂肪细胞去分化、前体脂肪细胞凋亡的调控[18-19]。因此,研究前体脂肪细胞凋亡分子机理为调控脂肪组织积累提供新的途径。目前有研究认为,脂肪细胞分化可减弱脂肪细胞对凋亡诱导敏感性,在3T3-L1前体脂肪细胞系的研究中,生长因子的去除可明显诱导前体脂肪细胞凋亡,前体脂肪细胞分化为脂肪细胞过程中,凋亡抑制基因bcl-2和AIP表达明显增加,阻碍caspase的级联途径传递和凋亡的产生,从而表现出抗凋亡的特征[20-21]。与之不同的是,有研究发现去除血清后,人的前体脂肪细胞分化为成熟脂肪细胞过程中,凋亡抑制基因AIP表达明显减少[22]。说明了3T3-L1前体脂肪细胞与人前体脂肪细胞凋亡的调控存在差异。
最近的研究表明,猪的脂肪沉积模式与啮齿动物存在显著差异,却与人类更为接近,且取材方便,故可作为研究人类肥胖症及相关疾病的理想模型[23]。目前为止,关于脂肪细胞凋亡的研究多集中于细胞系和成熟的脂肪细胞,尚未见任何有关猪原代前体脂肪细胞凋亡的研究报道。本研究以不同浓度的RES处理原代前体脂肪细胞,结果表明,RES可显著诱导细胞凋亡,出现细胞皱缩、染色体凝集等典型凋亡特征,呈浓度依赖性。近来的研究证明,RES抑制 3T3-L1前体脂肪细胞系中脂肪分化并诱导细胞凋亡[24],此外,RES调控多种因子以降低各种细胞系如HT29细胞、血管平滑肌细胞和骨髓瘤细胞的增殖活性并诱导细胞凋亡和细胞周期停滞[25-27]。本研究结果与上述研究结果相同,证明RES可诱导原代前体脂肪细胞凋亡。
脂肪细胞凋亡是多基因时序表达调控的结果。参与细胞凋亡调控的基因主要有sirt1、caspase-3、bcl-2、bax、p53、NF-κB等。研究表明,sirt1是位于细胞核内的细胞寿命调节因子,去乙酰化p53调控细胞增殖和凋亡。p53具有多个乙酰化位点,其高度乙酰化的状态可激活细胞凋亡和细胞周期停滞;而sirt1的过表达则抑制p53其转录活性,进而抑制氧化应激状态下p53依赖性的凋亡[5,14],哺乳动物中研究证实sirt2起着凋亡抑制因子的作用,该过程通过抑制p53的乙酰化来发生。与此相反的是,Griswold等研究表明,果蝇中过表达sirt2可促进caspase-3等凋亡相关基因的表达量增加,诱导caspase依赖性的细胞凋亡;sirt2的过表达并不影响p53的活性,与 p53协同地促进细胞的凋亡[28]。本研究的结果表明,p53的表达水平随RES浓度增加而逐渐降低,处理间差异显著,推测其内部的机制可能是:RES是sirt1药理性激活剂,上调sirt1的表达,进而去乙酰化调控p53的表达,致使p53的活性明显降低,这与上述的研究结果一致。不同的是,RES可同时增加猪前体脂肪细胞中caspase-3的蛋白表达,这与上述的结果不同。
NF-κB (Nuclear factor-kappa B) 是细胞核关键的转录调控因子,参与细胞黏连、细胞周期和细胞凋亡的调控。免疫沉淀和过表达的实验证实,sirt1直接与NF-κBp65亚基相互作用,使lys310位点去乙酰化而抑制其转录激活,增加细胞对TNF-α诱导凋亡的敏感性[15]。本研究结果显示NF-κB的mRNA表达量随RES浓度的增加出现上调,而蛋白表达逐渐下降,证实了NF-κB参与前体脂肪细胞凋亡调控,推测其内部的机制是由于 sirt1与 NF-κB的作用位点结合,从而抑制其在细胞凋亡中活性发挥。
Bcl-2能够保护细胞免受病毒感染、射线衍射、化疗药物等刺激引起的细胞凋亡。体内外的研究证实bcl-2可调控细胞中Ca+水平并抑制线粒体功能发挥。最近的研究表明[12],在U937细胞中,bcl-2的过表达可抑制白藜芦醇诱导的细胞凋亡;其内部的分子机制是:bcl-2调控线粒体膜的离子通道活性,阻断细胞色素释放,抑制caspase-3的激活。本研究的结果与上述相近,bcl-2活性的下降释放了细胞信号中的转导因子,进而刺激caspase-3活性升高,促进细胞凋亡。
综上所述及结合本研究发现,sirt1和凋亡相关因子活性的变化可能是RES诱导细胞凋亡的关键原因,但 sirt1如何与 caspase-3、bcl-2相互作用还有待进一步研究证实。
REFERENCES
[1] Prins J, O'Rahilly S. Regulation of adipose cell number in man.Clin Sci(Lond), 1997, 92: 3−11.
[2] Fremont L. Biological effects of resveratrol.Life Sci,2000, 66(8): 663−673.
[3] Rayalam S, Yang JY, Ambati S,et al.Resveratrol induces apoptosis and inhibits adipogenesis in 3T3-L1 adipocytes.Phytother Res, 2008, 22(10): 1367−1371.
[4] Borra M, Smith B, Denu J. Mechanism of human SIRT1 activation by resveratrol.J Biol Chem, 2005, 280(17):17187−17195.
[5] Yamamoto H, Schoonjans KJA. Sirtuin functions in health and disease.Mol Endocrinol, 2007, 21(8): 1745−1755.
[6] Picard F, Kurtev M, Chung N,et al.Sirt1 promotes fat mobilization in white adipocytes by repressing PPAR-gamma.Nature, 2004, 429: 771–776.
[7] Lagouge M, Argmann C, Gerhart-Hines Z,et al.Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1[alpha].Cell, 2006, 127(6): 1109−1122.
[8] Baur J, Pearson K, Price N,et al.Resveratrol improves health and survival of mice on a high-calorie diet.Nature,2006, 444(7117): 337−342.
[9] Bai L, Pang W, Yang Y,et al.Modulation of Sirt1 by resveratrol and nicotinamide alters proliferation and differentiation of pig preadipocytes.Mol Cell Biochem,2008, 307(1): 129−140.
[10] Guarente L. Sirtuins as potential targets for metabolic syndrome.Nature, 2006, 444(7121): 868−874.
[11] Duprez L, Wirawan E, Berghe TV,et al.Major cell death pathways at a glance.Microbes Infect, 2009, 11(13):1050−1062.
[12] Park J, Choi Y, Suh S,et al.Bcl-2 overexpression attenuates resveratrol-induced apoptosis in U937 cells by inhibition of caspase-3 activity.Carcinogenesis, 2001,22(10): 1633−1639.
[13] Gross A, McDonnell J, Korsmeyer S. BCL-2 family members and the mitochondria in apoptosis.Genes Dev,1999, 13(15): 1899−1911.
[14] Langley E, Pearson M, Faretta M,et al.Human SIR2 deacetylates p53 and antagonizes PML/p53-induced cellular senescence.EMBO J, 2002, 21(10): 2383−2396.
[15] Yeung F, Hoberg JE, Ramsey CS. Modulation of NF-κB-dependent transcription and cell survival by the SIRT1 deacetylase.EMBO J, 2004, 23(12): 2369−2380.
[16] Hwang C, Loftus T, Mandrup S,et al.Adipocyte differentiation and leptin expression.Annu Rev Devl Biol,1997, 13(1): 231−259.
[17] Ailhaud G. Cell surface receptors, nuclear receptors and ligands that regulate adipose tissue development.Clin Chim Acta, 1999, 286: 181−190.
[18] Alkhouri N, Gornicka A, Berk MP,et al.Adipocyte apoptosis, a link between obesity, insulin resistance, and hepatic steatosis.J Biol Chem, 2010, 285(5): 3428−3438.
[19] Sorisky A, Magun R, Gagnon AM. Adipose cell apoptosis:death in the energy depot.Int J Obes Relat Metab Disord,2000, 24(Suppl 4): S3−7.
[20] Magun R, Gagnon A, Yaraghi Z,et al.Expression and regulation of neuronal apoptosis inhibitory protein during adipocyte differentiation.Diabetes, 1998, 47(12):1948−1952.
[21] Magun R, Boone DL, Tsang BK. The effect of adipocyte differentiation on the capacity of 3T3-L1 cells to undergo apoptosis in response to growth factor deprivation.Int J Obes Relat Metab Disord, 1998, 22: 567−571.
[22] Papineau D, Gagnon A, Sorisky A. Apoptosis of human abdominal preadipocytes before and after differentiation into adipocytes in culture.Metabolism, 2003, 52(8):987−992.
[23] Yang GS, Zhang HW, Bai L. Pig-a ideal study animal model of obesity and diabeties.Prog Nat Sci, 2008, 18(5):481−487.
[24] Yang J, Della-Fera M, Rayalam S,et al.Enhanced inhibition of adipogenesis and induction of apoptosis in 3T3-L1 adipocytes with combinations of resveratrol and quercetin.Life Sci, 2008, 82(19/20): 1032−1039.
[25] Liang Y, Tsai S, Chen L,et al.Resveratrol-induced G2 arrest through the inhibition of CDK7 and p34CDC2 kinases in colon carcinoma HT29 cells.Biochem Pharmacol, 2003, 65(7): 1053−1060.
[26] Estrov Z, Shishodia S, Faderl S,et al.Resveratrol blocks interleukin-1 B-induced activation of the nuclear transcription factor NF-kB, inhibits proliferation, causes S-phase arrest, and induces apoptosis of acute myeloid leukemia cells.Blood, 2003, 102: 987−995.
[27] Haider U, Sorescu D, Griendling K,et al.Resveratrol increases serine15-phosphorylated but transcriptionally impaired p53 and induces a reversible DNA replication block in serum-activated vascular smooth muscle cells.Mol Pharmacol, 2003, 63(4): 925−932.
[28] Griswold A, Chang K, Runko A,et al.Sir2 mediates apoptosis through JNK-dependent pathways inDrosophila.Proc Natl Acad Sci USA, 2008, 105(25):8673−8678.
Effect and underlying mechanism of resveratol on porcine primary preadipocyte apoptosis
Zhao Zhang, Yang Yang, Weijun Pang, Chao Sun, and Gongshe Yang
Laboratory of Animal Fat Deposition and Muscle Development,Northwest A&F University,Yangling712100,China
Received:March 2, 2010;Accepted:May 19, 2010
Supported by:National Natural Science Foundation of China (No. 30600437), NWAFU Young Research Program (No. 0114030), Basic Science Research Program (No. QN2009021).
Corresponding author:Weijun Pang. Tel: +86-29-87091017; Fax: +86-29-87092430; E-mail: pwj1209@gmail.com
Chao Sun. Tel: +86-29-87091017; Fax: +86-29-87092430; E-mail: sunchao2775@163.com
国家自然科学基金项目 (No. 30600437),西北农林科技大学青年学术骨干支持计划 (No. 0114030),基本科研业务费专项资金项目 (No.QN2009021) 资助。

